细菌纤维素(bacterial cellulose,BC)是一种具有三维网状结构的多糖,属于纳米级分子,纯度高、结晶度高、机械性能良好、持水能力强、具有可调的表面化学性质,这些特性使其在食品和生物医药等领域得到广泛应用[1-2]。
许多细菌都能够产生细菌纤维素。细菌纤维素的产生使细菌与富氧表面接触,保护细胞免受紫外线等不利因素的影响,保持水分,增强定殖能力,还与细菌的趋化性有关[3-4]。不同来源的菌株产生细菌纤维素的能力有所不同,木醋杆菌(Gluconacetobacter xylinus)是目前已知的细菌纤维素合成能力最强的菌种[5]。除木醋杆菌外,红茶菌也具有产生细菌纤维素的能力,产量相对较高[6]。红茶菌是醋酸菌和酵母菌的共生体,其微生物组成与地理条件、气候条件和培养基条件有关[7],但是醋酸菌的种类比较稳定,主要包括Gluconacetobacter、Komagataeibacter、Acetobacter,负责产生细菌纤维素;酵母菌的种类相对丰富,主要包括Brettanomyces、Saccharomyces、Zygosaccharomyces、Schizosaccharomyces[8]。在自然形成的群落中,酵母菌与许多微生物形成了共生关系,如酵母菌通过谷氨酰胺、谷氨酸、精氨酸、组氨酸等氨基酸以及某些维生素和辅因子提高乳酸菌的生长速率,促进乳酸菌增殖,而不必进行直接物理接触[9-12]。
有研究表明,酵母菌的发酵液能够促进细菌纤维素的合成,推测除了乙醇外还有其他代谢产物在起作用[13]。酵母菌不仅会影响细菌纤维素的合成,而且酵母细胞的疏水性还有助于加强细菌纤维的结构[14]。为了明确红茶菌中的醋酸菌和酵母菌在产细菌纤维素时的作用关系,对红茶菌中的醋酸菌和酵母菌进行分离和鉴定,通过纯培养和共培养研究酵母菌对醋酸菌产细菌纤维素的影响,为初步了解红茶菌中微生物间的相互作用以及提高细菌纤维素的产量提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
木醋杆菌(Gluconacetobacter xylinus)1.1812:中国普通微生物菌种保藏管理中心。红茶菌:市售。
1.1.2 试剂
葡萄糖(分析纯):天津市天大化工实验厂;蛋白胨,酵母浸粉(均为生物试剂):北京奥博星生物技术有限责任公司;纳他霉素:阿拉丁试剂有限公司;纤维素酶(15 000 U/g):国药集团化学试剂有限公司;基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、2×Taq聚合酶链式反应(polymerase chain reaction,PCR)预混试剂:天根生化科技有限公司;引物:通用生物系统(安徽)有限公司。
1.1.3 培养基
HS培养基:葡萄糖2%,蛋白胨0.5%,酵母浸粉0.5%,柠檬酸0.115%,十二水合磷酸氢二钠0.68%,用醋酸将pH调至6.0。
HS平板培养基:在HS培养基的基础上加入0.1%纳他霉素和1.8%琼脂。
麦芽汁琼脂培养基:麦芽汁提取物2%,葡萄糖2%,蛋白胨0.1%,琼脂1.5%。
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YPD):葡萄糖2%,蛋白胨2%,酵母浸粉1%,自然pH。
糖茶水:大红袍1%,葡萄糖15%,自然pH。
1.2 仪器与设备
F-1安全智能型反压高温蒸煮锅:北京发恩科贸有限公司;SW-CJ-2D型超净工作台:北京永光明医疗仪器有限公司;DH-360电热恒温培养箱:北京中兴伟业有限公司;EPS-300型电泳仪:上海天能科技有限公司;9700型PCR仪:美国ABI公司。
1.3 方法
1.3.1 菌种的活化、接种和培养
醋酸菌的活化、接种和培养:将菌种转接至HS平板培养基上以获得单菌落,然后在50 mL HS培养基中接种2环菌种,30 ℃静置培养24 h,作为种子液。采用稀释涂布平板法对种子液中的醋酸菌进行计数,按照100 mL HS培养基约1×104 CFU的比例进行接种,接种完成后30 ℃静置培养7 d。
酵母菌的活化、接种和培养:将菌种转接至麦芽汁琼脂培养基上以获得单菌落,然后在50 mL YPD培养基中接种4环菌种,30 ℃静置培养24 h,作为种子液。采用稀释涂布平板法对种子液中的酵母菌进行计数,按照醋酸菌与酵母菌的比例为1∶1、1∶10、1∶100和1∶1 000在100 mL HS培养基进行接种,接种完成后30 ℃静置培养7 d。
红茶菌的活化、接种和培养:在300 mL糖茶水加入40 g红茶菌膜,30 ℃静置培养7 d,使用液面新产生的菌膜进行接种,100 mL HS培养基中加入1 g菌膜,接种完成后30 ℃静置培养7 d。
1.3.2 细菌纤维素产量的测定
培养结束后,将细菌纤维素膜剪碎,称取1 g碎膜加入9 mL无菌生理盐水中,同时加入200 μL 3 000 U/mL的纤维素酶进行酶解,酶解完全后在HS平板培养基中进行稀释涂布以获得醋酸菌的数量。剩余的碎膜放入称量瓶中,105 ℃烘干至质量恒定,根据含水率求得细菌纤维素的产量。
1.3.3 红茶菌中醋酸菌和酵母菌的分离鉴定
在90 mL无菌生理盐水中加入10 mL红茶菌发酵液、1 g菌膜和300 μL无菌纤维素酶液,待菌膜完全酶解后进行稀释,分别涂布在HS平板培养基和麦芽汁琼脂培养基中,待菌落长出后,挑取形态不同的单菌落反复纯化。利用基因组脱氧核糖核酸提取试剂盒对菌株的基因组DNA进行提取,采用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGCTACCTTGTACGACTT-3')对醋酸菌的16S rDNA序列进行扩增,NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')对酵母菌的26S rDNA序列进行扩增。PCR反应体系为Mix酶(Taq DNA聚合酶、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)、buffer)26 μL,ddH2O 21 μL,模板1 μL,正向引物1 μL,反向引物1 μL。PCR扩增条件为96 ℃预变性3 min,96 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环,72 ℃再延伸10 min。扩增产物送至通用生物系统(安徽)有限公司进行测序,将测序结果在GenBank中进行基本局部比对搜索工具(basiclocalalignment search tool,BLAST)比对,构建邻接(neighbor-joining,NJ)法系统发育树。
2 结果与分析
2.1 木醋杆菌和红茶菌细菌纤维素产量的比较
培养7 d后,木醋杆菌和红茶菌的细菌纤维素产量及醋酸菌的最终数量如表1所示。
表1 培养7 d后木醋杆菌和红茶菌的细菌纤维素产量及醋酸菌的最终菌落数
Table 1 Bacterial cellulose yield and final colony count of Gluconacetobacter xylinum and kombucha after culture for 7 d

由表1可知,红茶菌的细菌纤维素产量大约是木醋杆菌的5.1倍,而且在初始接种量相同的情况下,红茶菌中醋酸菌的最终菌落数大约是木醋杆菌的100倍,说明红茶菌中醋酸菌的增殖速度快于木醋杆菌,从而产生更多的细菌纤维素。红茶菌中的酵母菌可能对细菌纤维素的产生具有积极作用。
2.2 红茶菌中醋酸菌分离鉴定
为了确定红茶菌中醋酸菌的种属,通过涂布平板法对其进行分离。从红茶菌中分离出1株醋酸菌,编号A1,其菌落形态见图1。由图1可知,菌株A1菌落较小,淡黄色,边缘不整齐,不透明。利用PCR法扩增得到了A1的16S rDNA序列,测序后,通过BLAST比对,并利用MEGA构建NJ系统发育树,如图2所示。

图1 菌株A1的菌落形态
Fig.1 Colonial morphology of strain A1

图2 菌株A1基于16S rDNA序列的系统发育树
Fig.2 Phylogenetic tree of strain A1 based on 16S rDNA sequences
由图2可知,菌株A1与Komagataeibacter intermedius聚为一支,相似度为99.93%,因此初步鉴定菌株A1为居间驹形杆菌(Komagataeibacter intermedius)。K.intermedius不仅可以耐受高浓度的乙醇和乙酸,而且可以有效的生产细菌纤维素和葡萄糖酸,已被广泛应用于食品和制药工业[15]。
为了确定菌株A1是否能够产生细菌纤维素及产细菌纤维素的能力,将其接种到HS培养基中,静置培养7 d后测定细菌纤维素产量,以木醋杆菌作为对照,结果如表2所示。
由表2可知,虽然菌株A1的最终菌落数是木醋杆菌的100倍,但是两者的细菌纤维素产量几乎相同,说明菌株A1产生细菌纤维素的能力不如木醋杆菌,但是红茶菌产生的细菌纤维素远远多于菌株A1,这表明红茶菌中的酵母菌能够极大的促进菌株A1产生细菌纤维素。
表2 菌株A1和木醋杆菌的细菌纤维素产量及最终菌落数
Table 2 Bacterial cellulose yield and final colony count of strain A1 and Gluconacetobacter xylinum

2.3 红茶菌中酵母菌的分离鉴定
为了探究酵母菌对菌株A1的作用,通过涂布平板法对红茶菌中的酵母菌进行分离。从红茶菌中分离出3株酵母菌,编号为Y1、Y2和Y3,其中Y1数量最多,为优势酵母,它们的菌落形态见图3。

图3 菌株Y1(a)、Y2(b)、Y3(c、d)的菌落形态
Fig.3 Colonial morphology of strain Y1 (a)、Y2 (b)、Y3 (c,d)
由图3可知,Y1的菌落为白色,圆形,边缘整齐,侧面为山丘状突起,表面光滑湿润,不透明;Y2的菌落为白色,圆形扁平状,边缘整齐,表面光滑湿润,不透明;Y3的菌落为白色,圆形,菌落边缘及背面为栗色,边缘整齐,菌落中央有圆形突起,表面光滑湿润,不透明。利用PCR法扩增得到了Y1、Y2和Y3的26S rDNA序列,测序后,通过BLAST比对,并利用MEGA构建NJ系统发育树,结果如图4所示。
由图4可知,菌株Y1与Brettanomyces bruxellensis聚为一支,相似度为99.49%,因此初步鉴定菌株Y1为布鲁塞尔酒香酵母(Brettanomyces bruxellensis);菌株Y2与Zygosaccharomyces bisporus聚为一支,相似度为99.19%,因此初步鉴定菌株Y2为二孢接合酵母(Zygosaccharomyces bisporus);菌株Y3与Metschnikowiafructicola聚为一支,相似度为99.43%,因此初步鉴定菌株Y3为核果梅奇酵母(Metschnikowia fructicola)。Brettanomyces和Zygosaccharomyces通常被认为是腐败酵母,对低pH值、高乙醇浓度和高渗透压具有耐受性[16-17],这使得其非常适合红茶菌发酵液的环境。Metschnikowia常被用作拮抗酵母,用于控制水果和蔬菜上的病原体[18]。通过激活宿主防御机制,提高苯丙烷代谢途径中一系列酶的表达水平达到控制病原体的效果[19]。
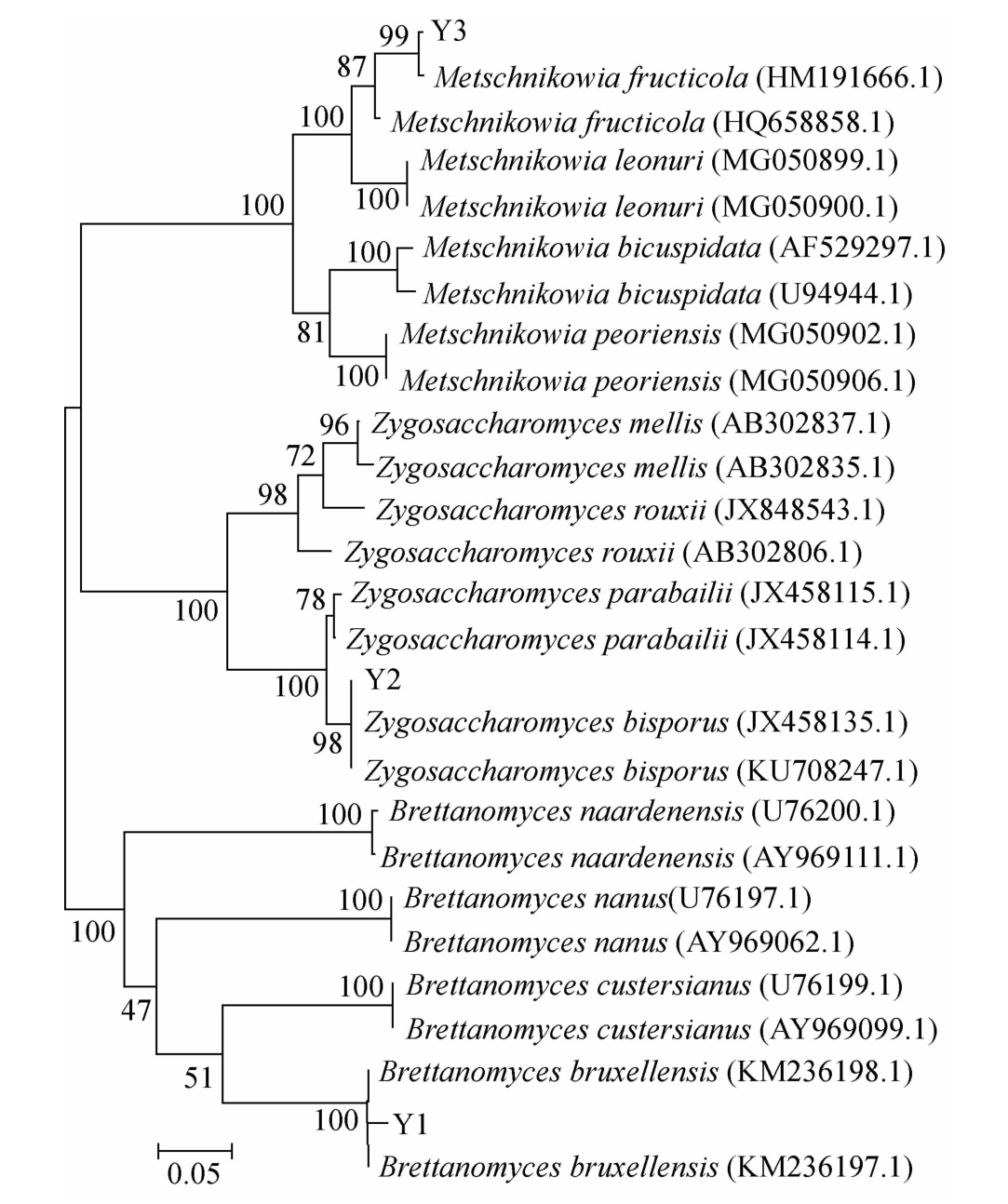
图4 菌株Y1、Y2和Y3基于26S rDNA序列的系统发育树
Fig.4 Phylogenetic tree of strain Y1,Y2 and Y3 based on 26S rDNA sequences
2.4 酵母菌对细菌纤维素产量的影响
为了探究菌株Y1对菌株A1产细菌纤维素的影响,按照不同的比例将两者接种在HS培养基中共培养,静置培养7 d后收获细菌纤维素,各组细菌纤维素产量结果见图5,不同酵母菌株与A1共培养的细菌纤维素产量结果见图6。
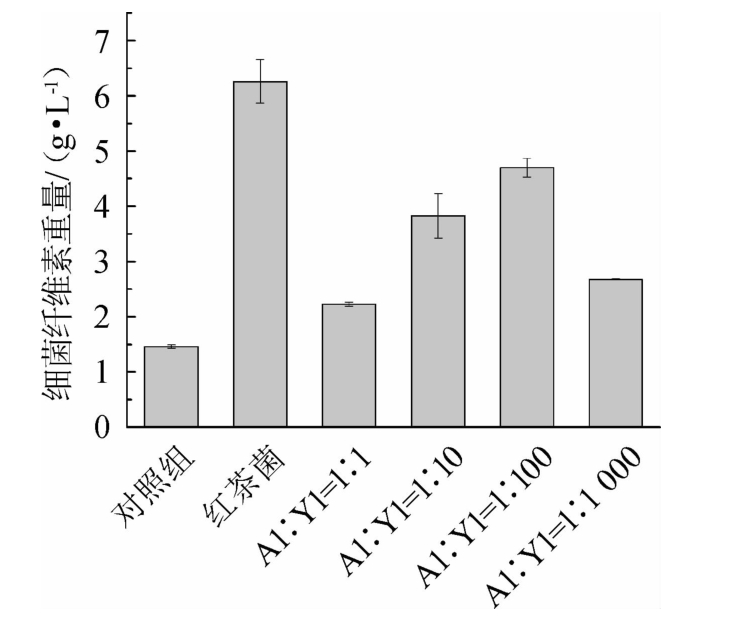
图5 菌株A1与Y1共培养的细菌纤维素产量
Fig.5 Bacterial cellulose yield by strain A1 co-culture with strain Y1
由图5可知,细菌纤维素产量随着菌株Y1比例的增加呈现出先增加后减小的趋势,但均高于对照组,表明菌株Y1能够促进菌株A1产生细菌纤维素。当菌株A1与Y1的比例为1∶100时,产生的细菌纤维素最多,为4.70 g/L,约是菌株A1纯培养的3.2倍,但是少于红茶菌产生的细菌纤维素,可能菌株Y2和Y3对A1也具有促进作用。由图6可知,菌株Y2对菌株A1具有较强的促进作用,但不及菌株Y1,而菌株Y3对菌株A1没有促进作用。有研究表明,在发酵过程中酵母菌产生的低浓度乙醇能够促进醋酸菌产生细菌纤维素,除此之外,3-甲基丁醇、乙酸、乳酸、糠醛和某些氨基酸也在这个过程中起作用[20]。
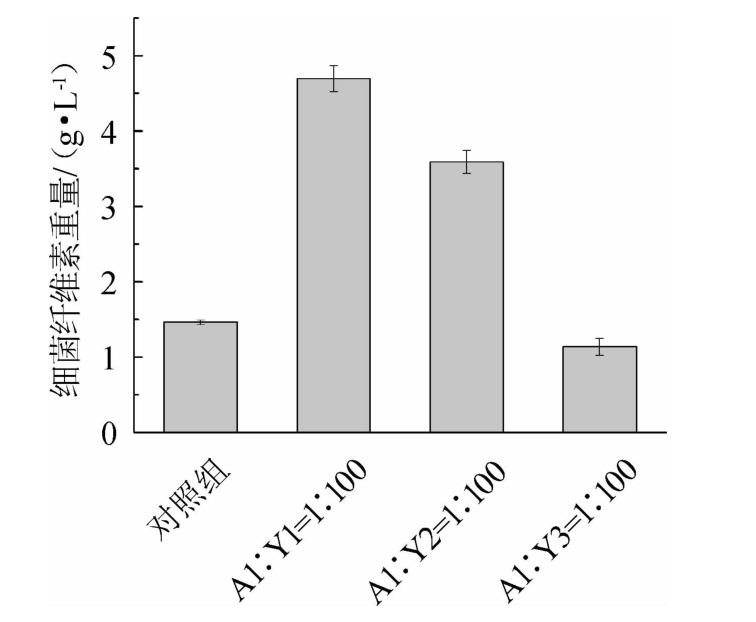
图6 不同酵母菌株与A1共培养的细菌纤维素产量
Fig.6 Bacterial cellulose yield by strain A1 co-culture with different yeast strains
3 结论
通过培养的方法从红茶菌中分离得到1株醋酸菌A1和3株酵母菌(Y1、Y2及Y3)。经分子生物学鉴定分别为居间驹形杆菌(Komagataeibacter intermedius);布鲁塞尔酒香酵母(Brettanomyces bruxellensis)、二孢接合酵母(Zygosaccharomyces bisporus)和核果梅奇酵母(Metschnikowia fruc ticola),其中B.bruxellensis为优势酵母。将K.intermedius与B.bruxellensis以1∶100的比例共培养时产生的细菌纤维素最多,为4.70 g/L,是K.intermedius纯培养的3.2倍;K.intermedius与Z.bisporus以1∶100的比例共培养时产生的细菌纤维素为3.59 g/L,是K.intermedius纯培养的2.5倍;K.intermedius与M.fructicola以1∶100的比例共培养时产生的细菌纤维素与K.intermedius纯培养几乎相同。结果表明,红茶菌中B.bruxellensis和Z.bisporus能够促进K.intermedius产细菌纤维素,而M.fructicola对K.intermedius没有明显的促进作用。
[1]PICHETH G F,PIRICH C L,SIERAKOWSKI M R,et al.Bacterial cellulose in biomedical applications:A review[J].Int J Biol Macromol,2017,104:97-106.
[2]SHI Z J,ZHANG Y,PHILLIPS G,et al.Utilization of bacterial cellulose in food[J].Food Hydrocolloid,2014,35:539-545.
[3]KLEMM D,SCHUMANN D,UDHARDT U,et al.Bacterial synthesized cellulose-artificial blood vessels for microsurgery[J].Prog Polym Sci,2001,26(9):1561-1603.
[4]BASU A,VADANAN S,LIM S.A novel platform for evaluating the environmental impacts on bacterial cellulose production[J].Sci Rep,2018,8:5780.
[5]GEA S,REYNOLDS C,ROOHPOUR N,et al.Investigation into the structural,morphological,mechanical and thermal behaviour of bacterial cellulose after a two-step purification process[J].Bioresource Technol,2011,102(19):9105-9110.
[6]张硕,杜倩雯,兰水,等.七种糖类对木醋杆菌和红茶菌的影响[J].纤维素科学与技术,2014,22(4):18-27.
[7]TEOH A,HEARD G,COX J.Yeast ecology of Kombucha fermentation[J].Int J Food Microbiol,2004,95(2):119-26.
[8]VILLARREAL-SOTO S A,BEAUFORT S,BOUAJILA J,et al.Understanding kombucha tea fermentation:A review[J].J Food Sci,2018,83(3):580-588.
[9]STADIE J,GULITZ A,EHRMANN M,et al.Metabolic activity and symbiotic interactions of lactic acid bacteria and yeasts isolated from water kefir[J].Food Microbiol,2013,35(2):92-98.
[10]MIRANDA-CASTILLEGA D E,MARTINEZ-PENICHE R A,NADAL M,et al.Enological qualities and interactions between native yeast and lactic acid bacteria from Queretaro,Mexico[J].J Food Sci,2018,83(7):1904-1912.
[11]PONOMAROVA O,GABRIELLI N,SÉVIN D,et al.Yeast creates a niche for symbiotic lactic acid bacteria through nitrogen overflow[J].Cell Syst,2017,5(4):345-357.
[12]SIEUWERTS S,BRON P,SMID E.Mutually stimulating interactions between lactic acid bacteria and Saccharomyces cerevisiae in sourdough fermentation[J].LWT-Food Sci Technol,2018,90:201-206.
[13]何晓磊,刘四新,邓健,等.不同培养基的酵母发酵液对细菌纤维素产量的影响[J].热带作物学报,2016,37(3):488-492.
[14]KREGIEL D,JAMES S A,RYGALA A,et al.Consortia formed by yeasts and acetic acid bacteria Asaia spp.in soft drinks[J].Anton Leeuw,2018,111(3):373-383.
[15]GAGGÌA F,BAFFONI L,GALIANO M,et al.Kombucha beverage from green,black and rooibos teas:A comparative study looking at microbiology,chemistry and antioxidant activity[J].Nutrients,2018,11(1):1.
[16]STEENSELS J,DAENEA L,MALCORPS P,et al.Brettanomyces yeastsfrom spoilage organisms to valuable contributors to industrial fermentations[J].Int J Food Microbiol,2015,206:24-38.
[17]ALONSO A,BELDA I,SANTOS A,et al.Advances in the control of the spoilage caused by Zygosaccharomyces species on sweet wines and concentrated grape musts[J].Food Control,2015,51:129-134.
[18]BANANI H,SPADARO D,ZHANG D P,et al.Postharvest application of a novel chitinase cloned from Metschnikowia fructicola and overexpressed in Pichia pastoris to control brown rot of peaches[J].Int J Food Microbiol,2015,199:54-61.
[19]HERSHKOVITZ V,BEN-DAYAN C,RAPHAEL G,et al.Global changes in gene expression of grapefruit peel tissue in response to the yeast biocontrol agent Metschnikowia fructicola[J].Mol Plant P,2012,13(4):338-349.
[20]邓健.3 株筛自发酵椰子水的分离物对细菌纤维素合成促进作用的研究[D].海口:海南大学,2015.