嗜盐菌是一类生长在海洋、盐湖、腌制品等高盐环境中的微生物[1]。根据微生物的嗜盐程度,可分为四大类,即非嗜盐菌(最适生长盐度即氯化钠浓度<0.2 mol/L)、弱嗜盐菌(最适生长盐度为0.2~0.5 mol/L)、中等嗜盐菌(最适生长盐度为0.5~2.5 mol/L)和极端嗜盐菌(最适生长盐度为2.5~5.2 mol/L),其中部分极端嗜盐菌为极端嗜盐古菌[1-2]。
嗜盐菌作为一类新型的、极具应用前景的微生物资源[3-4],近年来受到人们的广泛关注,其具有特殊的生理结构和代谢机制,同时也会产生许多具有特殊性质的生物活性物质[5-6],因此,对其研究既存在理论意义,又具有应用价值。在理论研究方面,人们对嗜盐菌的嗜盐机理[7]尤其感兴趣,生存在极端环境中的微生物,通常是通过调节代谢适应其所处生境而得以存活并发挥作用;在应用方面,其用于发酵生产,具有抵抗高盐环境胁迫的能力[8],不易污染杂菌,发酵工艺易于控制,成本较低,在高盐污水的处理方面也发挥重要作用[9-10]。近年来,随着分子生物学及各组学技术的快速发展,国内外对嗜盐微生物的研究逐渐增多。周旭华等[3]在浙江舟山地区近海和盐湖中分离出能产胞外多糖的嗜盐菌株;刘颖等[8]在大连近岸海域表层海水中分离出一株嗜盐菌,能产生表面活性剂。
本研究从盐生杜氏藻的废弃藻液中分离筛选一株能产生胞外黏性代谢物的嗜盐单胞菌,研究不同NaCl浓度、pH值、温度对其细胞生长的影响,并通过傅里叶变换红外光谱(Fourier transform-infrared spectroscopy,FT-IR)扫描分析胞外产物的结构,采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)仪分析胞外产物主要组成成分,旨在发现嗜盐菌新种、开发新型天然活性物质,为嗜盐微生物代谢机制研究及其代谢产物开发应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 培养基
分离培养基[11]:Tris-HCl(1 mol/L)10 mL,NaCl 60 g,蒸馏水1 L,调节pH值至7.5。
发酵培养基(LB-60)[12]:蛋白胨10 g,酵母粉5 g,NaCl 60 g,蒸馏水1 L,调节pH值至7.5。
以上培养基均在121 ℃高压蒸汽灭菌20 min,固体培养基中添加2%琼脂。
1.1.2 试剂
革兰氏染色试剂盒:北京索莱宝科技有限公司;氯化钠(分析纯):天津化学试剂一分厂;三羟甲基氨基甲烷(Tris)(≥99.9%):美国Sigma公司;甲氧基铵盐酸盐(色谱纯):瑞士Buchs等公司。
1.2 仪器与设备
UVmini-1240紫外分光光度计:日本Shimadzu公司;FD-1真空冷冻干燥机:上海田枫实业有限公司;GC7890/MS5975C气相色谱-质谱联用仪:美国Agilent公司;LDFX-50BI立式压力蒸汽灭菌锅:上海申安医疗器械厂;LRH-250-Gb恒温培养箱:韶关市泰宏医疗器械有限公司;CX40RF200系统显微镜:日本Olympus公司。
1.3 方法
1.3.1 菌株的分离
取1 mL盐生杜氏藻培养废弃液,按10倍梯度系列稀释后,取100 μL稀释液涂布于分离培养基平板中,30 ℃恒温培养2~3 d,待平板中长出菌落,挑取单菌落接种于LB-60培养基中,30 ℃静置培养7 d,以产生黏性代谢物的菌株为目的菌株。将菌液与体积分数为60%的甘油按体积比1∶1混合,于-80 ℃保藏。
1.3.2 菌株的鉴定
(1)形态学鉴定
将菌株按1%(V/V)的接种量接种于LB-60培养基中,30 ℃、180 r/min培养24 h。取少量菌液按10-1、10-2、10-3梯度稀释,吸取100 μL稀释液涂布于LB-60固体平板中,30 ℃静置培养至长出单菌落,观察菌落形态。取适量菌液涂布于载玻片并过火固定,制成临时装片,进行革兰氏染色[13],使用显微镜观察菌株染色状态。
将菌株按1%(V/V)的接种量接种于LB-60培养基中,30 ℃、180 r/min培养24 h,10 000 r/min离心5 min,收集菌体,生理盐水清洗3次,离心,将菌体重悬浮于2.5%戊二醛中,4 ℃过夜处理;离心,收集菌体,双蒸水(ddH2O)清洗两次,分别用体积分数为30%、70%的乙醇和无水乙醇梯度洗脱10 min,待乙醇挥发完全后,真空冷冻干燥12 h,取菌体粉末进行电镜扫描(scanning electron microscope,SEM)[14],观察细胞形态特征。
(2)分子生物学鉴定
将筛选到的菌株接种于含有5 mL LB-60培养基的试管中,30 ℃、180 r/min过夜培养。以菌株基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)为模板,对菌株的16S rDNA序列进行菌落聚合酶链式反应(polymerase chain reaction,PCR),所用引物为细菌通用引物27F/1492R(27F:5'-AGAGTTTGATCCTGGCTCAG-3',1429R:5'-GGTTACCTTGT TACGACTT-3')。PCR扩增体系:Taq Mix 12.5 μL,27F 1 μL,1492R 1 μL,菌液1 μL,双蒸水(ddH2O)9.5 μL;PCR扩增条件参照贾宇声等[14]的方法。PCR扩增结束后,采用琼脂糖凝胶电泳检测PCR扩增产物,检测合格后送至苏州金唯智生物技术有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology informa tion,NCBI)的Genbank数据库中进行Blast比对搜索[15],选取同源性较高的模式菌株的16S rDNA序列,使用MEGA5.05软件中的邻接(neighbor joining,NJ)法构建系统进化树[16-17]。
1.3.3 菌株的生长特性
种子液的制备:将保藏的菌株划线于LB-60固体平板,30 ℃恒温培养24 h,挑取单菌落于含有50 mL LB-60的液体培养基中,30 ℃、180 r/min培养24 h,作为种子液。
生长曲线:按1%(V/V)的接种量将种子液转接于LB-60培养基,30 ℃、180 r/min条件下振荡培养,每隔2 h取样,于波长600 nm处测定吸光度值(OD600nm)[2],以发酵时间(x)为横坐标,OD600nm值(y)为纵坐标,绘制生长曲线。
NaCl含量及初始pH值对菌株生长的影响:将菌株按1%(V/V)的接种量分别接种于不同NaCl含量(0、5 g/L、15 g/L、24 g/L、60 g/L、120 g/L、180 g/L、240 g/L)、不同初始pH值(2.0、4.0、6.0、7.0、8.0、10.0、12.0)的LB-60培养基中,30 ℃、180r/min培养24h,于波长600nm处测定吸光度值(OD600nm值)。
培养温度对菌株生长的影响:将菌株按1%接种量接种于LB-60培养基,置于不同温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)条件下培养24 h,于波长600 nm处测定吸光度值(OD600nm值)。
1.3.4 菌株胞外黏性代谢物的分析
胞外黏性代谢物的收集:按1%(V/V)的接种量将种子液接种于LB-60培养基中,30 ℃静置培养,每组三个平行,每隔5 d取样,10 000 r/min离心10 min,去除菌体,收集发酵液中的黏性代谢物,蒸馏水清洗3次,真空冷冻干燥,称质量(胞外黏性代谢物产量),备用。
FT-IR检测黏性代谢物成分:取1~2 mg样品进行傅里叶变换红外光谱扫描[18-19],分析其主要的官能团及特点。
GC-MS检测黏性代谢物组分:称取10 mg样品于安瓿瓶中,加入6 mol/L的HCl溶液6 mL,110 ℃反应20 h左右。反应结束后,10 000 r/min离心5 min,收集上清液,取900 μL上清液于1.5mLEP管中,真空冷冻干燥。加入5μL1.5mg/mL氘标记的琥珀酸,涡旋混匀3 min,加入100 μL甲氧基铵盐酸盐/吡啶溶液(20 mg/mL),涡旋,使样品充分溶解,40 ℃反应80 min;加入160 μL N-甲基-N-(三甲基硅烷)三氟乙酰胺(methyl-trimethyl-silyl-trifluoroacetamide,MSTFA),混匀,40 ℃反应80 min;衍生化后,12 000 r/min离心5 min;取上清液100 μL 装于进样瓶中,进行GC-MS检测[20-22]。定性分析使用美国国家标准技术研究所(NIST)数据库。定量分析采用面积归一化法,计算物质的相对含量[21-22],具体计算公式如下:
2 结果与分析
2.1 产黏性代谢物嗜盐菌株的分离
逐一挑取分离平板上的单菌落于LB-60培养基中,30 ℃静置培养3 d。其中菌株YZ1产生胞外黏性代谢物,故选取菌株YZ1作为目的菌株。
2.2 菌株YZ1的鉴定
2.2.1 形态学观察
菌株YZ1的菌落形态、细胞形态及扫描电镜结果见图1。由图1可知,菌株YZ1在LB-60固体培养基中,菌落呈圆形,凸起,白色或乳白色不透明,表面光滑湿润无褶皱,不产生孢子,不易挑起;经革兰氏染色后,呈红色,细、短杆状;菌株YZ1在电镜下(10 000×)呈细杆状,单个存在,部分菌体成对纵向连接,菌体表面光滑,无鞭毛,不产生孢子。根据染色与形态观察结果,初步鉴定菌株YZ1为革兰氏阴性杆菌。

图1 菌株YZ1的菌落形态(a)、细胞形态(b)及扫描电镜(c)结果
Fig.1 Colonial morphology (a),cell morphology (b) and scanning electron microscope results (c) of strain YZ1
2.2.2 分子生物学鉴定
菌株YZ1 16S rDNA序列的PCR扩增产物见图2。由图2可知,PCR扩增产物碱基长度为1 600 bp左右,与预期结果相符,纯化后进行测序。
将测序结果提交至NCBI的Genbank数据库中进行同源性比对搜索,发现菌株YZ1与Halomonas subterranea strain ZG16同源性最高,达99.3%。利用MEGA5.05软件中的NJ法构建系统进化树,结果见图3。由图3可知,菌株YZ1与Halomonas subterranea strain ZG16(登录号:NR044116.1)聚于同一分支,亲缘关系最近。结合形态学鉴定结果,鉴定菌株YZ1为Halomonas subterranea。
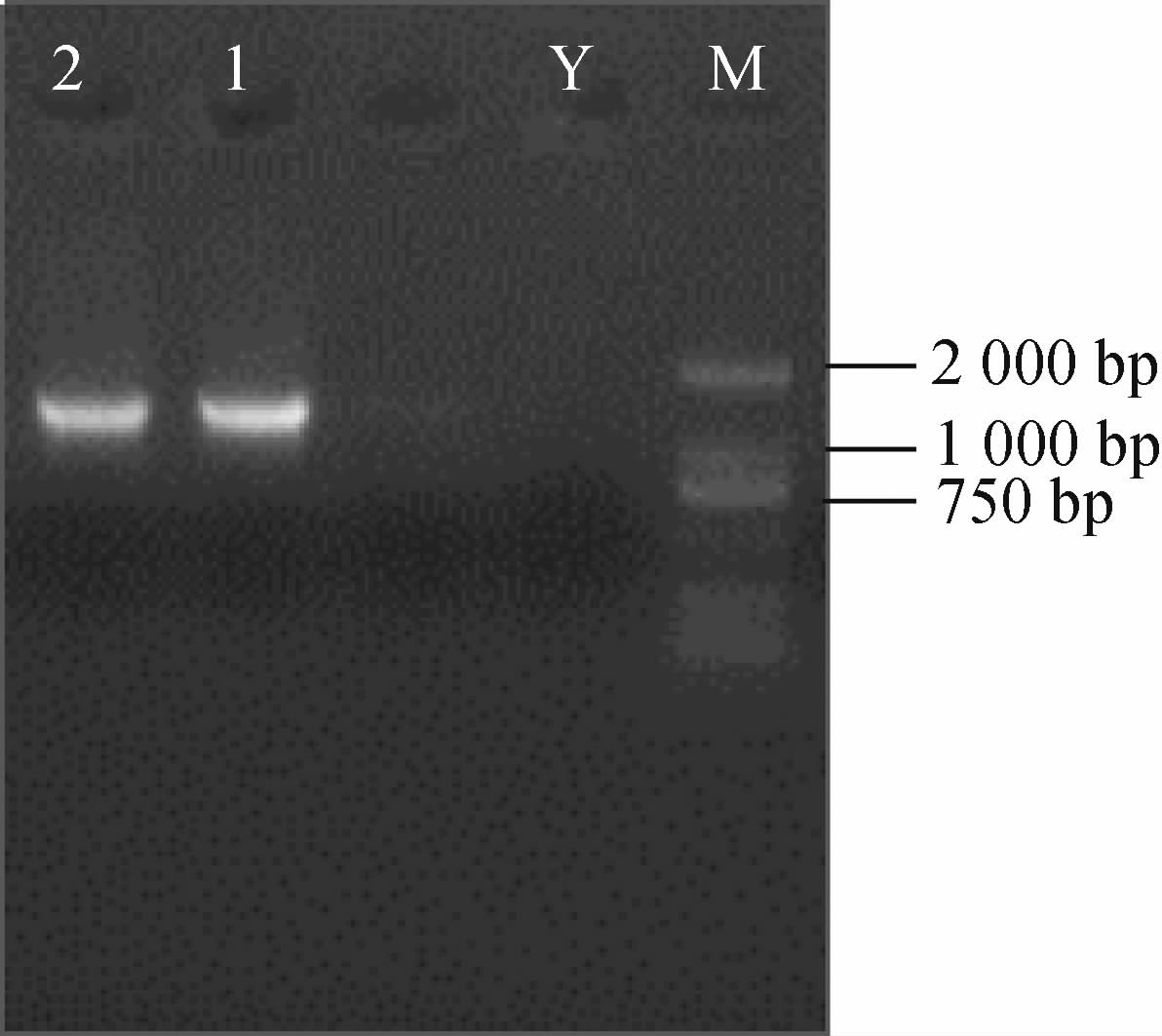
图2 菌株YZ1 16S rDNA序列PCR扩增产物琼脂糖凝胶电泳结果
Fig.2 Results of agarose gel electrophoresis of 16S rDNA PCR amplification products of strain YZ1
M为DNA Marker;Y为无DNA模板阴性对照;1、2为菌株YZ1 DNA模板PCR扩增产物。

图3 基于16S rDNA基因序列菌株YZ1的系统进化树
Fig.3 Phylogenetic tree of strain YZ1 based on 16S rDNA gene sequences
2.3 菌株YZ1的生长特性
2.3.1 菌株YZ1的生长曲线
生长曲线反映了细菌数量、生长状况、代谢情况等多种重要指标,是研究细菌的一项基本特征。菌株YZ1的生长曲线见图4。由图4可知,菌株YZ1的迟缓期为0~12 h,对数生长期为12~28 h,稳定期为28~48 h,48 h后开始进入衰亡期。确定菌株YZ1的对数生长期,对确定取样时间及胞外黏性产物的产出时间提供重要的参考。
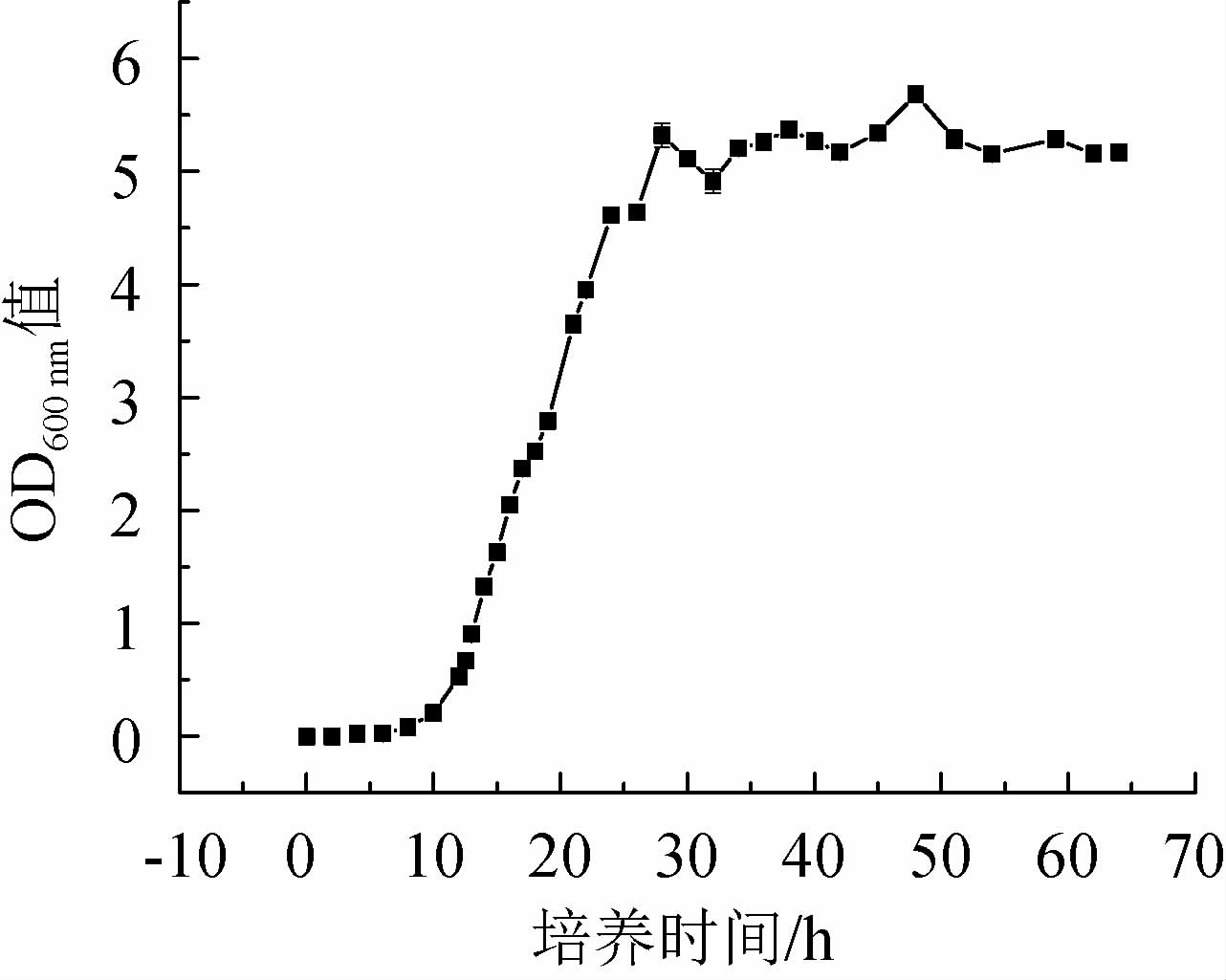
图4 菌株YZ1的生长曲线
Fig.4 Growth curve of strain YZ1
2.3.2 不同NaCl含量对菌株YZ1生长的影响
不同NaCl含量下菌株YZ1的生长状况见图5。由图5可知,当NaCl质量浓度<5 g/L之前,菌株基本不生长,随NaCl质量浓度的升高,菌体浓度不断增大,当NaCl质量浓度为60g/L和120g/L时,菌体浓度达到最大,之后菌体生长与NaCl质量浓度呈负相关。故菌株YZ1可在15~240 g/L NaCl质量浓度下生长,最适NaCl质量浓度为30~150 g/L。根据文献报道[23],中度嗜盐菌的最适生长盐浓度为0.5~2.5 mol/L,故菌株YZ1为中度嗜盐菌。
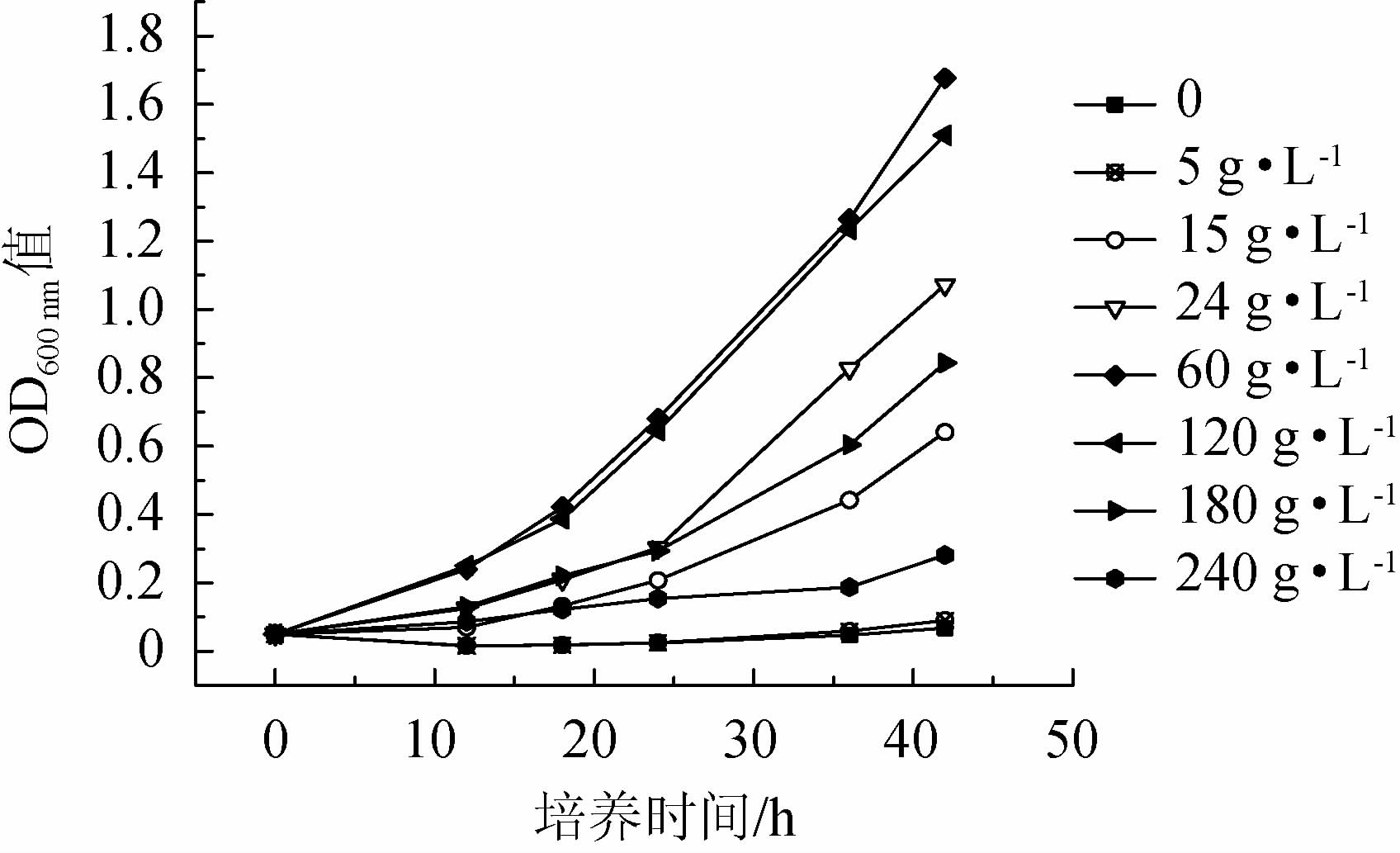
图5 不同NaCl含量对菌株YZ1生长的影响
Fig.5 Effect of different NaCl concentrations on strain YZ1 growth
2.3.3 不同初始pH值对菌株YZ1生长的影响
不同初始pH值对菌株YZ1生长的影响见图6。由图6可知,当初始pH值<4.0之前,菌株YZ1基本不生长,随初始pH值的升高,菌株YZ1生长加快;当初始pH值为7~8时,菌体浓度达到最大值,之后生长速率开始降低;当初始pH值达到12时,细菌基本停止生长,故菌株YZ1可在弱碱性环境中生长,最适生长初始pH值为7~8。
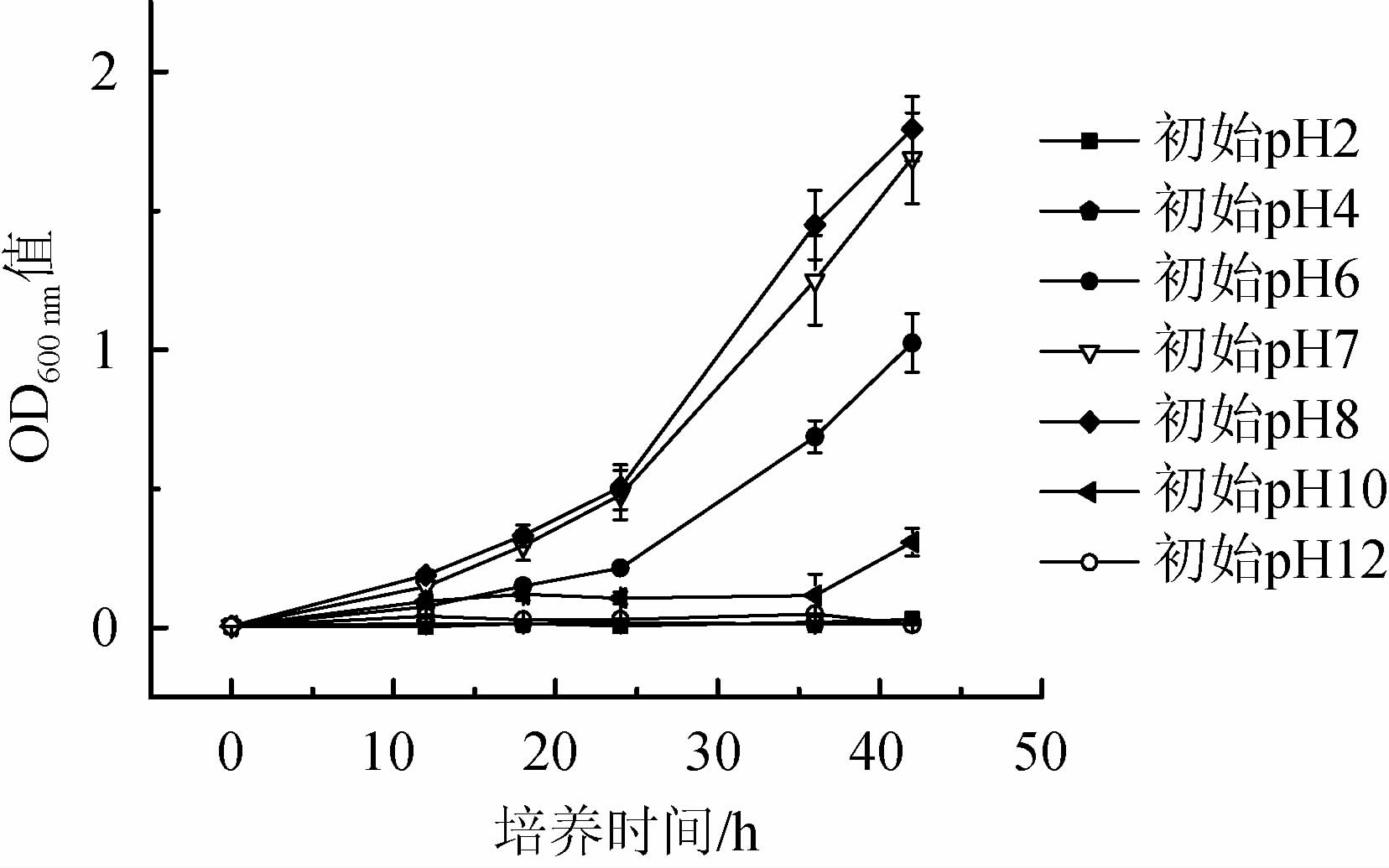
图6 不同初始pH值对菌株YZ1生长的影响
Fig.6 Effect of different initial pH on strain YZ1 growth
2.3.4 不同培养温度对菌株YZ1生长的影响
不同培养温度对菌株YZ1生长的影响见图7。由图7可知,菌株在20~40 ℃内均可生长,且随培养温度升高,菌株生长加快,45 ℃基本不生长,故菌株YZ1的最适生长温度为30~40 ℃,不耐高温。
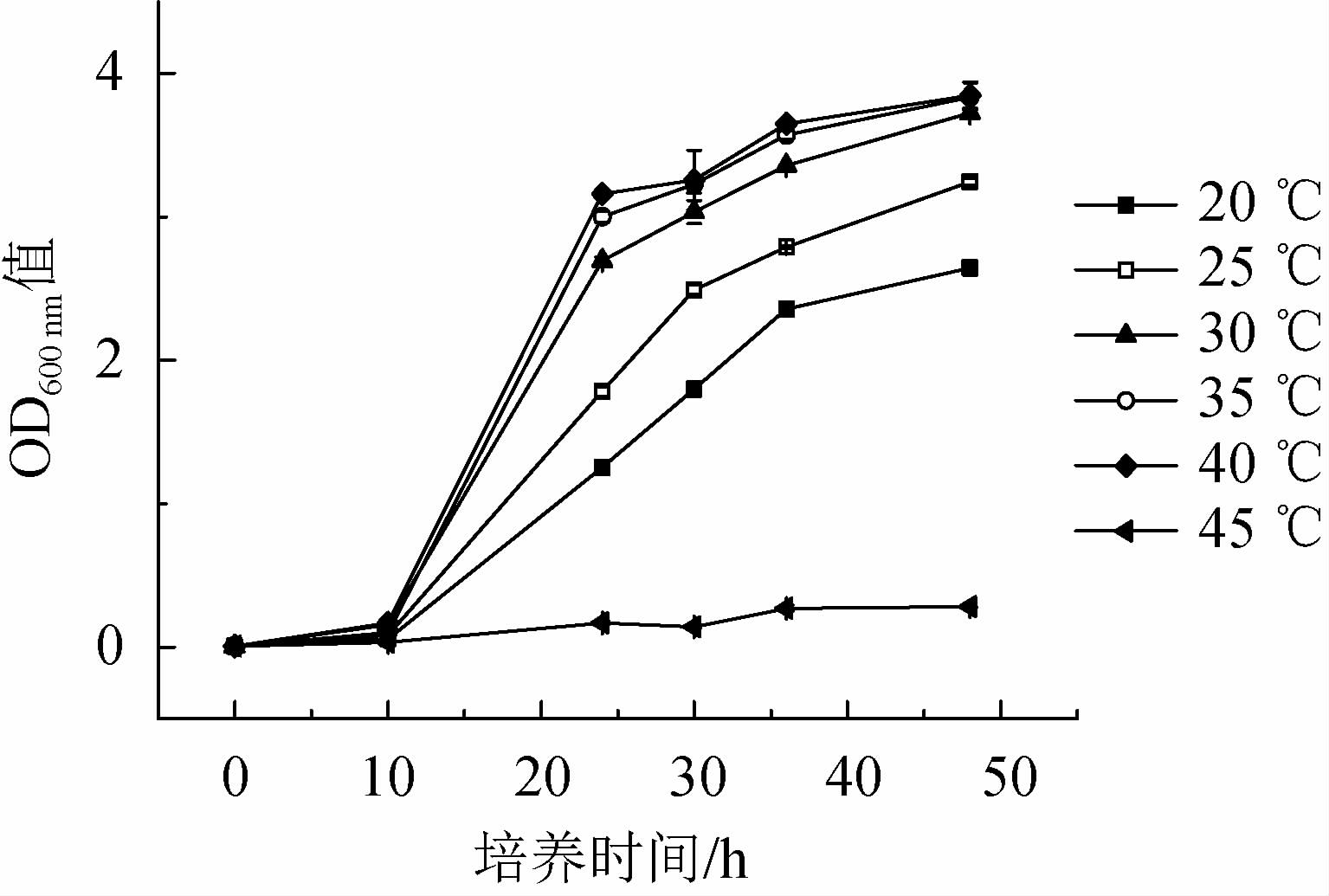
图7 不同培养温度对菌株YZ1生长的影响
Fig.7 Effect of different culture temperature on strain YZ1 growth
2.4 菌株YZ1胞外黏性代谢物分析
2.4.1 胞外黏性代谢物产量的变化
每隔5 d收集胞外黏性代谢物(见图8a),该产物在水中溶解性较差或不溶解,松散不紧实,水分含量较高。真空冷冻干燥后见图8b。干质量随时间的变化情况见图9。由图9可知,随着培养时间的增加,胞外黏性代谢物的产量不断积累,至30 d基本达到稳定,最高可达约20 g/L。
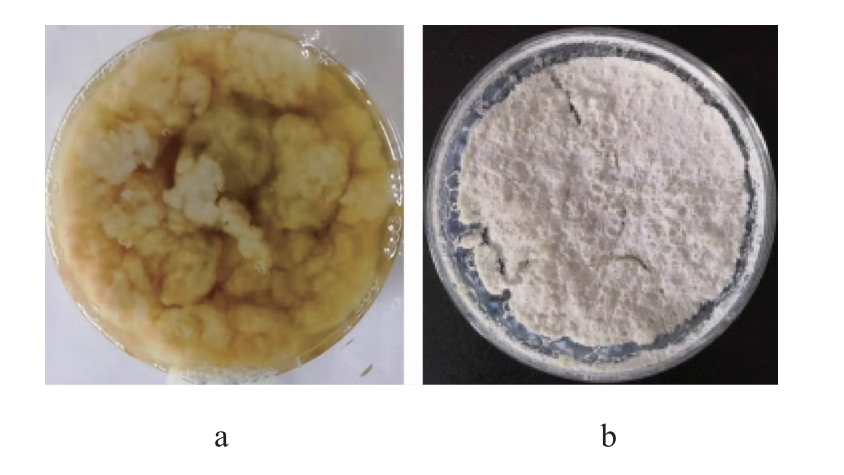
图8 菌株YZ1胞外黏性代谢物
Fig.8 Extracellular viscous metabolites of strain YZ1
a为水中的胞外黏性代谢物;b为冷冻干燥后的胞外黏性代谢物。

图9 菌株YZ1胞外黏性代谢物的积累量
Fig.9 Accumulation of extracellular viscous metabolites of strain YZ1
2.4.2 FT-IR分析胞外黏性代谢物主要官能团组成
利用FT-IR扫描胞外黏性代谢物在波数400~4 000 cm-1范围内的光谱图,分析物质中主要化学能团组成,扫描结果见图10。由图10可知,在波数3 425 cm-1处有一宽吸收峰,这是糖环中的-OH伸缩振动所致,此区域吸收峰的宽度和大小表明氢键的长度和取向的大小;在波数2 922 cm-1处的小吸收峰,为C-H不对称伸缩振动所致,此吸收峰与糖的特征吸收峰相对应;在波数1 639 cm-1处的吸收峰,为羧酸盐的C=O非对称伸缩振动所致,此处的吸收峰与蛋白质的特征吸收峰相对应;在波数1 452 cm-1,1 406 cm-1和1 238 cm-1处的弱吸收峰,为C-H变形振动所致;在波数1 087 cm-1处的吸收峰,为糖及其衍生物弯曲振动所致,该处的谱带归属于糖苷键,是糖的特征吸收峰[24-25]。由此可以判断该胞外黏性代谢产物中含有糖类、蛋白质及其分别对应的衍生物或聚合物等,成分复杂,物质种类较多。
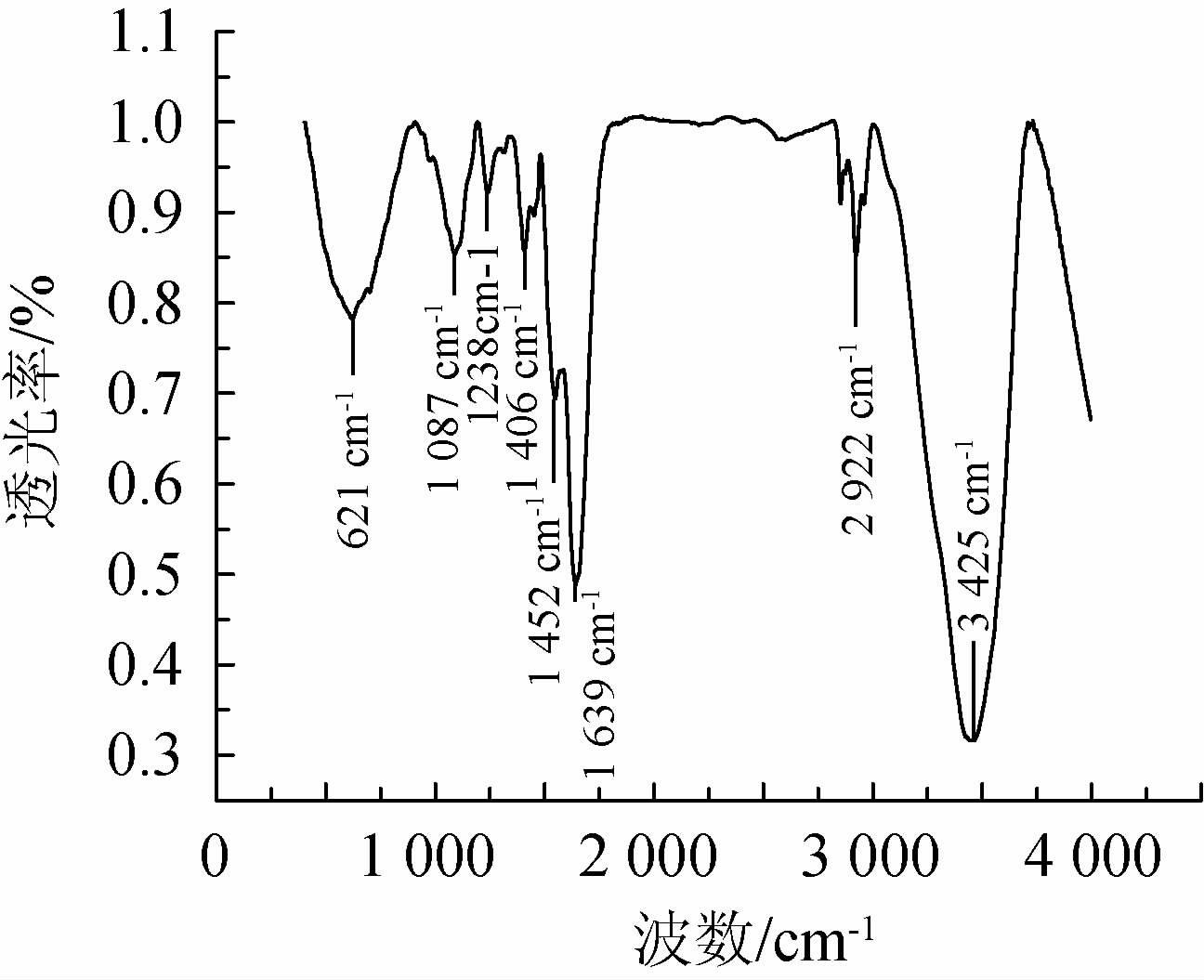
图10 菌株YZ1胞外黏性代谢物傅里叶变换红外光谱图
Fig.10 Fourier transform infrared spectroscopy of extracellular viscous metabolites of strain YZ1
2.4.3 GC-MS检测胞外黏性代谢物组分
利用GC-MS对菌株YZ1胞外黏性代谢产物的组成成分进行检测,结果见表1。由表1可知,共检测到59种组分,包括22种氨基酸、10种糖类、8种脂肪酸、3种胺类、4种醇类、5种酸类、1种烷类及6种其他类物质。其中氨基酸、糖类和脂肪酸含量较高,如谷氨酸、L-脯氨酸、L-赖氨酸、D-半乳糖、棕榈酸、硬脂酸等。结合红外光谱扫描的结果,蛋白质及糖类特征官能团的对应峰明显,故可以推测该胞外产物主要成分为糖蛋白或脂蛋白类物质。
表1 GC-MS检测菌株YZ1胞外黏性代谢物的组成及含量
Table 1 Composition and contents of extracellular viscous metabolites of strain YZ1 detected by GC-MS

续表

3 结论
本研究从盐生杜氏藻培养废弃液中筛选得到一株能够产生胞外黏性代谢物的嗜盐菌YZ1,经形态观察及分子生物学技术鉴定其为Halomonas subterranea。菌株YZ1的对数生长期为12~28h,最适生长NaCl质量浓度为30~150g/L,最适生长初始pH值为7.0~8.0,最适生长温度为30~40 ℃。菌株YZ1发酵30 d 时,胞外黏性代谢物产量为20 g/L,初步鉴定其主要成分为糖蛋白或脂蛋白类物质。
[1]刘爱民.嗜盐菌的研究进展[J].安徽师范大学学报(自然科学版),2002,25(2):181-184.
[2]马玉涛,朱铁群,田秉晖,等.中度嗜盐菌Halomonas sp.STSY-3 的耐盐特性研究[J].安徽农业科学,2012,40(10):6071-6073.
[3]周旭华,王勇,吴敏.舟山地区嗜盐菌的分离和产胞外多糖菌株的筛选[J].浙江大学学报(理学版),2007,34(3):335-339.
[4]杨砚.中度嗜盐菌新种Pontibacillus yanchengensis sp.nov.的鉴定与多相分类学研究[D].武汉:华中农业大学,2010.
[5]MILVA P,ATTILIO C,GIANFRANCO L,et al.An antarctic psychrotrophic bacterium Halomonas sp.ANT-3b,growing on n-hexadecane,produces a new emulsyfying glycolipid[J].Fems Microbiol Ecol,2010,53(1):157-166.
[6]CHEN X B,YIN J,YE J W,et al.Engineering Halomonas bluephagenesis TD01 for non-sterile production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate)[J].Bioresource Technol,2017,244(1):534-541.
[7]龙启福,朱德锐,韩睿,等.嗜盐菌相溶物质合成与转运调节机制[J].环境科学与技术,2011,34(9):63-66.
[8]刘颖,徐薇薇,郭平,等.海洋石油降解菌Halomonas sp.DH1 产生物表面活性剂的性能[J].中国航海,2018,41(4):115-118.
[9]LI W G.Isolation and identification of moderately halophilic bacterium and enhanced treatment of hypersaline tanning wastewater by the bacterium[J].J South China Univ T,2008.
[10]李超敏,王加宁,邱维忠,等.高效降解石油细菌的分离鉴定及降解能力的研究[J].生物技术,2007,17(4):80-82.
[11]GONG F,WANG J,LI J.Isolation and characterization of peroxiredoxin1 gene of Dunaliella salina[J].Gene,2017,635:39-45.
[12]KAWATA Y,JIN Y X,NOJIRI M.Efficient secretion of(R)-3-hydroxybutyric acid from Halomonas sp.KM-1 cultured with saccharified Japanese cedar under microaerobic conditions[J].Bioresource Technol,2013,140(7):443-445.
[13]李能章,彭远义.一株芦荟抗菌内生细菌的分离鉴定及生物学性质研究[J].生物技术通讯,2004,15(2):141-145.
[14]贾宇声,王兴兴,潘迎捷,等.西藏开菲尔粒中Lactobacillus kefiri 的分离与鉴定[J].上海海洋大学学报,2018,27(1):141-148.
[15]YUN S H,IN S B,PARK D H.Influence of NaCl on the growth and metabolism of Halomonas salina[J].J Microb Biot,2005,15(1):118-124.
[16]蔺旭光,李佳怡,牛天明,等.一株猪肺炎木糖氧化杆菌分离鉴定及系统进化树分析[J].中国人兽共患病学报,2017,33(10):908-911.
[17]CLARRIDGE J E 3RD.Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases[J].Clin Microbiol Rev,2004,17(4):840-862.
[18]SUSI H,BYLER D M.Protein structure by Fourier transform infrared spectroscopy:second derivative spectra[J].Biochem Bioph Res Co,1983,115(1):391-397.
[19]COIMBRA M A,BARROS A,BARROS M,et al.Multivariate analysis of uronic acid and neutral sugars in whole pectic samples by FT-IR spectroscopy[J].Carbohyd Polym,1998,37(3):241-248.
[20]吕和鑫,齐兵兵,崔相敢,等.氮源、磷源、硫源共同饥饿胁迫下盐生杜氏藻代谢响应分析[J].天津科技大学学报,2018,33(6):9-15.
[21]LI H,MA M L,LUO S,et al.Metabolic responses to ethanol in Saccharomyces cerevisiae using a gas chromatography tandem mass spectrometry-based metabolomics approach[J].Int J Biochem Cell Biol,2012,44(7):1087-1096.
[22]夏建飞,梁琼麟,胡坪,等.代谢组学研究策略与方法的新进展[J].分析化学,2009,37(1):136-143.
[23]刘莹,张继天,史雅颖.嗜盐菌的研究进展[J].科技创新与应用,2017(8):22-22.
[24]WOLKERS W F,OLIVER A E,FERN T,et al.A Fourier-transform infrared spectroscopy study of sugar glasses[J].Carbohyd Res,2004,339(6):1077-1085.
[25]于修烛,杜双奎,王青林,等.傅里叶红外光谱法油脂定量分析研究进展[J].中国粮油学报,2009,24(1):129-136.