根霉菌[1]为毛霉科,根霉属,是自然界中广泛存在的一类真菌,为我国数种传统发酵食品的重要优势菌[2],被大量用于米酒、黄酒的糖化过程[3-4]。根霉在生长过程中能产生大量的淀粉酶、糖化酶[5-6]、蛋白酶[7]、脂肪酶[8-10],而且还能产生苹果酸、富马酸、乳酸、琥珀酸等有机酸[11-13],被广泛应用于医药、食品、化工和能源等众多领域[14-15]。
根霉为丝状真菌,能在固态培养模型下生长,以顶端细胞延伸和分枝进行生长,根霉菌丝延伸过程中受到培养基的含水量和蓬松程度的影响[16],气生菌丝容易形成孢子,导致固态培养载体上生长不均,形成的代谢产物差异性较大[17]。
根霉菌的固态发酵,其种子质量成为固态发酵成功的重要指标。而使用的种子常采用液态种子和固态种子[18]。固态种子在培养过程中经常出现种子污染问题和菌丝过早产生孢子现象,同时还会伴随着黑曲霉、青霉、细菌的污染。而液态培养根霉,根霉菌丝生长在水中由于受阻力小,菌丝延伸容易,形成的菌丝体也比较粗壮,但培养后期菌体容易受摇床的回旋作用导致菌丝容易缠绕成团,呈絮凝团状,菌丝体分散度差,作为液体种子会导致接种不均匀,菌丝生长不均衡,代谢产物差异较大,不利于作为固态发酵的液体种子使用。
本实验采用黑根霉(Rhizopus nigricans)Q3Y作为实验菌株,通过液体发酵方式,调节液体发酵液中的游离水,以琼脂多糖吸水特性,吸附游离水形成胶体物,形成缺水现象,模拟固态发酵模式,研究该菌株的生长特性,分析不同黏度下菌丝生长的情况。
糯米作为一种重要的淀粉质原材料,具有黏性,加水形成的培养基黏性高,和设置的黏性液体发酵模型相类似,通过以糯米培养液为测试对象,分析了糯米发酵制糖过程中可溶性总糖、还原糖、寡糖和菌株产糖化酶的变化规律,为制备功能性发酵黑糖降低能耗和缩短操作环节,为高浓度寡糖浆[19],功能性寡糖[20-21]的可行性制备提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
黑根霉(Rhizopus nigricans)Q3Y菌种:云南师范大学生命科学学院微生物实验室保存;马铃薯(云南合作88)、糯米(昆明富民产地):市售。
1.1.2 化学试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):上海蓝季生物公司;可溶性淀粉(生化试剂):菱湖精细化工厂;琼脂粉、麦芽糖(均为生化试剂):上海蓝季生物公司;氢氧化钠(分析纯):上海试验四赫维化工有限公司;酒石酸钾钠(分析纯):上海申博化工有限公司;无水亚硫酸钠(分析纯):上海国药集团化学试剂有限公司;苯酚(分析纯):重庆川东化工(集团)有限公司。
1.1.3 培养基
种子活化采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:新鲜土豆切块,称取40.0 g,加入200 mL水,放入打浆机中捣浆,装到500 mL烧杯中,煮沸10 min,200目滤袋过滤,调节过滤液pH值为7.0,加入4.8 g琼脂粉,搅拌后,包扎,放入高压蒸汽灭菌锅中,在121 ℃灭菌30 min,冷却到60 ℃,每个灭菌的培养皿中倒入15.0 mL,制备PDA平板。
种子培养基:新鲜土豆切块,称取40.0 g,加入160.0 mL水,放入打浆机中捣浆,装到500.0 mL的烧杯中,煮沸10 min,200目滤袋过滤,调节过滤液pH为7.0。取250.0 mL的三角瓶,每个瓶中装入100.0 mL土豆汁溶液和0.5 g琼脂粉,摇晃均匀后包扎,放入高压蒸汽灭菌锅中,在121 ℃灭菌30 min,冷却待用。
1.2 仪器与设备
TGL-16B高速离心机:上海安亭科学仪器厂;UV-5100紫外可见分光光度计:上海元析仪器有限公司;WAY-2w阿贝折光仪:上海光学仪器厂;NDJ-5S数显黏度计:上海平轩科学仪器有限公司;XZ-J20B打浆机:中山市富卓电器有限公司;DEL7a 320 pH计:梅特勒托利多公司;DHP-9082电热恒温培养箱:上海一恒科学仪器有限公司;DK-98-11电热恒温水浴锅:天津泰斯特仪器有限公司;MQL-621R迴转式摇床:上海旻泉仪器有限公司;CX22LEDRFS1 奥林巴斯显微镜:日本奥林巴斯公司。
1.3 试验方法
1.3.1 黑根霉Q3Y菌种的活化及种子液的制备
菌种活化:取灭菌的PDA平板,使用接种环挑取黑根霉Q3Y表面上的孢子在平板上画线,置于28 ℃的培养箱中培养48 h,待种子长满整个平板,取出放在4 ℃冰箱保藏。
种子液的制备:取种子培养基,挖起平板中的菌种块约φ2 cm,接种到种子液中,包扎好后放在28 ℃、转速180 r/min的摇床上培养48 h。
1.3.2 黏度的测定
将黏度计用水清洗干净且擦干,调节黏度计水平状态,而后将2#转子放入样品中进行测定,记录数值。
1.3.3 糖化酶酶活力的测定[6]
葡萄糖标准曲线的制作:配制质量浓度为1.0 mg/mL的标准葡萄糖溶液,用试管分别取0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1.0 mL的葡萄糖溶液,依次补水1.9 mL、1.8 mL、1.7 mL、1.6 mL、1.5 mL、1.4 mL、1.3 mL、1.2 mL、1.1 mL、1.0 mL,再向每个试管中分别加入3.0 mL DNS溶液,放入沸水浴中煮沸5.0 min,冷却,定容为至15.0 mL,混匀,于波长540 nm条件下测定吸光度值(OD540nm值),以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,制作葡萄糖标准曲线,得到回归方程y=0.473x-0.019,相关系数R2为0.999。
糖化酶酶活定义:在50 ℃,pH 4.5的条件下,每分钟水解10.0 mg/mL的淀粉底物溶液产生1 μmol葡萄糖所需的酶量定义为一个酶活单位(U)。
1.3.4 可溶性总糖及还原糖含量的测定
纱布过滤根霉菌株Q3Y培养液,使用移液器吸取过滤液到1.5 mL离心管中,于15 000 r/min条件下离心5.0 min,收集上清液,待用。
可溶性总糖的测定:取上清液,用阿贝折射仪进行可溶性总糖测定;
还原糖的测定:取离心上清液0.1 mL加入干净试管中,加入1.8 mL水,加入3.0 mL DNS试剂,在沸水浴中反应5.0 min,取出冷却,加入10.0 mL单蒸水,混合均匀;空白管中加入2.0 mL单蒸水和3.0 mL DNS试剂,在沸水浴中反应5.0 min,取出冷却,加入10.0 mL单蒸水,混合均匀。以空白管为对照,在波长540.0 nm条件下比色,测定OD540nm值,通过葡萄糖标准曲线回归方程计算还原糖含量。
1.3.5 土豆培养基黏度对菌株Q3Y种子生长的影响
取400 g新鲜土豆,切块,加入400 mL水,放入打浆机中捣碎,定容至2 000 mL,煮沸,200目滤袋过滤得上清液分装15个三角瓶,每瓶装100.0 mL,琼脂粉添加量分别为0、0.10%、0.25%、0.50%、1.00%,每个水平重复3次,置于高压蒸汽灭菌锅中于0.1 MPa、121 ℃条件下灭菌30 min,冷却到25 ℃,使用黏度计测定培养基的黏度。
在每瓶含20%的土豆汁培养基中分别添加琼脂粉含量为0、0.10%、0.25%、0.50%、1.00%,于121 ℃条件下灭菌30 min。待冷却后,在超菌台中取根霉Q3Y平板的菌丝块(约φ2 cm)接入到三角瓶中,接种量约为3%。接种后置于28℃、180r/min条件下摇床培养35~40 h,取菌丝体通过显微镜观察细胞生长情况;取发酵液在15 000 r/min条件下离心5.0 min,取上清液测定还原糖及可溶性总糖含量。
1.3.6 糯米原料发酵分析
取8个300 mL三角瓶,糯米与蒸馏水的料水比分别为1∶10、2∶10、3∶10、4∶10、5∶10、6∶10、7∶10、8∶10(g∶mL),配制含水量为90.0%、83.3%、77%、71.4%、66.7%、62.5%,58.8%和55.0%的糯米培养基。将糯米培养基放置于0.1 MPa、115 ℃条件下蒸煮40 min,冷却至30 ℃,观察分析不同水分含量的糯米培养基的黏稠性及吸收膨胀状态。
取8个2 L的不锈钢盆,做好标记,糯米与蒸馏水的料水比分别为1∶10、2∶10、3∶10、4∶10、5∶10、6∶10、7∶10、8∶10(g∶mL),搅拌混匀使用纱布封口包扎,在115.0 ℃灭菌40.0 min,取出冷却,按糯米质量的10%接种量接种菌株Q3Y种子液,搅拌使糯米与黑根霉Q3Y菌种充分混合均匀,然后用保鲜膜密封盆口,放置于28 ℃恒温培养,培养24 h后,每隔12 h 取样测定发酵液中的pH、可溶性总糖及酶活力。
2 结果与分析
2.1 不同琼脂粉添加量对土豆汁培养基黏度的影响
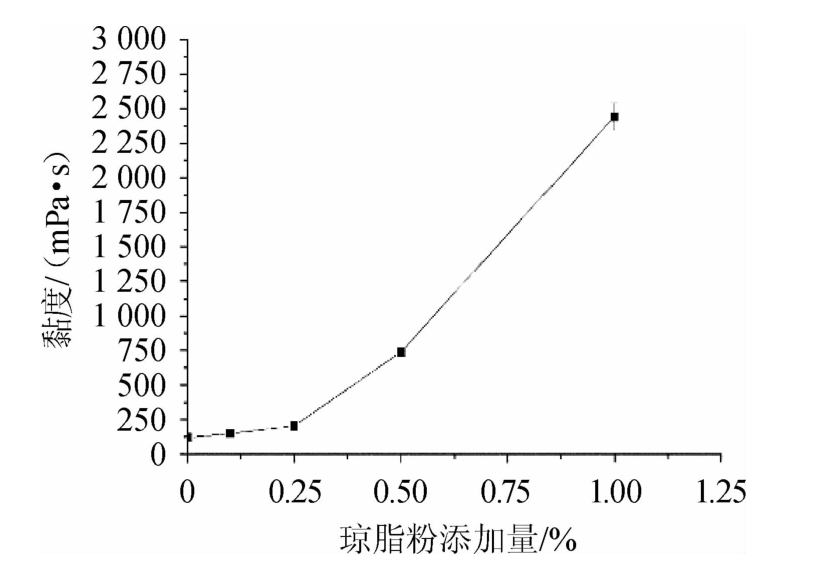
图1 琼脂粉添加量对土豆汁培养基黏度的影响
Fig.1 Effect of agar powder addition on viscosity of potato juice medium
由图1可知,土豆汁培养基起始黏度仅有100 mPa·s,由于黏度低,培养液浊度较清,形成的菌丝体生长较差;随着琼脂粉添加量增加,培养基的黏度快速增加;琼脂添加量为0.50%时,溶液黏度为500 mPa·s,根霉菌丝生长状态良好,菌悬液均匀,菌丝细腻,分散均匀,非常有利于液态培养根霉Q3Y菌株的生长;琼脂添加量为1.00%土豆汁培养基的黏度达到了2 500 mPa·s,液体的流动性变得非常差,发现黏度过大的土豆培养基中根霉菌丝体生长较差,而在添加琼脂少的培养液中成团,分散度弱,菌丝均匀度也是非常差。因此,通过适当增加黏度,提高溶液的张力,提高游离水的饱和度,无自由析出,模拟干旱胁迫效应,容易加速根霉菌丝细胞的深层培养,大量的菌丝细胞成为基内菌丝体,不易产生气生孢子。
2.2 土豆汁培养基黏度对菌株Q3Y细胞生长的影响
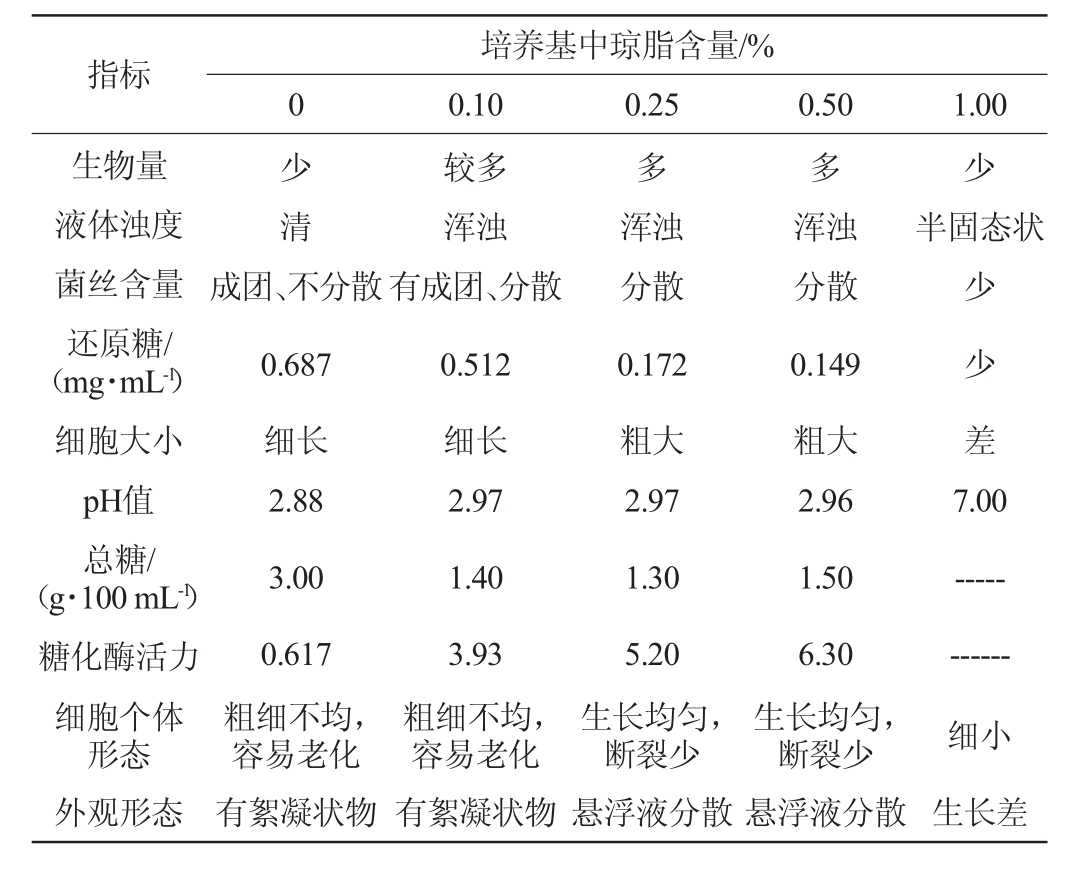
为了研究根霉在高黏度固态培养中菌丝生长状况及延伸情况,本实验在所使用的土豆培养基中添加了一定的琼脂,模拟糯米黏度的特性,让根霉在不同黏度的培养基中进行培养,结果见表1。由表1可知,在不同黏度的培养基中,种子的生长状况有所差异。4种不同黏度的培养基在种子的培养过程中,所产生的总糖和pH相差不大,但在菌丝生长形态上有着一定的差异。无添加琼脂的培养基和添加琼脂为0.10%形成的黏性培养基,其菌丝细胞较小,这可能是因为菌体在振荡培养过程中,由于培养液浊度较清,菌丝比较容易发生断裂,根霉菌具有一定的黏附性,在浊度较轻的培养液中,根霉菌的菌丝容易成团生长,不易分散,因此此种培养基黏度下,菌丝细胞较小。添加琼脂为0.50%的培养基黏度,能使根霉菌丝体的生长状态比较理想,通过显微镜观察可得,此黏度下的菌丝细胞比较均匀,这样可以使其更加容易在固态的培养基中延伸生长。因此,选择添加0.50%琼脂的土豆培养基更适于黑根霉Q3Y菌株的生长。
表1 培养基黏度对黑根霉Q3Y菌丝生长的影响
Table 1 Effect of medium viscosity on the mycelia growth of Rhizopus nigricans Q3Y
2.3 糯米原料发酵分析
2.3.1 不同含水量糯米的物理特性
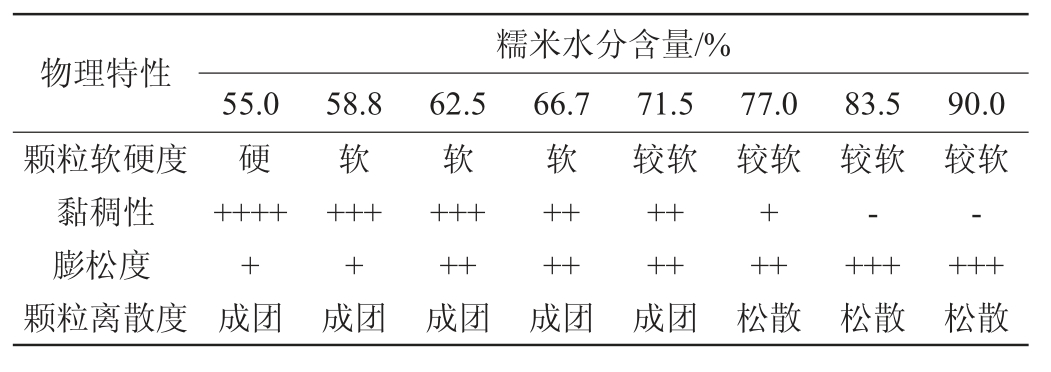
不同含水量的糯米物理特性分析结果见表2。由表2可知,含水量为58.8%和62.5%的糯米黏稠性和膨松度较好,颗粒软硬度适中,容易成团,有利于霉菌的生长,在该水分下的糯米特性属于固态发酵的特性,没有游离水,适合于根霉的生长。因此,根据糯米含水量的特性,为便于黑根霉的菌丝延伸及其生长,选择料水比为6∶10(g∶mL)(含水率62.5%)和7∶10(g∶mL)(含水率58.8%)的糯米培养基进行菌种发酵。
表2 不同含水量糯米的物理特性
Table 2 Physical properties of glutinous rice with different water contents
2.3.2 不同含水量糯米培养基发酵产物及原料利用率分析
实验设计了在相同接种量、培养温度条件下,根霉在料水比为1∶10、2∶10、3∶10、4∶10、5∶10、6∶10、7∶10、8∶10(g∶mL)的熟糯米培养基上的进行发酵培养,通过对可溶性总糖和还原糖的测定,分析了根霉生长对糯米淀粉的利用及原料利用率的影响,结果见图2。由图2a和2b可知,随着根霉菌培养时间的延长,伴随着菌丝细胞的延伸,糯米中的淀粉多糖被菌丝细胞水解形成水溶性多糖和还原糖,在料水比为6∶10(g∶mL)的发酵液中,当培养时间达到72 h时,可溶性总糖及还原糖含量分别为32 g/100 mL、26 g/100 mL,表明大量的淀粉被水解,可溶性总糖和还原糖呈正相关性,大量的可溶性总糖被逐渐转化为还原性单糖,这种现象也是符合根霉的双边发酵特性[20],边生长边水解淀粉,导致淀粉原料被彻底水解成还原糖。由图2c可知,料水比低的培养基中原料利用率最高,而在料水比为8∶10(g∶mL)的糯米培养基中,形成了高浓度糯米培养基,培养基含水率为55.6%,糯米颗粒硬,黏度高,颗粒蓬松度差,根霉生长水解72 h,原料的利用率只有14.8%。其原因主要是培养基中的糯米固形物浓度大,培养基中的游离水少,糖化酶在没有水分子参与条件下不能进一步催化水解淀粉,导致形成的还原糖产物较少;而游离水的减少导致糖苷水解糖类的催化能力降低,不利于代谢产物糖化酶对淀粉的降解。所以料水比越高,根霉菌丝体生长就弱,细胞延伸阻力大,形成的糖化酶产量也低。所以,在进行利用根霉进行制糖工艺研究中,使用料水比为6∶10(g∶mL)和7∶10(g∶mL)的培养基有利于发酵生产。

图2 黑根霉Q3Y发酵糯米水解产物各项指标分析
Fig.2 Analysis of hydrolysis product in Rhizopus nigricans Q3Y fermentation with glutinous rice medium
2.3.3 不同含水量糯米培养基发酵糖化酶活性分析
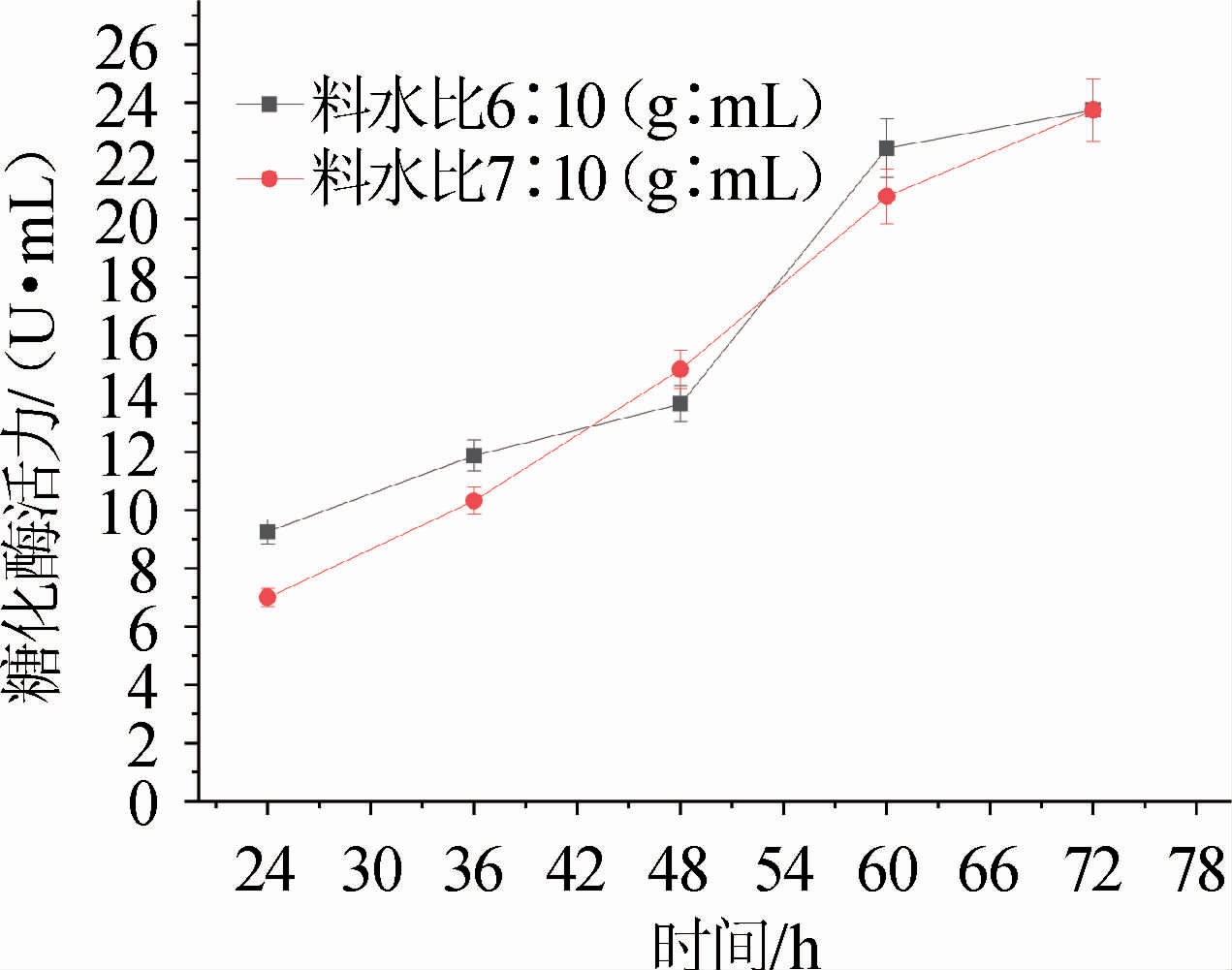
图3 黑根霉Q3Y发酵糯米培养基中糖化酶活力分析结果
Fig.3 Analysis results of glucoamylase activity in Rhizopus nigricans Q3Y fermentation with glutinous rice medium
将种子液接种到料水比为6∶10(g∶mL)和7:10(g∶mL)的糯米中进行培养24 h后,每隔12 h取样测定糖化酶活力,结果见图3。由图3可知,料水比为6∶10(g∶mL)和7∶10(g∶mL)的糯米培养液中的酶活随培养时间的增加而增高,且两者的产酶能力差异不大;还原糖含量随糖化酶活力增大而增加(见图2b),二者呈正相关。在料水比为6∶10(g∶mL)糯米培养液中,根霉发酵72 h,其糖化酶活力达到23.0 U/mL。
3 结论
本实验采用人为设置的胁迫环境,将黑根霉Q3Y菌株置于高黏度糯米培养基中进行培养,发现根霉在添加0.5%琼脂的培养基中生长良好,形成的培养悬浮液均匀稳定,培养后的菌丝形态分散,生物量高,菌丝细胞均匀。通过制备的种子液用于糯米发酵实验分析,结果表明根霉菌对糯米原料的分解能力非常好;在料水比为6∶10(g∶mL),含水量为62.5%的糯米培养基中的可溶性总糖能达到32g/100mL,还原糖能达到26g/100mL。在对代谢产物糖化酶分析中发现,根霉发酵72h,其糖化酶活力能达到23.0U/mL。表明通过调节培养基的黏液,胁迫菌丝细胞朝液体深层延伸、生长,是适合菌体生长的一种理想液体发酵培养模式,有利于延长菌丝体的生长周期,减少霉菌孢子的生成,提高生物量。
[1]MINNING S,SERRANO A,FERRER P,et al.Optimization of the highlevel production of Rhizopus oryzae lipase in Pichia pastoris[J].J Biotechnol,2001,86(1):59-70.
[2]刘金梅,张凤英.根霉在发酵工业与环境科学中的研究进展[J].生物技术通报,2013(11):26-33.
[3]南小华,李牧,陈福生.高产糖化酶根霉菌株的筛选、鉴定及其在孝感米酒中的应用[J].中国酿造,2018,37(9):88-93.
[4]刘芳,曹新志,任晓华.甜酒曲华根霉淀粉酶菌株紫外线诱变育种[J].中国酿造,2009,28(7):78-80.
[5]ESCARAMBONI B,FERNÁNDEZNU′ÑEZ E G,CARVALHO A F A,et al.Ethanol biosynthesis by fast hydrolysis of cassava bagasse using fungal amylases produced in optimized conditions[J].Ind Crop Prod,2018,112(2):368-377.
[6]张晓娟,陆震鸣,柴丽娟,等.中国传统酿造食品微生物生态学及其研究策略[J].中国科学,2019,45(5):575-584.
[7]LENNARTSSON P R,TAHERZADEH M J,EDEBO L.Encyclopedia of Food Microbiology(Second Edition)[M].Oxford:Academic Press,2014:284-290.
[8]CHEN G,MIAO M,JIANG B,et al.Effects of high hydrostatic pressure on Rhizopus chinensis lipase:II.Intermediate states during unfolding[J].Inn Food Sci Emerg Technol,2018,45(2):152-160.
[9]PITOL L O,FINKLER A T J,DIAS G S,et al.Optimization studies todevelop a low-cost medium for production of the lipases of Rhizopus microsporus by solid-state fermentation and scale-up of the process to a pilot packed-bed bioreactor[J].Process Biochem,2017,62(11):37-47.
[10]QUINTANA P G,CANET A,MARCIELLO M,et al.Enzyme-catalyzed preparation of chenodeoxycholic esters by an immobilized heterologous Rhizopus oryzae lipase[J].J Mol Catal B-Enzym,2015,118(8):36-42.
[11]FU Y Q,YIN L F,ZHU H Y,et al.High-efficiency L-lactic acid production by Rhizopus oryzae using a novel modified one-step fermentation strategy[J].Bioresource Technol,2016,218(10):410-417.
[12]刘亚,杨英,孙婷,等.米根霉发酵产L-苹果酸的工艺优化[J].食品科学,2015,36(11):100-109.
[13]刘宁,李霜,何皓,等.少根根霉利用木糖和葡萄糖分步发酵制备富马酸[J].过程工程学报,2008,8(4):794-797.
[14]徐晴,马小琛,付永前,等.根霉菌利用木质纤维素发酵生产有机酸的研究进展[J].中国生物工程杂志,2009,29(9):114-118.
[15]颜丽,刘秀河,李同乐.华根霉的研究进展及应用[J].中国酿造,2019,38(1):5-8.
[16]TANG X,LUO T,LI X,et al.Application and analysis of Rhizopus oryzae mycelia extending characteristics in solid-state fermentation for producing glucoamylase[J].J Microbiol Biotechn,2018,28(11):1865-1875.
[17]张晓娟,陆震鸣,柴丽娟,等.中国传统酿造食品微生物生态学及其研究策略[J].中国科学,2019,49(5):575-584.
[18]蔡君,王栋,徐岩.华根霉固态与液态培养产胞外蛋白的比较蛋白质组学分析[J].微生物学通报,2017,44(2):402-410.
[19]李兴革,李志江,牛广财,等.利用糖化酶水解马铃薯淀粉生产糖浆的工艺研究[J].中国酿造,2010,219(6):59-62.
[20]WANG C H,LAI P,CHEN M E,et al.Antioxidative capacity produced by Bifidobacterium-and Lactobacillus acidophilus-mediated fermentations of konjac glucomannan and glucomannan oligosaccharides[J].J Sci Food Agr,2008,88(7):1294-1300.
[21]LIU J,XU Q,ZHANG J,et al.Preparation,composition analysis,and antioxidant activities of konjac oligo-glucomannan[J].Carbohydr Polym,2015,130(5):398-404.