光是自然界中影响生物体发育和生理过程的重要信号,对真菌的生长发育和代谢产物合成有很大影响[1]。据研究报道,光变化会促使真菌重新编程其1/5的基因来改变生长发育模式,还能对无性或有性发育进行选择或对代谢产物进行重调[2-4]。如光能够促进构巢曲霉(Aspergillus nidulans)偏向有性发育,抑制无性发育。不同波长和不同颜色的光对丝状真菌有着不同的调控模式,红光抑制头绒泡菌(Physarum polycephalum)的光碎片化,而远红光则促进它的光碎片化[5]。绿僵菌(Metarhizium robertsii)在红光照射下产生的分生孢子对逆境的耐受最差,而蓝光和白光照射下,孢子对逆境的耐受较好[6]。
红曲霉是中国传统药食兼用菌种,可代谢产生多种生物活性物质,广泛应用于酿酒、制药等领域,其生长、发育、代谢等也同样受到光的调控。MIYAKE T等[7]研究发现,丛毛红曲霉(Monascus pilosus)经不同波长光照处理后,其菌丝的长短、疏密,无性孢子的形成量及有性孢子的萌发都发生相应的改变;BÜHLER R M M等[8-9]研究表明,红光可以促进红曲霉生长发育和色素产生;CHEN D等[10]研究发现,蓝光和照射时长都会影响红曲霉不同色素的合成。蓝光[11]抑制红曲霉中桔霉素的合成,白光[12]和蓝光[13]对红曲霉的生长发育和次级代谢产物产生的影响与培养基中的氮源密切相关。氮源代谢还受到昼夜节律的调控[14],蓝光可以增强硝酸还原酶的部分亚基活性诱导菌丝向有性发育分化,说明光反应和氮代谢之间存在联系[15]。岳倩倩等[16]研究发现,铵盐可以促进红曲霉的生长发育和代谢,同时,培养基的氮源和pH值也会影响安卡红曲霉(Monascus anka)的不同色素积累[17],6-呋喃氨基嘌呤(6-fur-turylaminopurine)可以提高红色素的产量、色素的光稳定性和发酵液色泽[18];SHI K等[17]研究发现,硫酸铵为氮源时,Monascus anka胞内色素主要是红色素,但当以蛋白胨为氮源时,胞内色素主要是黄色素。更换为鸡毛蛋白胨,则有利于紫色红曲霉(Monascus purpureus)所有色素的合成和积累[19]。因此,氮源对红曲霉的的生长发育和代谢也有重要的影响,而且和光调控存在相关性。
光和氮源对真菌的发育和代谢都有着重要的调控作用,两者之间也存在密切联系,但目前结合双因素对红曲霉的协同调控研究还不全面,为探究安卡红曲霉(Monascus anka)GZU4577中光调控与氮源代谢的关系,本研究采用红光与不同无机氮源相结合的方法,通过菌落观察、生长测量、分生孢子和闭囊壳合成数量检测以及色价的测定,研究红光和氮源对Monascus anka GZU4577的调控情况,为后续深入研究光与氮源协同调控途径提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
安卡红曲霉(Monascus anka)GZU4577:本实验室分离保藏。
1.1.2 培养基
沙氏琼脂改良培养基:麦芽糖5 g,蛋白胨10 g,葡萄糖20 g,酵母膏5 g,琼脂20 g,蒸馏水1 000 mL,pH值自然,121 ℃高压灭菌25 min。
无氮源察氏(Czapek)培养基:K2HPO4 1 g,KCl 0.5 g,MgSO4 0.5 g,FeSO4 0.01 g,蔗糖30 g,琼脂15 g,蒸馏水1 000 mL,pH自然,121 ℃高压灭菌25 min。
调控培养基:向无氮源Czapek培养基中分别添加NH4NO3 10 g/L、NH4Cl 10 g/L、NaNO3 10 g/L作为氮源。
1.1.3 化学试剂
NH4NO3、NH4Cl、NaNO3(均为分析纯):重庆北碚精细化工厂;K2HPO4、KCl、MgSO4、FeSO4(均为分析纯):天津市科密欧化学试剂有限公司;麦芽糖、蛋白胨、葡萄糖、酵母膏(均为生化试剂):上海盛思生化科技有限公司。
1.2 仪器与设备
SW-CJ-1F标准型净化工作台:苏州净化设备有限公司;DH-360A恒温培养箱:天津市实验仪器厂;Motic1300光学显微镜:陕西麦迪奥医药科技有限公司;YX280B高压灭菌锅:上海申安医疗器械厂;115 cm/28 W单色光源灯管:日本日立公司;Multiskan FC酶标仪:赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 培养方法
以无氮源Czapek培养基作为对照(CK),将安卡红曲霉GZU4577接种于沙氏琼脂改良培养基,30 ℃条件下培养16 h,用无菌水洗下孢子,转入带有玻璃珠的无菌三角瓶中,振荡,充分打散孢子,三层擦镜纸过滤,经孢子计数,制成终浓度为1×106 CFU/mL的均一孢子悬液。取10 μL孢子悬液分别接种于无氮源察氏培养基和调控培养基中心(每组重复3次),分别置于红光(波长690~700 nm)(光照强度为449.94 Lux)、黑暗条件下,28 ℃连续培养9 d。
1.3.2 形态观察
每隔24 h拍照,观察菌落形态、隆起度及变色时间,采用游标卡尺测量菌落直径,采用光学显微镜观察气生菌丝、孢子及边缘菌丝的变化。
1.3.3 色素提取及测定方法
将培养好的安卡红曲霉GZU4577烘干,测定干质量,研碎,置于带塞试管中,加入10 mL体积分数为80%的乙醇,避光浸提5 h,获得色素粗提物。稀释一定倍数后,置于酶标仪中,分别在波长510 nm、465 nm、410 nm处测定其吸光度值。其中以波长510 nm处的吸光度值代表红色素,465 nm处的吸光度值代表橙色素,410 nm处的吸光度值代表黄色素。根据吸光度值计算色价,其计算公式如下:
1.3.4 孢子数计数方法
安卡红曲霉GZU4577培养9 d后,采用内径为10 mm的打孔器在菌落上均匀打孔,置于含有玻璃珠的三角瓶内,加入10 mL 0.2%Tween80溶液,漩涡振荡洗孢子,采用显微镜计数闭囊壳,四层擦镜纸过滤后,采用血球计数板对分生孢子进行计数[20]。
1.3.5 分析方法
每个实验重复3次,使用SPSS Statistics 17.0软件进行数据分析;采用Origin 9.0软件绘图。
2 结果与分析
2.1 红光结合不同无机氮源对安卡红曲霉GZU4577生长的影响
红光结合不同无机氮源对安卡红曲霉GZU4577生长的影响见图1、图2及表1。

图1 红光结合不同无机氮源对安卡红曲霉GZU4577菌落形态的影响
Fig.1 Effect of red light combined with different inorganic nitrogen sources on colony morphology of Monascus anka GZU4577
CK:无氮源添加;NaNO3:NaNO3作为唯一氮源;NH4Cl:NH4Cl作为唯一氮源;NH4NO3:NH4NO3作为唯一氮源;R:红光;D:黑暗。下同。
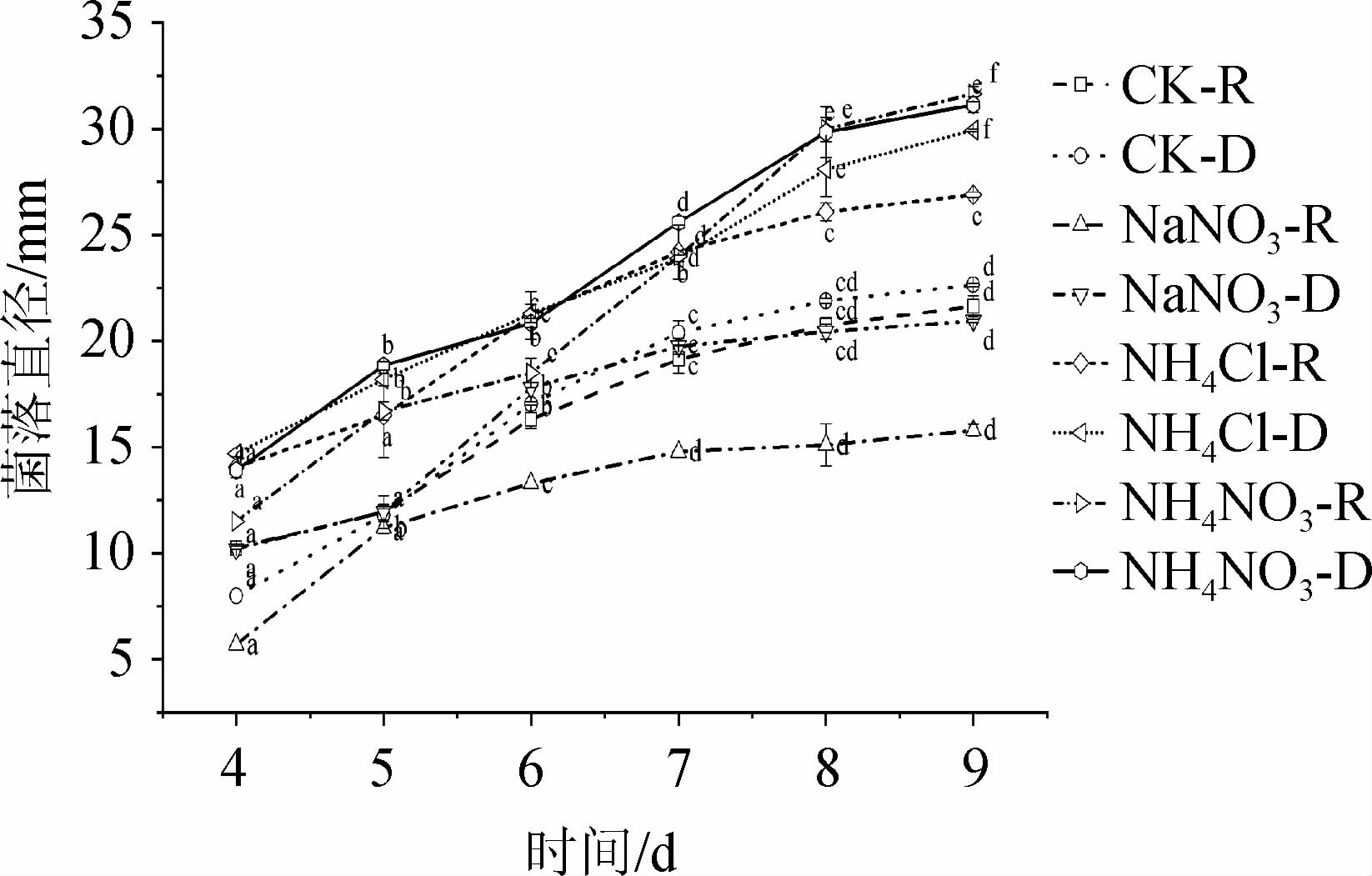
图2 红光结合不同无机氮源对安卡红曲霉GZU4577菌落直径的影响
Fig.2 Effect of red light combined with different inorganic nitrogen sources on Monascus anka GZU4577 colony diameter
不同字母代表差异性显著(P<0.05)。下同。
表1 红光结合不同无机氮源对安卡红曲霉GZU4577菌落形态(28 ℃培养9 d)特征的影响
Table1 Effect of red light combined with different inorganic nitrogen sources on Monascus anka GZU4577 colony morphology(culture at 28 ℃for 9 d)
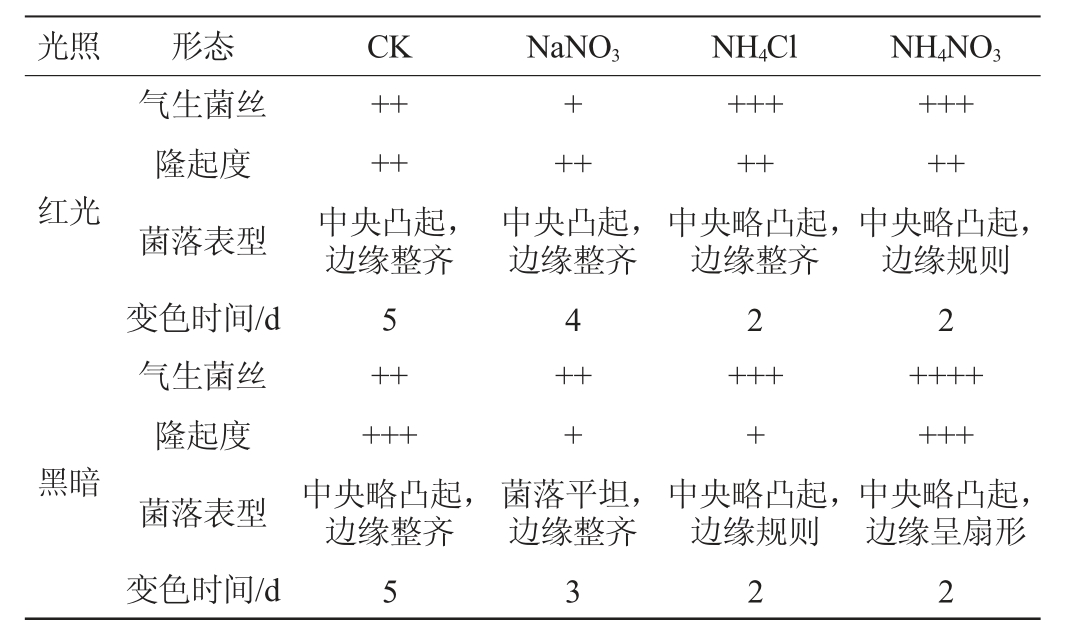
注:“+”表示菌丝非常稀薄;“++”表示菌丝稀薄;“+++”表示菌丝稠密;“++++”表示菌丝非常茂盛。
由图1、图2及表1可知,与黑暗条件相比,当无氮源添加时,在生长前期(4 d),红光照射使气生菌丝较黑暗条件下浓密,隆起度略高,但在生长后期(9 d),红光照射下菌落较小,气生菌丝隆起度较低,气生菌丝稠密程度一致,只是边缘菌丝略稀薄,气生菌丝均为淡粉色。当培养4 d时,红光条件下菌落直径显著>黑暗条件下的菌落直径(P<0.05),但随着培养时间的推移,菌落直径之间无显著性差异(P>0.05),说明在无氮源添加的情况下,红光不能促进或者抑制菌落的径向生长,该结果与MIYAKE T等[7]研究结论一致,红光对菌落大小没有显著影响。当添加不同无机氮源后,红光的影响规律发生变化。当以NaNO3为唯一氮源时,红光显著抑制菌落的径向生长(P<0.05),培养至9 d时,菌落直径为15.8 mm,几乎没有气生菌丝,菌苔稀薄,变色时间晚(4 d),说明NaNO3的存在使红光抑制菌落的生长。当以NH4Cl为唯一氮源时,红光条件下的菌落形态颜色深红,而黑暗条件下菌落颜色呈橙色,菌落的气生菌丝及隆起度与黑暗条件下相近。菌落的径向生长在黑暗条件下略显优势,但是差异不显著(P>0.05),菌株边缘规则,菌落平坦,气生菌丝生长良好,变色时间短(2 d)。当以NH4NO3为唯一氮源时,黑暗条件下的气生菌丝非常茂盛,红光条件下菌落的气生菌丝逊色于黑暗条件,隆起度也较低。且黑暗条件下菌落边缘呈放射性扇形,而红光条件下菌落呈规则圆形。红光照射下菌落的颜色呈暗红,而黑暗条件下菌落的颜色更偏橙黄色。培养初期(5 d和6 d)黑暗条件显著促进菌落的径向生长(P<0.05),但是在生长后期(7 d和8 d)红光和黑暗条件下菌落直径无显著差异(P>0.05)。
2.2 红光结合不同无机氮源对安卡红曲霉GZU4577分生孢子和闭囊壳的影响
红光结合不同无机氮源对安卡红曲霉GZU4577分生孢子和闭囊壳的影响见图3。
由图3可知,在无氮源添加时,红光照射条件下,分生孢子和闭囊壳生成量分别为22.53×106CFU/mL、1.39×103CFU/mL;黑暗条件下,分生孢子生成量只有6.57×106 CFU/mL,且未检测到闭囊壳,说明红光能促进安卡红曲霉GZU4577分生孢子及闭囊壳的生成,有利于安卡红曲霉GZU4577分别进入无性生殖和有性生殖。添加无机氮源后,红光对安卡红曲霉GZU4577的分生孢子和闭囊壳的影响发生改变,当以NaNO3为唯一氮源时,在红光条件下,安卡红曲霉GZU4577的闭囊壳和分生孢子的数量均显著低于黑暗条件(P<0.05),说明NO3-的存在下,红光抑制安卡红曲霉GZU4577的分生孢子及闭囊壳的生成。当以NH4Cl为唯一氮源时,在红光条件下,安卡红曲霉GZU4577的闭囊壳数量显著低于黑暗条件(P<0.05),而分生孢子的生成量却显著高于黑暗条件(P<0.05),说明NH4+的存在使得红光促进了安卡红曲霉GZU4577的无性发育,抑制有性发育。当以NH4NO3为唯一氮源时,在红光条件下,安卡红曲霉GZU4577的闭囊壳和分生孢子量显著低于黑暗条件(P<0.05),说明NH4+和NO3-同时存在使得红光抑制安卡红曲霉GZU4577的分生孢子和闭囊壳的生成。因此,在一定量无机氮源存在情况下,黑暗有利于闭囊壳的形成,促使安卡红曲霉GZU4577进入有性生殖,与据文献报道的黑暗有助于构巢曲霉(Aspergillus nidulans)进入有性繁殖[15]的结论一致。

图3 红光结合不同无机氮源对安卡红曲霉GZU4577分生孢子和闭囊壳量的影响
Fig.3 Effect of red light combined with different inorganic nitrogen sources on conidia and cleistothecia of Monascus anka GZU4577
2.3 红光结合不同无机氮源对安卡红曲霉GZU4577产色素的影响
红曲色素是红曲霉非常重要的次级代谢产物,具有多种生理活性[21],选择最佳的色素合成条件具有重要意义。红光结合不同无机氮源对安卡红曲霉GZU4577产色素的影响见图4。
由图4可知,在无氮源添加时,各色素色价非常低,且红光与黑暗对色素的积累量没有显著影响(P>0.05);添加无机氮源后,无机氮源不同,红光对合成色素的影响不同。当以NaNO3为唯一氮源时,各色素色价非常低,且红光与黑暗对色素的积累量没有显著影响(P>0.05),但黄色素色价显著高于无NaNO3添加的条件,说明NaNO3可能对黄色素的合成有特殊促进作用。当以NH4Cl为唯一氮源时,红光条件下红色素(125.33 U/g)、橙色素(112.86 U/g)、黄色素(200.66 U/g)的色价均显著低于黑暗条件下各色素色价(P<0.05),说明NH4Cl存在时使得红光抑制色素的合成。当以NH4NO3为唯一氮源时,红光条件下红色素(98.99 U/g)、黄色素(149.69 U/g)、橙色素(87.18 U/g)的色价显著低于黑暗条件下(P<0.05)。以NH4Cl为唯一氮源时,各色素的色价显著高于其他试验组(P<0.05),相比于NaNO3和NH4NO3,NH4Cl是色素合成的最佳氮源。结果显示,红光对色素的色价的影响与是否氮源充足和氮源种类相关。
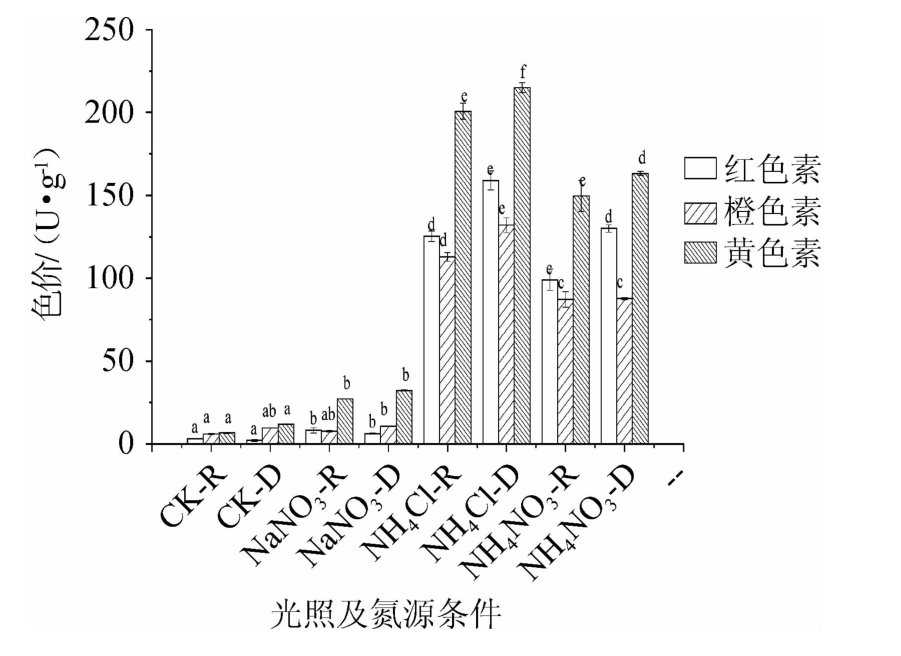
图4 红光结合不同无机氮源对安卡红曲霉GZU4577产色素的影响
Fig.4 Effect of red light combined with different inorganic nitrogen sources on pigment production by Monascus anka GZU4577
3 结论
基于无氮源察氏培养基,在无氮源添加条件下,红光照射对安卡红曲霉(Monascus anka)GZU4577径向生长和各色素的色价无显著影响(P>0.05),但显著促进了分生孢子和闭囊壳的生成(P<0.05);添加无机氮源后,红光对安卡红曲霉GZU4577的影响机制发生改变:添加NaNO3后,红光照射显著抑制安卡红曲霉GZU4577的径向生长和分生孢子、闭囊壳的生成(P<0.05),但对各色素色价无显著影响(P>0.05)。添加NH4Cl后,红光只抑制安卡红曲霉GZU4577的闭囊壳的生成和各色素的色价(P<0.05)。添加NH4NO3后,红光显著抑制了安卡红曲霉GZU4577的闭囊壳和分生孢子、红色素和黄色素的生成(P<0.05)。因此,红光对安卡红曲霉GZU4577的调控与培养基中的氮源存在与否以及氮源种类相关,该研究为安卡红曲霉GZU4577光调控研究提供了参考,为光信号与营养物质对红曲霉生长代谢的调控机理研究奠定了基础。
[1]SUZUKI T.Light-irradiation wavelength and intensity changes influence aflatoxin synthesis in fungi[J].Toxins,2018,10(1):31.
[2]BAYRAM Ö,FEUSSNER K,DUMKOW M,et al.Changes of global gene expression and secondary metabolite accumulation during light-dependent Aspergillus nidulans development[J].Fungal Genet Biol,2016,87:30-53.
[3]YU Z,FISCHER R.Light sensing and responses in fungi[J].Nat Rev Microbiol,2019,17(1):25-36.
[4]FULLER K K,DUNLAP J C,LOROS J J.Fungal light sensing at the bench and beyond[J].Adv Genet,2016,96:1-51.
[5]KAKIUCHI Y,TAKAHASHI T,MURAKAMI A,et al.Light irradiation induces fragmentation of the plasmodium,a novel photomorphogenesis in the true slime mold Physarum polycephalum:action spectra and evidence for involvement of the phytochrome[J].Photochem Photobiol,2001,73(3):324-329.
[6]DIAS L P,PEDRINI N,BRAGA G U L,et al.Outcome of blue,green,red,and white light on Metarhizium robertsii during mycelial growth on conidial stress tolerance and gene expression[J].Fungal Biol,https://doi.org/10.1016/j.funbio.2019.04.007.
[7]MIYAKE T,MORI A,KII T,et al.Light effects on cell development and secondary metabolism in Monascus[J].J Ind Microbiol Biotechnol,2005,32(3):103-108.
[8]BÜHLER R M M,MÜLLER B L,MORITZ D E,et al.Influence of light intensity on growth and pigment production by Monascus ruber in submerged fermentation[J].Appl Biochem Biotech,2015,176(5):1277-1289.
[9]WANG L,DAI Y,CHEN W,et al.Effects of light intensity and color on the biomass,extracellular red pigment,and citrinin production of Monascus ruber[J].J Agr Food Chem,2016,64(50):9506-9514.
[10]CHEN D,XUE C,CHEN M,et al.Effects of blue light on pigment biosynthesis of Monascus[J].J Microbiol,2016,54(4):305-310.
[11]ZHANG X,LIU W,CHEN X,et al.Effects and mechanism of blue light on Monascus in liquid fermentation[J].Molecules,2017,22(3):E385.
[12]薛原.发酵条件对红曲霉红曲素和桔霉素含量的影响[D].天津:天津科技大学,2015.
[13]张杰.温度和蓝光对红曲霉莫纳可林K 代谢调控的影响[D].天津:天津科技大学,2015.
[14]CORREA A,LEWIS Z A,GREENE A V,et al.Multiple oscillators regulate circadian gene expression in Neurospora[J].P Natl Acad Sci USA,2003,100(23):13597-13602.
[15]TISCH D,SCHMOLL M.Light regulation of metabolic pathways in fungi[J].Appl Microbiol Biotechnol,2010,85(5):1259-1277.
[16]岳倩倩,倪爱欣,周礼红.无机氮源对红曲霉调控初探[J].中国酿造,2016,35(12):48-52.
[17]SHI K,SONG D,CHEN G,et al.Controlling composition and color characteristics of Monascus pigments by pH and nitrogen sources in submerged fermentation[J].J Biosci Bioeng,2015,120(2):145-154.
[18]ZHANG X,WANG J,CHEN M,et al.Effect of nitrogen sources on production and photostability of Monascus pigments in liquid fermentation[J].IERI Procedia,2013,5:344-350.
[19]ORAK T,CAGLAR O,ORTUCU S,et al.Chicken feather peptone:A new alternative nitrogen source for pigment production by Monascus purpureus[J].J Biotechnol,2018,271:56-62.
[20]沈萍,陈向东.微生物学实验[M].第五版.北京:高等教育出版社,2019:100-103.
[21]苏东晓,张瑞芬,张名位,等.红曲色素生物活性研究进展[J].河南工业大学学报(自然科学版),2017,38(2):129-135.