柳州酸笋属于典型的泡菜,是将大头甜笋和井水混合后进行厌氧发酵而制成,主要的发酵菌株来源于井水和大头甜笋自身所携带的乳酸菌。如同其他泡菜一样,在酸笋发酵过程中容易产生亚硝酸盐,而亚硝酸盐的存在会对人体健康产生潜在危害[1]。过量的亚硝酸盐在人体内可转化为亚硝胺,而亚硝胺具有强烈的致癌作用[2]。人体长期摄入过量的亚硝酸盐可引发胃癌、肺癌等疾病产生[3-6]。此外,过量的亚硝酸盐会引起急性中毒,轻者出现头晕呕吐、全身乏力等症状;重者可引起呼吸困难、昏迷甚至窒息死亡[7]。有研究表明,许多乳酸菌如植物乳杆菌(Lactobacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)等[8-9]具有降解亚硝酸盐的能力,这些乳酸菌所产生的亚硝酸盐还原酶在降解亚硝酸盐上起到了重要作用[10-11]。杜晓华等[12-16]从多种酸制品中筛选出了降解亚硝酸盐的优良乳酸菌,而且这类降解亚硝酸盐的乳酸菌在乳酸肠球菌(Enterococcus lactococcus)、消化乳杆菌(Lactobacillus alimentarius)以及植物乳杆菌(Lactobacillus plantarum)中均有存在[17-18]。
柳州酸笋是柳州螺蛳粉的重要辅料,是形成柳州螺蛳粉的独特风味的重要成份。然而在发酵过程中具有产生亚硝酸盐的潜在可能性。因此,本研究用MRS-CaCO3培养基对酸笋发酵液中的乳酸菌进行分离,通过测定亚硝酸盐降解率,从柳州酸笋中筛选出降解亚硝酸盐的功能性乳酸菌,并研究影响其亚硝酸盐降解的因素,为今后开发降亚硝酸盐的微生态活性菌剂奠定基础,对无亚硝酸盐的优质酸笋研发具有重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
酸笋发酵液样品:采集于广西柳州市区、柳城县、鹿寨县,共33份样品。
1.1.2 化学试剂
蛋白胨、牛肉膏、酵母粉、琼脂粉、胰蛋白胨、多聚蛋白胨、细菌学蛋白胨(均为生化试剂):广东环凯微生物科技有限公司;葡萄糖、蔗糖、乳糖和可溶性淀粉、磷酸氢二钾、亚硝酸钠(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
MRS固体培养基、MRS液体培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
Eclipse E200生物显微镜:日本尼康公司;Master-S15超纯水机:上海和泰仪器有限公司;L9800基因扩增仪:北京莱普特科学仪器有限公司;GenoSens1880凝胶成像分析系统:上海勤翔科学仪器有限公司;UV-1800紫外可见分光光度计:上海美谱达仪器有限公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
将采集的酸笋发酵液稀释后,利用倾注法在含钙乳酸细菌MRS固体培养基上进行分离,挑选具有钙溶圈较大的菌落,于MRS固体平板上纯化2次后进行甘油保存。
1.3.2 降解亚硝酸盐乳酸菌的初筛
用无菌接种环取试管中保存的目标菌株1环,接种到MRS液体培养基中,于37℃培养10h,测定菌液在波长600nm处的吸光度值(OD600nm值),调整菌液的OD600nm值为0.6,将其作为种子液。然后将目标菌株按1%(V/V)的接种量接种于亚硝酸盐质量浓度为125 mg/mL 的MRS液体培养基中,37 ℃恒温静置培养24 h,取0.1 mL菌液置于10 mL离心管中,依次加入0.25 mL饱和硼砂溶液、0.1 mL亚铁氰化钾溶液、0.1 mL乙酸锌溶液和4 mL超纯水,混匀后于8 000×g离心1 min。取2.5 mL上清液加入10 mL离心管中,加入0.50 mL对氨基苯磺酸溶液,涡旋混匀后避光静置5 min,再加入0.25 mL盐酸萘乙二胺溶液和1.75 mL超纯水,涡旋混匀后避光静置10 min。于波长538 nm处测定吸光度值,绘制标准曲线,按照标准曲线回归方程计算亚硝酸盐含量,并按下式计算亚硝酸盐降解率。
式中:x为菌株的亚硝酸盐降解率,%;C0为原培养基中亚硝酸盐质量浓度,mg/mL;C1为测试样品质量浓度,mg/mL;100为换算系数。
1.3.3 降解亚硝酸盐乳酸菌的复筛
将目标菌株按1%的接种量(V/V)接种于亚硝酸盐含量为625 mg/mL的MRS液体培养基中,37 ℃恒温静置培养12 h,测定菌液中的亚硝酸盐含量,计算降解率,方法同上。
1.3.4 菌株的形态学观察[13]
将目标菌株在MRS固体培养基上进行培养,观察菌株菌落形态,再对菌株进行革兰氏染色,观察菌株细胞形态。
1.3.5 目标菌株的分子生物学鉴定
将目标菌株接种于MRS液体培养基中,于37℃、200r/min条件下振荡培养过夜,收集菌体并提取菌体的总DNA(具体方法参考试剂盒说明书)。以其为模板,用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TCCTCCGCTTATTGATATGC-3')对其16 S rDNA序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系:2×PCR Mix 10 μL,Primer 27F 0.5 μL,Primer 1492 R 0.5 μL,Tempted DNA 1.0 μL,ddH2O 8.0 μL。
PCR扩增程序:94 ℃预变性5 min;98 ℃变性30 s;50 ℃退火30 s;72 ℃延伸1min,循环30次;72 ℃延伸5 min。PCR扩增产物送至华大基因生物公司进行测序。
测序结果在美国国立生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic localalignmentsearch tool,BLAST)同源性搜索,选取同源性较高的模式菌株的16S rDNA序列,采用软件MEGA6.0中的邻接(neighborjoining,NJ)法构建系统发育树。
1.3.6 不同因素对乳酸菌降解亚硝酸盐能力的影响
碳源的确定:分别以同样浓度的蔗糖、乳糖和可溶性淀粉等碳源替代含625 mg/mL亚硝酸盐的MRS液体培养基中的葡萄糖,经过121 ℃、30 min灭菌处理冷却,将目标菌株的种子液按照1.0%(V/V)接种量接种到上述培养基中,于37 ℃恒温静置培养,分别在12 h、24 h、36 h、48 h、60 h取菌液进行亚硝酸盐含量测定,考察不同碳源对亚硝酸盐降解率的影响。
氮源的确定:分别以同样浓度的胰蛋白胨、细菌学蛋白胨和多聚蛋白胨等氮源替代含625 mg/mL亚硝酸盐的MRS液体培养基中的蛋白胨,经过121 ℃、30 min灭菌处理冷却,将目标菌株的种子液按照1.0%(V/V)接种量接种到上述培养基中,于37 ℃恒温静置培养,不同时间取菌液测定亚硝酸盐含量测定,考察不同氮源对亚硝酸盐降解率的影响。
接种量的确定:将目标菌株的种子液分别按0.5%、1.0%、2.0%、4.0%、6.0%(V/V)的接种量接种于含625 mg/mL的亚硝酸盐MRS液体培养基中,于37 ℃恒温静置培养,考察不同接种量对亚硝酸盐降解率的影响。
pH值的确定:将目标菌株的种子液按照1.0%(V/V)接种量分别接种到pH值为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0的并含有625 mg/mL的亚硝酸盐MRS液体培养基中,于37 ℃恒温静置培养,考察不同pH值对亚硝酸盐降解率的影响。
温度的确定:将目标菌株的种子液按1.0%(V/V)的接种量接种于含625 mg/mL的亚硝酸盐MRS液体培养基中,分别于22 ℃、27 ℃、32 ℃、37 ℃、42 ℃、47 ℃温度条件下进行静置培养,考察不同温度对亚硝酸盐降解率的影响。
1.3.7 数据处理与统计
所有实验数据重复3次,使用Excel2013进行标准偏差分析,用T-test进行差异性分析,用Origin9.0软件进行绘图分析。
2 结果与分析
2.1 降亚硝酸盐乳酸菌的筛选
2.1.1 乳酸菌的分离
利用MRS-CaCO3培养基对33份酸笋发酵液中的乳酸菌进行分离、得到22株形态均一的白色菌落,所有菌落周围都出现典型的溶钙圈,将其纯化后进行编号,分别为:LC-3-1、LC-3-2、LC-3-3、LC-3-4、LC-3-5、LC-3-6、LC-3-7、LC-3-8、LC-3-9、LC-3-10、LC-3-11、LC-3-12、LC-3-13、LC-3-14、LC-3-15、LC-3-16、LC-3-17、LC-3-18、LC-3-19、LC-3-20、LC-3-21、LC-3-22。
2.1.2 亚硝酸盐乳酸菌初筛和复筛
在125 mg/mL亚硝酸盐质量浓度下22株菌的亚硝酸盐降解率结果见表1。
表1 22株菌的亚硝酸盐降解率
Table 1 Degradation rates of nitrite of 22 strains
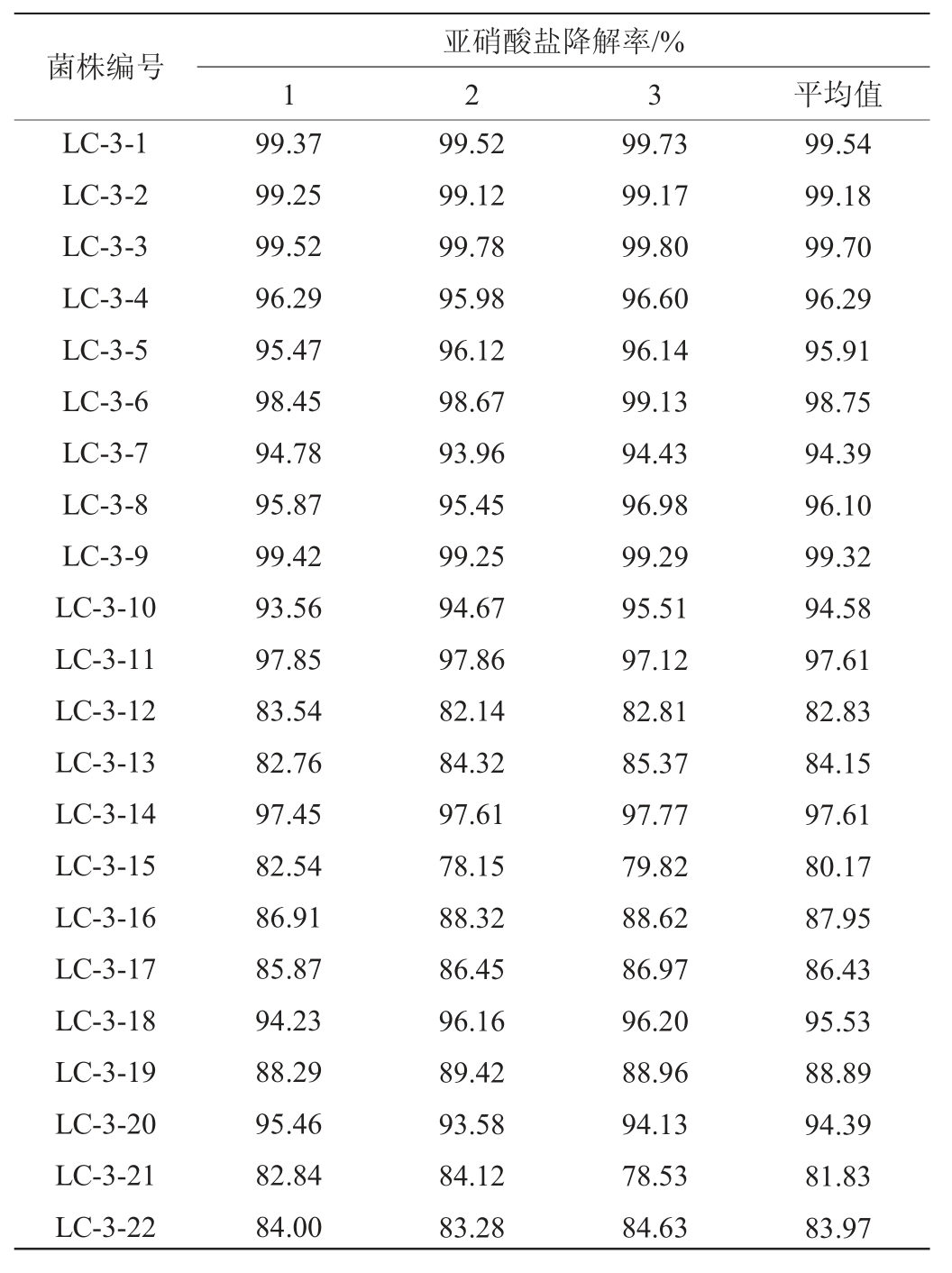
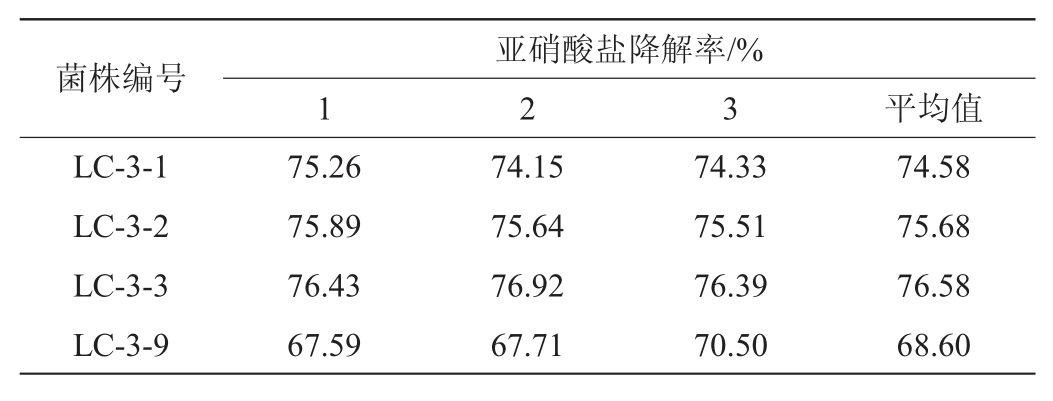
由表1可知,通过初筛比较22株候选菌株的亚硝酸盐降解率,其中,菌株LC-3-1、LC-3-2、LC-3-3和LC-3-9的亚硝酸盐降解率超过99%。对这四株菌亚硝酸盐降解率进行复筛,亚硝酸盐的降解能力大小依次为菌株LC-3-3>菌株LC-3-2>菌株LC-3-1>菌株LC-3-9,结果见表2。由表2可知,菌株LC-3-3亚硝酸盐降解率最大,平均值为76.58%。因此,对菌株LC-3-3进行下一步试验。
表2 625 mg/mL亚硝酸盐浓度下4株菌的亚硝酸盐降解率
Table 2 Degradation rates of nitrite of 4 strains at nitrite concentration of 625 mg/ml
2.2 菌株LC-3-3的形态学观察
菌株LC-3-3的菌落及细胞形态观察结果见图1。由图1A可知,菌株LC-3-3的菌落在MRS固体培养基中呈圆形,中等大小,凸起,微白色,湿润,边缘整齐,菌落背面为黄色。由图1B可知,菌株LC-3-3呈典型的革兰氏阳性,杆状、无芽孢,单细胞大小为(6.34×5.08)μm。
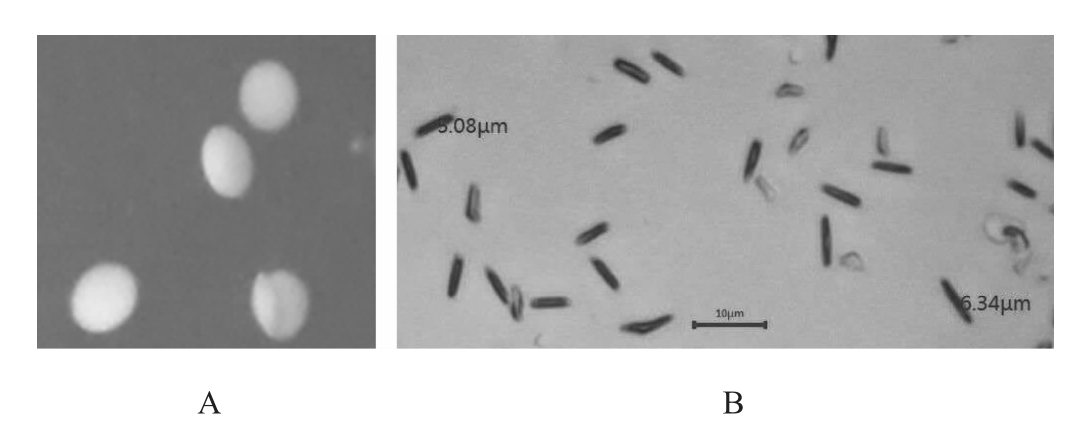
图1 菌株LC-3-3的菌落(A)及细胞(B)形态
Fig.1 Colony (A) and cell (B) morphology of strain LC-3-3
2.3 分子生物学鉴定
以菌株LC-3-3的基因组DNA为模板,以细菌鉴定通用引物27F及1492R为引物进行PCR扩增,采用1.2%琼脂糖凝胶电泳检测PCR扩增产物,结果见图2。由图2可知,PCR扩增产物在1 500 bp左右,与预期结果相符,送至测序公司进行测序。

图2 菌株LC-3-3 16S rDNA PCR扩增产物琼脂糖凝胶电泳图
Fig.2 Agarose gel electrophoresis of strain LC-3-3 16S rDNA PCR amplification products
M:DL2 000 DNA Marker;1:菌株LC-3-3;2:空白对照。
菌株LC-3-3的16S rDNA序列经同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,构建系统发育树,结果见图3。由图3可知,菌株LC-3-3与植物乳杆菌(Lactobacillus plantarum)聚于一支,亲缘关系最近,同源性为99%。因此,菌株LC-3-3被鉴定为植物乳杆菌(Lactobacillus plantarum)。

图3 基于16S rDNA序列菌株LC-3-3的系统发育树
Fig.3 Phylogenetic tree of strain LC-3-3 based on 16S rDNA sequences
2.4 不同因素对植物乳杆菌LC-3-3降亚硝酸盐能力的影响
2.4.1 不同碳源对植物乳杆菌LC-3-3降亚硝酸盐能力的影响
以上4种碳源分别作为培养基中唯一碳源时,培养植物乳杆菌LC-3-3,每隔12 h取样测定发酵液中亚硝酸盐的含量,分别取样5次,分析4种碳源对植物乳杆菌LC-3-3降解亚硝酸盐的影响,结果见图4。由图4可知,各碳源对亚硝酸盐降解率的影响为葡萄糖>蔗糖>乳糖>可溶性淀粉。对它们进行两两比较,分析碳源间的显著性差异,结果见表3。由表3可知,除蔗糖与乳糖培养基间无显著性差异外(P<0.05),其他均有显著性差异(P<0.05)。呈现这种结果的原因可能是碳源结构的差异,葡萄糖作为单糖,可以直接被植物乳杆菌LC-3-3利用,有利于对亚硝酸盐的降解;而蔗糖和乳糖属于二糖,需要被分解后才能利用,利用其降解亚硝酸盐的效果次之,可溶性淀粉属于多糖,被分解的效率更低,植物乳杆菌LC-3-3利用其降解亚硝酸盐的效果更差。
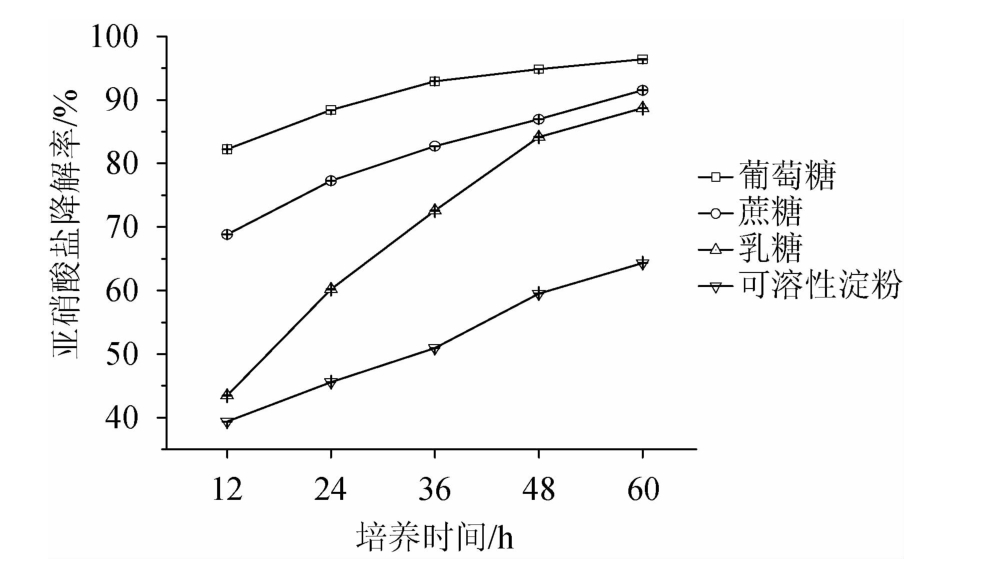
图4 不同碳源对植物乳杆菌LC-3-3降亚硝酸盐能力的影响
Fig.4 Effects of different carbon sources on nitrite-degrading ability of Lactobacillus plantarum LC-3-3
表3 4种碳源间的差异性分析
Table 3 Differences analysis among the four carbon sources

2.4.2 不同氮源对植物乳杆菌LC-3-3降亚硝酸盐能力的影响
以上4种氮源分别作为培养基中唯一氮源来培养植物乳杆菌LC-3-3,每隔12 h取样测定发酵液中亚硝酸盐的含量,分别取样5次进行测定,分析4种氮源对植物乳杆菌LC-3-3降解亚硝酸盐的影响,结果见图5。如图5所示,亚硝酸盐降解率为蛋白胨>细菌学蛋白胨>胰蛋白胨>多聚蛋白胨。对它们进行两两比较,分析氮源间的显著性差异,如表4所示,蛋白胨、细菌学蛋白胨和胰蛋白胨三种培养基间的降解率无显著性差异(P>0.05),发酵多聚蛋白胨与蛋白胨和细菌学蛋白胨有显著性差异(P<0.05)。因此蛋白胨、细菌学蛋白胨和胰蛋白胨均可作为植物乳杆菌LC-3-3降解亚硝酸盐的氮源,而多聚蛋白胨不利于植物乳杆菌LC-3-3对亚硝酸盐的降解。

图5 不同氮源对植物乳杆菌LC-3-3降亚硝酸盐能力的影响
Fig.5 Effects of different nitrogen sources on nitrite-degrading ability of Lactobacillus plantarum LC-3-3
表4 4种氮源间的差异性分析
Table 4 Differences analysis among the four nitrogen sources
2.4.3 不同接种量对植物乳杆菌LC-3-3降亚硝酸盐能力的影响
将植物乳杆菌LC-3-3分别以0.5%、1.0%、2.0%、4.0%和6.0%进行接种,每隔12 h取样测定发酵液中亚硝酸盐的含量,分别取样5次进行测定,分析接种量对植物乳杆菌LC-3-3降解亚硝酸盐的影响,结果如图6所示,不同时期亚硝酸盐降解率随培养时间的增加而升高,且随着接种量的减少而降低。对它们进行两两比较,分析接种量间的显著性,结果见表5。由表5可知,相邻接种量间均有显著差异(P<0.05)。因此,接种量越高,生物量越大,越有利于亚硝酸盐的降解。
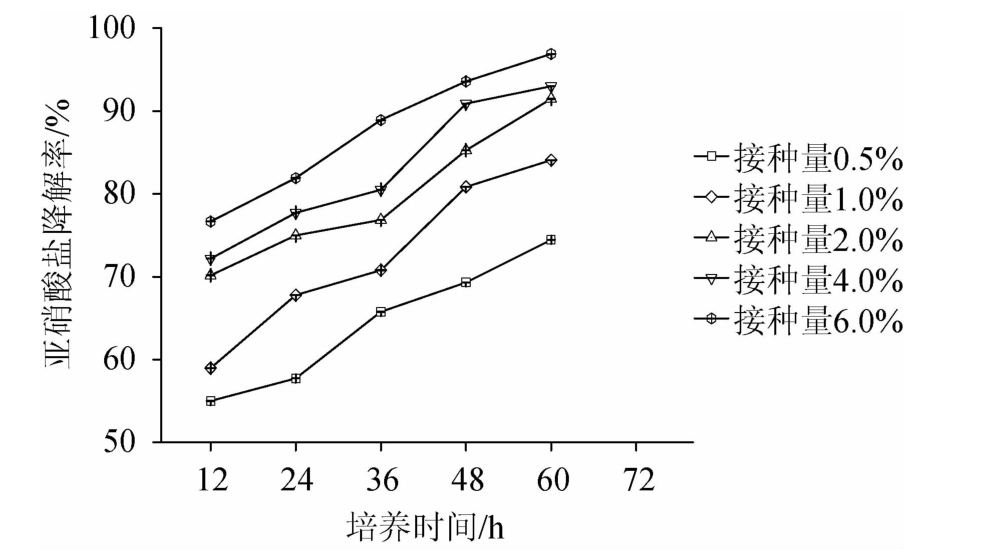
图6 不同接种量对植物乳杆菌LC-3-3降亚硝酸盐的能力的影响
Fig.6 Effects of different inoculum on nitrite-degrading ability of Lactobacillus plantarum LC-3-3
表5 接种量间的差异性分析
Table 5 Differences analysis among the inoculum
2.4.4 不同pH对植物乳杆菌LC-3-3降亚硝酸盐能力的影响

图7 不同pH对植物乳杆菌LC-3-3降亚硝酸盐的能力的影响
Fig.7 Effects of different pH value on nitrite-degrading ability of Lactobacillus plantarum LC-3-3
由图7可知,在pH4.5~pH6.0之间,随着接pH的增加,亚硝酸盐降解降解率逐渐增加,在pH6.0~8.0之间,随着pH的增加,亚硝酸盐降解率逐渐降低,且在发酵的60 h内均出现这种趋势,因此植物乳杆菌LC-3-3降解亚硝酸盐的最适pH为6.0,弱酸性环境促进了植物乳杆菌LC-3-3对亚硝酸盐的降解。
2.4.5 不同温度对植物乳杆菌LC-3-3降亚硝酸盐能力的影响由图8可知,发酵温度为22~47 ℃之间,随着温度的升高,植物乳杆菌LC-3-3对亚硝酸盐的降解率呈先增强后减弱的趋势,其降解亚硝酸盐的最适温度为37 ℃。比较不同温度发酵12 h的亚硝酸盐降解率,37 ℃条件下的降解率明显高于其他温度,随着发酵时间的延长,不同温度间降解率的差异逐渐缩小,这可能是因为37 ℃条件下植物乳杆菌LC-3-3生长最好,生物量最大,但随着发酵时间的延长,其温度条件下的生物量也得到了积累,缩小了不同温度条件下生物量的差异,从而缩小了亚硝酸盐降解率的差异。
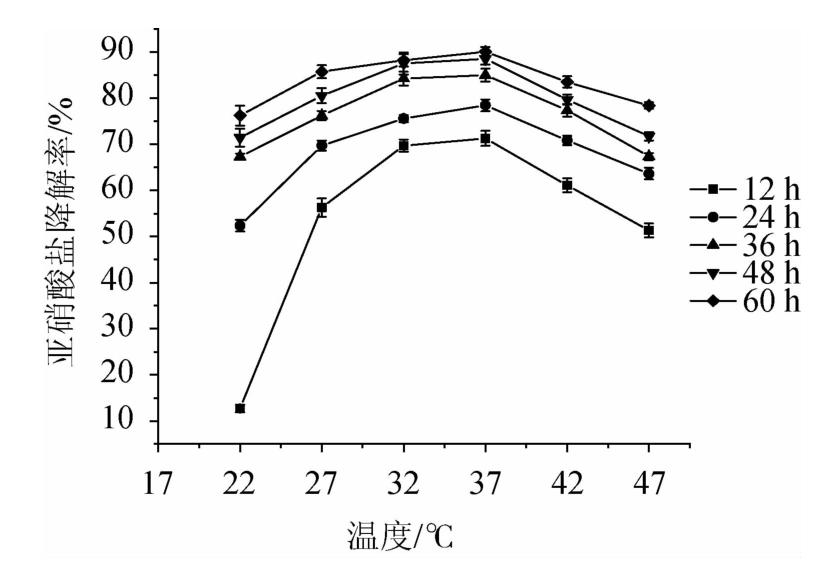
图8 不同温度对植物乳杆菌LC-3-3降亚硝酸盐的能力的影响
Fig.8 Effects of different temperature on nitrite-degrading ability of Lactobacillus plantarum LC-3-3
3 结论
本研究从柳州自然发酵酸笋中分离纯化获得一株降亚硝酸盐能力较好的菌株LC-3-3,经形态学观察、分子生物学鉴定其为植物乳杆菌(Lactobacillus plantarum)。该菌株在MRS培养基中生长良好,采用MRS培养基的其他组分及其浓度,以葡萄糖为唯一碳源(添加量为20 g/L)、蛋白胨为唯一氮源(添加量为10 g/L)、接种量为6%、pH值为6.0、温度为37 ℃的条件下,最适合植物乳杆菌LC-3-3对亚硝酸盐的降解。该菌株源于广西发酵酸笋,将其用于酸笋发酵具有安全性高的显著特点,此外,由于竹笋的季节性,发酵酸笋的保藏期通常需要长达1年时间,该菌株的获得在辅助酸笋发酵,降低酸笋中亚硝酸的含量具有良好的应用价值。
[1]徐丹萍,蒲彪,敖晓琳,等.传统泡菜中乳酸菌的研究现状[J].食品工业科技,2013,34(19):369-373.
[2]刘小宁,王文光.泡菜中亚硝酸盐的危害及预防措施[J].陕西农业科学,2010,56(4):109-110.
[3]KARIMZADEH L,KOOHDANI F,SIASSI F.Relation between nitrate and nitrite food habits with lung cancer[J].J Exp Therap,2012,10(2):107-112.
[4]HERNÁNDEZ-RAMÍREZ R U,GALVÁN-PORTILLO M V,WARD M H,et al.Dietary intake of polyphenols,nitrate and nitrite and gastric cancer risk in Mexico City[J].Int J Cancer,2009,125(6):1424-1430.
[5]MEY D E,KLERCK K D,MAERE H D,et al.The occurrence of N-nitrosamines,residual nitrite and biogenic amines in commercial dry fermented sausages and evaluation of their occasional relation[J].Meat Sci,2014,96(2):821-828.
[6]RASSAF T,FERDINANDY P,SCHULZ R.Nitrite in organ protection[J].Brit J Pharmacol,2013,171(1):1-11.
[7]吴慧昊,牛锋,陈珊珊,等.高效降亚硝酸盐乳酸菌的驯化复筛及菌株鉴定[J].食品科学,2016,37(19):160-165.
[8]林琳,钱培丽,朱彩琴,等.高压氧协同药物综合治疗急性亚硝酸盐中毒9 例分析[J].中华全科医学,2012,10(7):1149-1150.
[8]CHO J,LEE D,YANG C,et al.Microbial population dynamics of kimchi,a fermented cabbage product[J].FEMS Microbiol Lett,2006,257(2):262-267.
[9]KIM J,CHUN J,HAN H U,et al. Leuconostoc kimchii sp.nov.a new species from kimchi[J].Int J Syst Evol Microbiol,2000,50(5):1915-1919.
[10]王兰,邓放明,陈思思,等.植物乳杆菌L5 降解亚硝酸盐机理的初步研究[J].食品与发酵工业2014,32(12):120-124.
[11]ZENG X Q,PAN Q,GUO Y X,et al.Potential mechanism of nitrite degradation by Lactobacillus fermentum RC4 based on proteomic analysis[J].J Proteom,2018,194(1):70-78.
[12]杜晓华,刘书亮,蒲彪,等.四川泡菜中降解亚硝酸盐乳酸菌的筛选鉴定及其应用[J].食品与发酵工业,2013,39(4):48-52.
[13]朱军莉,赵进,朱雅霏.自然发酵蔬菜制品中降解亚硝酸盐乳酸菌的分离与鉴定[J].中国酿造,2015,34(6):44-47.
[14]刘玉,郑心茹,林伟言,等.降解亚硝酸盐乳酸菌的筛选及其在发酵鱼糜中的初步应用[J].中国酿造,2019,38(2):66-72.
[15]程方方,武运,武亚婷,等.酸马乳源降解亚硝酸盐乳酸菌的分离及鉴定[J].中国酿造,2018,37(9):72-77.
[16]张兴吉,葛武鹏,刘阳,等.西部传统发酵乳品中乳酸菌筛分及其亚硝酸盐降解能力[J].食品科学,2018,39(14):199-205.
[17]丁娟芳,杨嘉,朱淑云,等.扬州酱菜中降解亚硝酸盐乳酸菌的筛选、鉴定及性能研究[J].2018,37(12):87-91.
[18]汤伟,胡维,王菁蕊,等.消化乳杆菌泡菜分离株W369 的鉴定及其益生功能[J].微生物学报,2016,56(6):932-942.
[19]PAIK H D,LEE J Y.Investigation of reduction and tolerance capability of lactic acid bacteria isolated from kimchi against nitrate and nitrite in fermented sausage condition[J].Meat Sci,2014,97(4):609-614.
[20]吴慧昊,牛锋,陈珊珊,等.高效降亚硝酸盐乳酸菌的驯化复筛及菌株鉴定[J].食品科学,2016,37(19):160-165.