在白酒酿造行业中,杂醇油是影响酒质及口感的主要因素之一[1]。通过原料控制及工艺优化等手段不能从根本上解决这一问题。将能够酯化杂醇油的酶类或菌株加入原料或酒曲参与发酵,不仅能够降低杂醇油的含量,而且能够增加酯类种类,赋予酒体更加饱满的口感。小曲白酒和液态酿造的白酒最大的缺陷是较高的杂醇油含量造成饮用后容易头痛和饮用时的苦涩味[2-4]。因此,酯化酶的筛选和表达对小曲白酒品质的提升具有重要的意义。
酯化酶来源极为广泛,根据其来源可大致分为动物来源酯化酶、植物来源酯化酶及微生物来源酯化酶。其中动植物来源的酯化酶提取工艺繁琐,成本相对较高[5-7],因此用于实验或工业的酯化酶基本来源于微生物[8-10]。而且从酒曲、酒醅或其他极端环境中分离的微生物酯化酶,具有一些更加优异的功能及催化活性[11-12]。微生物酯化酶具有催化条件温和、能耗低、副产物少,具有高效、高选择性、环境友好的优点,更适合于工业化大生产,在基础理论研究和实际应用中都具有重大价值[12-16]。
传统酒曲中一些产香酵母及细菌也能产生催化作用的酯化酶,但只能催化乙酸乙酯、己酸乙酯等的合成,对杂醇油无明显的催化作用[17-20]。杂醇油酯化酶和构建高效表达杂醇油的酵母菌株鲜有报道。
本实验以从深海沉积物中筛选出产杂醇油酯化酶菌株的总核糖核酸(ribonucleic acid,RNA)为模板,采用逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)方法扩增近平滑假丝酵母杂醇油酯化酶基因,并于毕赤酵母中高效表达。酯化杂醇油的酯化酶不仅对提升小曲白酒和液态酿造的白酒的品质具有重要的意义,而且对整个酿酒行业提升白酒的品质具有重要的实际应用意义。
1 材料与方法
1.1 材料与试剂
菌株:从深海沉积物中筛选出的产杂醇油酯化酶的近平滑假丝酵母(Candida parapsilosis);毕赤酵母(Pichia pastoris)GS115:真核表达宿主;质粒pPICZαA:外分泌型表达载体,亚克隆于大肠杆菌(Esherichia coli)DH5α。
试剂:乙酸正戊酯、乙酸正丙酯、乙酸异丁酯、乙酸异戊酯及乙醇等(均为色谱级):上海阿拉丁生化科技股份有限公司;其他试剂盒:天根生化科技(北京)有限公司;限制性内切酶:宝生物工程(大连)有限公司。
种子培养基:蛋白胨10 g,牛肉膏3 g,葡萄糖5 g,陈海水补至1 000 mL,pH 7.6,115 ℃灭菌30 min。
产酶培养基:胰蛋白胨10 g,麸皮25 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,NaCl 10.0 g,自来水补至1 000 mL,pH 7.5,121 ℃灭菌20 min。
1.2 仪器与设备
SC005675聚合酶链式反应(polymerase chain reaction,PCR)分析仪、Tanon-1600Bio-Rad凝胶成像系统仪:美国Bio-Rad公司;TG16-W高速冷冻离心机:美国Thermo Fisher Scientific公司;JY92-II气相色谱仪:宁波新芝生物科技有限公司;HP-101毛细管气相色谱柱(50 m×0.53 mm×0.50 μm):德国Merck公司。
1.3 方法
1.3.1 杂醇油酯化酶的提取及含量测定
产酯化酶的近平滑假丝酵母或构建的酵母菌先于种子培养基上28 ℃、200 r/min活化18 h,以2%接种量接种于产酶培养基,产酶培养基装液量70 mL/250 mL,30 ℃、200 r/min培养3d。发酵醪液3层干净纱布过滤,滤液于台式高速冷冻离心机5000r/min离心5min,除去细小麸皮残渣及菌株菌体。上清液以0.22μm尼龙滤膜过滤,除去菌体,得到酯化酶粗酶液。
酯化体系:杂醇油含量(正丙醇、异丁醇、异戊醇)各1%;乙酸含量2%;粗酶液含量50%;水含量45%。先加水、杂醇油及乙酸,再加入酶液。且在加入粗酶液前,以200 g/L NaOH溶液将体系pH调至3.5。粗酶液均做2组酯化体系,其中1组为实验组,另1组为对照组。对照组为酶液以等量的去离子水代替。酯化体系30 ℃、200 r/min酯化24 h。
以顶空气相色谱法测量酯化产物中杂醇油酯的含量[21-22]。气相色谱条件为色谱柱:HP-101毛细管气相色谱柱(50 m×0.53 mm×0.50 μm);柱温:二阶段升温:初始温度35 ℃,保持7 min,以4 ℃/min升至60 ℃,再以6 ℃/min升至105℃,最后以20℃/min升至200℃,保持10min;进样口温度200℃,检测器温度220℃,载气为高纯氮气,氢气:30.0mL/min;空气流量:200 mL/min;柱前压为30 kPa,柱流量为1.12~1.36 mL/min;尾吹30.0 mL/min;分流比40∶1;进样量1 mL;内标为2%乙酸正戊酯。
1.3.2 酯化酶基因PCR扩增
根据酯化酶序列,利用引物设计软件Primer 5.0设计特异引物,引物序列如下:
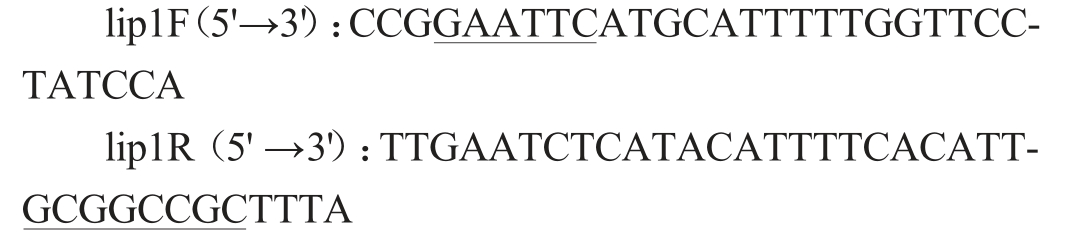
上游引物加入保护碱基CCG 和EcoR I 酶切位点GAATTC,下游引物加入保护碱基TTTA和Not I酶切位点GCGGCCGC。
1.3.3 总RNA提取
将活化的近平滑假丝酵母(Candida parapsilosis)接种至种子培养基中,30 ℃培养24 h,按赛默飞公司![]() RNA Mini Kit说明书步骤提取总核糖核酸(RNA)。提取的酵母菌总RNA用1%琼脂糖电泳,电泳电压为150 V,电泳25 min。
RNA Mini Kit说明书步骤提取总核糖核酸(RNA)。提取的酵母菌总RNA用1%琼脂糖电泳,电泳电压为150 V,电泳25 min。
1.3.4 逆转录聚合酶链反应扩增杂醇油酯化酶编码序列
通过以提取的酵母菌Lip-8总RNA为模板,反转录合成cDNA第一链,并进行目的基因的扩增。本步骤采用天根生化科技(北京)有限公司的Quant One Step(reverse transcription-polymerase chain reaction,RT-PCR)kit(KR113)进行操作,其反应体系及PCR条件均按试剂盒说明书进行。PCR扩增产物采用0.8%琼脂糖电泳,80 V、35 min,用凝胶成像仪检测目的条带的大小,PCR产物回收纯化测序。
1.3.5 表达载体构建
将反转录获取的PCR产物及提取的空载质粒pPICZαA分别进行双酶切,再以T4连接酶16 ℃过夜连接。化学转化法导入空载Esherichia coli DH5α[23],得到亚克隆菌株。再提取质粒,以BamH I酶酶切线性化,按照BTX电穿孔仪ECM 830自带毕赤酵母电转程序,进行电转化。
1.3.6 重组子的诱导表达及蛋白电泳
获得的酵母转化子活化后,每24 h补加甲醇至终浓度1%,诱导毕赤酵母表达酯化酶[24-25]。诱导结束后,离心取上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDSPAGE)分析。样品与5倍上样缓冲液混合均匀后,沸水浴5 min,再10 000 r/min常温离心2 min,储存于4 ℃备用。样品上样量为15 μL,浓缩胶电泳电压为80 V,分离胶电泳电压为130 V。电泳结束后以快速染色脱色法进行处理[26]。
2 结果与分析
2.1 近平滑假丝酵母酯化酶酯化杂醇油的性能
菌株所产的酯化酶粗酶液加入酯化体系酯化,测量酯化液中乙酸正丙酯、乙酸异丁酯、乙酸异戊酯的质量浓度。将所测得的实验组质量浓度减去空白组质量浓度后,得到实际酯化合成的质量浓度结果见表1。由表1可知,近平滑假丝酵母产生的酯化酶具有一定的酯化正丙醇、异丁醇和异戊醇的能力。
表1 近平滑假丝酵母酯化酶酯化杂醇油的性质
Table 1 Properties of esterase from Candida parapsilosis for fusel oil esterification

2.2 酯化酶基因扩增
2.2.1 近平滑假丝酵母总RNA提取
采用总RNA提取试剂盒法从近平滑假丝酵母中提取总RNA,提取的总RNA电泳分析见图1。由图1可知,提取的RNA条带较清晰,完整性较好,纯度也较高,可以用于反转录合成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)。
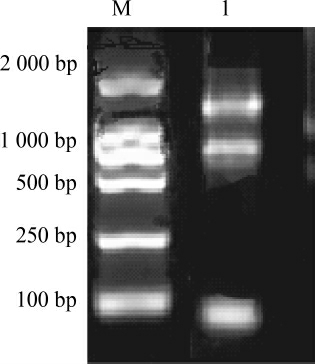
图1 近平滑假丝酵母总RNA琼脂糖凝胶电泳结果
Fig.1 Agarose gel electrophoresis results of total RNA of Candida parapsilosis
M:RNA Marker;1:提取总RNA。
2.2.2 近平滑假丝酵母酯化酶基因RT-PCR

图2 近平滑假丝酵母酯化酶反转录PCR产物琼脂糖凝胶电泳结果
Fig.2 Agarose gel electrophoresis results of reverse transcriptase-PCR product of esterase from Candida parapsilosis
M:DNA Marker;1:总RNA为模板的RT-PCR 产物。
以总RNA为模板,以QuantOneStepRT-PCRkit进行PCR,近平滑假丝酵母酯化酶反转录PCR产物电泳图见图2。由图2可知,PCR产物大小接近于1 500 bp,与预期片段大小一致。纯化后测序,推出酯化酶的氨基酸序列,结果见图3。

图3 酯化酶氨基酸序列
Fig.3 Amino acid sequence of esterase
2.3 毕赤酵母中表达杂醇油酯化酶基因
2.3.1 重组子的诱导表达及SDS-PAGE
诱导结束后取上清进行SDS-PAGE分析,结果见图4。孔道1为诱导,孔道2为未诱导,根据蛋白质电泳图分析可知,孔道1于44.3~66.4 kDa间多出一个条带。根据蛋白质数据库(protein data bank,PDB)及美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中lipase 1编码氨基酸计算,lipase 1分子质量为50.86 kDa,与目的条带接近。结果表明构建的载体能转化入毕赤酵母细胞,并能启动杂醇油酯化酶基因的表达。
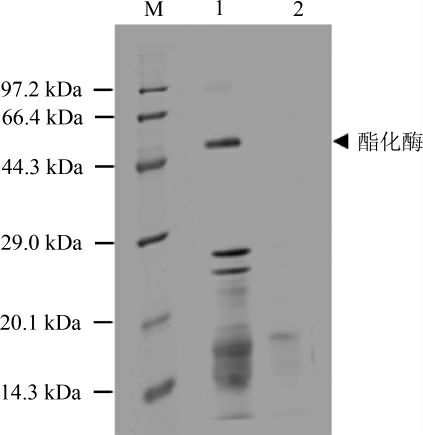
图4 毕赤酵母表达的酯化酶的SDS-PAGE结果
Fig.4 SDS-PAGE of esterase expressed by Pichia pastoris
M:Protein Marker;1重组毕赤酵母胞外蛋白;2毕赤酵母胞外蛋白。
2.3.2 构建的毕赤酵母表达杂醇油酯化酶
重组子诱导表达结束后,以5 000×g、4 ℃离心5 min,上清即为酯化酶粗酶液。按1.3方法进行酶活的检测,结果见表2。由表2可知,根据顶空气相色谱的检测结果,该酯化酶活性比原始菌株表达酶活高。毕赤酵母表达的酯化酶酯化合成乙酸正丙酯、乙酸异丁酯、乙酸异戊酯的合成量比近平滑假丝酵母的酯化酶合成的量分别增加1.63倍、1.15倍、0.99倍,结果表明,酯化酶基因在毕赤酵母中高效表达。
表2 毕赤酵母表达的酯化酶酶活
Table 2 Esterase activity expressed by Pichia pastoris

2.3.3 杂醇油酯化酶分子模型分析
根据已知的lipase的蛋白质序列,通过Discovery Studio软件及“Swiss-model Workspace”[27]进行lipase的模型构建。根据已报道的Candida antarctica酯化酶Lipase A(PDB:3guu.1)[28]空间结构为模板,构建的空间结构图见图5。构建的空间结构模型以PyMoL软件分析[29]。由图5可知,lipase与传统的酯化酶空间构型相差无几,均为8个α螺旋围成的“8套环”的环域结构,底物固定于环中进行催化合成。

图5 酯化酶的分子模型
Fig.5 Molecular model of esterase
3 结论
本研究解析出杂醇油酯化酶的氨基酸序列,并对杂醇油酯化酶基因进行了异源表达,构建了高效表达杂醇油酯化酶的酵母工程菌株。构建的酵母菌株能酯化正丙醇、异丁醇和异戊醇。杂醇油酯化酶不仅能丰富了酒体酯类含量,还能大幅度降低蒸馏的酒体中的杂醇油含量从而极大的提升白酒品质。本研究构建的高效表达杂醇油酯化酶的酵母菌株对提升酿造白酒的品质具有重要的实际意义。
[1]张瑞瑞.白酒杂醇油酯化酶的分子构建[J].中国酿造,2019,38(5):86-89.
[2]严锦,方尚玲,蒋威,等.降低小曲酒中杂醇油含量的研究进展[J].酿酒,2012,39(6):32-35.
[3]杨生智,沈永祥,曹亚龙,等.添加氮源对降低小曲白酒中杂醇油含量的研究[J].酿酒,2018(6):57-59.
[4]吴赫川,马莹莹,杨建刚,等.川法小曲白酒发展现状及其瓶颈问题分析[J].安徽农业科学,2014,42(33):11850-11853,11856.
[5]CONTESINI F J,LOPES D B,MACEDO G A,et al.Aspergillus sp.lipase:Potential biocatalyst for industrial use[J]. J Mol Catal B:Enzym,2010,67(3-4):163-171.
[6]尚宪明.南极大磷虾脂肪酶提取纯化及其酶学性质研究[D].青岛:中国海洋大学,2014.
[7]MENDES A A,OLIVEIRA P C,CASTRO HEIZIR F.Properties andbiotechnological applications of porcine pancreatic lipase[J]. J Mol Catal B:Enzym,2012,78:119-134.
[8]KIM J,DENG L L,HONG E,et al.Cloning and characterization of a novel thermostable esterase from Bacillus gelatini KACC 12197[J].Protein Express Purif,2015,116:90-97.
[9]WANG G,YU M Z,DONG F,et al.Esterase activity inspired selection and characterization of zearalenone degrading bacteria Bacillus pumilus ES-21[J].Food Control,2017,77:57-64.
[10]LI X J,ZHENG R C,WU Z M,et al.Thermophilic esterase from Thermomyces lanuginosus:Molecular cloning,functional expression and biochemical characterization[J].Protein Express Purif,2014,101:1-7.
[11]ARIFIN A R,KIM S J,YIM J H,et al.Isolation and biochemical characterization of Bacillus pumilus lipases from the Antarctic[J]. J Microbiol Biotechn,2013,23(5):661-667.
[12]任楠楠,王晓辉,迟乃玉,等.微生物甾醇酯酶的研究进展[J].中国酿造,2017,36(6):9-13.
[13]任楠楠,王晓辉,迟乃玉,等.海洋低温甾醇酯酶菌株的筛选鉴定及其酶学特性研究[J].中国酿造,2019,38(1):37-41.
[14]ROMANO D,BONOMI F,DE MATTOS M C,et al.Esterases as stereoselective biocatalysts[J].Biotechnol Adv,2015,33(5):547-565.
[15]SEBASTIÁN T,MARIOD B,SWATHY S L,et al.Enzymatic synthesis of banana flavour(isoamyl acetate)by Bacillus licheniformis S-86 esterase[J].Food Res Int,2009,42(4):454-460.
[16]SHAKIBA M H,ALI M S M,RAHMAN R N Z R A,et al.Cloning,expression and characterization of a novel cold-adapted GDSL family esterase from Photobacterium sp.strain J15[J].Extremophiles,2016,20(1):44-55.
[17]LAI Q M,LEE Y Y,PHUAH E T,et al.Lipase/Esterase:properties and industrial applications[M].New York:Encyclopedia of Food Chemistry,2019:158-167.
[18]刘欢欢,杨帆,李贞景,等.高产酯化酶红曲菌的筛选、鉴定及酶学性质研究[J].中国酿造,2019,38(5):49-53.
[19]PARK S M.Acetyl xylan esterase of Aspergillus ficcum catalyzed the synthesis of peracetic acid from ethyl acetate and hydrogen peroxide[J].J Biosci Bioeng,2011,112(5):473-475.
[20]WON S J,JEONG H B,KIM H K.Characterization of novel salt-tolerant esterase isolated from the marine bacterium Alteromonas sp.39-G1[J].J Microbiol Biotech,2019,31:890-899.
[21]龙玮.顶空气相色谱法测定水中卤代烃类化合物[J].工业用水与废水,2018,49(4):78-81.
[22]刘蓉,张永江,邓茂,等.顶空气相色谱法测定环境水样中14 种挥发性卤代烃[J].西南师范大学学报(自然科学版),2018,43(3):133-138.
[23]陈伟伟.碱性植酸酶的定向进化及其在不同宿主中的表达[D].杭州:浙江大学,2015.
[24]赖红星.白地霉脂肪酶基因的异源表达与定向进化[D].北京:中国农业科学院,2010.
[25]张瑶,路国兵,崔为正,等.洋葱伯克霍尔德氏菌Lu10-1 脂肪酶的异源表达[J].食品与生物技术学报,2016,35(6):640-647.
[26]林方养,杨耀东,万婕,等.几种SDS-PAGE 凝胶电泳染色方法的比较[J].安徽农业科学,2014(8):2295-2296.
[27]KIEFER F,ARNOLD K,KUNZLI M,et al.The SWISS-MODEL repository and associated resources[J]. Nucleic Acids Res,2009,37(Database issue):387-392.
[28]BRANDT A M,LI X G,NYMALM-REJSTROM Y,et al.The crystal structure of lipase A from Candida antarctica[J].Acta Crystallogr A,2008,A64:C245.
[29]HART K,MCKAY T,TEDLA-BOYD W,et al.Protein function prediction using ProMOL and PyMOL[J].Faseb J,2015,29:722-725.