蓝莓(Semen trigonellae)果实近球形,具有很高的营养价值[1-2],是联合国粮农组织(food and agriculture organization of the united nations,FAO)推荐的五大最健康果品之一[3]。以新鲜的蓝莓果实为原料,经过酒精发酵等制成的蓝莓果酒,口感良好独特,营养价值高。王姗姗等[4]通过对蓝莓果酒进行功能性研究,发现蓝莓果酒有降血脂、促进细胞增殖等功能。
花色苷是花青素以糖苷键的形式与糖结合而成的一种黄酮类水溶性天然色素,具有较强的抗氧化活性,如红树莓花色苷的抗氧化能力均优于维生素C(vitamin C,VC)[5],清除自由基能力分别是VC、维生素E(vitamin E,VE)的20和50倍[5]。蓝莓果酒中花色苷是评价其质量的重要指标。但花色苷的结构导致其稳定性较差,羟基数目的增加则会使其稳定性降低[6-7]。除此之外,花色苷的稳定性还受温度、pH、光照、金属离子、辅色剂、糖类、二氧化硫等因素的影响[8]。周宝利等[9]通过研究茄子果皮中的花色苷,发现Mg2+、蔗糖、柠檬酸和苯甲酸钠都可以提高花色苷的稳定性,而Cu2+、VC则会破坏花色苷的稳定性。
本研究对不同发酵工艺酿造的蓝莓果酒进行花色苷含量及酒精度进行测定,综合比较选出最适的发酵工艺参数。以pH、温度、光照、包装材质、糖浓度为考察因素,以蓝莓果酒花色苷保存率为评价指标,研究蓝莓果酒花色苷的稳定性。对蓝莓果酒的DPPH·、·OH、O2-·清除能力以及总抗氧化能力进行测定,分析蓝莓果酒的抗氧化性。以期获得花色苷含量高、抗氧化活性强的蓝莓果酒,为蓝莓果酒品质的提升及生产优化提供参考。
1 材料与方法
1.1 材料与试剂
蓝莓(蓝美一号):浙江蓝美农业有限公司;安琪SY酿酒酵母:安琪酵母有限公司;果胶酶(酶活>500 000 U/g)、无水乙醇(色谱纯)、水杨酸、柠檬酸(均为分析纯):成都科龙化工试剂厂;没食子酸、VC、二苯代苦味酰基自由基(均为分析纯):美国Sigma公司。
1.2 仪器与设备
HR-2003榨汁机:飞利浦中国投资有限公司;LHS-150SC恒温恒湿箱:上海齐欣科学仪器有限公司;PB-10酸度计:德国赛多利斯集团;UV1000紫外可见分光光度计:上海天美科学仪器有限公司。
1.3 方法
1.3.1 蓝莓果酒的酿造工艺流程及操作要点
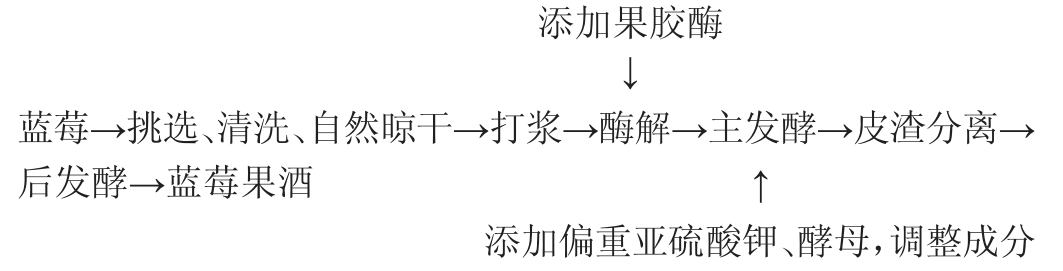
操作要点:蓝莓经挑选、清洗、自然晾干后打浆,在果浆中添加0.02%果胶酶50 ℃酶解3 h,初始糖度22°Bx,加入偏重亚硫酸钾使SO2含量为100mg/L,加入Ca2CO3调pH为3.5,添加0.4%安琪SY酿酒酵母,在22 ℃条件下于1 L发酵罐中发酵8 d。结束后,汁渣分离取上清液,密封后于阴凉干燥处陈酿数日,得蓝莓果酒。
1.3.2 蓝莓果酒发酵工艺优化
发酵时间分别为6 d、7 d、8 d、9 d、10 d,发酵温度分别为16 ℃、19 ℃、22 ℃、25 ℃、28 ℃,SO2添加量分别为0、50 mg/L、100 mg/L、150 mg/L、200 mg/L,初始pH值分别为3.2、3.5、3.8、4.1、4.4,酵母添加量分别为0.1%、0.2%、0.3%、0.4%、0.5%,考察发酵时间、发酵温度、SO2添加量、初始pH值、酵母添加量对蓝莓果酒花色苷含量及酒精度影响。
1.3.3 分析检测
(1)酒精度
按照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的方法进行测定。
(2)蓝莓果酒中花色苷含量的测定
采用pH示差法。移取1 mL的蓝莓果酒样液,用pH 1.0和pH 4.5的缓冲溶液将其稀释25倍,平衡一段时间后在波长510 nm和700 nm条件下测其吸光度值,将测得值代入以下公式计算得蓝莓果酒花色苷含量[10]。
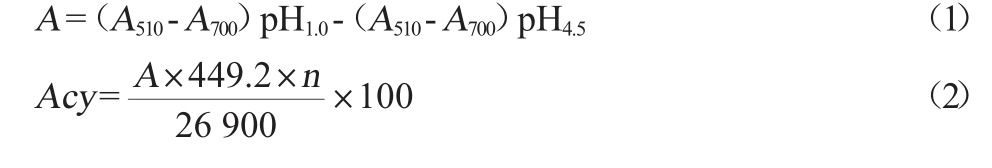
式中:A510为样品在波长510 nm处的吸光度值;A700为样品在波长700 nm处的吸光度值;n为稀释倍数;449.2为矢车菊素-3-葡萄糖苷分子质量;26 900:矢车菊素-3-葡萄糖苷消光系数;Acy为花色苷含量,mg/100 mL。
以不同条件下花色苷保存率为依据,对蓝莓果酒花色苷稳定性进行分析。计算公式如下:
式中:Acy0为条件处理前蓝莓果酒中花色苷含量,mg/100 mL;
Acy1为条件处理后蓝莓果酒中花色苷含量,mg/100 mL。
1.3.4 蓝莓果酒花色苷抗氧化性分析
(1)DPPH自由基清除
根据KILANI S等[11]的方法测定,取1 mL的蓝莓果酒添加2 mL的DPPH(0.2 mmol/L)溶液,并于室温下避光30 min,以乙醇为空白,波长517 nm条件下测定其吸光度值,与VC溶液(50 μg/mL)作对比。DPPH清除能力计算公式如下:
式中:R1为DPPH自由基清除率;A为1 mL样品液加上2 mL DPPH自由基溶液的吸光度值;B为1 mL样品液加上2 mL乙醇的吸光度值;C为1 mL乙醇加上2 mL DPPH自由基溶液的吸光度值。
(2)羟基自由基的清除
取0.5mL的蓝莓果酒然后依次添加2mLFeSO4(6 mmol/L),2mL水杨酸-乙醇溶液(6mmol/L),2mLH2O2溶液(6mmol/L),37 ℃水浴30 min,以蒸馏水为空白,在波长510 nm条件下测定其吸光度值[12],最后与VC溶液(1 mg/100 mL)进行对比。·OH清除率计算公式如下:
式中:R2为·OH清除率;AX为加入待测酒样时的吸光度值;AX0为未加入H2O2溶液的反应液吸光度值;A0为未加入蓝莓果酒样液的反应液吸光度值。
(3)超氧阴离子自由基的清除
采用邻苯三酚自氧化法[13]。将0.2 mL的蓝莓果酒加入到Tris-HCl(0.05mol/L、pH8.2)中,空白组添加等体积蒸馏水,于25℃保温10min,再加入0.2mL邻苯三酚溶液(0.01mol/L),混匀后于波长320 nm处测定吸光度值,最后与VC溶液(1 mg/100 mL)进行对比。超氧阴离子自由基清除能力计算公式如下:
式中:R2为O2-·清除率;A为不加酒样时的反应速率;B为加入待测酒样时的反应速率。
(4)总抗氧化能力
参考李影[3]所使用的方法测定蓝莓果酒的总抗氧化能力。取0.1 mL蓝莓果酒样液,依次添加2 mL磷酸缓冲液(pH 6.60,2 mol/L)、2 mL铁氰化钾溶液(1%),混匀后于50 ℃水浴20 min,再加入1 mL三氯乙酸溶液(10%),500 r/min离心10 min,取1 mL上清液,加入1 mL三氯化铁溶液(0.05%),用蒸馏水定容至10 mL,在波长700 nm处测定其吸光度值,与VC溶液(1 g/L)进行对比,吸光度值越大,表明其总抗氧化能力越强。
1.3.5 贮藏条件对蓝莓果酒花色苷稳定性的影响
在pH值分别为2.0、3.0、4.0、5.0、6.0,温度分别为20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃,糖质量浓度分别为0、6 mg/L、8 mg/L、10 mg/L、12 mg/L、14 mg/L,分别在室内自然光、室外自然光、室内避光处放置,考察pH值、温度、糖质量浓度、光照等因素对蓝莓果酒花色苷稳定性的影响。
2 结果与分析
2.1 发酵工艺参数对蓝莓果酒花色苷的影响
2.1.1 发酵时间对蓝莓果酒花色苷的影响
发酵时间对蓝莓果酒花色苷含量及酒精度的影响结果见图1。由图1可知,在发酵6~11 d时,随着发酵时间增加,蓝莓果酒中的花色苷含量缓慢地降低,这可能是因为在蓝莓果酒发酵的过程中醪液中的酸、糖和由微生物代谢产生的酶会破坏花色苷。当发酵时间<8 d时,随着发酵时间的增加,酒精度逐渐增加。这主要是因为当发酵时间比较短时,醪液中的糖等一些能源物质比较充足,可以提供足够的能量供酿酒酵母进行酒精发酵,将糖转化为乙醇,并且随着发酵时间的增加,酵母菌会将糖转化得更加彻底。但当发酵时间>8 d之后,醪液中剩下的少量能源物质会被逐渐消耗完全,酒精不会再继续产生,同时一些细菌还会消耗已产生的酒精。因此,综合考虑确定蓝莓果酒较优的发酵时间为8 d。
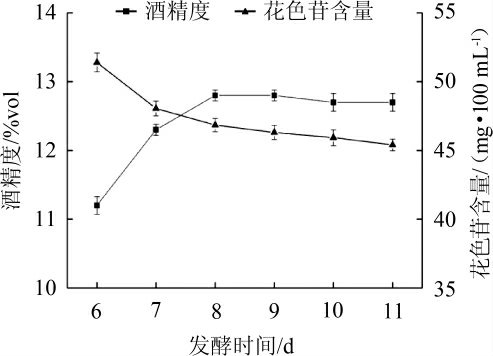
图1 发酵时间对蓝莓果酒花色苷含量及酒精度的影响
Fig.1 Effect of fermentation time on anthocyanin content and alcohol content of blueberry wine
2.1.2 发酵温度对蓝莓果酒花色苷的影响
发酵温度对蓝莓果酒花色苷含量及酒精度的影响结果见图2。当发酵温度为16~22 ℃时,花色苷的含量随发酵温度的升高而增加;当发酵温度为22 ℃时,花色苷含量可以达到最大,为46.24 mg/100 mL;当发酵温度为22~28 ℃时,花色苷含量随发酵温度的升高而几乎不变,但总体上呈下降趋势。这可能是因为温度的升高会使酵母的生长繁殖及代谢活动加快,酵母自身的内部活动越活跃就越有利于花色苷的浸出,同时酒精度的升高也有利于花色苷的浸出[14],但是当升高至一定的温度时,果酒的酒精度会降低,因此花色苷的含量也会随之下降,但下降的幅度较小。蓝莓果酒的酒精度随着发酵温度的升高先升后降,这主要是因为发酵温度过低时,酿酒酵母的生长繁殖及代谢活动受到阻碍,起酵时间增加且发酵速率降低,产酒精速度下降,当发酵温度过高时,酵母生长繁殖活动较快,糖类的消耗速度也随之加快,而且酵母产生的过多的副产物会使酵母发酵活动受到阻碍,导致酵母出现过早疲劳的情况,因此,综合考虑确定蓝莓果酒的最适发酵温度为22 ℃。
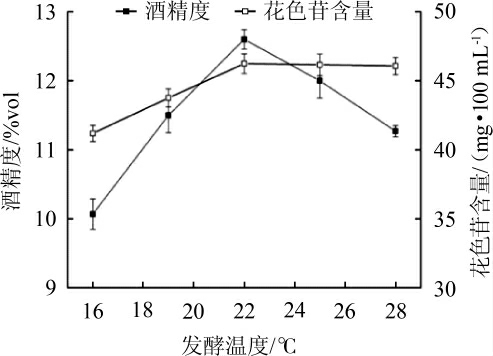
图2 发酵温度对蓝莓果酒花色苷含量及酒精度的影响
Fig.2 Effect of fermentation temperature on anthocyanin content and alcohol content of blueberry wine
2.1.3 SO2添加量对蓝莓果酒花色苷的影响
SO2添加量对蓝莓果酒花色苷含量及酒精度的影响结果见图3。由图3可知,当SO2的添加量在0~150 mg/L时,花色苷含量随着SO2添加量的增加而增加;当SO2的添加量150 mg/L时,蓝莓果酒的花色苷含量可以达到最大,为49.23 mg/100 mL;当SO2添加量>150 mg/L时,花色苷含量随着二氧化硫添加量的增加而降低。这主要的原因可能是SO2的增加能抑制杂菌生长,促使酵母更好的进行酒精发酵,因而有利于花色苷的溶出,但是当SO2添加量过高时,会在发酵醪液酸性的环境下生成HSO3-,该物质能够通过与花色苷分子中的C2或C4位进行亲核作用从而形成花色苷亚硫酸盐,而该物质无色;其次SO2还可以起到漂白剂的作用,这也会使果酒中的花色苷含量降低[15]。蓝莓果酒的酒精度随SO2添加量增加先升后降。当SO2添加量过低时,发酵醪液容易被其他杂菌所污染,糖类损失严重,酿酒酵母的发酵受到一定的阻碍,导致果酒的酒精度降低;当SO2添加量过高时,发酵醪液中游离的SO2增加导致酸度增加,这对酵母的生长繁殖及代谢较为不利,故果酒的酒精度也会有所降低。因此,综合考虑确定SO2最适添加量为100 mg/L。
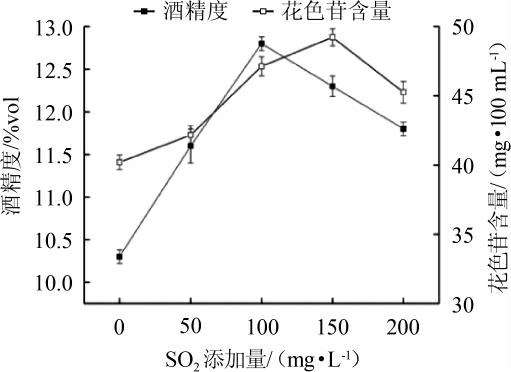
图3 SO2添加量对蓝莓果酒花色苷含量及酒精度的影响
Fig.3 Effect of sulfur dioxide addition on anthocyanin content and alcohol content in blueberry wine
2.1.4 发酵液初始pH值对蓝莓果酒花色苷的影响
初始pH值对蓝莓果酒花色苷含量及酒精度的影响结果见图4。由图4可知,花色苷含量随发酵醪液初始pH的增加而降低,当发酵醪液初始pH为3.2时,蓝莓果酒的花色苷含量达到最高,为49.21 mg/100 mL,这可能是因为蓝莓果酒花色苷在pH值为3左右的环境中稳定性较好[16],因此损失率较小。当发酵醪液初始pH值为3.2时,酒精度为12.3%vol,花色苷含量为49.21 mg/100 mL;当发酵醪液的pH值为3.5时,蓝莓果酒的酒精度为12.73%vol,花色苷含量为47.01 mg/100 mL,比较发酵醪液pH值为3.2和3.5时的酒精度及花色苷含量,发现蓝莓果酒的酒精度增加0.43%vol,花色苷含量下降了2.2 mg/100 mL。从酒精度再结合花色苷含量方面考虑,蓝莓果酒的发酵醪液最适初始pH值应为3.5。
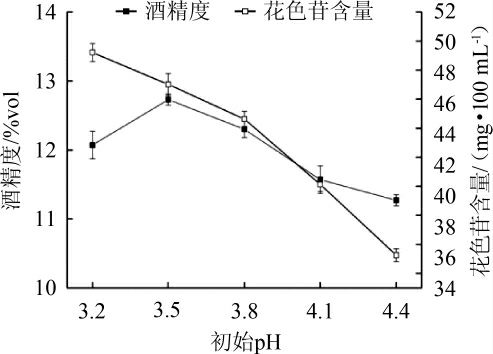
图4 初始pH对蓝莓果酒花色苷含量及酒精度的影响
Fig.4 Effect of pH on anthocyanin content and alcohol content in blueberry wine
2.1.5 酵母添加量对蓝莓果酒花色苷的影响
酵母添加量对蓝莓果酒花色苷含量及酒精度的影响结果见图5。由图5可知,酵母添加量对蓝莓果酒花色苷含量的影响较小,蓝莓果酒花色苷含量随着酵母添加量的变化几乎不会出现显著的变化。酵母添加量在0.1%~0.5%时,蓝莓果酒的酒精度随其增加先升后降,当酵母添加量为0.4%时,达到最高12.8%vol。因此,综合考虑酵母最适添加量为0.4%。

图5 酵母添加量对蓝莓果酒花色苷含量及酒精度的影响
Fig.5 Effect of yeast addition on anthocyanin content and alcohol content in blueberry wine
2.2 蓝莓果酒花色苷抗氧化性分析
清除自由基或阻止自由基的产生是花色苷抗氧化的主要机制之一,且在一定的浓度范围内,蓝莓花色苷的自由基清除率随蓝莓果酒浓度的增加而提高[17]。因此有必要提高蓝莓果酒花色苷贮藏稳定性,尽可能减少损失。
表1 蓝莓果酒的抗氧化能力
Table 1 Antioxidant capacity of blueberry wine
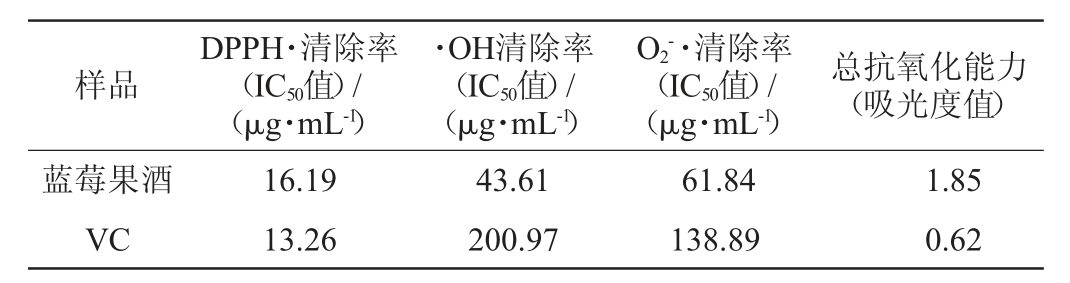
由表1所示,通过用半抑制浓度(half maximal inhibitory concentration,IC50)值来表示蓝莓果酒及VC的抗氧化能力,IC50的数值越小,表示抗氧化能力越强。由表可知,蓝莓果酒和VC的DPPH·清除IC50值分别为16.19μg/mL和13.26μg/mL,这说明蓝莓果酒的DPPH·清除能力低于VC。·OH有很强的氧化性,是对机体危害最大的一类活泼的活性分子。O2-·不仅自身具有危害性,而且还可以通过化学反应生成其他全部的氧自由基,进一步危害机体,因此它也是第一个生成的氧自由基[18]。蓝莓果酒的·OH和O2-·清除能力均显著地高于VC,表现出比较好的抗氧化活性。
由表1可知,蓝莓果酒的吸光度值为1.85,1 g/L VC的吸光度值为0.62,吸光度值越大,表明其总抗氧化能力越强,所以蓝莓果酒的总抗氧化能力大于VC的总抗氧化能力。这主要是因为在花色苷的结构中含有多个属于羟基供体的酚羟基,可使植物组织中容易被氧化的成分得到保护,即蓝莓果酒中花色苷极易被氧化,因此发酵及贮藏过程中采取隔氧措施将有利于蓝莓果酒花色苷的稳定。
2.3 贮藏过程中影响蓝莓果酒花色苷稳定性的因素分析
2.3.1 温度对蓝莓果酒花色苷稳定性的影响
温度对蓝莓果酒花色苷稳定性的影响结果见图6。由图6可知,蓝莓果酒花色苷的保存率随温度在20~70 ℃范围内增加而不断地降低,其中20 ℃与30 ℃的花色苷保存率差异较小,在此范围内温度提升对花色苷浸提的促进作用成为主要影响因素,这主要是因为温度的升高会使水分子的对流速度也随之增加,因此水分子对花色苷分子破坏作用也就相应的增强[19],而且这个过程还遵循动力学方程,如花色苷在50 ℃、70 ℃、90 ℃条件下的降解速率常数分别为0.026 3 h-1、0.086 4 h-1,热降解活化能为63.61 kJ/mol[20];当温度升高时,花色苷还会向着无色的查尔酮及甲醇假碱的方向转化[21]。因此,较低温度有助于蓝莓果酒中花色苷的稳定,贮藏温度在30 ℃以下为宜。
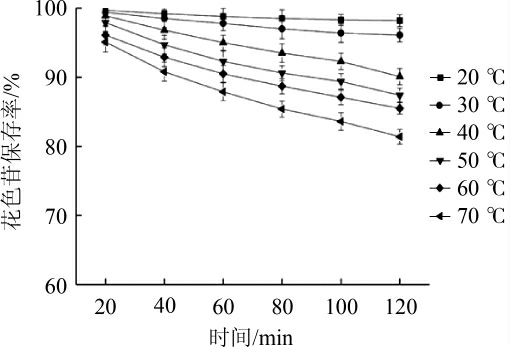
图6 温度对蓝莓果酒花色苷保存率的影响
Fig.6 Effect of temperature on anthocyanin retention rate of blueberry wine
2.3.2 pH值对蓝莓果酒花色苷稳定性的影响

图7 pH值对蓝莓果酒花色苷保存率的影响
Fig.7 Effect of pH on anthocyanin retention rate of blueberry wine
pH值对蓝莓果酒花色苷保存率的影响结果见图7。由图7可知,蓝莓果酒花色苷的保存率随pH值在2~6范围内的增加呈降低趋势,但在pH值为3时,蓝莓果酒花色苷的保存率略高于pH值为2时,所以蓝莓果酒花色苷在pH为3的环境下比较稳定。pH值对花色苷的结构有一定影响,在pH<2时,花色苷多以红色的黄烊阳离子形式存在;在pH值为3~6时,由于受到水的亲核攻击,黄烊阳离子被水合,花色苷浓度也就随之下降,此时花色苷主要是以无色的甲醇假碱和查尔酮假碱的形式存在。LUNA-VITAL D等[22]通过运用第一反应动力学研究玉米中花色苷的稳定性,发现玉米花色苷的半衰期预测值随着pH的增加而显著的下降,当pH>5时,因为色度不成线性的原因导致无法计算玉米花色苷的半衰期[23-26]。因此综合上述分析,蓝莓果酒贮藏pH为3较为适宜。
2.3.3 光照对蓝莓果酒花色苷稳定性的影响
光照对蓝莓果酒花色苷的影响结果见图8。由图8可知,蓝莓果酒花色苷的保存率在室内避光的条件下最高,室内自然光次之,室外自然光最低。蓝莓果酒花色苷的保存率随光照强度及时间的增加而降低,这可能是因为光照会使花色苷分子的酰基脱落,而花色苷分子上的酰基可以增加其稳定性,因此花色苷的稳定会随光照的增加而降低[19]。这也与李畅颖等[27]研究一致。即蓝莓果酒的花色苷在避光的条件下更稳定,因此,蓝莓果酒应避光保存。

图8 光照对蓝莓果酒花色苷保存率的影响
Fig.8 Effects of illumination on anthocyanin retention rate of blueberry wine
2.3.4 蔗糖添加量对蓝莓果酒花色苷稳定性的影响
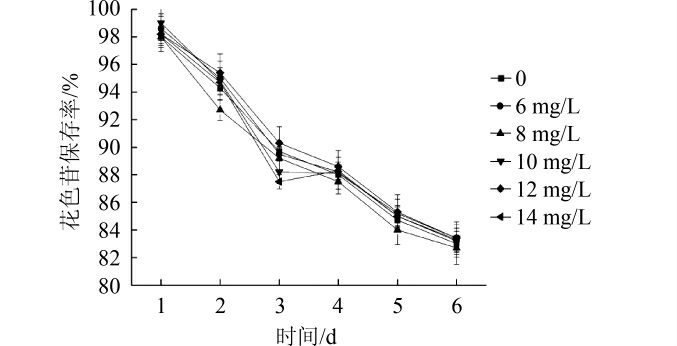
图9 蔗糖添加量对蓝莓果酒花色苷保存率的影响
Fig.9 Effect of sucrose addition on anthocyanin retention rate of blueberry wine
蔗糖的添加量对蓝莓果酒的花色苷保存率的影响结果见图9。由图9可知,当蔗糖的添加量为6 mg/L、10 mg/L时,与不添加蔗糖相比,蓝莓果酒的花色苷保存率会有所增加;当蔗糖的添加量为8 mg/L时,与不添加蔗糖的对照相比,蓝莓果酒的保存率有所降低。因此,当蓝莓果酒中的蔗糖添加量为10 mg/L时,在此条件下,蓝莓果酒的花色苷稳定性最高。
3 结论
结果表明,最佳蓝莓果酒发酵工艺为发酵时间8 d、发酵温度22 ℃、SO2添加量100 mg/L、pH 3.5、酵母添加量0.4%。在此优化条件下,花色苷含量为46.47 mg/100 mL,酒精度为12.76%vol。
以蓝莓果酒为研究对象,以蓝莓果酒花色苷的保存率为依据,研究pH、温度、光照及糖浓度对蓝莓果酒花色苷稳定性的影响。蓝莓果酒花色苷分别在pH为3、30 ℃以下、避光、隔氧、糖浓度为10 mg/L的条件下比较稳定。蓝莓果酒的DPPH·清除能力弱于VC,但·OH和O2-·清除能力显著地高于VC,IC50值分别为16.19μg/mL、43.61μg/mL、61.84μg/mL,总抗氧化能力强于VC,具有较强的抗氧化活性。
[1]俞德浚.中国果树分类学[M].北京:中国农业出版社,1979:217.
[2]SU M S,CHIEN P J.Antioxidant activity,anthocyanins,and phenolics of rabbiteye blueberry(Vaccinium ashei)fluid products as affected by fermentation[J].Food Chem,2006,104(1):182-187.
[3]李影.蓝莓发酵酒最佳工艺条件及其功能性的研究[D].延边:延边大学,2014.
[4]王姗姗,孙爱东,李淑燕.蓝莓的保健功能及其开发应用[J].中国食物与营养,2010(6):17-20.
[5]万山.红树莓花色苷超声波辅助提取及体外生物活性研究[D].北京:北京林业大学,2016.
[6]HRAZINDA G,BORZELL A J,ROBINSON W B.Studies on the stability of the anthocyanidin-3,5-diglucosides[J]. Am J Enol Viticult,1970,4:201-204.
[7]吕锋,何洪巨,冯启利.蔬菜中的花色苷及其保健功能[J].中国食物与营养,2007(3):47-49.
[8]ODRIOZOLA-SERRANO I,SOLIVA-FORTUNY R,MART N-BELLOSO O.Impact of high-intensity pulsed electric fields variables on vitamin C,anthocyanins and antioxidant capacity of strawberry juice[J]. LWT-FoodSci Technol,2009,42(1):93-100.
[9]周宝利,张琦,叶雪凌,等.不同品种茄子果皮花青素含量及其稳定性[J].食品科学,2011,32(1):99-103.
[10]刘雪可,苏梦飞,杨宁,等.不同提取方法对蓝靛果果渣花色苷提取效率的影响[J].食品研究与开发,2018,39(24):44-48.
[11]KILANI S,AMMAR R B,BOUHLEL I,et al.Investigation of extracts from(Tunisian)Cyperus rotundus as antimutagens and radical scavengers[J].Environ Toxicol Pharmacol,2005,20(3):478-484.
[12]YANG X M,YU W,OU Z P,et al.Antioxidant and immunity activity of water extract and crude polysaccharide from Ficus carica L.fruit[J].Plant Food Human Nutr,2009,64(2):167-173.
[13]张晓璐,徐凯宏.山楂叶总黄酮清除·DPPH 和超氧阴离子自由基的活性研究[J].林业科技,2008(5):51-54.
[14]王辉.蓝莓干酒发酵工艺研究[D].哈尔滨:哈尔滨商业大学,2015.
[15]王孝荣,罗佳丽,潘年龙,等.草莓果酒酿造工艺的优化及其香气成分分析[J].食品科学,2014,35(7):196-201.
[16]姚蓓,赵慧芳,吴文龙,等.不同品种蓝莓花色苷色素稳定性的比较[J].食品科学,2017,38(11):142-147.
[17]邓淑芳,白敏冬,白希尧,等.羟基自由基特性及其化学反应[J].大连海事大学学报,2004,30(3):62-64.
[18]薄艳秋.蓝莓花青素的提取和抗氧化活性研究[D].哈尔滨:东北农业大学,2012.
[19]田密霞,胡文忠,李亚东,等.不同品种蓝莓花色苷稳定性的比较研究[J].食品工业科技,2015,36(13):60-71.
[20]曹雪丹,方修贵,赵凯,等.蓝莓汁花色苷热降解动力学及抗坏血酸对其热稳定性的影响[J].中国食品学报,2013,13(3):47-54.
[21]罗晓玲,徐嘉红,杨武斌,等.蓝莓花色苷抗氧化功能及稳定性研究进展[J].食品工业科技,2018,39(4):312-317.
[22]LUNA-VITAL D,LI Q,WEST L,et al.Anthocyanin condensed forms do not affect color or chemical stability of purple corn pericarp extracts stored under different pHs[J]. Food Chem,2017,232:639-647.
[23]赵子丹,葛谦,牛艳.花色苷的稳定性研究进展[J].宁夏农林科技,2016,57(2):50-53.
[24]贺博,梁进,吴林生,等.蓝莓花色苷的稳定性及微胶囊化研究进展[J].中国农学通报,2015,31(5):127-131.
[25]李安文.蓝莓花色苷稳定性及分离纯化技术研究[D].长沙:湖南农业大学,2011.
[26]CAVALCANTI R N,SANTOS D T,MEIRELES M A A.Non-thermal stabilization mechanisms of anthocyanins in model and food systems-An overview[J].Food Res Int,2011,44(2):499-509.
[27]李颖畅,孟宪军,孙靖靖,等.蓝莓花色苷的降血脂和抗氧化作用[J].食品与发酵工业,2008,34(10):44-48.