我国海域辽阔,海藻资源丰富,具有经济价值的大型海藻有100多种[1]。马尾藻是其中常见的一类热带、亚热带大型褐藻,含有丰富的膳食纤维、褐藻胶、褐藻淀粉、矿物质、维生素等成分,其必需氨基酸含量远高于海带和紫菜[2-4]。但由于其细胞中含有较多褐藻胶、褐藻糖胶、纤维素等不易降解的成分,直接使用时营养成分不能得到充分吸收[5]。通过褐藻胶裂解酶进行马尾藻酶解,可以将难以消化的褐藻胶分解成寡糖、单糖,从而提高营养价值[6-7]。通过酶法降解制备的褐藻寡糖具有多种生理活性,如促生长、增强免疫、神经保护、抗炎、抗凝、抗病毒等,在食品、药品、农业、保健品、化妆品等领域具有广泛的应用价值[8-12]。
褐藻胶裂解酶是多糖裂解酶的一种,可通过β-消除反应将褐藻胶降解为在非还原端具有双键的不饱和寡糖[13]。由于其底物特异性,褐藻胶裂解酶可分为G嵌段特异性裂解酶(polyG lyase)、M嵌段特异性裂解酶(polyM lyase)及MG嵌段的双功能褐藻胶裂解酶(polyMG lyase)[14]。迄今为止,已经从海洋生物(藻类、软体动物、细菌和真菌)、陆生细菌和病毒中鉴定出褐藻胶裂解酶[15],其中海洋细菌是褐藻胶裂解酶的重要来源,如假单胞菌[16]、黄杆菌[17]、交替假单胞菌[18]、弧菌[19]、芽胞杆菌[20]等。本论文以实验室自行制备的褐藻胶裂解酶为研究对象,对其酶学性质和酶解马尾藻的工艺进行研究,为褐藻寡糖的规模化生产与应用奠定基础。
1 材料与方法
1.1 材料与试剂
褐藻胶裂解酶粗酶液:本实验室制备保存。
孤囊马尾藻(Sargassum oligocystum):产自海南琼海海域。用自来水洗去盐分等杂质,晒干、粉碎,过60目筛,得到马尾藻粉末。
海藻酸钠(食品级)、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):索莱宝生物科技有限公司;其他化学试剂均为国产分析纯。
褐藻胶裂解酶活性检测培养基:褐藻酸钠5.0 g/L,(NH4)2SO45.0 g/L,K2HPO42.0 g/L,MgSO4·7H2O 1.0 g/L,NaCl 5.0 g/L,FeSO4·7H2O 0.01 g/L,琼脂18.0 g/L,pH7.5。
1.2 仪器与设备
SP-756PC紫外可见分光光度计:上海光谱仪器有限公司;MK2000-2E干式恒温器:杭州奥盛仪器有限公司;ZHWY-2112B恒温振荡培养箱:上海智城分析仪器制备有限公司;5804R冷冻离心机:德国艾本德股份公司;R215旋转蒸发器:瑞士布琪有限公司;DZF-6051真空干燥箱:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 褐藻胶裂解酶酶活活性测定
取褐藻胶裂解酶粗酶液10 μL点样于活性检测培养基上,以加入灭活酶液为空白对照,室温条件下反应16 h后,加入10 mL 1 mol/L CaCl2溶液,5~10 min后观察,产生透明圈则表明此裂解酶对聚古罗糖醛酸(polygulouronic acid,PG)的特异性;产生晕圈则表明对聚甘露糖醛酸(polymannuronic acid,PM)的特异性[21]。
酶活定量测定采用紫外吸收法[22]:取1.8 mL底物(3.0 g褐藻酸钠溶于1 L 50 mmol/L磷酸盐缓冲液(pH7.0)),40 ℃预热5 min,加入0.2 mL待测样品,40 ℃温浴10 min,100 ℃加热10 min灭活混合反应体系,以加入灭活酶液的混合体系为空白对照,测定在波长235 nm处的紫外吸收值。在上述酶活测定方法下,定义波长235 nm处的紫外吸收值每分钟增加0.1的酶量为酶的一个活力单位(U/mL)。
1.3.2 酶学性质试验
酶液制备:采用硫酸铵沉淀法[23]。将粗酶液在4 ℃条件下加入饱和度为80%的硫酸铵,静置过夜,将溶液10 000 r/min离心30min(4℃),保留沉淀,加入少量磷酸缓冲液(0.05mol/L,pH 7.0)溶解,装入透析袋,在相同缓冲液中进行透析处理,每隔6 h更换缓冲液,透析24 h。以透析后酶液作为酶学性质测定酶液。
温度稳定性和最适反应温度试验[24]:粗酶液在不同温度(4 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃)条件下温育1 h后,测定酶的热稳定性,将最高酶活定义为100%。测定在上述不同温度条件下的酶活,以确定其最适反应温度。
pH稳定性和最适反应pH试验[25]:分别以Na2HPO4-柠檬酸缓冲液(pH 3~8)、Na2HPO4-NaH2PO4缓冲液(pH 6~8)、Tris-HCl缓冲液(pH 7~9)作为底物缓冲液,以置于4 ℃保留24 h后的残留酶活力来表征pH稳定性。在上述缓冲液中测定酶活,确定该酶最佳反应pH值,将最高酶活定义为100%。
不同金属离子及化合物质对酶活性的影响[25]:在底物中分别加入终浓度为1 mmol/L的KCl、CaCl2、NH4Cl、FeSO4、MgCl2、ZnSO4、BaCl2、MnSO4、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、尿素,研究其对酶活力的影响。定义空白组(未添加金属离子及化合物质)的相对酶活力为100%。
1.3.3 寡糖提取与含量测定
向酶解马尾藻粉中加入适量无菌水,混匀,抽滤得寡糖溶液。滤渣用等量无菌水重复提取3遍,合并滤液。按照1∶100(V/V)加入30%H2O2,95 ℃加热5 min使其脱色,放入真空干燥箱浓缩至原来的1/10,加入3倍体积的无水乙醇,混匀、静置过夜后离心,取上清液,干燥后得到粗寡糖。
寡糖含量测定:采用DNS法[26]测定。以葡萄糖醛酸作为基准物质,分别以葡萄糖醛酸质量浓度、OD540nm值为横、纵坐标得到葡萄糖醛酸吸光度值-质量浓度标准曲线回归方程为Y=2.401 1X+0.020 4,相关性系数R2达0.999 4。将粗寡糖溶于1 mL蒸馏水中,加入3.0 mL DNS试剂,沸水浴15 min,冷却后定容至25 mL,测定OD540nm,根据回归方程计算出寡糖含量。
1.3.4 马尾藻酶解工艺优化
单因素试验:以寡糖含量为响应指标,酶解的工艺基本参数固定为含水率67%、酶解时间10 h、酶解温度30 ℃。在基本参数下采用单因素法依次考察含水率(67%、75%、80%、83%)、酶解时间(0、4 h、6 h、8 h、10 h、24 h)、酶解温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃)对寡糖含量的影响。寡糖提取与测定方法参考1.3.3进行。
响应面优化:根据Box-Behnken中心组合试验设计原理,在单因素试验的基础上,选取3因素3水平试验对酶解条件进行优化,试验因素和水平见表1,每组试验重复3次,取平均值。利用Design-Expert 8.0.6 软件优化工艺条件。
表1 Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests

2 结果与分析
2.1 褐藻胶裂解酶活性测定
由图1可知,褐藻胶裂解酶粗酶液在检测培养基上,观察到重复试验1、2两处均有两种类型的胶凝反应,说明具有PM和PG底物特异性,空白对照未发生胶凝反应。测定其粗酶液酶活为15.20 U/mL。
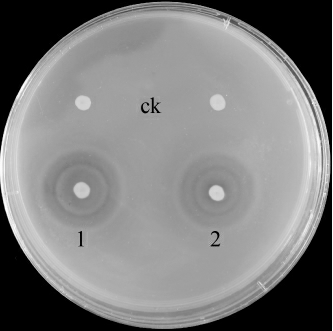
图1 褐藻胶裂解酶检测平板上的透明圈
Fig.1 Transparent zone on alginate lyase activity assay plate
2.2 褐藻胶裂解酶酶学性质
2.2.1 温度稳定性和最适反应温度
由图2可知,酶液在低于40 ℃的条件保温1 h,酶活力可保持90%以上;当温度高于40 ℃,酶活力急剧下降,在60 ℃保温1 h后仅剩24%酶活力,当温度达到70 ℃时活性近乎丧失,说明该酶不宜在高温环境中贮存。由图3可知,酶在不同温度下表现出来的酶活力差异很大,最适酶促反应温度为50 ℃,当低于40 ℃或高于60 ℃时酶活性急剧降低。
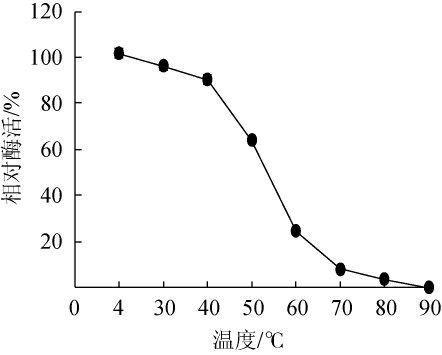
图2 褐藻胶裂解酶的温度稳定性
Fig.2 Temperature stability of alginate lyase
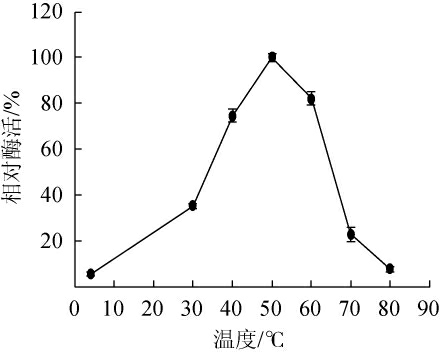
图3 温度对褐藻胶裂解酶活力的影响
Fig.3 Effect of temperature on alginate lyase activity
2.2.2 pH稳定性和最适反应pH
由图4可知,pH为6~8时剩余酶活力均达到90%以上,pH7时剩余酶活力最高,pH3时酶活力仍达到60%。由图5可知,在pH 8时反应酶活性最高,在pH 7~9区间内酶反应活性在70%以上,由此可见该酶在pH接近中性时稳定性较好。
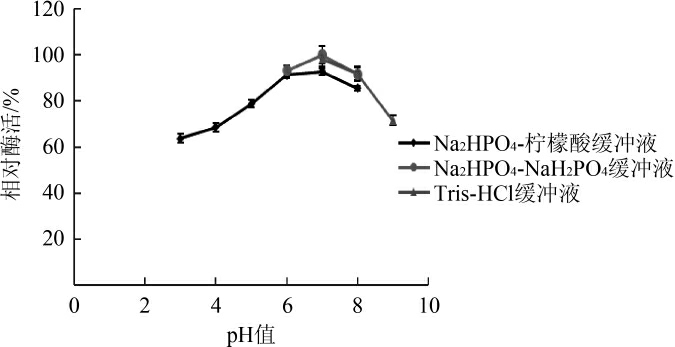
图4 褐藻胶裂解酶的pH值稳定性
Fig.4 pH value stability of alginate lyase
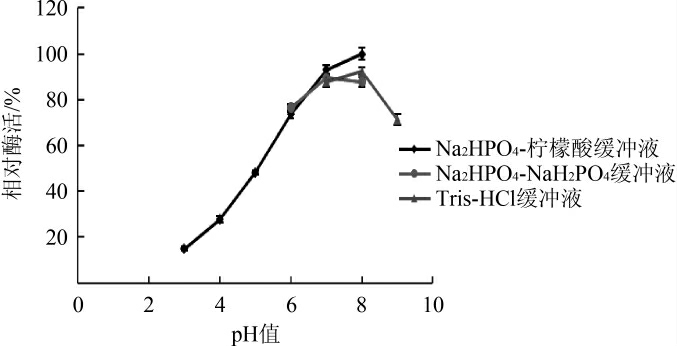
图5 pH值对褐藻胶裂解酶活力的影响
Fig.5 Effect of pH value on alginate lyase activity
2.2.3 金属离子及化学物质对酶的影响
由图6可知,Ca2+、Mg2+和Fe2+对酶活性显示出促进作用,Ca2+可提高酶活16.5%,其次为Mg2+、NH2+和Fe2+等,而Ba2+、Zn2+和Mn2+等金属离子对酶活性显示出抑制作用。EDTA对该酶活性影响最大,剩余酶活性仅约为对照组的27.1%。
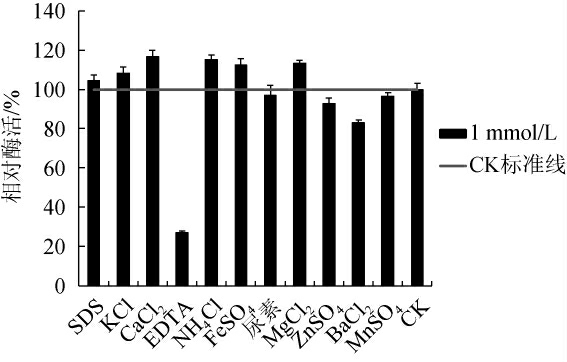
图6 不同金属离子及化学物质对褐藻胶裂解酶活性的影响
Fig.6 Effect of different metal ions and chemical components on alginate lyase activity
2.3 马尾藻酶解工艺优化
2.3.1 单因素试验
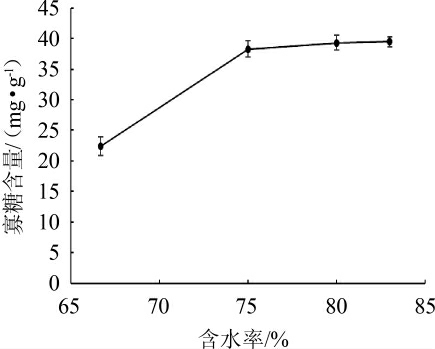
图7 含水率对褐藻胶裂解酶酶解马尾藻的影响
Fig.7 Effect of water content on enzymatic hydrolysis of Sargassum by alginate lyase
由图7可知,含水率为67%~75%时,随着含水率的提高,寡糖含量逐渐升高,当含水率达到75%时寡糖含量为38.29 mg/g,含水率高于75%时寡糖含量无显著提高。考虑到实际生产体系中增高含水率会增加后期的生产成本,选择马尾藻适宜的含水率为75%。
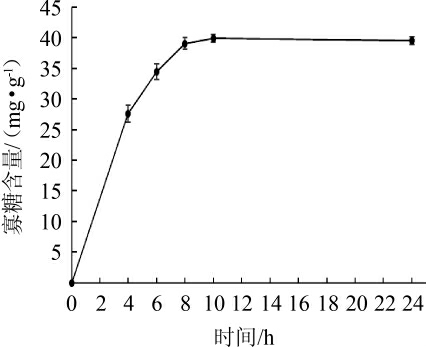
图8 酶解时间对褐藻胶裂解酶酶解马尾藻的影响
Fig.8 Effect of enzymolysis time on enzymatic hydrolysis of Sargassum alginate lyase
由图8可知,反应初期随酶解时间的延长,寡糖含量快速上升,在8 h时寡糖的增加趋于平缓,到10 h时达到最大值39.90 mg/g。因此,选择酶解时间为10 h。

图9 酶解温度对褐藻胶裂解酶酶解马尾藻的影响
Fig.9 Effect of enzymolysis temperature on enzymatic hydrolysis of Sargassum by alginate lyase
由图9可知,随酶解温度的升高,寡糖含量先快速上升,40 ℃后缓慢下降。这是因为酶促反应温度为40~60 ℃时酶活力最好,一定范围内提高温度酶活增加,寡糖含量随之提高,但升高至40 ℃后,酶的热稳定性急剧降低,导致酶活减小,寡糖的含量降低。因此,选择最适酶解温度为40 ℃,此时寡糖含量为40.47 mg/g。
2.3.3 响应面试验设计结果与分析
以含水率、酶解时间和酶解温度为主要影响因素,以褐藻寡糖含量(Y)为响应值,确定褐藻胶裂解酶酶解马尾藻藻粉的最佳酶解工艺条件,试验方案及寡糖含量如表2所示。
根据表2的结果,用Design-Expert 8.0.6软件进行方差分析,结果见表3。
表2 Box-Behnken 试验设计及结果
Table 2 Design and results of Box-Behnken tests
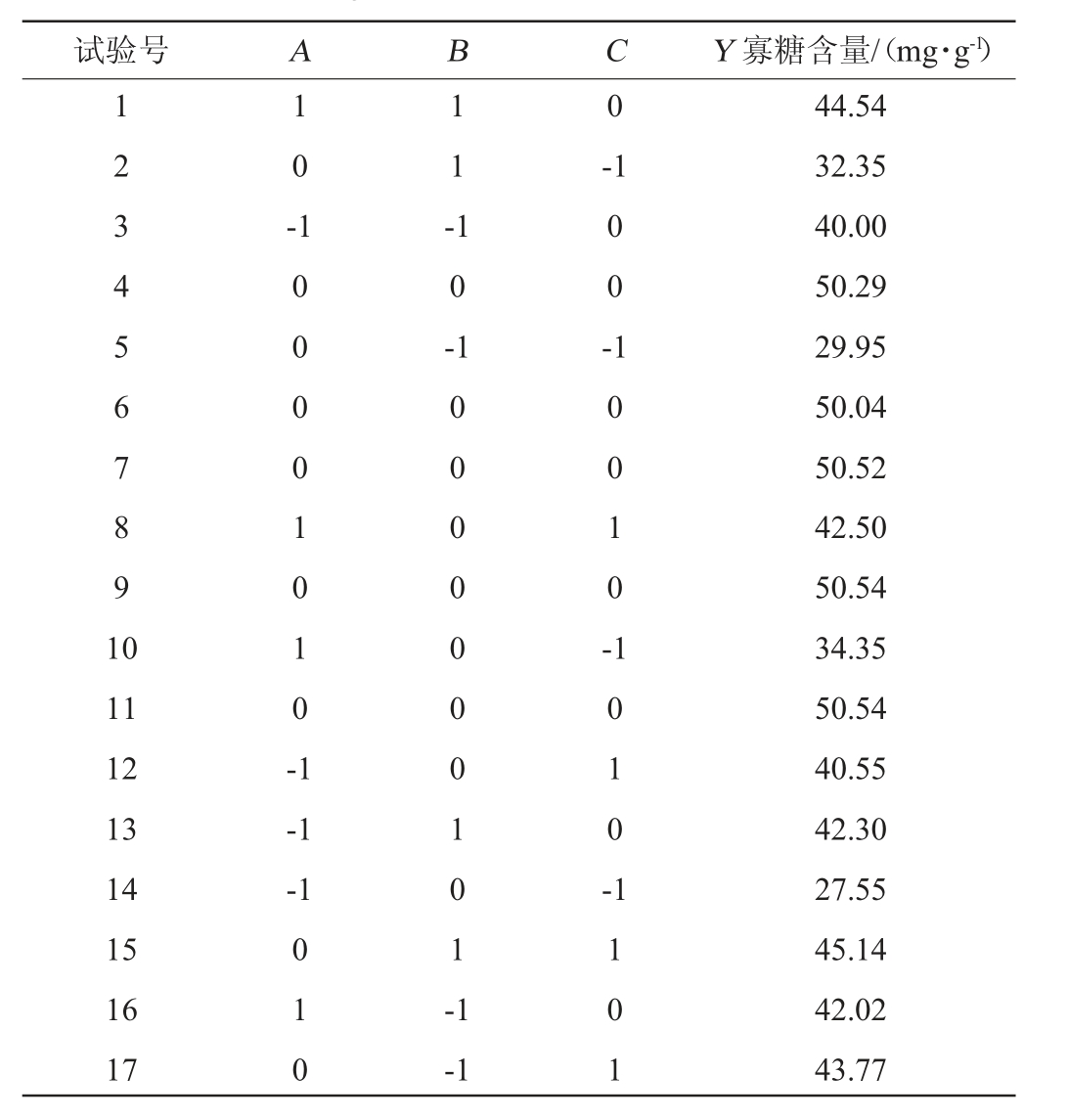
表3 回归模型方差分析
Table 3 Variance analysis of regression model
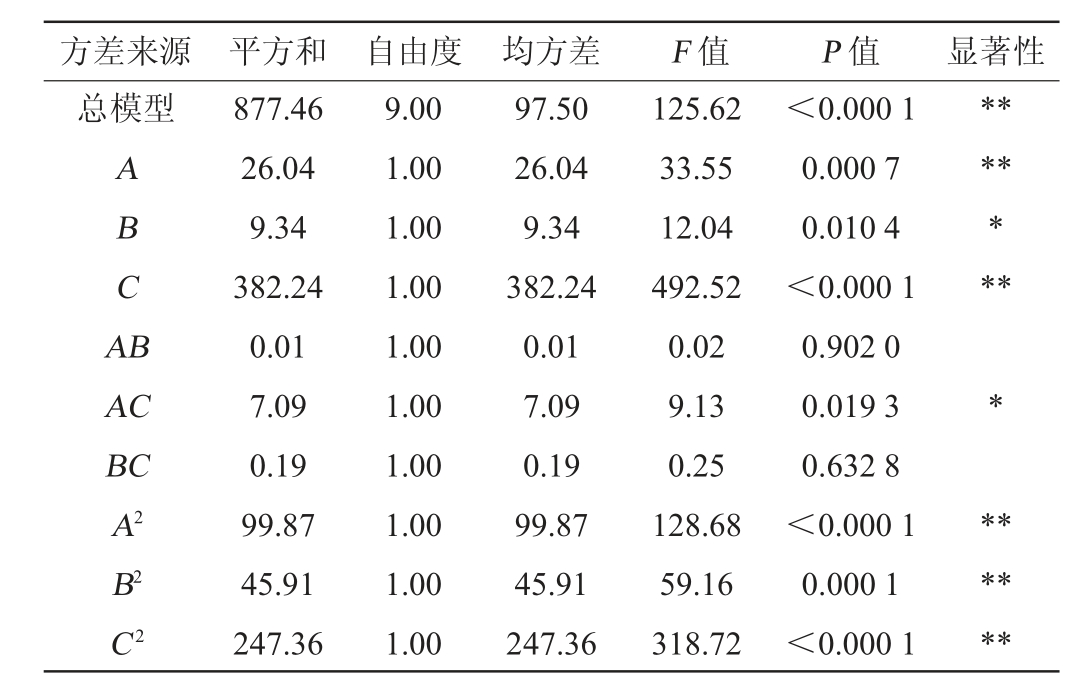
续表
注:“**”表示对试验结果有极显著影响(P<0.01);“*”表示对试验结果有显著性影响(P<0.05)。
由表2、表3可知,试验所选模型极显著(P<0.01)。一次项中酶解温度(A)和含水率(C)对寡糖含量影响均达极显著水平(P<0.01),二次项中A2、B2和C2对寡糖含量影响极显著(P<0.01),交互项中AC影响显著(P<0.05);B(酶解时间)影响显著(P<0.05),而AB、BC影响不显著。各因素对响应值的影响不是简单的线性关系,影响程度为:含水率>酶解温度>酶解时间。采用Design-Expert 8.0.6软件对表3的数据进行回归分析,得三元二次回归方程:Y=1.86A+1.11B+7.15C+0.056AB-1.38AC-0.23BC-4.87A2-3.30B2-9.161C2+49.09。
用Design-Expert 8.0.6软件分析模型的可信度,模型的决定系数R2=0.993 8,调整决定系数R2Adj=0.985 9。R2接近1,表明模型预测的响应值准确,可用于试验分析和预测。变异系数(coefficient of variation,CV)反映试验的可重复性,其值越小表明试验越精确,模型变异系数(CV)=2.09%<10%;模型信噪比Adeq Precision=34.369>4,表明模型的相应信号足够强,模型可信并可用于拟合试验结果。综上分析,该模型可用于分析预测褐藻胶裂解酶酶解马尾藻的工艺。
响应面法的分析图是特定的响应值与自变量的三维空间图,能直观反映自变量对响应值的影响程度。酶解时间含水率与酶解温度的交互作用对寡糖含量的影响,响应面发生了弯曲,表明其对寡糖含量的影响不是简单的线性关系。由图10可知,酶解时间对寡糖含量的影响大于酶解温度的影响,两个因素的交互作用不显著。同样,图10(b)和图10(c)响应面也发生了弯曲,表明含水率和酶解温度与寡糖含量也不是简单的线性关系,进一步优化得含水率对寡糖含量的影响大于酶解温度和时间的影响。从图10(a)可以看出含水率与酶解温度的交互作用显著,图10(c)可以看出含水率与酶解时间的交互作用不显著,以上结果与表4回归方程方差分析结果一致。
基于软件分析得出的最佳酶解条件为含水率75.64%、酶解时间10.31 h、酶解温度40.69 ℃,该条件下寡糖含量理论值为50.66 mg/g。实际操作中,调整含水率为75%、酶解时间为10.3 h、酶解温度为40.7 ℃,得寡糖含量实际值为50.42 mg/g,与预测值接近,表明回归模型与试验结果符合良好,回归方程能真实地反映含水率、酶解温度、酶解时间对寡糖含量的影响,模型具有可行性。

图10 酶解时间、温度与含水率交互作用对寡糖含量影响的响应曲面和等高线
Fig.10 Response surface plots and contour line of effects of interaction between hydrolysis time,temperature and water content on polysaccharide yield
3 结论
通过研究酶学性质,发现实验室制备的褐藻胶裂解酶反应最适温度为50 ℃,最适pH值为7.0,在pH 5.0~9.0及低于40 ℃的环境中比较稳定。Ca2+、Mg2+和Fe2+等离子对褐藻胶裂解酶有促进作用,EDTA、Ba2+、Zn2+等有抑制作用。通过单因素和响应面法试验,获得了褐藻胶裂解酶酶解马尾藻的最佳酶解工艺条件为含水率为75%、酶解时间为10.3 h、酶解温度为40.7 ℃。此优化条件下寡糖含量为(50.420.24)mg/g。本试验可为菌株HB172198产褐藻胶裂解酶的工业应用和马尾藻的固体酶解工艺提供理论依据和技术参考。
[1]詹冬梅,王翔宇,辛美丽,等.三种马尾藻的营养组成分析[J].广西科学院学报,2016,32(3):221-225.
[2]胡斌,王秉利,许鹏,等.马尾藻营养成分研究进展[J].水产学杂志,2016,29(1):48-53.
[3]MATANJUN P,MOHAMED S,MUSTAPHA N M,et al.Nutrient content of tropical edible seaweeds, Eucheuma cottonii, Caulerpa lentillifera and Sargassum polycystum[J].J Appl Phycol,2009,21(1):75-80.
[4]PLAZA M,SANTOYO S,JAIME L,et al.Screening for bioactive compounds from algae[J].J Pharm Biomed Anal,2010,51(2):450-455.
[5]黄磊,詹勇,许梓荣.海藻多糖的结构与生物学功能研究进展[J].浙江农业学报,2005,17(1):49-53.
[6]CHOI J I,KIM H J.Preparation of low molecular weight fucoidan by gammairradiation and its anticancer activity[J].Carbohydr Polym,2013,97(2):358-362.
[7]KIM K J,LEE O H,LEE B Y.Low-molecular-weight fucoidan regulates myogenic differentiation through the mitogen-activated protein kinase pathway in C2C12 cells[J].Brit J Nutr,2011,106(12):1836-1844.
[8]COURTOIS J.Oligosaccharides from land plants and algae:Production and applications in therapeutics and biotechnology[J].Curr Opin Microbiol,2009,12(3):261-273.
[9]孙哲朴,刘辉,武欣雨,等.褐藻胶寡糖制备和生物活性的研究进展[J].食品工业,2019,40(2):291-296.
[10]IWAMOTO Y,XU X,TAMURA T,et al.Enzymatically depolymerized alginate oligomers that cause cytotoxic cytokine production in human mononuclear cells[J].Biosci Biotechn Biochem,2003,67(2):258-263.
[11]ZHAO X,LI B,XUE C,et al.Effect of molecular weight on the antioxidant property of low molecular weight alginate from Laminaria japonica[J].J Appl Phycol,2012,24(2):295-300.
[12]窦勇,胡佩红.褐藻胶寡糖制备及抑菌活性研究[J].广东农业科学,2009,12(1):161-163.
[13]ZHU B,YIN H.Alginate lyase:Review of major sources and classification,properties,structure-function analysis and applications[J]. Bioengineered,2015,6(3):125-131.
[14]IWAMOTO Y,IRIYAMA K,OSATOMI K,et al.Primary structure and chemical modification of some amino acid residues of bifunctional alginate lyase from a marine bacterium Pseudoalteromonas sp.strain No.272[J].J Protein Chem,2002,21(7):455-463.
[15]ERTESVÅG H.Alginate-modifying enzymes:biological roles and biotechnological uses[J].Front Microbiol,2015,6(1):523-533.
[16]LI L,JIANG X,GUAN H,et al.Preparation,purification and characterization of alginate oligosaccharides degraded by alginate lyase from Pseudomonas sp.HZJ 216[J].Carbohydr Res,2011,346(6):794-800.
[17]HUANG L,ZHOU J,LI X,et al.Characterization of a new alginate lyase from newly isolated Flavobacterium sp.S20[J]. J Ind Microbiol Biot,2013,40(1):113-122.
[18]LI J W,DONG S,SONG J,et al.Purification and characterization of a bifunctional alginate lyase from Pseudoalteromonas sp.SM0524[J].Mar Drugs,2011,9(1):109-123.
[19]LI S,WANG L,HAO J,et al.Purification and characterization of a new alginate lyase from marine bacterium Vibrio sp.SY08[J].Marine Drugs,2016,15(1):1-11.
[20]CHEN P,ZHU Y M,MEN Y,et al.Purification and characterization of a novel alginate lyase from the marine bacterium Bacillus sp.Alg07[J].Marine Drugs,2018,16(3):86-90.
[21]HISANO T,NISHIMURA M,YAMASHITA T,et al.A simple method for determination of substrate specificity of alginate lyases[J]. J Ferment Bioeng,1994,78(2):182-184.
[22]SONG K,YU W G,HAN F,et al.Purification and characterization of alginate lyase from marine bacterium Vibrio sp.QY101[J].Acta Biochim Biophysica Sinica,2003,35(5):473-477.
[23]牛术敏,郭晓军,李术娜,等.枯草芽孢杆菌BS-26 菌株纤溶酶的性质分析及活性组分的分离纯化[J].微生物学报,2008,48(10):1387-1392.
[24]林小洪,叶秀云,王国增,等.产木聚糖酶菌株的筛选、鉴定及酶学性质研究[J].中国食品学报,2016,16(1):115-122.
[25]马焕,权淑静,刘德海,等.产木聚糖酶菌株的筛选、鉴定及其酶学性质研究[J].中国酿造,2016,35(12):123-128.
[26]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:10-11.