微生物絮凝剂是一类具有絮凝活性的微生物体或微生物代谢产物或分泌物,其主要成分是多糖、蛋白质及脱氧核糖核酸等物质[1-3]。目前,微生物絮凝剂主要应用于废水悬浮颗粒的去除、乳浊液的油水分离、改善污泥沉降性能、降低高浓度有机废水中的有机物质、重金属的富集[4-7]。微生物絮凝剂具有无毒性、无二次污染、应用范围广等优点[8-9],但由于生产成本高,导致其工业化发展缓慢。
目前,众多研究以淀粉废水[10-11]、蜜糖废水[12]、养猪废水[13]、乳制品废水[14]、啤酒废水[15-16]等作为替代培养基生产微生物絮凝剂。利用黄水作替代培养基,生产微生物絮凝剂的报道较少[17]。
黄水是传统浓香型白酒酿造中特有副产物[18]。一般情况下,每生产1000kg大曲酒,大约会产生黄水300~400kg[19]。黄水pH范围在3~4,高化学需氧量(chemicaloxygendemand,COD)25 000~40 000 mg/L;高生化需氧量(biochemical oxygen demand,BOD)25 000~30 000 mg/L[20]。黄水中含有大量的有机物质,如含氮化合物、还原糖及种类丰富的有机酸、醇、醛等物质,经气相色谱分析,黄水中含有8.2 g/L的还原糖、2.6%的乙醇、4.73 g/L的总酸以及多种微量成分[21]。
本研究以黄水作为替代培养基,采用单因素及响应面试验优化超压肠杆菌(Enterobacter nimipressuralis)利用黄水培养基生产微生物絮凝剂培养条件,既降低了微生物絮凝剂的生产成本,也有效的降低了黄水中的有机物浓度,达到以废治废,为生产微生物絮凝剂的廉价培养基选取提供了科学依据,也探索了废水资源化利用途径。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与黄水
超压肠杆菌(Enterobacter nimipressuralis):由本实验室筛选和保藏;黄水:取自四川省成都市水井坊公司水井坊基地,密封保存在4 ℃冰箱中,备用。
1.1.2 化学试剂
NaOH、盐酸、CaCl2(均为分析纯):成都市科隆化学品有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;牛肉膏(生化试剂):北京索莱宝科技有限公司;高岭土:天津市恒兴化学试剂制造有限公司。
1.1.3 培养基
发酵培养基采用牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,去离子水1 000 mL,pH7.2~7.4。121 ℃灭菌20 min。
1.2 仪器与设备
PRACTUM224-1CN电子天平:赛多利斯科学仪器有限公司;PHS-2C笔式pH计:上海康仪仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器:上海博讯实业有限公司;HWS-150立式恒温培养摇床:上海世平实验设备有限公司;721E型可见分光光度计:上海光谱仪器有限公司。
1.3 实验方法
1.3.1 微生物絮凝剂的制备
将菌株按5%的接种量接种于发酵培养基中,在设定的条件下,经培养获得的发酵液即为微生物絮凝剂。
1.3.2 絮凝率的测定[22]
称取0.5 g高岭土置于烧杯中,加入98 mL去离子水,50 g/L的CaCl2溶液1 mL,1 mL发酵液,180 r/min充分搅拌3 min,静置10 min。测定上清液的OD550nm值,每组实验均做3个平行,去离子水作空白对照。絮凝率计算公式如下:
式中:η为絮凝率,%;A为絮凝处理前上清液于波长550 nm处的吸光度值;B为絮凝处理后上清液于波长550 nm处的吸光度值。
1.3.3 黄水培养基的制备
用去离子水将黄水按不同体积比稀释并配制为黄水培养基,使黄水所占的体积比分别为10%、20%、30%、40%、50%、60%、70%、80%、90%、100%;同时将黄水与牛肉膏蛋白胨培养基按不同体积比混合,配制成黄水与牛肉膏蛋白胨混合培养基,如上,黄水所占体积比为10%~100%。将菌株分别接种到稀释为不同倍数的黄水培养基中和混合培养基中。在恒温摇床中,温度32 ℃、130 r/min,振荡培养72 h,测定发酵液絮凝率。
1.3.4 培养基优化单因素试验
最佳碳氮源的确定:分别以5 g/L的葡萄糖、2.5 g/L蔗糖及2.5 g/L可溶性淀粉作为碳源,5 g/L NaCl为无机盐,分别加入5 g/L蛋白胨、5 g/L牛肉膏、5 g/L酵母浸粉、5 g/L胰蛋白胨、2.5 g/L NH4Cl、1 g/L尿素,测定发酵液絮凝率。
最佳无机盐的确定:以10%黄水、5 g/L葡萄糖和1 g/L尿素为发酵培养基,分别添加2.5 g/L NaCl、CaCl2、MgSO4、KCl、FeSO4,接入5%的种子液,培养后测定发酵液絮凝率。
分别调整黄水体积分数为5%、10%、15%、20%、25%、30%;葡萄糖添加量为2.5 g/L、5.0 g/L、7.5 g/L、10.0 g/L、12.5 g/L、15.0 g/L;尿素添加量为0.50 g/L、0.75 g/L、1.00 g/L、1.25 g/L、1.50 g/L、1.75 g/L;KCl添加量为1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L、3.5 g/L;接种量为4%、6%、8%、10%、12%、14%;培养基初始pH值为5、6、7、8、9。考察黄水体积比、葡萄糖添加量、尿素添加量、KCl添加量、接种量及初始pH值对发酵液絮凝率的影响。
1.3.5 培养条件Plackett-Burman试验设计
以单因素试验结果为依据,根据Plackett-Burman试验设计原理,采用N=12试验设计,以絮凝率(Y)为响应值,运用Design Expert 8.0.6软件对黄水体积分数(A)、葡萄糖添加量(B)、尿素添加量(C)、KCl添加量(D)、接种量(E)、初始pH(F)这6个因素进行研究,每一个自变量的高低水平分别以1、-1进行编码,Plackett-Burman试验设计因素与水平见表1。
表1 培养基成分优化Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman tests for medium components optimization

1.3.6 最陡爬坡试验
根据Plackett-Burman测试结果中每个显著影响因素效应的大小,设定步长和变化方向,找出峰值,并快速逼近最佳值区域。
1.3.7 培养基优化响应面试验设计
根据最佳爬坡试验的结果,将絮凝剂最高的一组作为中心组合试验设计的中心点,根据Box-Behnken试验原理[23],运用Design Expert 8.0.6软件以KCl添加量(A)、尿素添加量(B)、黄水体积分数(C)为评价因素,以絮凝率(Y)为响应值,Box-Behnken试验设计编码值与水平见表2。
表2 培养基成分优化Box-Behnken试验因素与水平
Table 2 Factors and levels of Box-Behnken tests for medium components optimization

2 结果与分析
2.1 黄水作为替代培养基制备微生物絮凝剂
2.1.1 产絮菌经黄水培养和混合培养对絮凝效果的影响
由图1可知,菌株经10%的黄水培养与10%的混合培养的絮凝率基本持平,分别为73.83%和74.25%。与混合培养基相比,黄水的成本更低,而且达到了废物利用的效果,因此,最适黄水体积分数为10%。
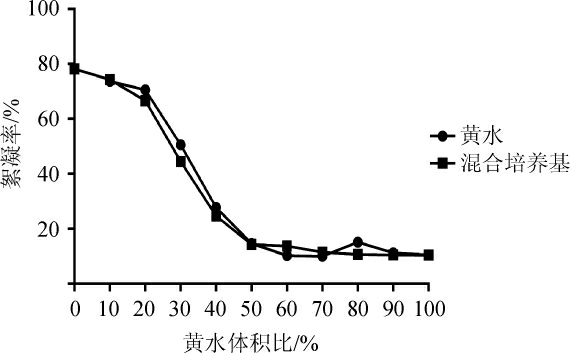
图1 产絮凝剂菌经纯黄水培养和混合培养对絮凝效果的影响
Fig.1 Effect of flocculant-producing bactrium after pure Huangshui medium and mixed medium culture on flocculation efficiency
2.1.2 不同碳氮源对絮凝效果的影响
碳氮源种类对产絮菌分泌微生物絮凝剂有一定的影响[24]。由图2可知,菌株可以利用多种碳氮源来产生微生物絮凝剂,当碳氮源组合为葡萄糖和尿素时,菌株的絮凝率为77.35%,所以菌株的最佳碳氮源组合是葡萄糖和尿素。

图2 不同碳氮源对絮凝效果的影响
Fig.2 Effect of different carbon and nitrogen sources on flocculation efficiency
2.1.3 不同无机盐对絮凝效果的影响
在培养基中加入无机盐,其中的金属离子能中和并使生物高分子表面官能团所带的负电荷稳定,有效的促进产絮菌的产絮性能[25]。由图3可知,KCl是最佳无机盐。

图3 不同无机盐对絮凝效果的影响
Fig.3 Effect of different inorganic salts on flocculation efficiency
2.2 培养条件优化单因素试验
2.2.1 不同体积分数黄水对絮凝效果的影响
由图4可知,絮凝率随着黄水体积分数的增加,呈现先快速增加又缓慢下降的趋势。当黄水体积分数为15%时,絮凝率最大为78.75%。黄水中的乙醇可以促进产絮菌生产微生物絮凝剂[10]。黄水体积分数过高时其中不利于菌体生存繁殖的物质(如糠醛)积累或黄水浓度过低其中的有机物质不足,不利于产絮菌的生长,则抑制了其代谢产物的分泌。因此,最佳黄水体积分数为15%。
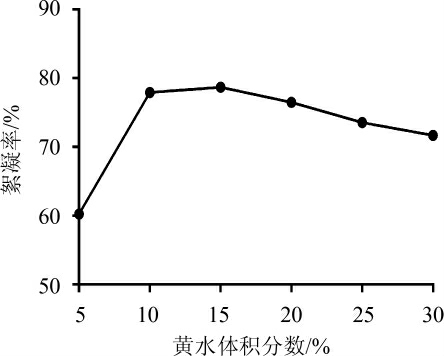
图4 不同体积分数黄水对絮凝效果的影响
Fig.4 Effect of different volume fraction of Huangshui on flocculation efficiency
2.2.2 不同葡萄糖添加量对絮凝效果的影响
如图5所示,当葡萄糖添加量<7.5 g/L时,絮凝率随着葡萄糖添加量的增加而增加。当葡萄糖添加量>7.5 g/L时,絮凝率随着葡萄糖添加量的增加反而呈现下降趋势。当葡萄糖添加量为7.5 g/L时,絮凝率最大为80.7%。因此,最佳葡萄糖添加量为7.5 g/L。
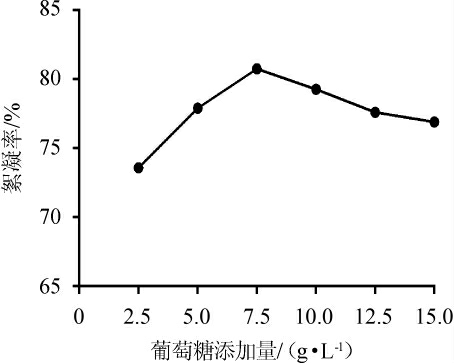
图5 不同葡萄糖添加量对絮凝效果的影响
Fig.5 Effect of different glucose addition on flocculation efficiency
2.2.3 不同尿素添加量对絮凝效果的影响
如图6所示,当尿素添加量<1.25 g/L时,絮凝率随着尿素添加量的增加而迅速增加;当尿素添加量>1.25 g/L时,絮凝率反而呈现下降趋势。当尿素添加量为1.25 g/L时,絮凝率最大为78.9%。因此,最佳尿素添加量为1.25 g/L。
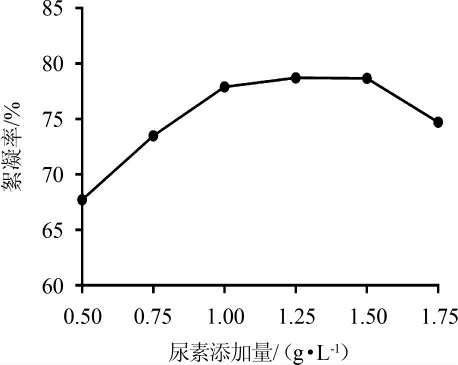
图6 不同尿素添加量对絮凝效果的影响
Fig.6 Effect of different urea addition on flocculation efficiency
2.2.4 不同KCl添加量对絮凝效果的影响
如图7所示,当KCl添加量<2.5 g/L时,絮凝率随着KCl添加量的增加而升高;当KCl添加量>2.5 g/L时,絮凝率随着KCl添加量的增加反而呈现下降趋势。当KCl添加量为2.5g/L时,絮凝率最大为80.77%。因此,最佳KCl添加量为2.5 g/L。
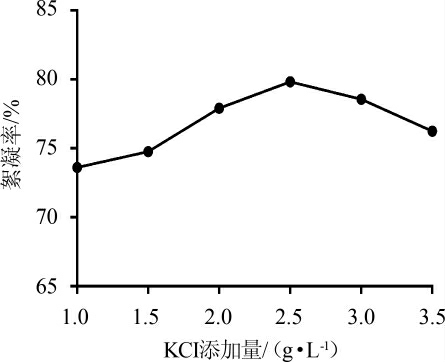
图7 不同KCl添加量对絮凝效果的影响
Fig.7 Effect of different KCl addition on flocculation efficiency
2.2.5 不同接种量对絮凝效果的影响
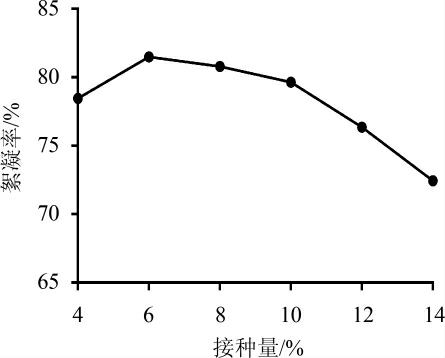
图8 不同接种量对絮凝效果的影响
Fig.8 Effect of different inoculum on flocculation efficiency
如图8所示,当接种量较低时,絮凝率较低,随着接种量在4%~6%范围内的增加,絮凝率也随之上升,当接种量为6%时,絮凝率最大为81.74%。当接种量>6%,虽然适应期缩短了许多,但是由于培养基营养成分一定,营养消耗过快,菌体易老化不利于产物的生成和积累,因而导致絮凝率下降。因此,最佳接种量为6%。
2.2.6 初始pH不同对絮凝率的影响
如图9所示,当培养基初始pH为5~7时,絮凝率随初始pH增加而增大;当培养基初始pH为7时,絮凝率最大为79.32%;当初始pH>7之后,絮凝率稍有下降。因此,最佳初始pH为7。

图9 不同初始pH值对絮凝效果的影响
Fig.9 Effect of different initial pH on flocculation efficiency
2.3 Plackett-Burman试验设计结果
基于单因素试验,以絮凝率(Y)为响应值,采用Plackett-Burman(N=12)试验考察影响絮凝效果的8个因素的显著性。Plackett-Burman试验的设计和结果见表3,主效应分析采用Design-Expert8.0.6软件进行,结果见表4。
表3 培养基成分优化Plackett-Burman试验设计与结果
Table 3 Design and results of Plackett-Burman tests for medium components optimization
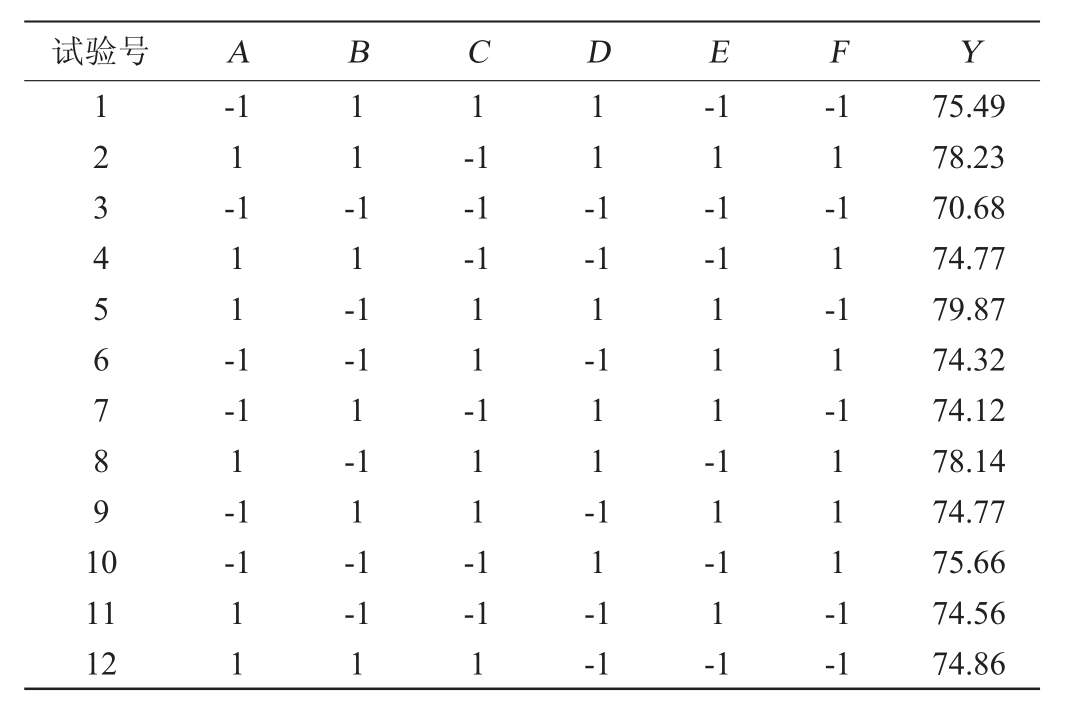
通过F值检测相关因素的显著性,由表4可知,模型的F值16.98,P值为0.003 5<0.05,说明得出的一阶回归模型是显著的,拟合程度高,可以用于理论预测。因素黄水体积分数(P=0.002 1<0.05)、尿素添加量(P=0.016 2<0.05)、KCl添加量(P=0.001 2<0.05)为显著性因素。因此对黄水体积分数、尿素添加量和KCl添加量这3个显著因子进一步优化。
表4 培养基成分优化Plackett-Burman试验主效应分析
Table 4 Main effects analysis of Plackett-Burman tests for medium components optimization

2.4 最陡爬坡试验
最陡爬坡试验是确定逼近中心点的显著影响因素的取值以及提高絮凝率,黄水体积分数、尿素添加量及KCl添加量这3个因素的变化方向和步长的试验设计及结果见表5。由表5可知,3个显著影响因素的中心点在第3组试验附近,因此确定第3组的水平作为响应面试验的中心点,即黄水体积分数20%、尿素添加量1.5 g/L及KCl添加量3 g/L。
表5 最陡爬坡试验设计与结果
Table 5 Design and results of the steepest ascent tests for medium components optimization

2.5 响应面法优化培养基成分
以KCl添加量(A),尿素添加量(B)黄水体积分数(C)为影响因素,絮凝率(Y)作为响应值,采用Design-Expert 8.0.6软件进行设计,Box-Behnken试验设计结果见表6,方差分析结果见表7。
表6 培养基成分优化Box-Behnken试验设计与结果
Table 6 Design and results of Box-Behnken tests for medium components optimization

续表

表7 回归模型方差分析
Table 7 Variance analysis of regression model
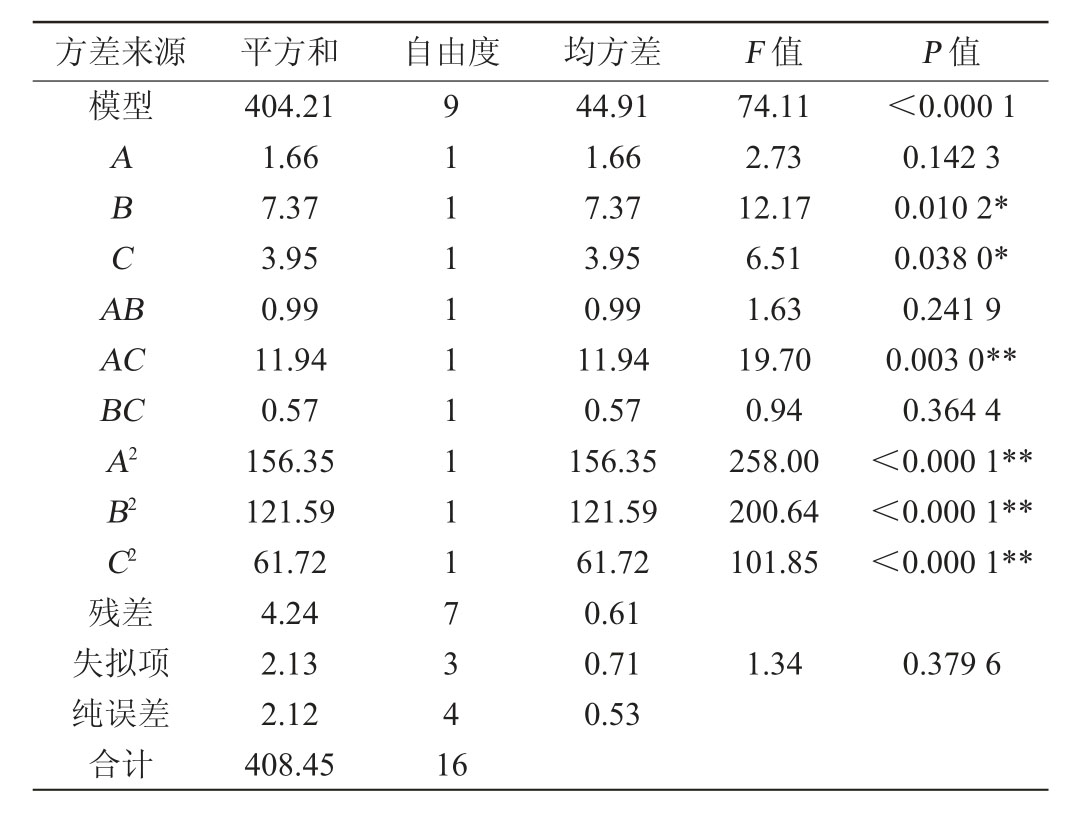
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
利用Design-Expert 8.0.6软件对表6数据进行拟合,得到响应面二次回归方程:Y=84.52+0.46A+0.96B-0.70C-0.50AB-1.73AC-0.38BC-6.09A2-5.37B2-3.83C2。模型的P值<0.000 1,说明模型的二次拟合方程是高度显著的,失拟项P值为0.379 6>0.05,说明失拟因素不存在,该回归方程可以用于初步分析和预测。一次项B、C对结果影响显著(P<0.05)、二次项A2、B2、C2和交互项AC对结果影响极显著(P<0.01)。
KCl添加量、尿素添加量和黄水体积分数各因素两两交互对絮凝率的影响结果见图10。
由图10a可知,三维曲面图较为缓和,等高线呈较缓和的椭圆形,说明尿素与KCl添加量的交互作用相对较小。由图10b可知,三维曲面图最为陡峭,等高线呈明显的椭圆形,说明黄水体积分数与KCl添加量交互作用相对显著。由图10c可知,三维曲面图较为缓和,等高线呈较缓和的椭圆形,说明尿素添加量与黄水体积分数的交互作用相对较小。
通过软件Design-Expert 8.0.6软件分析得到最佳培养基成分为3.02 g/L KCl,1.52 g/L尿素,17.23%黄水,此时絮凝率理论值为84.6124%。结合试验实际操作的可行性,将上述最优培养基组分修正为3.0 g/L KCl,1.5 g/L尿素,17%黄水。以响应面分析得到的最佳结果进行重复试验3次,测得絮凝率实际平均值为84.35%,与理论值基本吻合。

图10 KCl添加量、尿素添加量及黄水体积分数对絮凝率影响的响应面曲面及等高线
Fig.10 Response surface plots and contour lines of effects of interaction between KCl addition,urea addition and Huangshui volume fraction on flocculation rate
3 结论
通过单因素试验、Plackett-Burman试验、最陡爬坡试验及响应面试验结果表明,超压肠杆菌产絮凝剂优化发酵条件为培养基初始pH值7,接种量6%,黄水体积分数为17%,葡萄糖添加量为7.5g/L、尿素添加量为1.5g/L、KCl添加量为3 g/L。在此最佳培养基条件下,絮凝剂的絮凝率可达到84.35%。该研究为超压肠杆菌利用黄水培养基生产微生物絮凝剂的研究及应用奠定了理论基础。
[1]PENG L Y,YANG C P,ZENG G M,et al.Characterization and application of bioflocculant prepared by Rhodococcus erythropolis using sludge and livestock wastewater as cheap culture media[J].Appl Microbiol Biot,2014,98(15):6847-6858.
[2]陈俊,詹志钢,陈哲,等.一株絮凝菌的鉴定、絮凝基因定位及其絮凝剂成分分析[J].生物技术通报,2012,28(4):122-126.
[3]李明源,王继莲,魏云林,等.细菌胞外多糖的特性及应用研究[J].生物技术通报,2014,30(6):51-56.
[4]周英勃,柴涛,段婉君.白醋废水制备微生物絮凝剂的响应面法优化及其对造纸废水的处理[J].环境工程学报,2016,10(10):5698-5664.
[5]张峰,彭辉,杨思敏,等.微生物絮凝剂与Fenton 试剂联合调理对印染污泥脱水性能的影响[J].环境工程学报,2016,10(6):2962-2968.
[6]潘晓鸿,程扬健,潘丹梅,林璋,关雄.廉价培养细菌及其在含Cr(Ⅵ)和Ni(Ⅱ)电镀废水治理中的应用(英文)[J].农业生物技术学报,2014,22(6):779-786.
[7]周云,刘英,张志强.微生物絮凝剂制备的研究新进展[J].环境污染与防治,2014,36(4):80-85.
[8]谢雅静,杨劲峰,赵继红.微生物絮凝剂在废水处理中的应用现状研究[J].北方经贸,2013(2):112-113.
[9]ZHOU X T,HAN Z,SUN S Q,et al.Application research status and development prospect of microbial flocculant[J]. Meteorol Environ Res,2015,6(10):26-29.
[10]熊星滢.淀粉废水培养黑曲霉产微生物絮凝剂及应用研究[D].成都:成都理工大学,2016.
[11]王馨蔚.木薯淀粉废水培养复合微生物絮凝剂产生菌的条件优化[D].南宁:广西大学,2016.
[12]ZHUANG X L,WANG Y P,LI Q B,et al.The production of bioflocculants by Bacillus licheniformis using molasses and its application in the sugarcane industry[J].Biotechnol Bioproc Eng,2012,17(5):1041-1047.
[13]邵承斌,敖黎鑫,思显佩,等.猪粪水培养絮凝剂产生菌的研究[J].西南师范大学学报,2011,36(1):142-147.
[14]WANG S G,GONG W X,LIU X W,et al.Production of a novel bioflocculant by culture of Klebsiella mobilis using dairy wastewater[J].Biochem Eng,2007,36(2):81-86.
[15]芦艳,乔福珍,孟丽丽.啤酒废水培养复合型生物絮凝剂产生菌的研究[J].水处理技术,2010,36(5):31-33,37.
[16]王钰舟,杨雷,张景来,等.利用啤酒废水培养极大螺旋藻[J].化工环保,2014,34(3):257-261
[17]彭翠珍,宗绪岩,徐勇,等.酿酒废水产微生物絮凝剂菌株的筛选及发酵条件优化[J].中国酿造,2017,36(9):92-97.
[18]赵东,牛广杰,彭志云,等.TA.XTplus 物性测试仪对黄水分析初探[J].酿酒,2013,40(3):28-30.
[19]梁艳玲,伍彦华,苏芬芬,等.大曲酒副产物黄水的综合利用[J].轻工科技,2016(10):1-2,20.
[20]袁春红,宋菲菲,林凯,等.白酒发酵副产物黄水中两株产纤维素酶芽孢杆菌的分离鉴定[J].中国酿造,2014,33(11):90-93.
[21]潘玲玲,王媚,罗明有,等.浓香型白酒黄水、窑泥中微生物总DNA提取方法比较[J].中国酿造,2016,35(4):42-46.
[22]ZHONG C,XU A,CHEN L,et al.Production of a bioflocculant from chromotropic acid waste water and its application in steroid estrogen[J].Colloid Surface B,2014,8(6):729-737.
[23]蒋彪,王常高,杜馨,等.响应面法优化芽孢杆菌CJPE209 产角蛋白酶发酵培养基的研究[J].中国酿造,2017,36(5):76-80.
[24]OH H M,LEE S J,PARK M H,et al.Harvesting of Chlorella vulgar is using a bioflocculant from Paenibacillus sp.AM49[J]. Biotechnol Lett,2001,23(15):1229-1234.
[25]SALEHIZADEH H,SHOJAOSADATI S A.Extracellular biopolymeric flocculants:Recent trends and biotechnological importance[J]. Biotechnol Adv,2003,19(5):371-385.