酯类物质是我国白酒及食醋等发酵类产品中重要的风味物质,如清香型白酒中的乙酸乙酯和乳酸乙酯[1],浓香型白酒中的己酸乙酯[2]等,这些物质的含量及在风味物质中所占比例影响着白酒的风格[3]。而酯类物质在发酵食品中的重要来源之一是由有机酸和醇类物质在酯化酶的催化作用下合成的[4]。为此,酯化酶的有无、酶活力的大小及对不同底物种类的催化能力,影响着发酵产物中的酯类物质的种类、含量[5-6]。获得高产酯化酶的菌株并应用于传统白酒、食醋酿造食品中,对于提升该类产品的品质具有重要意义[7-8]。张磊等[9]研究发现,红曲霉可以产生酯化酶,可应用于白酒生产用大曲、窖泥、糟醅中,以提升白酒的酯类含量,改善白酒风味、缩短发酵周期、提升酒质。此外,有研究报道红曲霉不仅可产生酯化酶[10],还可以产生多种胞外酶,如蛋白酶[11]、糖化酶、液化酶[12],且具有耐高温[13]、耐酸、耐酒精[14]等特性,具有应用前景。本课题组前期以山西酒醅为研究对象,分离筛选获得了一株高产酯化酶且具有上述生物学特征的菌株Hm。本试验在此基础上以红曲霉Hm为研究对象,小米为固态发酵基质,酯化力为测定指标,通过单因素试验、Plackett-Burman试验筛选显著因子,运用响应面Box-Benhnken试验设计建立数学模型,优化工艺条件,为该菌株在白酒、食醋及其他传统酿造类产品中的应用奠定了理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
红曲霉(Monascus purpureus)Hm:分离自山西某清香型白酒厂新鲜酒醅中。小米:市售。
1.1.2 试剂
己酸、硫酸(分析纯):成都科龙化工试剂厂;无水乙醇(分析纯):天津市化学试剂三厂;氢氧化钠(分析纯):天津市大陆化学试剂厂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:1%酵母膏,2%蛋白胨,2%葡萄糖,2%琼脂。
麦芽汁琼脂培养基:10%发酵专用麦芽浸粉,2%琼脂。
小米固态发酵培养基:将蒸熟的小米45 g装入250 mL的锥形瓶中,121 ℃、0.1 MPa灭菌20 min。
1.2 仪器与设备
pHSJ-4A pH计:美国奥立龙公司;85-2A磁力搅拌器:精凿科技(上海)有限公司;DL-1万用电炉:北京市永光明医疗仪器有限公司;BS2010S电子天平:北京赛多利斯天平有限公司。
1.3 方法
1.3.1 分析检测
酯化力、糖化力及液化力采用QB/T 5188—2017《酿造红曲》规定的方法测定[15]。
酯化力单位定义为1 g样品在35 ℃,经过7 d催化己酸和乙醇合成己酸乙酯的毫克数(U/g)。
糖化力单位定义为1 g样品于35 ℃、pH4.6条件下,1 h分解可溶性淀粉产生1 mg葡萄糖(U/g)。
液化力单位定义为1 g样品在35 ℃、pH4.6条件下,1 h能液化淀粉的克数(U/g)。
1.3.2 孢子菌悬液的制备
将红曲霉Hm接种于麦芽汁培养基上,30 ℃培养7 d后,加入无菌水,使用移液枪反复吸打,将得到的孢子悬液置于无菌有玻璃珠的250 mL锥形瓶中,使用涡旋搅拌器至孢子充分打散,利用血球计数板将孢子悬液稀释至1×107个孢子/mL[16]。
1.3.3 单因素试验
以酯化力为评价指标,研究接种量、发酵温度、发酵时间、初始pH、水分含量对红曲霉Hm产酯化酶能力的影响。
将红曲霉Hm孢子悬液,分别以不同接种量(6%、8%、10%、12%、14%)接入不同初始pH值(4、5、6、7、8)、水分含量(55%、60%、65%、70%、75%)的小米固态发酵培养基中,分别在不同发酵温度(24 ℃、27 ℃、30 ℃、33 ℃、36 ℃)条件下培养不同时间(3 d、5 d、7 d、9 d、11 d),测定其酯化力,研究接种量对红曲霉Hm产酯化酶能力的影响。
1.3.4 Plackett-Burman(PB)法筛选试验
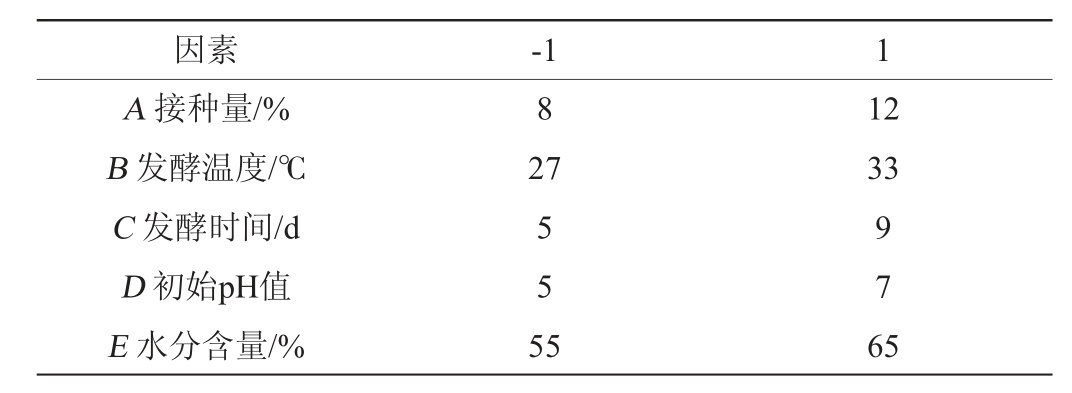
在单因素试验的基础上,对影响红曲霉Hm产酯化酶能力的5个因子(接种量、发酵温度、发酵时间、初始pH值、水分含量)进行PB试验筛选因子,试验设计见表1。
表1 Plackett-Burman试验因素与水平
Table 1 Factors and levels of Plackett-Burman tests
1.3.5 运用响应面法优化红曲霉高产酯化酶发酵工艺条件
根据PB试验筛选的显著因子的影响顺序,确定发酵温度(A)、发酵时间(B)、水分含量(C)为主要的3个影响因子,以这3个影响因子为变量,酯化力(Y)为响应值,设计3因素3水平的响应面试验(见表2),确定红曲霉高产酯化酶发酵最优工艺条件。
表2 响应面试验因素与水平
Table 2 Factors and levels of response surface tests

2 结果与分析
2.1 单因素试验
2.1.1 接种量对红曲霉Hm产酯化酶能力的影响

图1 接种量对酯化力的影响
Fig.1 Effect of inoculum on esterification power
由图1可知,随着接种量的增加,酯化力呈现先上升后下降的趋势。当接种量为10%时,酯化力最高可达到(14.61±0.10)U/g;造成以上现象的原因,可能是由于当接种量为6%~8%时,红曲霉Hm菌体数量较少,代谢缓慢,产生的酯化酶含量低,使得酯化力较低;当接种量为12%~14%时,大量的孢子萌发,快速消耗了培养基的营养物质,产生大量的代谢产物,降低了红曲霉Hm产酯化酶的能力[17]。因此,选择适宜的接种量为10%。
2.1.2 发酵温度对红曲霉Hm产酯化酶能力的影响

图2 发酵温度对酯化力的影响
Fig.2 Effect of fermentation temperature on esterification power
由图2可知,随着发酵温度的升高,酯化力呈现快速上升后缓慢降低的趋势。在30 ℃时,酯化力最高可达到(14.65±0.07)U/g。以上结果表明,随着温度的升高,红曲霉Hm产酯化酶能力逐渐升高;当温度高于30 ℃时,较高的温度会使红曲霉Hm产酯化酶能力降低[18]。因此,选择适宜的发酵温度为30 ℃。
2.1.3 发酵时间对红曲霉Hm产酯化酶能力的影响

图3 发酵时间对酯化力的影响
Fig.3 Effect of fermentation time on esterification power
由图3可知,发酵初期,酯化力快速上升;发酵7 d时,酯化力最高可达到(14.53±0.07)U/g;7 d后,酯化力呈现大幅度降低的趋势。以上结果表明,随着发酵时间的延长,红曲霉Hm产酯化酶的能力逐渐升高,发酵7 d后,产酯化酶能力降低,推测造成以上现象的原因是,发酵前期红曲霉Hm处于对数生长期,生长代谢旺盛,产生酯化酶的能力强;当发酵7 d后,生产代谢变缓,产生酯化酶能力降低,产生的酯化酶由于受发酵体系中代谢产物和次级代谢产物的影响,活力受到影响,使得酯化力大幅度降低[19]。因此,选择发酵时间为7 d。
2.1.4 初始pH对红曲霉Hm产酯化酶能力的影响
由图4可知,随着初始pH的升高,酯化力呈现快速上升后大幅度降低的趋势。酸性条件下,随着pH的逐渐升高,红曲霉Hm产酯化酶的能力逐渐提高。在初始pH为6时,酯化力最高可达到(14.75±0.08)U/g。以上结果表明,红曲霉Hm在偏酸性的条件下酯化酶的能力较强。因此,选择产酶培养基初始pH值为6。
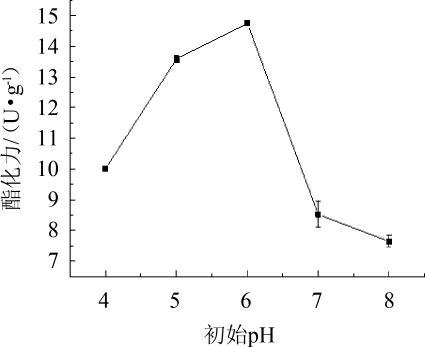
图4 初始pH对酯化力的影响
Fig.4 Effect of initial pH on esterification power
2.1.5 水分含量对红曲霉Hm产酯化酶能力的影响
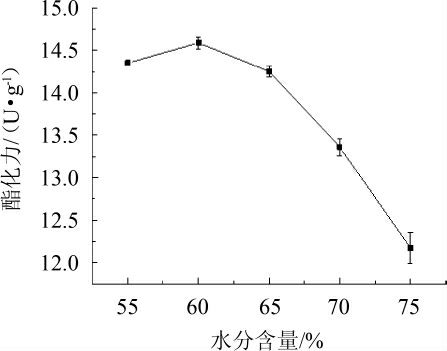
图5 水分含量对酯化力的影响
Fig.5 Effect of water content on esterification power
由图5可知,随着水分含量的逐渐升高,红曲霉Hm酶制剂的的酯化力逐渐下降,当水分含量达到60%时,酯化力最高达到(14.59±0.07)U/g。当高于60%时,酯化力逐渐降低。以上结果表明,水分含量对于Hm产酯化酶的能力影响较大,造成以上现象的原因,可能是因为当水分含量低于60%时,小米固态培养基水分不足,造成红曲霉Hm生长缓慢[20];当水分含量达到60%时,小米固态培养基小米颗粒饱满,水分充足,红曲霉Hm生长良好;当水分含量达到65%~75%时,小米固态培养基出现结块现象,不利于红曲霉的有氧呼吸,影响该菌株产生酯化酶的能力。因此,选择培养基含水量为60%。
2.2 Plackett-Burman(PB)法筛选试验
在单因素的基础上,利用PB试验对接种量、发酵温度、发酵时间、初始pH、水分含量5个因素进行显著因子的筛选,分组为12组。PB试验设计见表3。
根据试验设计结果得到方程:Y=11.850 0+2.083 3A+0.056 7B-0.163 3C-0.303 3D-0.016 7E。再经过Minitab17软件进行方差分析得知,R=99.85%,在研究的整体回归区域内,该模型的拟合性较好,试验结果准确。
表3 Plackett-Burman试验设计及结果
Table 3 Design and results of Plackett-Burman tests

表4 Plackett-Burman试验方差分析
Table 4 Variance analysis of Plackett-Burman tests
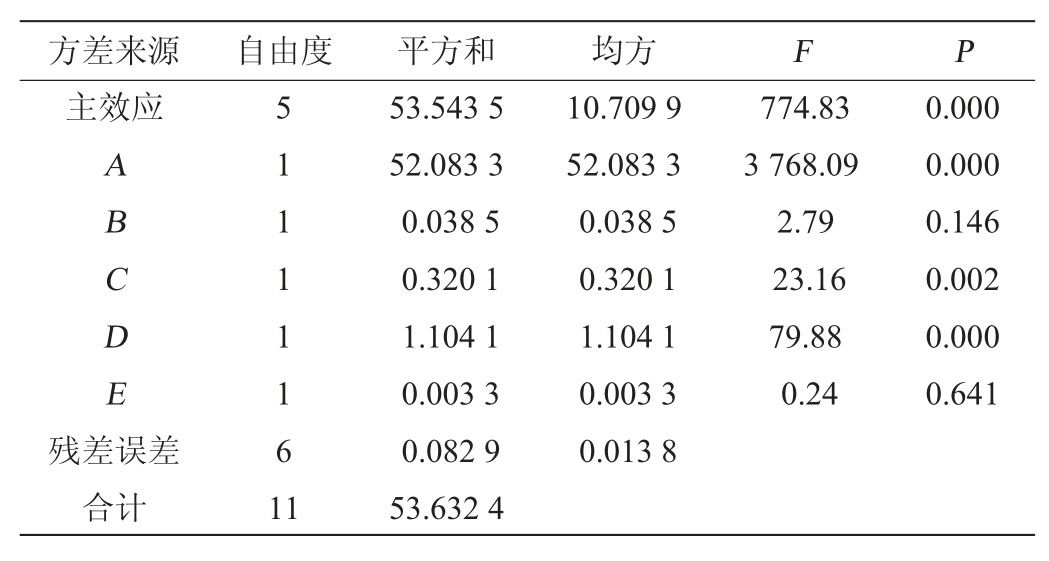
由表4可知,P(A/发酵时间)=0.000,P(C/发酵温度)=0.002,P(D/水分含量)=0.000,其P值均小于0.05。即选择显著因素发酵时间、发酵温度、水分含量进行下一步的响应面优化试验设计。
2.3 响应面法工艺优化结果
2.3.1 响应面法工艺优化结果及方差分析
响应面软件分析得知,发酵时间(A)、发酵温度(B)、水分含量(C)对酯化力的影响回归拟合后得到二次多项回归模型,Y=14.70+0.82A+0.10B-0.52C+0.81AB+0.63AC+1.45BC-3.16A2-2.58B2-4.98C2,模型回归系数R2=99.71%,调整后R2=99.35%,由此可知,此项回归拟合度较好,引起响应值酯化力变化的原因有99.71%的可能性是因为发酵时间、发酵温度、水分含量3个因素的变化,由表6可知,整体模型P<0.01,代表极显著,表明该二次方程模型达到极显著,失拟项P=0.051 5>0.05,表明方程失拟不显著。说明该方程对试验拟合性较好,模型能够真实的试验数据。
由表6可知,发酵时间二次项、发酵温度二次项、水分含量二次项、交互项BC对酯化力的影响均达到极显著水平(P<0.01),这4种均对酯化力为负效应,表明发酵时间、发酵温度、水分含量是最终测定酯化力的3个关键控制点因素;发酵时间一次项、水分含量一次项、交互项AB、交互项AC对酯化力的影响均达到显著水平(P<0.05),发酵时间A、AB、AC对酯化力均为正效应,水分含量C对酯化力为负效应。
表5 响应面试验设计与结果
Table 5 Design and results of response surface tests
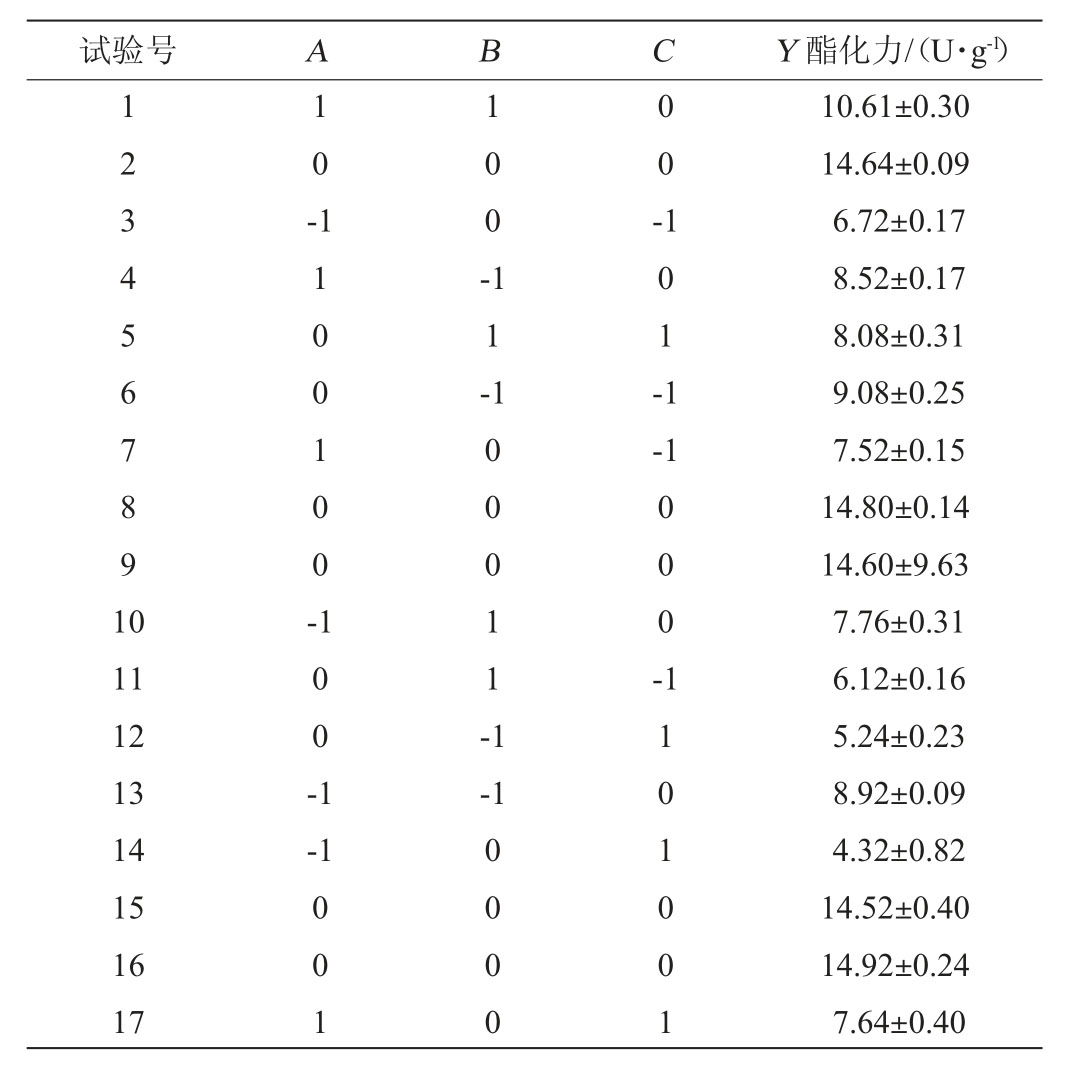
表6 响应面试验结果方差分析
Table 6 Results and variance analysis of response surface tests
注:“*”表示对结果影响显著差异(P<0.05);“**”表示对结果影响极显著差异(P<0.01)。
根据响应面软件分析可得出发酵最佳工艺条件为发酵时间为7 d,发酵温度为30 ℃,水分含量为60%,在此条件下酯化力预测值为14.76 U/g。
2.3.2 响应面结果及其等高线分析
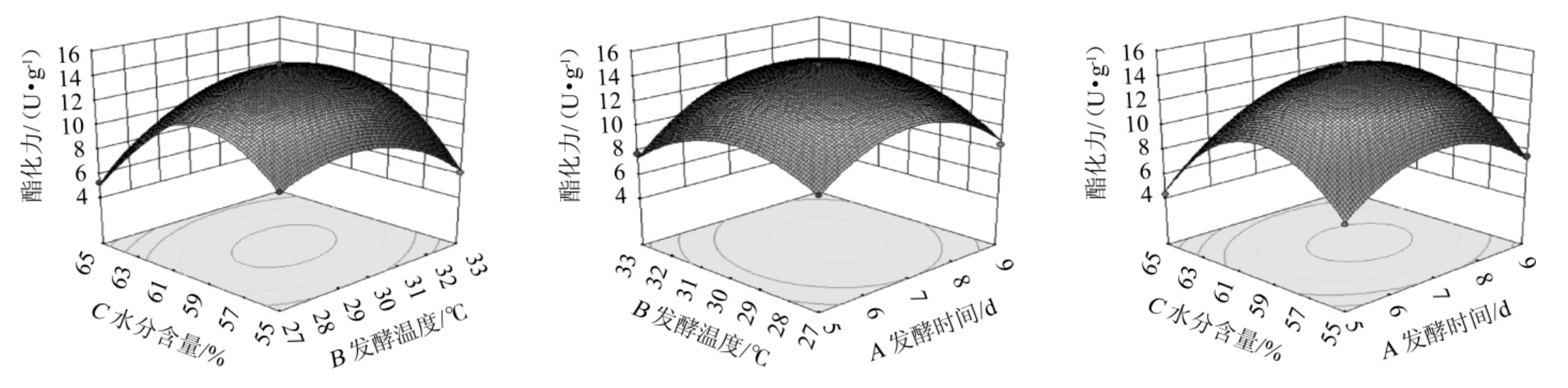
图6 发酵温度、发酵时间和水分含量交互作用对酯化力影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between fermentation temperature,time and water content on esterification power
由图6可知,AB、AC、BC都有明显的交互作用,特别是BC交互作用较显著,响应面曲线走势较陡,有明显的最高点和最优水平。
2.4 响应面验证试验
根据响应面软件分析可得出最佳工艺条件为发酵时间为7 d,发酵温度为30 ℃,水分含量为60%,以此为条件做3个平行试验得到酯化力实际值为(14.75±0.08)U/g,与预测值14.76 U/g相比基本保持一致,即响应面试验具有现实可靠的意义。
2.5 红曲霉Hm的酶活力
将红曲霉Hm以10%的接种量接种到水分含量为60%,pH6的小米固态发酵基质中,30 ℃发酵7 d。由表7可知,红曲霉Hm的酯化酶活力为(14.75±0.08)U/g,高于清香型白酒生产用大曲的酯化酶活力,表明红曲霉Hm可以高产酯化酶强化发酵应用于白酒的生产。
表7 清香型白酒生产用大曲与红曲霉Hm酶活力的比较
Table 7 Comparison of enzyme activities between Daqu for the production of Fen-flavor Baijiu and Monascus Hm

3 结论
本试验以红曲霉Hm为研究对象,酯化力为测定指标,通过单因素试验、Plackett-Burman试验、Box-Benhnken试验优化红曲霉高产酯化酶发酵工艺。最佳工艺条件为发酵时间7 d、发酵温度30 ℃、接种量10%、初始pH值为6、水分含量60%。以此条件生产红曲霉Hm的酯化力为(14.75±0.08)U/g,糖化力为(480±42.43)U/g,液化力为(22.4±0.62)U/g。该红曲霉Hm产酯化酶活力较高,且具有糖化和液化酶活力,可应用于白酒、食醋及其他传统性酿造产品的生产中。
[1]刘新宇.红曲霉的分离纯化及在清香型白酒中的应用[D].临汾:山西师范大学,2014.
[2]李付丽,吴鑫颖,王晓丹,等.微生物技术在浓香型白酒增香方面的应用[J].中国酿造,2014,33(1):9-13.
[3]孙宝国,吴继红,黄明泉,等.白酒风味化学研究进展[J].中国食品学报,2015,15(9):7-14.
[4]刘延波,邢星月,赵志军,等.高产脂肪酶菌株的筛选鉴定及产酶条件优化[J].中国酿造,2019,38(7):54-59.
[5]曾婷婷,张志刚.白酒酿造中酯化酶的研究现状[J].酿酒,2010,37(6):12-14.
[6]潘名志.红曲霉产酯化酶特性及其酶学性质的研究[D].贵阳:贵州大学,2009.
[7]刘欢欢,杨帆,李贞景,等.高产酯化酶红曲菌的筛选、鉴定及酶学性质研究[J].中国酿造,2019,38(5):49-53.
[8]张瑞瑞,徐子一,孙厚权,等.新型酯化酶在传统白酒酿造行业中的应用[J].酿酒,2018,45(6):20-23.
[9]张磊,张华玲,刘绪,等.红曲霉产酯化酶条件的研究[J].酿酒科技,2013(9):68-70.
[10]CHEN M B,LIU H,ZHEN D,et al.Research on the esterification property of esterase produced by Monascus sp.[J].Afr J Biotechnol,2011,10(18):5166-5172.
[11]吴宏,代文婷,连喜军,等.不同液态发酵基质对红曲霉产红曲色素及桔霉素的影响[J].中国酿造,2018,37(11):91-94.
[12]王艳,吴鑫颖,等.紫色红曲霉FBKL3.0018 液态发酵产酯化酶的工艺优化[J].食品工业科技,2018(15):147-153.
[13]陈景智,林娟,叶秀云,等.紫色红曲霉液态发酵产糖化酶的工艺研究[J].食品工业科技,2017(12):146-155.
[14]付海平.产Monacolin K 红曲霉的筛选及其发酵条件的研究[D].长沙:湖南农业大学,2004.
[15]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社,2011.
[16]陈功.红曲霉高密度萃取发酵色素代谢与跨膜运输行为[D].广州:华南理工大学,2017.
[17]胡娜,吴鑫颖,李付丽,等.紫色红曲霉FBKL3.0018 固态发酵产酯化酶的研究[J].食品科技,2017,42(7):20-25.
[18]张秀媛,何扩,石后,等.响应面法优化小米红曲制备工艺及其抗肿瘤活性研究[J].中国粮油学报,2015,30(3):19-22.
[19]邢爽.白酒发酵过程中酯类物质形成机理的研究[D].天津:天津科技大学,2018.
[20]胡娜,吴鑫颖,李付丽,等.紫色红曲霉FBKL3.0018 产酯化酶的酶学性质研究[J].中国酿造,2017,36(5):123-127.