红曲霉菌(Monascus spp.)又称红曲菌,是一种重要的食用微生物,能产生红曲色素、莫纳可林K、γ-氨基丁酸等大量有益的次级代谢产物,近年来受到越来越多国内外学者的普遍关注[1]。然而,红曲霉菌也会产生次级代谢产物桔霉素(citrinin),又名桔青霉素,是一种真菌毒素,具有一定的抑菌活性和细胞毒性[2],对动物的肾脏、肝脏、心脏、胃肠道等器官具有很强的毒性[3]。因此,红曲产品的安全性受到普遍关注,欧洲及美国、日本等国家都对红曲霉菌发酵产品桔霉素的限量标准进行了严格规定。桔霉素的存在降低了红曲霉菌及其发酵产品的安全性,限制了红曲霉菌及其发酵产品的应用。因此,研究桔霉素的代谢及调控机制,降低红曲米等红曲发酵产品的桔霉素含量具有重要的意义。
作为一种聚酮类次级代谢产物,桔霉素以乙酰辅酶A和丙二酰辅酶A为原料,在聚酮合酶(polyketide synthase,PKS)及一系列氧化还原酶的作用下生成[4]。产桔霉素的红曲霉菌主要包括紫色红曲霉(Monascus purpureus)、安卡红曲霉(Monascus ruber)、丛毛红曲霉(Monascus pilosus),尤其是紫色红曲和安卡红曲,他们都具有桔霉素合成基因簇[5]。桔霉素合成相关基因成簇排列,共44 kbp,16个基因[6]。其中,ctnA基因是转录因子[7],对桔霉素的产量具有非常重要的正调控作用;orf7基因对桔霉素合成具有负调控作用[8],pksCT作为聚酮合酶基因,对桔霉素合成有关键作用。此外,LaeA、VeA等全局性转录因子在真菌的信号转导中具有重要作用[9],对真菌的初级代谢、次级代谢、生长和发育都具有调控作用,LaeA是甲基转移酶基因,VeA是真菌特有的Velvet蛋白家族,含有Velvet结构域,LaeA和VeA可以调控真菌的多个下游转录因子。PKA信号通路是真菌非常重要的信号通路,传递外界信号,调节真菌的生长发育和代谢等各种生理功能[10]。
红曲霉菌桔霉素的代谢受光照、pH值、温度、溶氧、培养基成分等条件的影响[11-15],但影响机制还有待于进一步研究。本研究以产桔霉素紫色红曲霉(M.purpureus)M9为研究对象,利用高效液相色谱(high performance liquid chromatography,HPLC)法测定其在红光、蓝光、黑暗条件下的桔霉素产量,并利用实时荧光定量聚合酶链式反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)对桔霉素相关合成基因簇(ctnA、pksCT、orf7基因)、全局性转录因子(LaeA、VeA基因)及pka基因的表达量进行测定,研究光照对红曲霉桔霉素代谢机制的影响。有助于阐明桔霉素代谢调控机制,为低桔霉素红曲霉发酵及相关产品的开发提供研究思路和技术指导。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
紫色红曲霉(M.purpureus)M9:天津科技大学食品工程与生物技术学院保藏。
1.1.2 试剂
乙腈、甲醇(均为色谱纯):德国Merko公司;无水乙醇、磷酸(均为色谱纯):天津市百世化工有限公司;桔霉素标准品(纯度99%):美国Sigma公司;E.Z.N.A.TM Fungal核糖核酸(ribonucleic acid,RNA)Kit:美国OMEGA公司;反转录试剂盒HiFiScript cDNA Synthesis kit:江苏康为世纪生物科技有限公司;荧光定量试剂盒TB Green Premix Ex TaqⅡ:宝生物工程(大连)有限公司。
1.1.3 培养基
保藏培养基[16]:麦芽汁(糖度10°Bx),琼脂粉20 g/L。
种子培养基[17]:葡萄糖60 g/L,蛋白胨20 g/L,KH2PO410 g/L,NaNO310 g/L,MgSO4·7H2O 5 g/L。
YES培养基:蔗糖160 g/L,酵母浸粉40 g/L。
以上培养基的灭菌条件均为121 ℃灭菌20 min。
1.2 仪器与设备
MX3000P实时荧光定量PCR仪、1260高效液相色谱仪(带有G1321A荧光检测器):美国安捷伦科技公司;S1000梯度PCR仪:美国伯乐公司;Allegra 25R台式高速冷冻离心机:美国贝克曼库尔特有限公司;SW-CJ-1FD超净工作台:上海博迅实业有限公司医疗设备厂;HYG-Ⅱ回转式恒温调速摇床:上海欣蕊自动化设备有限公司;DGG-101-2B电热鼓风干燥箱:天津市天宇实验仪器有限公司。
1.3 方法
1.3.1 菌株的培养
活化:将红曲霉M9接种于斜面保藏培养基,30 ℃条件下培养5~7 d。
种子液制备:活化的红曲霉M9中加入1 mL无菌水,将孢子刮下,制成孢子悬液,将孢子悬液接种于种子培养基中,30 ℃、180 r/min条件下培养30 h,得种子液。
培养:将M9种子液制成孢子悬浮液(2×106个/mL),按照10%(V/V)的接种量接种于YES培养基中,分别在光照强度为150 lux的蓝光(400 nm)和红光(700 nm)及黑暗条件下30 ℃培养,分别在培养3 d、5 d、7 d、9 d及11 d取样,测定生物量、桔霉素,并进行基因表达定量分析。
1.3.2 生物量的测定
在培养3d、5d、7d、9d及11d时取样,发酵液经5000r/min离心25 min,收集菌丝体沉淀,用蒸馏水冲洗后离心,弃去上清液,重复3次;收集的菌丝体于60 ℃干燥箱中干燥至恒质量,准确称量。
1.3.3 桔霉素的检测
取0.5 mL发酵液,加入9.5 mL体积分数为75%的乙醇,60 ℃保温1 h,6 000 r/min 离心10 min,取上清,用0.45 μm滤膜过滤。采用HPLC法测定桔霉素含量[15]。
HPLC条件:色谱柱为Agilent TC-C18(4.6 mm×250 mm,5 μm);流动相为水∶乙腈∶甲醇=30∶50∶20(V/V),pH 2.6;柱温为30 ℃;流速为1 mL/min;荧光检测器;进样量为20 μL。
1.3.4 基因表达量分析
ctnA、pksCT及orf7基因的引物序列参考文献[18]。参考M.purpureus YY-1基因组序列,利用primer5.0软件设计LaeA、VeA、pka、β-actin基因的引物[19],β-actin作为内参基因,引物序列见表1。
表1 LaeA、VeA、pka及β-actin基因的引物序列
Table 1 Sequences of primers of LaeA、VeA、pka and β-actin genes

利用E.Z.N.A.TM Fungal RNA Kit提取总RNA,以其为模板,利用HiFiScriptcDNASynthesiskit进行反转录获得cDNA。以cDNA为模板,β-actin基因为内参,利用TB Green Premix Ex TaqⅡ试剂盒进行基因表达荧光定量分析。PCR扩增程序:95 ℃、30 s;95 ℃、5 s,60 ℃、30 s,72 ℃、15 s,40个循环。熔解曲线:95 ℃、15 s,60 ℃、30 s,95 ℃、15 s。
1.3.5 数据处理
所有实验均重复3次,使用SPSS 10.0软件进行单因素方差分析。
2 结果与分析
2.1 不同光照条件下菌体生物量及桔霉素产量
蓝光、红光、黑暗条件下,紫色红曲霉M9的菌体生物量和桔霉素产量见图1。
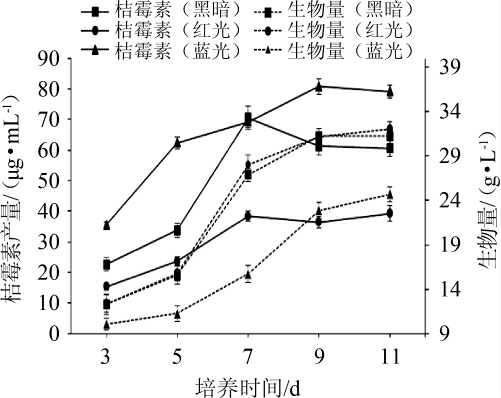
图1 不同光照条件下紫色红曲霉M9的生物量和桔霉素产量
Fig.1 Biomass and citrinin yield of Monascus purpureus M9 under different light conditions
由图1可知,蓝光条件下,紫色红曲霉M9的生长速度最慢,生物量最低,桔霉素产量最高。与黑暗条件相比,培养11 d,蓝光条件下菌体生物量降低15.85%,桔霉素产量升高30.40%;红光条件下菌体生物量无显著差异(P>0.05),桔霉素产量降低35.26%。结果表明,蓝光有利于紫色红曲霉M9产桔霉素,而红光能抑制其产桔霉素。
2.2 不同光照条件下桔霉素合成相关基因相对表达量
蓝光、红光、黑暗条件下,紫色红曲霉M9中桔霉素合成相关基因的相对表达量见图2。
由图2可知,与黑暗条件相比,红光抑制ctnA、pksCT基因的表达,促进orf7基因的表达,在培养5 d时抑制(促进)作用最强,相对表达量分别为黑暗条件下的25.90%、30.77%、292.93%。蓝光促进ctnA、pksCT基因的表达、抑制orf7基因的表达,在培养3 d时促进(抑制)作用最强,相对表达量分别为黑暗条件下的151%、167%、34%。ctnA是桔霉素基因簇的转录因子,对pksCT、orf4等多个基因具有激活作用,正调控桔霉素的合成代谢[20]。orf7是桔霉素的合成抑制因子,有研究表明,敲除orf7基因可以提高桔霉素产量142.4%[8]。结果表明,光照影响基因簇内部的激活转录因子ctnA、抑制因子orf7及合成关键基因pksCT的转录水平。

图2 不同光照对紫色红曲霉M9中ctnA(a)、pksCT(b)及orf7(c)基因相对表达量的影响
Fig.2 Effect of different light on relative expression quantity of ctnA (a), pksCT (b) and orf7 (c) genes in Monascus purpureus M9
2.3 不同光照条件下全局转录因子的相对表达量
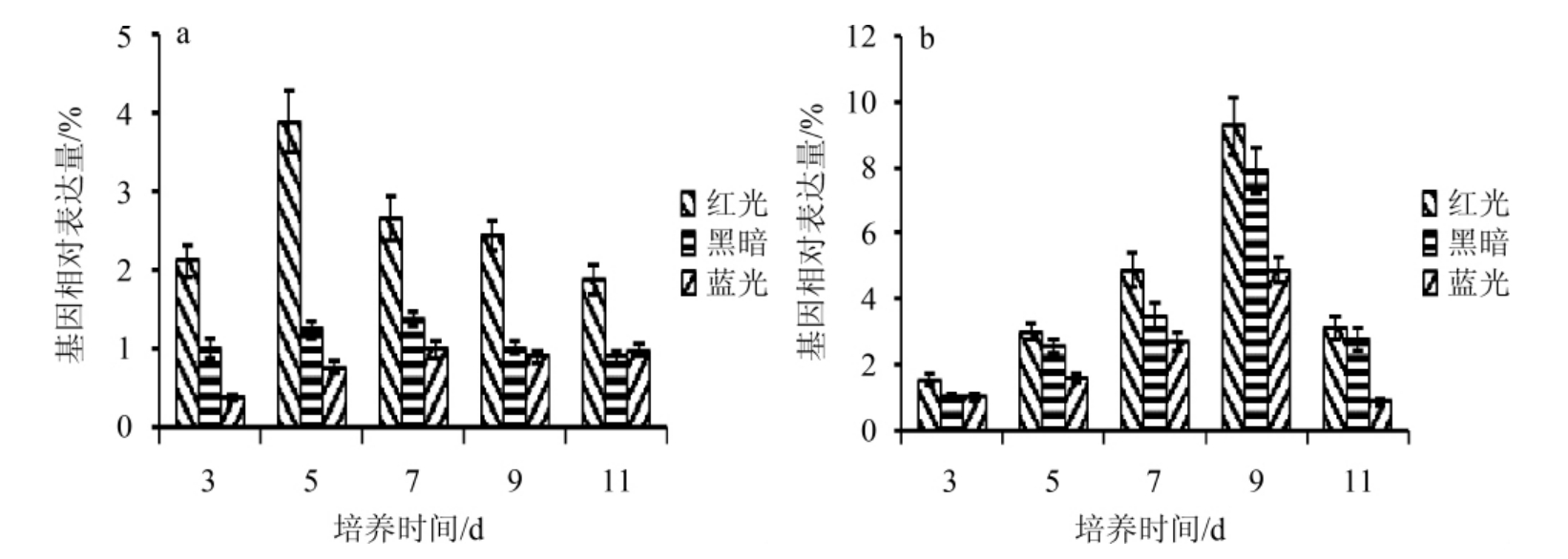
图3 不同光照对紫色红曲霉M9中LaeA(a)及VeA(b)基因相对表达量的影响
Fig.3 Effect of different light on relative expression quantity of LaeA (a) and VeA (b) genes in Monascus purpureus M9
蓝光、红光、黑暗条件下,紫色红曲霉M9中LaeA和VeA基因相对表达量见图3。由图3可知,与黑暗条件比较,红光能促进全局性转录因子LaeA、VeA基因的表达,蓝光能抑制LaeA、VeA基因的表达。结果发现,LaeA和VeA基因相对表达量降低,桔霉素产量升高,LaeA和VeA基因相对表达量升高而桔霉素产量降低,说明光照通过调控红曲全局性转录因子的表达,调控桔霉素的合成代谢。
2.4 不同光照条件下pka基因相对表达量
蓝光、红光、黑暗条件下,紫色红曲霉M9中pka基因相对表达量见图4。

图4 不同光照下紫色红曲霉M9中pka基因的相对表达量的影响
Fig.4 Effects of different light on relative expression quantity of pka in Monascus purpureus M9
光照、温度、溶氧等外界信号需要通过信号通路传递,才能实现对目的基因的调控作用。由图4可知,与黑暗条件比较,红光促进了pka基因的表达,蓝光抑制了pka基因的表达。并且pka基因相对表达量升高,桔霉素产量降低;pka基因相对表达量降低,桔霉素产量升高。结果表明,PKA信号通路能够响应红光、蓝光等不同的光照条件对不同光信号产生不同的反应,并将信号进一步传递,直到引起桔霉素代谢的变化,并且与桔霉素产量负相关。
3 结论
研究光照对红曲霉桔霉素代谢机制的影响。结果发现,与黑暗条件相比,蓝光条件下菌体生物量降低15.85%,桔霉素产量升高30.40%;红光条件下生物量无显著差异(P>0.05),桔霉素产量降低35.26%。蓝光促进ctnA和pksCT基因的表达、抑制orf7、LaeA、VeA和pka基因的表达,红光抑制ctnA和pksCT基因的表达、促进orf7、LaeA、VeA和pka基因的表达。结果表明,光照通过调控LaeA、VeA和pka基因的表达量进行信号传递,调控桔霉素基因簇重要的调控因子ctnA和orf7,改变桔霉素合成基因pksCT表达量,进而实现对桔霉素产量的调控作用。
[1]FENG Y,SHAO Y,CHEN F.Monascus pigments[J].Appl Microbiol Biot,2012,96(6):1421-1440.
[2]FILHO J W G D O,ISLAM M T,ALI E S,et al.A comprehensive review on biological properties of citrinin[J].Food Chem Toxicol,2017,110:130-141.
[3]POÓR M,LEMLI B,BÁLINT M,et al.Interaction of citrinin with humanserum albumin[J].Toxins,2015,7(12):5155-5166.
[4]HE Y,COX R J.The molecular steps of citrinin biosynthesis in fungi[J].Chem Sci,2016,7(3):2119-2127.
[5]FENG Y L,CHEN W P,CHEN F S.A Monascus pilosus MS-1 strain with high-yield monacolin K but no citrinin[J]. Food Sci Biot,2016,25(4):1115-1122.
[6]LI Y P,XU Y,HUANG Z B.Isolation and characterization of the citrinin biosynthetic gene cluster from Monascus aurantiacus[J]. Biotechnol Lett,2012,34(1):131-136.
[7]LIANG B,DU X J,LI P,et al. Orf6 gene encoded glyoxalase involved in mycotoxin citrinin biosynthesis in Monascus purpureus YY-1[J].Appl Microbiol Biot,2017,101(19):7281-7292.
[8]邹乐花,李燕萍,黄志兵,等.橙色红曲菌As 3.4384 orf 基因缺失菌株的构建及其功能分析[J].中国生物工程杂志,2011,31(7):79-84.
[9]LIU Q P,CAI L,SHAO Y C,et al.Inactivation of the global regulator LaeA in Monascus ruber results in a species-dependent response in sporulation and secondary metabolism[J].Fungal Biol,2016,120(3):297-305.
[10]HUANG G,HUANG Q,WEI Y,et al.Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans[J].Mol Microb,2019,111(1):6-16.
[11]WANG L L,DAI Y,CHEN W P,et al.Effects of light intensity and color on the biomass,extracellular red pigment,and citrinin production of Monascus ruber[J].J Agr Food Chem,2016,64(50):9506-9514.
[12]HUANG Z,ZHANG L,WANG Y,et al.Effects of rutin and its derivatives on citrinin production by Monascus aurantiacus Li AS3.4384 in liquid fermentation using different types of media[J]. Food Chem,2019,284:205-212.
[13]ZHEN Z X,XIONG X Q,LIU Y B,et al.NaCl inhibits citrinin and stimulates Monascus pigments and monacolin K production[J].Toxins,2019,11(2):118.
[14]XIONG X,ZHANG X H,WU Z Q,et al.Optimal selection of agricultural products to inhibit citrinin production during submerged culture of Monascus anka[J].Biotechnol Bioproc Eng,2015,19(6):1005-1013.
[15]陈勉华,吉达维,马人杰,等.不同发酵基质对红曲重要代谢产物的影响[J].中国酿造,2013,32(3):22-24.
[16]HE Y,LIU Q,SHAO Y,CHEN F.ku70 and ku80 null mutants improve the gene targeting frequency in Monascus ruber M7[J]. Appl Microbiol Biot,2013,97:4965-4976.
[17]CHEN D,XUE C M,CHEN M H,et al.Effects of blue light on pigment biosynthesis of Monascus[J].J Microbiol,2016,54(4):305-310.
[18]马博雅,张佳,王雪莲,等.缺氧对红曲霉桔霉素相关基因表达量及产量的影响[J].中国酿造,2016,35(7):143-146.
[19]YANG Y,LIU B,DU X,et al.Complete genome sequence and transcriptomics analyses reveal pigment biosynthesis and regulatory mechanisms in an industrial strain,Monascus purpureus YY-1[J].Sci Rep,2015,5:8331.
[20]SHIMIZU T,KINOSHITA H,NIHIRA T.Identification and in vivo functional analysis by gene disruption of ctnA,an activator gene involved in citrinin biosynthesis in Monascus purpureus[J].Appl Environ Microbiol,2007,73(16):5097-5103.