食品加工过程中,食源性病菌容易污染食品致使其成品存在食用风险[1],寻找高效、低成本的抑制食源性病菌生长的方法对食品产业的发展与安全显得尤为重要。生物抑菌法因操作简单、抑制率高、安全性能好等优势而备受青睐[2-3]。以尼生素为代表的抑制物质因具有良好的抑菌特性而备受食品加工厂关注,但其在酸性环境才能起到良好的抑菌作用[4],因而发展其他细菌所产的抑菌物质是十分有必要[5]。
目前,关于芽孢杆菌产抑菌物质及其性能的研究较少,但其抑菌物质在抑菌活性和pH抗性等方面却能表现出多样性[6-7]。部分芽孢杆菌属在历史上被长期应用于食品和动物饲料的添加剂,并且具有良好的安全性[8]。传统的芽孢杆菌如枯草芽孢杆菌和地衣芽孢杆菌已经获得欧洲食品安全局(European Food Safety Authority,EFSA)的安全认证以及美国食品和药物管理局(food and drug administration,FDA)的安全认证[9-10]。芽孢杆菌属的抑菌物质具有良好的稳定性和广泛的抑菌谱,因此开发新的芽孢杆菌抑菌物质是有必要的[11-12],同时在开发新的芽孢杆菌细菌素也需要对其安全性进行严格的测评。
以芽孢杆菌ZYCHH-01为试验菌株,对其发酵过程的培养基pH值、接种量、发酵温度、发酵时间进行探讨,测定细菌浓度和抑菌物质抑菌圈,通过响应面法进行优化,建立模型分析最佳发酵条件,并对芽孢杆菌ZYCHH-01产抑菌物质的热稳定性、pH稳定性、耐储存性、酶的敏感性、有机溶剂和表面活性剂稳定性以及对不同细菌活性进行分析,为芽孢杆菌属产抑菌物质的大量制备提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
芽孢杆菌(Bacillus)ZYCHH-01、金黄色葡萄球菌(Staphylococcus aureus)(ATCC 29523)、鼠伤寒沙门氏菌(Salmonella typhimurium)(CMCC 20115)、单增李斯特菌(Listeria monocytogenes)(ATCC 19115),指示菌株大肠杆菌(Escherichia coli)(ATCC 25922):保存于海南大学热带岛屿资源先进材料教育部重点实验室。
1.1.2 试剂
氯化钠、甲醇、乙醇、乙腈、丙酮、异丙醇、Tween 20、Tween 80(均为分析纯):西陇化工股份有限公司;蛋白胨(生化试剂):北京双旋微生物培养基制品厂;葡萄糖、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、尿素(urea)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(均为分析纯):广州化学试剂厂;乳酸链球菌素、木瓜蛋白酶、蛋白酶K(30 U/mg)、碱性蛋白酶(200 U/mg)、中性蛋白酶(50 U/mg)、胰蛋白酶(10 000 U/mg)、α-淀粉酶(50 U/mg)、纤维素酶(50 U/mg)(均为生化试剂):上海麦克林生化科技有限公司。
1.1.3 培养基
种子培养基、指示菌活化培养基均为牛肉膏蛋白胨液体培养基,调pH7.0~7.2。
发酵培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,葡萄糖4 g,豆粕粉4 g,定容至1 000 mL。
固体培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,技术琼脂粉15 g,定容至1 000 mL,调pH7.0~7.2。
1.2 仪器与设备
DH8-D全温振荡器:苏州培英实验设备有限公司;SPX-200-Ⅱ生化培养箱:上海跃进医疗器械有限公司;H1850R台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;UV-3300PC型紫外可见分光光度计:上海美谱达仪器有限公司;seven compact pH计:梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 指示菌液的制备
接种1环大肠杆菌至50 mL种子培养基中,于37 ℃、190 r/min条件下培养24 h。
1.3.2 无菌上清液的制备
接种1%芽孢杆菌ZYCHH-01至发酵培养基中,37 ℃、190 r/min培养24 h,4 ℃、12 000 r/min离心30 min,取上清液,用0.22 μm滤膜过滤菌体,4 ℃条件下保存。
1.3.3 抑菌物质抑菌圈测定
取100 μL指示菌液涂布于固体培养基中,轻置内径为6 mm,外径8 mm的牛津杯于固体培养基表面,并加入100 μL无菌上清液,4 ℃静置4 h后,37 ℃静置培养24 h,测量并记录抑菌圈直径的大小。
1.3.4 细菌浓度的测定
将发酵好的芽孢杆菌ZYCHH-01发酵液,用紫外可见分光光度计于波长600 nm处测量其吸光度值。
1.3.5 单因素试验
分别接种(1%、2%、3%、4%、5%)种龄24 h芽孢杆菌ZYCHH-01至(pH值分别为5、6、7、8、9)的发酵培养基中,分别在(28 ℃、31 ℃、34 ℃、37 ℃、40 ℃)条件下、190 r/min分别培养(6 h、9 h、12 h、15 h、18 h、21 h、24 h、27 h、30 h、33 h、36 h),测定发酵液细菌浓度,取无菌上清液,测定抑菌圈大小。
1.3.6 Box-Behnken试验响应面优化
根据单因素优化结果,选取发酵温度(A)、培养基pH值(B)、发酵时间(C)3个影响较大的因素为试验因素,以抑菌圈直径(Y)为响应值,采用Design-Expert 8.0.6设计3因素3水平Box-Behnken响应面试验,试验因素及编码水平见表1。
表1 响应面试验因素与水平
Table 1 Factors and levels of response surface experiments

1.3.7 最小抑菌浓度的测定
以无菌上清液为试验组,10 000 IU/mL的乳酸链球菌素为阳性对照组,采用二倍稀释法将试验组和阳性对照组分别稀释为1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128,测定实验组和阳性对照组抑菌圈的大小。
1.3.8 抑菌物质活性稳定性测定
不同pH下的热稳定性:将不同pH的无菌上清液分别在20 ℃、40 ℃、60 ℃、80 ℃、100 ℃条件下处理30 min,待恢复至室温,分别测定抑菌圈的大小。
酶对抑菌物质稳定性的影响:在无菌上清液和无菌生理盐水中分别加入质量浓度均为1.0 mg/mL的木瓜蛋白酶(pH7)、蛋白酶K(pH7)、碱性蛋白酶(pH9)、中性蛋白酶(pH7)、胰蛋白酶(pH8)、α-淀粉酶(pH7)、纤维素酶(pH6),37 ℃温育3 h,以含有酶的生理盐水为对照组,测定抑菌圈大小。
有机溶剂和表面活性剂对于抑菌物质的影响:将体积分数10%的甲醇、乙醇、乙腈、丙酮、异丙醇以及0.1 g/L的Tween 20、Tween 80、EDTA、SDS、Urea分别加入无菌上清液中,室温温育5 h,以加入生理盐水的上清液和无菌上清液为对照组,测定抑菌圈大小。
储藏时间对抑菌物质活性的影响:将无菌上清液分装在12根离心管内,4 ℃分别储存0、2 d、4 d、6 d、8 d、10 d、12 d、14 d、16 d、18 d、20 d、22 d,测定抑菌圈的大小。
抑菌物质对不同细菌的活性:分别接种大肠杆菌(ATCC 25922)、金黄色葡萄球菌(ATCC 29523)、鼠伤寒沙门氏菌(CMCC 20115)、单增李斯特菌(ATCC 19115)至种子培养基,37 ℃、190 r/min培养24 h作为指示菌,测定无菌上清液对指示菌的抑菌圈大小。
2 结果与分析
2.1 培养条件优化
2.1.1 培养基pH对抑菌物质活性的影响

图1 培养基pH值对抑菌物质活性的影响
Fig.1 Effect of medium pH on antibacterial substances activity
由图1可知,当培养基pH值为5时细菌浓度和抑菌物质活性较低,随着pH值升高细菌浓度和抑菌物质活性提高显著。pH值为8时,抑菌圈直径最大,直径为20.62 mm,细菌浓度和抑菌物质活性达到峰值。pH值为9时,细菌浓度和抑菌物质活性下降明显。可能由于过酸或者过碱环境都会影响细菌的增殖代谢,导致抑菌物质活性较低,或因不同pH值条件下细菌对抑菌物质的吸附不同,从而影响抑菌物质的活性[13]。因此,培养基最佳发酵pH值为8。
2.1.2 接种量对抑菌物质活性的影响
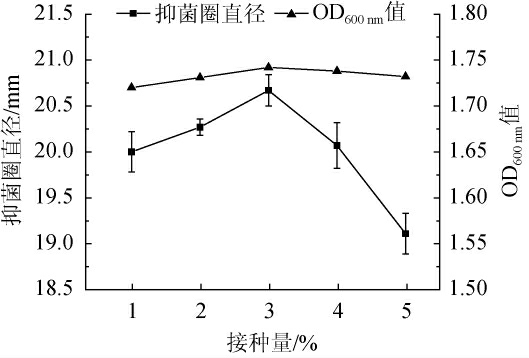
图2 接种量对抑菌物质活性的影响
Fig.2 Effect of inoculum on antibacterial substances activity
由图2可知,接种量为1%时,细菌浓度和抑菌物质活性较高,随着接种量的增加,细菌浓度和抑菌物质活性升高,接种量为3%时,抑菌圈最大,直径为20.67 mm,细菌浓度和抑菌物质活性达到峰值。接种量过大时,细菌浓度和抑菌物质活性略有下降,由于细菌生长到一定阶段,培养基内的营养物质消耗过快,使抑菌物质的产生受菌体细胞群体感应调节,导致抑菌物质活性降低[14]。因此,最佳接种量为3%。
2.1.3 发酵温度对抑菌物质活性的影响

图3 发酵温度对抑菌物质活性的影响
Fig.3 Effect of fermentation temperature on antibacterial substances activity
由图3可知,发酵温度为28 ℃时,细菌浓度和抑菌物质活性较小,随着发酵温度升高,细菌浓度和抑菌物质活性增大;发酵温度为37 ℃时,细菌浓度和抑菌物质活性最高,抑菌圈最大,直径为20.84 mm;发酵温度为40 ℃时,细菌浓度和抑菌物质活性明显降低。因为细菌在增殖和代谢时有多种酶参与,当发酵温度过高或过低时酶的活性降低,细菌增殖代谢速度减缓,使抑菌物质合成受到抑制[15]。因此,最佳发酵温度为37 ℃。
2.1.4 发酵时间对抑菌物质活性的影响
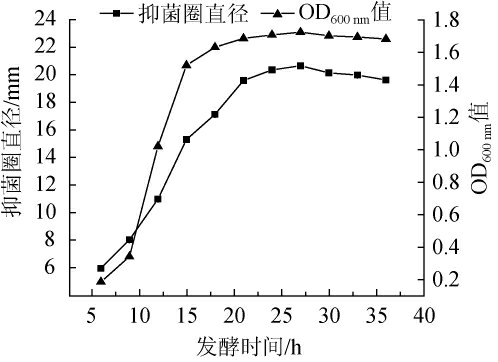
图4 发酵时间对抑菌物质活性的影响
Fig.4 Effect of fermentation time on antibacterial substances activity
由图4可知,芽孢杆菌ZYCHH-01发酵6 h时,细菌浓度和抑菌物质活性很低,细菌浓度和抑菌物质活性随着发酵时间延长增加显著。发酵时间18~27 h时,细菌浓度和抑菌物质活性缓慢提升。发酵时间为27 h时,细菌浓度和抑菌物质活性最高;发酵时间27 h后,细菌浓度和抑菌物质活性持续下降。由于菌株生长时会产生少量的抑菌物质,随着细菌进入稳定期,抑菌物质活性明显提升,细菌发酵时间过长,进入衰亡期,部分菌体自溶释放的蛋白酶降解部分抑菌物质,或者发酵液中有害产物积累过多,导致细菌浓度降低,抑菌物质活性降低,抑菌圈直径下降[16]。因此,最佳发酵时间为27 h。
2.2 Box-Behnken响应面优化试验结果
利用Design-Expert 8.0.6设计3因素3水平Box-Behnken响应面试验结果见表2,方差分析见表3。以抑菌圈直径(Y)为响应值,以发酵温度(A)、培养基pH值(B)、发酵时间(C)为因子,进行拟合分析,得到回归方程:Y=20.59-2.42A-0.63B+0.34C+0.19AB+0.017AC+0.04BC-2.96A2-1.56B2-0.75C2。
表2 中心组合试验设计与结果
Table 2 Design and results of center combination experiments

表3 回归模型方差分析
Table 3 Variance analysis of regression model

注:“*”表示对结果影响差异显著(P<0.05);“**”表示对结果影响差异极显著(P<0.01)。
由表3可知,各因素影响顺序为A>B>C,即发酵温度>培养基pH>发酵时间,回归模型中A、A2、B2均为极显著水平(P<0.01),B、C、C2均为显著水平(P<0.05),交互项AB、BC、AC均不显著,模型P值<0.000 1,失拟项P值0.240 8>0.05,失拟不显著,说明回归方程极显著。其中决定系数R2=0.995 7、调整决定系数R2Adj=0.990 2,说明此回归方程拟合度高,故此模型可用来对芽孢杆菌ZYCHH-01产抑菌物质条件优化分析。

图5 发酵温度、培养基pH值、发酵时间交互作用对抑菌圈直径影响的响应曲面与等高线
Fig.5 Response surface plots and contour lines of effects of interaction between fermentation temperature,medium pH and fermentation time on inhibition zone diameter
由图5可知,根据回归方程所得到的响应曲面,分别反映了发酵温度,培养基pH,发酵时间三个因素之间的交互作用对抑菌圈直径大小的影响。每组响应曲面开口向下,表明在此曲面内有最大点。回归方程的二次项系数均为负值,响应值存在极大值。因此芽孢杆菌ZYCHH-01产抑菌物质最优条件:发酵温度35.75 ℃,培养基pH值7.78,发酵时间27.65 h,此条件下抑菌圈直径最大为21.20 mm。
为提高试验的方便性和可靠性,将最佳培养条件修正为发酵温度36 ℃,培养基pH值7.8,发酵时间27.5 h。按照修正后条件进行试验,抑菌圈直径大小平均值为21.12 mm,与预测值21.20 mm相近。预测值和实际值的良好拟合,证明该模型真实有效。
2.2 最小抑菌浓度的测定
表4 不同上清液稀释度的抑菌浓度
Table 4 Inhibitory concentration of supernatant with different dilution
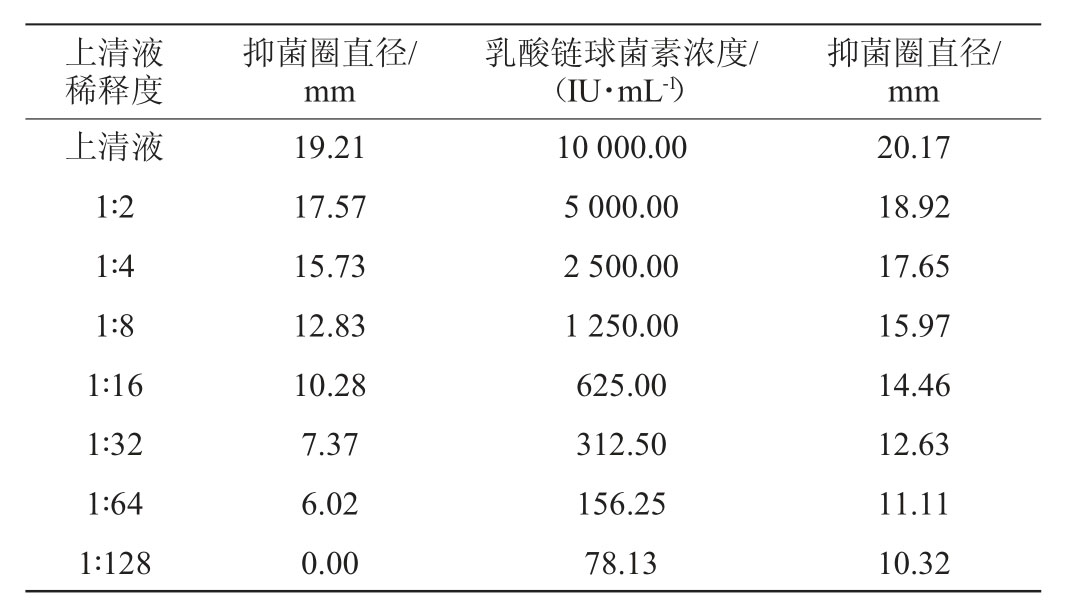
由表4可知,上清液和乳酸链球菌素抑菌圈大小随着浓度的降低而减小,上清液稀释1∶64时,抑菌圈直径为6.02 mm,当稀释1∶128时,上清液无抑菌活性;此时,阳性对照组乳酸链球菌素浓度为78.13 IU/mL,仍有较好的抑菌活性。因此,最小抑菌浓度为上清液稀释1∶64。
2.3 抑菌物质的特性
2.3.1 不同pH条件下的热稳定性

图6 不同pH值和发酵温度对抑菌物质活性的影响
Fig.6 Effect of different pH and fermentation temperature on antibacterial substances activity
由图6可知,芽孢杆菌ZYCHH-01所产的抑菌物质活性随着处理温度的升高而降低,在20~60 ℃时,抑菌物质均有活性,pH值为8时抑菌圈最大,抑菌活性最高。在80 ℃时,pH值为9的抑菌物质完全失活,抑菌物质在pH值为7抑菌圈最大活性最高,在100 ℃时,pH值为5和9的抑菌物质完全失活,由于高温使抑菌物质的构象发生改变[17],导致其完全失活,抑菌物质在pH值为7抑菌圈最大活性最高。在pH值为6~8内经高温处理后,抑菌物质仍保有较好的活性,因此该抑菌物质具有良好的热稳定性和较好的耐酸碱性。
2.3.2 酶对抑菌物质稳定性的影响
表5 酶对抑菌物质活性的影响
Table 5 Effect of enzyme on antibacterial substances activity
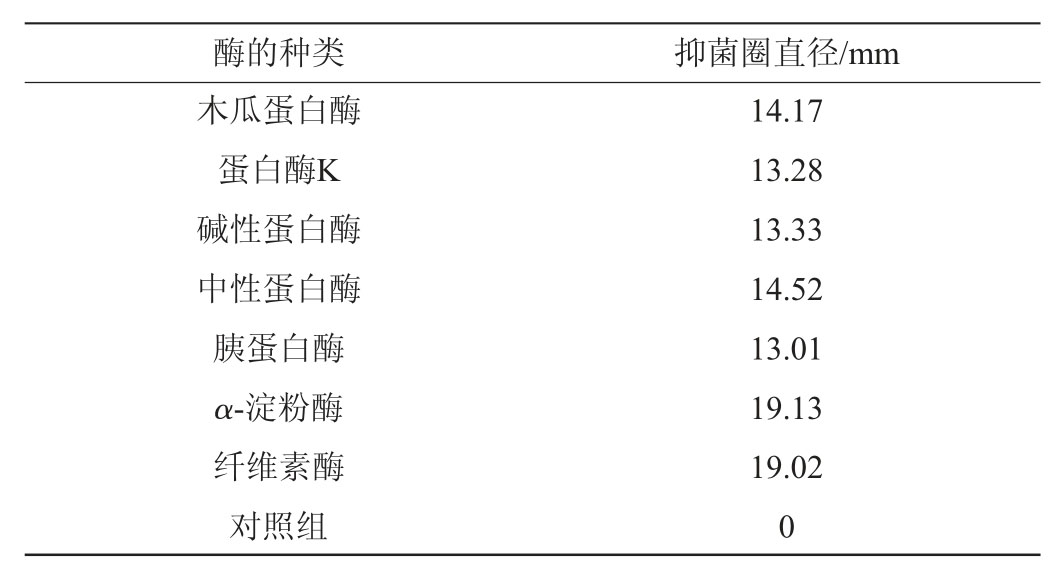
由表5可知,经蛋白酶处理后的抑菌物质活性明显降低,与α-淀粉酶和纤维素酶处理后的试验组和对照组作对比,表明该抑菌物质中含有蛋白质或者肽,但仍有部分抗菌活性,可能存在多糖或者脂类等其他具有抗菌作用的代谢产物[18],或因蛋白酶的浓度较低处理时间较短导致部分活性蛋白没有失活[19]。
2.3.3 有机溶剂和表面活性剂对抑菌物质活性的影响
表6 有机溶剂和表面活性剂对抑菌物质活性的影响
Table 6 Effect of organic solvents and surfactants on antibacterial substances activity
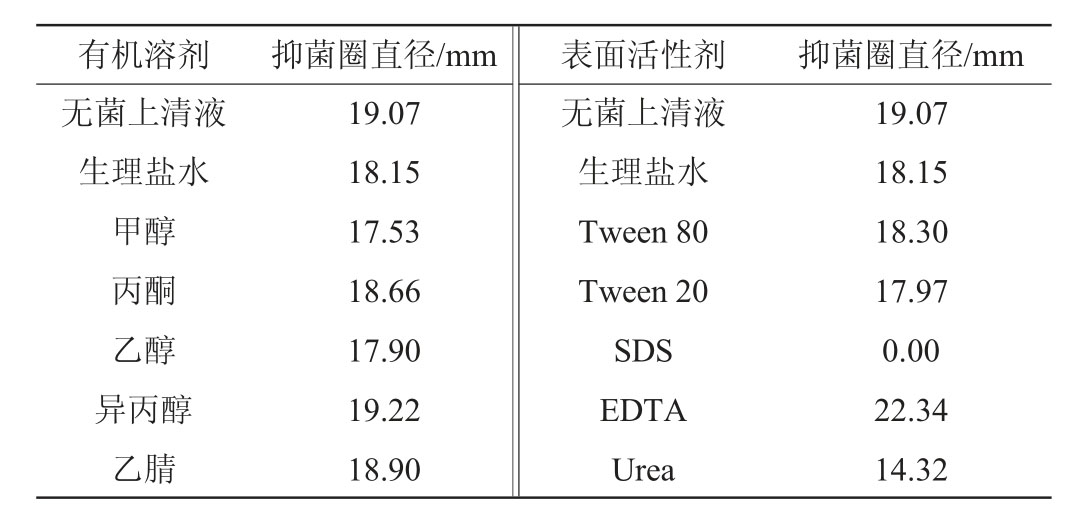
由表6可知,有机溶剂对抑菌物质的活性影响不显著,说明该抑菌物质在有机溶剂中有良好的稳定性。Tween 80、Tween 20对抑菌物质的活性基本没有影响,添加EDTA后,抑菌活性提升明显,推测EDTA改变了细菌细胞膜的渗透性从而增加了对抑菌物质的敏感性[20],增强了抑菌活性,SDS、Urea破坏了抑菌物质中蛋白的氢键和疏水键,从而破坏了蛋白质的结构,使抑菌物质失活或者活性降低[21]。
2.3.4 储藏时间对抑菌物质活性的影响
由图7可知,将无菌上清液在4 ℃条件储存,冷藏时间0~6 d,抑菌物质活性较高,随着时间延长,抑菌物质活性呈先下降后趋于稳定的趋势,18 d后,抑菌物质仍具有活性且趋于稳定,可能是部分抑菌物质在无菌上清液中发生了氧化,使抑菌活性降低。

图7 储藏时间对抑菌物质活性的影响
Fig.7 Effect of storage time on antibacterial substances activity
2.3.5 抑菌物质对不同细菌的活性
表7 抑菌物质对细菌抑菌活性
Table 7 Antibacterial activity of antibacterial substances against bacteria

由表7可知,对大肠杆菌的活性显著,同时对其他3种常见的食源性病菌均有较好的活性。表明此抑菌物质对部分食源性病菌有良好的抑制作用。
3 结论
通过单因素试验,确定芽孢杆菌ZYCHH-01产抑菌物质最佳单因素条件为培养基pH 8,接种量3%,发酵温度37 ℃,发酵时间27 h。在单因素试验的结果上,利用响应面法对其产抑菌物质条件进行优化,确定最佳发酵条件为培养基pH 7.8,接种量3%,发酵温度36 ℃,发酵时间27.5 h。在此优化条件下,抑菌圈直径为21.12 mm。采用二倍稀释法测定最小抑菌浓度为上清液稀释1∶64。对菌株产的抑菌物质进行研究,发现抑菌物质对蛋白酶敏感,对α-淀粉酶和纤维素酶不敏感,推测抑菌物质中含有蛋白质或肽。抑菌物质活性pH范围大且在pH6~8环境中具有良好的热稳定性,经100 ℃处理后,仍有较好活性,较耐存储,有机试剂和部分表面活性剂对其影响较小,SDS、Urea对其抑菌活性降低影响显著,但与EDTA共同作用抑菌活性提升明显,对食源性病菌有良好的抑菌活性。
[1]JACK R W,TAGG J R,RAY B.Bacteriocins of gram-positive bacteria[J].Microbiol Rev,1995,59(2):171-200.
[2]徐炳政,王颖,梁小月,等.乳酸菌细菌素应用研究进展[J].黑龙江八一农垦大学学报,2015,27(1):60-63.
[3]尹胜利,杜鉴,徐晨.乳酸菌的研究现状及其应用[J].食品科技,2012,37(9):25-29.
[4]KIM N,KIM W J,KANG S.Anti-biofilm effect of crude bacteriocin derived from Lactobacillus brevis DF01 on Escherichia coli and Salmonella typhimurium[J].Food Control,2019,98(7):274-280.
[5]KLAENHAMMER T R.Genetics of bacteriocins produced by lactic acid bacteria[J].FEMS Microbiol Rev,1993,12(1):39-85.
[6]SCHALLMEYM,SINGHA,WARDOP.Developmentsin the use ofBacillus species for industrial production[J].Can J Microbiol,2004,50(1):1-17.
[7]HU Y,LIU X,SHAN C,et al.Novel bacteriocin produced by Lactobacillus alimentarius FM-MM4 from a traditional Chinese fermented meat Nanx Wudl:Purification,identification and antimicrobial characteristics[J].Food Control,2017,77(9):290-297.
[8]LEE S G,CHANG H C.Purification and characterization of mejucin,a new bacteriocin produced by Bacillus subtilis SN7[J].LWT-Food Sci Technol,2018,87(6):8-15.
[9]WORAPRAYOTE W,PUMPUANG L,TOSUKHOWONG A,et al.Two putatively novel bacteriocins active against Gram-negative food borne pathogens produced by Weissella hellenica BCC 7293[J].Food Control,2015,55(3):176-184.
[10]ABRIOUEL H,FRANZ C M A P,OMAR N B,et al.Diversity and applications of Bacillus bacteriocins[J]. FEMS Microbiol Rev,2015,35(1):201-232.
[11]郭庆风,陈林,马经纬.凝集芽孢杆菌益生机制及应用研究进展[J].食品研究与开发,2018,39(18):208-213.
[12]ARNESEN L P,FAGERLUND A,GRANUM P E.From soil to gut:Bacillus cereus and its food poisoning toxins[J].FEMS Microbiol Rev,2008,32(4):579-606.
[13]杨永青,谢远红,张红星,等.枯草芽孢杆菌C3 产抗菌物质发酵条件优化[J].中国酿造,2014,33(3):28-31.
[14]范丽霞,胡晓苹,刘文波,等.响应面试验优化链霉菌Z331-A 的发酵条件[J].中国酿造,2018,37(4):77-82.
[15]曹礼,张学虹,赵惠蓉,等.响应面法优化盐碱土中所得一株细菌的培养条件[J].中国酿造,2018,37(2):91-94.
[16]陈静,何连芳,张玉苍.嗜酸乳杆菌产细菌素培养基及培养条件的优化[J].中国酿造,2010,29(12):75-79.
[17]AN J,ZHU W,LIU Y,et al.Purification and characterization of a novel bacteriocin CAMT2 produced by Bacillus amyloliquefaciens isolated from marine fish Epinephelus areolatus[J].Food Control,2015,51(2):278-282.
[18]黄华毅,黄咏槐,黄焕华,等.枯草芽孢杆菌STO-12 脂肽类物质抑菌活性及其特性分析[J].林业与环境科学,2018,34(4):8-14.
[19]张立娜,罗立新.一株产抑菌物质的蜡样芽胞杆菌的鉴定及其抑菌物质性质[J].中国酿造,2012,31(2):99-102.
[20]WU Y,AN J,LIU Y,et al.Mode of action of a novel anti-Listeria bacteriocin(CAMT2)produced by Bacillus amyloliquefaciens ZJHD3-06 from Epinephelus areolatus[J].Arch Microbiol,2019,201(1):61-66.
[21]赵娜.抗菌活性瑞士乳杆菌AJT 的筛选鉴定及抗菌物质研究[D].呼和浩特:内蒙古农业大学,2013.