酒曲起源于中国,被誉为中国第五大发明,曲乃酒之骨,曲的种类决定了酒的香型和风格,酒曲在白酒发酵过程中主要作为糖化发酵剂,提供微生物动力、酶动力和风味前体物,对白酒品质和风味提升尤为重要,因此就有了“醅作肉,水作血,曲为骨”的说法。中国酒曲的分类繁多,根据大曲在曲房中能达到的最高培养温度,一般将大曲分为高温曲、中温曲和低温曲。
高温大曲是酱香白酒的糖化发酵剂,曲中风味前体物质和特有的微生物体系形成了酱香型白酒的特有风格:酱香突出、幽雅细腻、酒体醇厚、空杯留香持久。高温大曲的制曲温度最高可达60~70 ℃,使得大曲中霉菌和酵母数量减少,细菌数量相对增多。研究表明,细菌在高温大曲中的作用主要是产香,是形成酱香型白酒典型香气特性的主要菌群。因此,对酱香型大曲细菌菌群结构多样性及其功能性进行研究,有助于提高对酱香型大曲的制曲机理的认识,从而对制曲过程进行调控,对大曲的品质以及酱香型白酒的品质提升具有重要作用。本文在前人研究的基础上,对酱香型大曲细菌菌群结构多样性及功能性的研究方法、研究结果进行归纳总结,以期对酱香型大曲中细菌的研究提供参考。
1 酱香型大曲细菌菌群结构多样性
酱香型白酒酿造工艺独特,整个生产周期需经历二次投料,八轮次发酵,七次蒸酒,长期陈酿,精心勾兑而成[1]。其高温制曲是酱香大曲制作的一大特色,其制作特点是水分多和温度高,从而使在整个大曲制作过程中,细菌数量总体增加。霉菌与酵母由于受制曲环境的影响,使得两者在大曲中的含量减少。由此可见,细菌在酱香型大曲中的作用至关重要,研究酱香大曲细菌菌群多样性对于后期解析产酱香的独特风味的作用机制提供理论基础。而常用的研究方法主要包括:传统可培养分离技术与免培养分离技术。这两种分离技术的目的旨在解析大曲中的微生物菌群结构,都各有其独特的特点,且具有互补的作用。
1.1 传统可培养分离技术研究酱香型大曲细菌群落结构多样性
1.1.1 传统可培养分离技术
传统可培养分离技术主要是将样品中的微生物分离纯化后,根据菌株的形态特征、生理生化特性或遗传特性确定其种属。在筛选过程中运用直接镜检法或平板培养菌落计数法对筛选出的目标菌株进行统计分析,由于固态基质对微生物细胞的吸附作用、固态基质颗粒对镜检的干扰使得直接镜检计数不完全;此外,平板菌落计数由于培养基、培养条件的差异也会造成微生物计数差异。虽然该技术在研究白酒微生物的结构多样性及其数量变化中运用较为广泛[2-3],但是该方法耗时、耗力、分离不完全、易受人为因素的影响和环境条件的限制。研究表明,运用传统可培养分离技术仅能分离出1%~5%的微生物[4]。因此,该技术对单一样品中某类微生物进行针对性的筛选运用得较多,若要对整个样品中的微生物结构多样性进行分析,选用可培养分离技术不能达到此目的,还需借助新的技术方法和手段。
1.1.2 传统可培养分离技术研究酱香型大曲细菌群落结构多样性的现状
近年研究发现,运用传统可培养分离技术从酱香大曲中分离得到的多数是芽孢杆菌(Bacillus)群,具体研究情况见表1。
表1 传统可培养分离技术研究细菌多样性的现状
Table 1 Research status of bacterial diversity by traditional culture-dependent techniques

综上所述,运用传统可培养分离技术对酱香型大曲细菌群落结构多样性进行研究,发现多数为耐高温的芽孢杆菌属、少数微球菌属、葡萄球菌属、费氏链霉菌属等细菌类群。芽孢杆菌属在酱香型大曲中的数量相对其他细菌属较多,因为大多数芽孢杆菌能在高温、高盐、偏酸、高湿等贫瘠的环境中生长繁殖,代谢产生高温蛋白酶、淀粉酶类,辅助霉菌降解大曲中的原料,并生成多种游离氨基酸,在发酵过程中形成一系列复杂反应,产生独特的酱香风味。但是在制曲过程中可变因素很多,制曲环境、工艺参数等也会影响芽孢杆菌的种类,从而影响整个大曲中的细菌菌群。
1.2 免培养分离技术对酱香型大曲细菌群落结构多样性研究
1.2.1 免培养分离技术
近年,免培养技术在研究浓香型、清香型白酒酿造过程中微生物结构多样性方面的运用最为普遍,而对酱香型大曲、环境、酒醅等微生物多样性的研究也慢慢兴起。目前,在研究白酒酿造过程中微生物多样性所运用的分子生物学方法主要有聚合酶链式反应(polymerase chain reaction,PCR)技术、高通量测序技术、克隆文库法、荧光原位杂交法、限制性酶切片段长度多态性法、聚合酶链式反应-变性或温度梯度凝胶电泳法(ploymerase chain reaction and denaturing/temperature gredient gel electrophoresis,PCR-DGGE/TGGE)等。为了摆脱传统可培养分离技术的束缚,免培养技术能够更客观的探索样品中的微生物结构且从遗传特性上较客观的分析样品中的微生物群落,并能精确地揭示微生物种类和遗传多样性。本文基于近年运用免培养技术在酱香型大曲微生物群落结构多样性的研究现状,简单的介绍了PCR-DGGE技术、高通量测序技术及16S rDNA克隆文库技术的基本原理、特点及其技术手段。
(1)PCR-DGGE技术
DGGE在20世纪80年代初期由MYERS R M等[15-16]发明,主要用于检测脱氧核糖核酸(deoxyribonucleic acid,DNA)片段中的点突变[15-16]。其基本原理基于一般的聚丙烯酰胺凝胶电泳,在此基础上,加入梯度变性剂,从而能够把同样长度但序列不同的DNA片段区分开。
MUYZER G等[17]在1993年首次将PCR-DGGE技术应用于微生物群落结构研究。目前该技术已被广泛应用于解析各生态系统中的细菌或古细菌、真菌群落结构多样性[18]。该技术直接从样品中抽提宏基因组,不需要进行培养,且能检测到难以培养或不可培养的微生物[19];其次,该技术检测快速、精确、直观。但是此方法只能分析500个碱基对以下的DNA片段,只有系统中1%以上的微生物种群能被检测出,系统中的弱势菌群不能或者难以被检测到,且在PCR引物设计扩增某些特定菌群时,微生物群落结构组成会因为部分菌群序列间的同源性差异明显使得群落组成结果被高估,同时,有些细菌具有多个拷贝的核糖体核糖核酸(ribonucleic acid,RNA)操纵单元也会使得其群落组成被高估。
(2)高通量测序技术
高通量测序技术是在第一代测序技术(即Maxam-Gilbert和Sanger测序技术)的基础上发展而来的[20],其与传统可培养技术相比能快速地进行序列分析,且分析的序列数量大、同时能检测到一些弱势菌群以及一些不可培养的微生物,使得检测更为全面、精确度高、通量大。高通量测序技术流程包括样品采集、核酸序列的提取及纯化、文库构建、测序、原始序列信息比对注释、数据处理等[20-24]。高通量测序技术的基本原理基于其测序平台的不同而有所差异,目前,运用的测序平台主要有Roche 454焦磷酸测序平台、Illumina测序平台、SOLiD测序平台、Ion Torrent测序平台和PacBio SMRT测序平台[25]。其中Roche 454和Illumina测序平台在研究白酒酿造过程中微生物群落结构多样性方面较为广泛。
高通量测序所检测到的原始序列需进行总体分析后再利用基因数据库进行物种注释,进一步确定其微生物分类学地位。常用的分析方法有聚类分析、判别分析、排序分析、相关性分析和差异性分析等[26]。近年来研究发现,在研究白酒酿造过程中微生物群落结构多样性常用的数据分析方法有主成分分析(principal component analysis,PCA)、典型相关分析(canonical correlation analysis,CCA)及相对丰度热图。由于高通量测序所得到的测序数据量大从而限制研究者对其数据进行有效数据的筛选,其基因文库的构建及测序方法也会因为引物退火温度不当、模板DNA代表性不强等导致引入系统偏差和随机性,从而使样本中核酸分子含量与实际样品含量有偏差。因此,对高通量测序技术所要达到的测序要求越来越高,即在降低成本的情况下达到对样品中微生物群落结构多样性更深入、更精确、更全面的分析与研究。
(3)16S rDNA克隆文库技术
16S r DNA 克隆文库技术是直接从分子水平上研究微生物的结构,在解析复杂环境微生物群落结构中能更可靠、更直接的反应细菌群落的构成及多样性。其基本原理是基于微生物群落16S rRNA基因片段的克隆表达构建文库,从而推测样品中微生物的分类学地位,该技术成熟,便于操作。但是因为其操作步骤较为繁琐,工作量较大,导致获得的能够反映微生物宏基因组的信息量较为局限,主要以优势菌群为主,从而出现物种丰度被高估以及微生物群落大小与多样性的可能性被低估[27]。如若只解析样品中微生物群落的优势菌群,选用此技术能够很好地达到此目的。
1.2.2 免培养分离技术研究酱香型大曲细菌群落结构多样性的现状
随着现代分子生物学不断发展,免培养分离技术被广泛运用到菌种鉴定中。与传统可培养相比,免培养分离技术能够快速、精确地鉴定出微生物,同时能够发现新的微生物种类。目前,运用免培养分离技术分析白酒酿造过程中的细菌群落结构多样性多见于浓香型白酒,而对酱香型白酒酿造过程中细菌菌群的研究较少,多见于酒醅、堆积、窖池中微生物菌群的研究。黄蕴利等[28]运用高通量测序技术从酱香型白酒第二轮次酒堆积过程中共检测到细菌属138个;窖池发酵过程中共检测到细菌属262个。郭敏等[29]同样运用高通量测序技术从酱香型白酒3轮次酒醅中检测到特有细菌属9个,而从7轮次酒醅中检测到特有细菌属8个。采用免培养分离技术对酱香型大曲细菌菌群结构研究的现状见表2。
以上研究表明,从酱香型大曲中主要检测到厚壁菌门、放线菌门、变形菌门、拟杆菌门、蓝藻门、梭杆菌门、拟杆菌门等的细菌属,其中厚壁菌门、放线菌门、变形菌门、拟杆菌门在酱香大曲中占主导地位。其次,免培养分离技术还检测到Uncultured Propionibacteriaceae bacterium、Uncultured Weissella sp.、Uncultured Cyanobacterium等不可培养的细菌菌群以及棒状杆菌属、魏斯氏菌属等稀有细菌属。与传统可培养相比,更能全面地分析酱香大曲细菌多样性。但是在研究大曲中微生物的功能属性时,还需借助可培养技术。两种技术联用互补对解析微生物的结构与功能特性更全面。但是通过免培养分离技术检测出的细菌类群多数只能确定其属水平,无法确定到种。此外,检测到的一些不可培养的微生物在白酒酿造中的生物学特性及功能特性还需深入探讨。
表2 免培养分离技术研究酱香型白酒大曲细菌多样性的现状
Table 2 Research status of bacterial diversity of Moutai-flavor Baijiu Daqu by culture-independent technique

2 酱香型大曲细菌菌群功能特性研究方法
好曲产好酒,曲自然离不开微生物的作用。而茅台酒采用的就是典型的细菌曲,成品高温曲中细菌数量达90%以上,且多数为嗜热芽孢杆菌,因而酱香型白酒主体香味主要通过这些微生物代谢产生的酱香物质或酱香前体物质形成的[37-38]。因此,深入研究酱香型大曲中细菌的产酶特性、产香特性,对解析酱香型白酒独特风味的形成机制具有重要的指导意义。
2.1 酱香型大曲细菌产酶特性研究
酱香型大曲细菌产酶的研究主要体现在其产蛋白酶、淀粉酶、纤溶酶、糖化酶、脂肪酶和漆酶等特性。常用的研究方法主要是根据其具体的酶学特性而有所不同。比如α-淀粉酶的测定采用淀粉-碘液平板法、蛋白酶测定普遍采用酪蛋白平板法、纤溶酶活力测定采用血纤维蛋白平板法。但是此类方法只能初步确定其酶学特性,不能得知其产酶量。另一种方法是在上述方法的基础上,采用特定酶的发酵培养基或将目标菌株直接进行固、液发酵一段时间,再运用国标测定酶的方法进行产酶特性研究,通常用酶活力单位表示。该方法能够确定目标菌株在某一特定条件下转化底物所需的酶量。
在酱香型白酒发酵体系中,对产酶细菌的研究主要以芽孢杆菌为主。聂慧芳等[39]从酱香型大曲中分离出两株具有中性蛋白酶和酸性蛋白酶活力的枯草芽孢杆菌,具有较高的蛋白分解能力。王晓丹等[40]研究发现,腐生葡萄球菌(Staphylococcus saprophyticus)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、鸡葡萄球菌(Staphylococcus gallinarum)、地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)和埃希氏大肠杆菌(Escherichia coli)能够产酸性蛋白酶、糖化酶和脂肪酶。而关于酱香型大曲中芽孢杆菌属酿造酶活力大小的研究现状见表3。
表3 酱香型白酒大曲中芽孢杆菌属酿造酶活力研究现状
Table 3 Research status of brewing enzyme activity of Bacillus in Moutai-flavor Baijiu Daqu
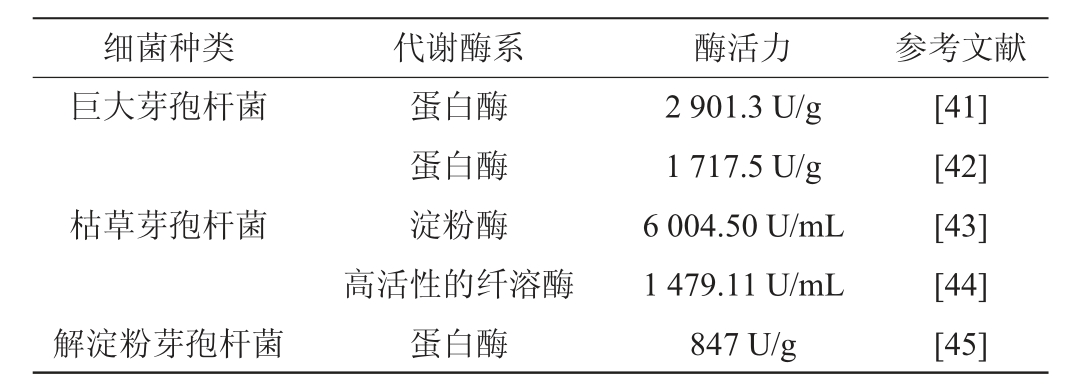
综上所述,酱香型大曲细菌具有产蛋白酶、淀粉酶、纤溶酶、糖化酶、脂肪酶、漆酶等酶学特性,每种酶在酱香型白酒酿造过程中都扮演着不同的角色,且行使的作用各有差异。在白酒酿造过程中,漆酶能够氧化愈创木酚以及在小分子介体化合物的作用下氧化酪氨酸,这些小分子介体化合物主要是酱香型白酒中的芳香族化合物,如丁香醛、丁香酸、香草醛、阿魏酸等小分子酚类衍生物[46-47]。林芬等[44]从酱香型白酒中筛选一株既产酱香又具有纤溶酶活性的细菌,通过抗凝血实验和体外血栓溶解实验表明,该菌株发酵上清液具有体外血栓溶解作用和抗凝血效果,该菌在白酒酿造、酶制剂、药物、饲料、香料等产业中提供丰富的生物资源且具有很强的利用价值,其纤溶酶活性也为生产新型的溶血栓药物提供了参考。具有中性蛋白酶活性的细菌能够辅助霉菌中酸性蛋白酶对原料中蛋白质的降解;另外酱香型白酒固态发酵过程中耐高温α-淀粉酶在高温条件下能分解粮食中的淀粉,提高粮食利用率;在制作麸皮浸出汁时,加入耐高温α-淀粉酶,采用“中温蒸煮”法,可以降低麸皮浸出汁的糖化醪黏度,提高其流动性,有利于菌株在浓醪中发酵产香。
目前对于酱香型大曲细菌酿造酶学的研究都局限于检测其菌株是否具有产酶特性、优化产酶条件、提升产酶能力等,而其产酶能力在整个酿造过程中对白酒风味、酒质影响机制的研究还不够清楚。其次对于酶的提取量以及应用的研究领域也较为局限,若将其制成酶制剂运用于其他领域可为酱香型白酒中功能微生物的研究提供一个新方向。
2.2 酱香型大曲细菌产香特性研究
细菌在酱香型白酒酿造过程中主要作用是产香,近年来研究都是直接从大曲中筛选出具有产酱香风味的菌株,根据大曲独特的环境,模拟固液发酵至一定时间再对其发酵基质进行感官与风味成分分析。常用的风味物质检测技术有高效液相色谱(high performance liquid chromatography,HPLC)、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪、气相色谱-嗅闻(gaschromatographyolfactometry,GC-O)法等。常用的样品前处理方法有顶空固相微萃取(head space solid-phase microextraction,HS-SPME)、液液微萃取(liquid-liquid microextraction,LLME)、搅拌棒吸附萃取(stir bar sorptive extraction,SBSE)等。各检测技术以及样品前处理方法的基本原理、特点见表4。
表4 常用风味检测技术及样品前处理方法
Table 4 Common detection techniques for flavor and sample pretreatment methods

近年,在对酱香型白酒大曲细菌产香功能的研究中发现,样品前处理大多都采用顶空固相微萃取技术,因为该技术相对其他前处理技术操作简单、快速,并能与GC-O或GC-MS联用。随着现代风味检测技术的发展,解析酒的风味物质和微生物二者之间的联系也越来越明朗,为后期研究微生物在白酒酿造过程中的作用机制提供技术支撑。
酱香型白酒在酿造过程中,微生物通过降解原料中的大分子物质,以供自身生长代谢。由于制曲温度逐渐升高,微生物在整个制曲环境中代谢生成新的物质,使得大曲中的成分较为复杂,而新生成的物质部分具有香味,从而形成特有的白酒香味。其代谢特性研究现状见表5。
从以上研究表明,酱香型白酒的主体香味成分仍然是研究的一大热点,从酱香型大曲中筛选出的产酱香的细菌大多都产酸类、醇类、酯类、酮类和吡嗪类等物质。而这些物质大都呈现不同的风味,其中酯类化合物、醇类化合物、芳香族类化合物及缩醛类化合物主要贡献较强的水果香、甜香;酸类化合物和硫化物主要贡献腐臭味;含氮化合物、内酯类化合物主要贡献焙烤香和杏仁香;呋喃类化合物则主要贡献焦糖香。沈海月[54]通过比较不同贮存年份的酱香型白酒的风味,研究发现贮存时间越长的酒其酱香风味越强,主要是因为酯类、醇类化合物降低,即水果香、甜香减少有利于凸显其酱香;同时含氮类和酚类化合物增加也有利于酱香增强。对于功能微生物纯种发酵大多都只呈现一种风味,虽然检测出的风味化合物有很多种,但是某些风味物质占比较大会掩盖其他风味物质的风味。目前,对功能微生物的研究大多都是微生物的纯种发酵感官闻香以及发酵基质成分检测慢慢解析其产香机制。但都只找到与产酱香有关的物质,如乙偶姻、3-羟基-2-丁酮、四甲基吡嗪等。对于微生物在酱香大曲中的相互作用以及各微生物的代谢特性、酶学特性与风味物质之间的联系对产酱香的影响都有待深入研究。
表5 酱香型白酒大曲细菌代谢特性研究
Table 5 Metabolic characteristics of bacteria in Moutai-flavor Baijiu Daqu

3 功能细菌的发酵生态调控应用
如何提升酒质与出酒率以及改善酒的风味一直是企业所面临的一大难题,而酱香型白酒酿造过程不是单一菌株作用结果,而是多种微生物相互作用,进而形成独特的微生物区系。若仅从细菌的角度分析其功能与作用太过局限。相应地,混合发酵能从其他角度分析细菌在白酒酿造中的作用。
杨涛等[55]从酱香型大曲中筛选出5株嗜热芽孢杆菌和3株酵母运用于白酒生产,发现用嗜热芽孢杆菌、酵母菌与糟醅复合酱香明显。凌杰[56]研究了酱香型白酒酿造中地衣芽孢杆菌与酿酒酵母之间的相互作用,发现酿酒酵母在发酵过程中产生的酸性环境会抑制地衣芽孢杆菌的生长,从而削减了地衣芽孢在酱香型白酒生产中的作用,但随着制曲温度的升高,地衣芽孢杆菌的作用越明显,此研究只单纯的分析酿酒酵母与地衣芽孢杆菌生长的关系,对酿酒酵母是如何抑制地衣芽孢杆菌的生长,其抑制机制还需深入探讨。
现如今,对于从酱香型大曲中筛选出的功能微生物,大多都以混合发酵方式运用于白酒生产中,以提升白酒的风味成分,增加白酒感官品质。但是一些功能微生物所代谢产生的风味物质对于人体是有益的(如四甲基吡嗪),将其深入研究,更能体现其生物学价值。
4 总结与展望
运用传统可培养分离技术对酱香型大曲细菌菌群结构研究发现,酱香型大曲中多数为芽孢杆菌属,少数为微球菌属、葡萄球菌属、费氏链霉菌属等细菌类群;采用免培养分离技术对酱香型大曲细菌菌群结构多样性研究发现,其中主要为厚壁菌门、放线菌门、变形菌门、拟杆菌门、蓝藻门、梭杆菌门、拟杆菌门等的细菌属。从细菌功能性研究中表明,细菌的功能性研究太过局限,大多都局限于其代谢风味物质和酶学特性对白酒酿造过程的影响,以及微生物共培养体系相互作用对白酒风味的影响;其次,对于分离到的不可培养的微生物菌群的生理生态特性及其功能特性的研究需要深入解析。而酱香大曲中的微生物能够保证其产生独特的酱香风味,这主要源于其代谢的特征风味物质以及其酶学特性,如若将这些能够代谢产风味的菌株运用于食品调味的生产以及烟叶发酵增香等领域,也为之后白酒中产香细菌提供新的研究方向。
[1]秦含章.白酒酿造的科学与技术[M].北京:中国轻工业出版社,1997:36-42.
[2]乔宗伟,张文学,张丽莺,等.浓香型白酒发酵过程中酒醅的微生物区系分析[J].酿酒,2005(1):18-22.
[3]吴飞.浓香型白酒窖池发酵过程中酵母类微生物的分析[D].成都:四川大学,2006.
[4]HUNTER-CEVERA J C.The value of microbial diversity[J].Curr Opin Microbiol,1998,1(3):278-285.
[5]庄名扬,王仲文.酱香型高温大曲中功能菌B_(3-1)菌株的分离、选育及其分类学鉴定[J].酿酒,2003(5):26-27.
[6]杨代永,范光先,汪地强,等.高温大曲中的微生物研究[J].酿酒科技,2007(5):37-38.
[7]张荣.产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学,2009.
[8]罗建超,谢和.大曲中产酱香芽孢杆菌的筛选及其代谢产香探析[J].酿酒科技,2012(5):35-40.
[9]刘效毅,郭坤亮,辛玉华.高温大曲中微生物的分离与鉴定[J].酿酒科技,2012(6):52-55.
[10]刘婧玮,蒋英丽,沈毅,等.高温大曲中一株酱香功能菌的分离鉴定及验证[J].酿酒科技,2014(10):19-22.
[11]余婷婷,赖世强,曹文涛,等.高温大曲中产酱香耐高温细菌的筛选及鉴定[J].贵州农业科学,2013,41(11):109-112.
[12]朱德文,蒋英丽,高鸿,等.酱香型大曲中一株产香芽孢杆菌的分离鉴定[J].酿酒科技,2014(6):39-41,46.
[13]杨佳,祖拜代,杨青,等.肖尔布拉克高温大曲中细菌分离及产香研究[J].酿酒科技,2014(10):47-50
[14]王婧.酱香大曲中产吡嗪类物质芽孢杆菌的筛选及其应用研究[D].贵阳:贵州大学,2016.
[15]MYERS R M,FISHER S G,LERMAN L S,et al.Nearly all single base substitutions in DNA fragments joined to a GC-clamp can be detected by denaturing gradient gel electrophoresis[J].Nucleic Acid Res,1985,13(9):3131-3145.
[16]MYERS R M,FISHER S G,TOM M,et al.Modification of the melting properties of duplex DNA by attachment of a GC-rich DNA sequence as determined by denaturing gradient gel electrophoresis [J].Nucleic Acid Res,1985,13(9):3111-3129.
[17]MUYZER G,DEWAAL E C,UITTERLINDEN A G.Profiling of complex microbial-populations by denaturing gradient gel-electrophoresis analysis of polymerase chain reaction-amplified genes-coding for 16S Ribosomal-RNA[J].Appl Environ Microbiol,1993,59(3):695-700.
[18]GOMES N C M,FAGBOLA O,COSTA R,et al.Dynamics of fungal communities in bulk and maize rhizosphere soil in the tropics[J]. Appl Environ Microbiol,2003,69(7):3758-3766.
[19]PETERSEN S O,DEBOSZ K,SCHJ P,et al.Phospholipid fatty acid profiles and C availability in wet-stable macro-aggregates from conventionally and organically farmed soils[J].Geoderma,1997,78(34):181-196.
[20]WANG C X,GAECIA-FERNANDEZ D,ALBERT M,et al.Fungal diversity in grape must and wine fermentation assessed by massive sequencing,quantitative PCR and DGGE[J].Front Microbiol,2015,6:1156.
[21]SUN W N,XIAO H Z,PENG Q,et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Ann Microbiol,2016,66(3):1293-1301.
[22]ZHANG X H,ZHAO J L,DU X W.Barcoded pyrosequencing analysis of the bacterial community of Daqu for light-flavour Chinese liquor[J].Lett Appl Microbiol,2014,58(6):549-555.
[23]WANG L,WANG Y Y,WANG D Q,et al.Dynamic changes in the bacterial community in Moutai liquor fermentation process characterized by deep sequencing[J].J Inst Brew,2015,121(4):603-608.
[24]QUAST C,PRUESSE E,YILMAZ P,et al.The SILVA ribosomal RNA gene database project:improved data processing and web-based tools[J].Nucleic Acids Res,2013,41(D1):D590-D596.
[25]吴成,王春晓,王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学,2019,40(3):348-355.
[26]张红霞.PLFA 对清香大曲微生物群落结构分析及产酯酵母的筛选应用研究[D].临汾:山西师范大学,2016.
[27]杜如冰.芝麻香型白酒酿造过程乳酸菌定量以及代谢特征[D].无锡:江南大学,2019.
[28]黄蕴利,黄永光,胡建峰,等.酱香型白酒第二轮次酒发酵过程微生物多样性研究[J].中国酿造,2017,36(9):30-35.
[29]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[30]高亦豹.聚合酶链式反应—变性梯度电泳技术(PCR-DGGE)研究中国白酒大曲中微生物群落结构[D].无锡:江南大学,2010.
[31]谭映月,胡萍,等.应用PCR-DGGE 技术分析酱香型白酒酒曲细菌多样性[J].酿酒科技,2012(10):107-111.
[32]程才璎,刘晓风,袁月祥,等.酱香型白酒酒曲和连续七轮次堆积酒醅的细菌群落结构[J].应用与环境生物学报,2014,20(5):825-831.
[33]王彩虹.基于克隆文库法研究不同香型大曲微生物群落结构[D].自贡:四川理工学院,2014.
[34]王晓丹,班世栋,周鸿翔,等.贵州省遵义地区3 个酱香型大曲细菌群落的比较分析[J].食品科学,2016,37(7):110-116.
[35]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[36]戴奕杰,李宗军,田志强,等.酱香型白酒大曲和糟醅的细菌多样性分析[J].食品科学,2019,40(4):152-159.
[37]FASOLI S,MARAOTTO M,RIZZOTTI L,et al.Bacterial composition of commercial probiotic products as evaluated by PCR-DGGE analysis[J].Int J Food Microbiol,2003,82(1):59-70.
[38]刘晓光,谢和,屈直.酱香型白酒风味物质的形成与微生物关系的研究现状与进展[J].贵州农业科学,2007(2):131-134.
[39]聂慧芳,蒋英丽,沈毅,等.酱香型大曲中高产蛋白酶细菌的分离鉴定[J].酿酒科技,2015(12):41-44.
[40]王晓丹,胡宝东,班世栋,等.酱香型大曲酶系与大曲中微生物产酶关系的研究[J].酿酒科技,2015(9):1-7.
[41]杨国华,邱树毅,黄永光.酱香大曲中产香细菌发酵产蛋白酶的条件优化[J].中国酿造,2011(12):47-50.
[42]袁先铃,黄丹,刘达玉,等.酱香型大曲中蛋白酶产生菌的分离鉴定及产酶条件研究[J].中国酿造,2012,31(6):34-37.
[43]毛祥,黄丹,沈才萍,等.酱香型大曲中产淀粉酶菌的分离鉴定及发酵特性研究[J].中国酿造,2015,34(12):24-27.
[44]林芬,谢和.产酱香细菌中高活性纤溶酶菌株的筛选[J].食品科学,2010,31(17):258-262.
[45]张双燕.清香型白酒风味物质形成与大曲微生物相关性研究[D].北京:北京理工大学,2016.
[46]庄名扬.酱香型白酒中微量成分的生理活性[J].酿酒,2012,39(3):9-16.
[47]庄名扬.中国白酒香味物质形成机理及酿酒工艺的调控[J].四川食品与发酵,2007(2):1-6.
[48]任晗堃.气相色谱-闻香器(GC-O)技术研究进展[C]//第九届中国香料香精学术研讨会论文集.北京:中国香料香精化妆品工业协会,2012:7.
[49]DAVID F,SANDRA P.Stir bar sorptive extraction for trace analysis[J].J Chromatogr A,2007,1152(1-2):54-69.
[50]武思齐.产酱香芽孢杆菌的代谢产物及其研究[D].贵阳:贵州大学,2009.
[51]黄永光,杨国华,张肖克,等.产酱香风味芽孢杆菌类菌株发酵代谢产物及其酶分析研究[J].酿酒科技,2013(1):41-45.
[52]赵兴秀,何义国,赵长青,等.产酱香功能菌的筛选及其风味物质研究[J].食品工业科技,2016,37(6):196-200.
[53]王晓丹,王婧,朱国军,等.酱香大曲中产四甲基吡嗪细菌的分离鉴定及其功能性研究[J].中国酿造,2017,36(1):55-60.
[54]沈海月.酱香型白酒香气物质研究[D].无锡:江南大学,2010.
[55]杨涛,梁明锋,李国友,等.微生物技术在酱香型白酒生产中的应用研究[J].酿酒科技,2011(4):20-24,28.
[56]凌杰.酱香型白酒发酵中地衣芽孢杆菌与酿酒酵母的相互作用[J].微生物学通报,2013,40(11):2014-2021.