葛根(Pueraria lobata)是豆科植物野葛和甘葛藤罗的块根,是中国南方一些省份的常用食材,主要产于湖北、广西、广东、江西等地区。葛根富含淀粉,含有人体必需的8种氨基酸和铁、钙、锌、锗等矿物质元素[1-3]。黄酮类化合物具有清除自由基、扩张血管、降低血压和防止动脉硬化、改善血液循环、避免细胞低氧伤害的功能,有解酒功效[4]。酸乳是经乳酸菌在一定条件下发酵而成的有活性微生物的有益饮品,也是一种微生态调节剂,可恢复肠道微生态环境[5-8]。酒精代谢容易导致人体内的代谢紊乱,而酸乳中含有的大量的氨基酸可以帮助其进行调节,酸乳被大量应用在食品中[9-12]。葛根酸乳的研发不仅能得到一种营养价值丰富的乳饮品,还为葛根的深度开发利用提供了一种新途径,同时在饮品中添加酸乳是目前的发展趋势[13-14]。黄诚等[15]对葛根原料护色处理,复合稳定剂配比,加工过程进行单因素分析,并结合感官评定得到一种优化葛根酸乳。马静等[16]总结了发酵温度、pH值、发酵时间等因素对乳酸菌胞外多糖(exopolysaccharide,EPS)产量的影响,但是没有将其应用在葛根发酵乳中。本试验以试验室筛选的一株高产胞外多糖的乳酸菌为发酵菌株,以总黄酮含量和乳酸菌胞外多糖含量为评价指标来优化葛根发酵乳工艺,以期得到一种营养价值丰富的葛根发酵乳。
1 材料与方法
1.1 材料与试剂
发酵菌株:湖北工业大学酿酒研究所从酸奶中筛选的产胞外多糖的乳酸菌。菌种鉴定为德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus,L.b)和唾液链球菌嗜热亚种(Streptococcus salivarius subsp.thermophilus,S.t)。
酸奶:市售;脱脂奶粉:内蒙古蒙牛乳业股份有限公司;葛根:产于湖北荆门(超市购买);芦丁:美国Acros Organic公司;石油醚、NaOH、Al(NO3)3、Al2(SO4)3、Na2NO2、K2HPO4、柠檬酸二铵、乙酸钠、葡萄糖、吐温-80、MgSO4·7H2O、MnSO4(均为分析纯):国药集团化学试剂有限公司。耐高温α-淀粉酶(20 000 U/g)、糖化酶(100 000 U/g):山东苏柯汉生物工程股份有限公司。
MRS液体培养基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,K2HPO42 g,柠檬酸二铵2 g,乙酸钠5 g,葡萄糖20 g,吐温-80 1 mL,MgSO4·7H2O 0.5 g,MnSO40.25 g,蒸馏水1 000 mL,pH 6.2~6.4。
1.2 仪器与设备
DRP-9272型电热恒温培养箱:上海森信试验仪器有限公司;JMR-117型pH计:北京菁美瑞科技有限公司;XSP-9CA型光学显微镜:上海光学仪器厂;L8(762)紫外分光光度计:上海仪电分析仪器有限公司;GJB100-120三柱塞均质机:常州地利人和均质机有限公司;BPP-7800 pH计:贝尔分析仪器(大连)有限公司。
1.3 试验方法
1.3.1 葛根发酵乳工艺流程及操作要点

将葛根洗干净,去皮切块,加蒸馏水打浆使葛根质量分数为10%,过滤,加10 U/g葛根质量的淀粉酶85~90 ℃糊化2h,冷却至60~65℃加200U/g葛根质量的糖化酶糖化2h。
脱脂乳过滤、均质,杀菌、冷却到35 ℃以下后与葛根糖化液按一定比例混合。
添加葡萄糖,调整脱脂乳、葛根糖化液混合物初始pH值为5.7~6.9,121 ℃灭菌15 min。
将菌种接种到MRS液体培养基中,在37 ℃条件下培养48 h。按脱脂乳∶葛根糖化液=2∶1(V/V)的比例配成种子培养液,将在MRS液体培养基中活化好的菌液接种0.2%到种子培养液中,在40 ℃条件下厌氧培养16 h,得到种子液。
再将种子液按一定比例接种到葛根脱脂乳混合液中在40 ℃厌氧发酵20 h。
1.3.2 发酵菌株的确定及其生长曲线的测定
按10%脱脂乳∶10%葛根糖化液=1∶1(V/V)配制培养基,自然pH,分别以3%接种量接种,在40 ℃厌氧的条件下培养20 h,发酵结束后检测葛根总黄酮和乳酸菌EPS,选择葛根总黄酮和乳酸菌EPS含量最高的菌株为本试验的发酵菌株。
脱脂乳:葛根液分别按照1∶1、1∶2、2∶1(V/V)配制培养基,自然pH。将上述确定的菌株以3%的接种量分别接种于各培养基,在40 ℃厌氧条件下培养30 h,间隔5 h取样涂布于平皿上计数,同时测定发酵液pH值,绘制各培养基中乳酸菌的生长曲线,确定培养基的组分。
1.3.3 葛根发酵乳发酵条件优化单因素试验
确定其他因素不变,进行单因素试验,每一个单因素所得出的结果用于后续试验。分别调整发酵温度为25 ℃、30 ℃、35 ℃、40 ℃、45 ℃;发酵液初始pH值为5.7、6.1、6.3、6.6、6.9;接种量为1%、2%、3%、4%、5%;葡萄糖添加量为0.5%、1.0%、1.5%、2.0%、2.5%;发酵时间为14 h、17 h、20 h、23 h、26 h。测定发酵结束后的葛根总黄酮和EPS含量。
1.3.4 葛根发酵乳发酵条件优化响应面试验
在单因素试验的基础上,以葛根总黄酮(Y1)和EPS含量(Y2)为响应值,选取影响较大的因素即发酵温度(X1)、发酵时间(X2)和葡萄糖添加量(X3)设计响应面优化试验,因素与水平如表1。
表1 葛根发酵乳发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for fermentation conditions optimization of fermented pueraria-milk

1.3.5 测定方法
总黄酮测定方法:分光光度法[17];胞外多糖(EPS)测定方法:硫酸-苯酚法[18]。生长曲线测定方法:间隔5 h取样涂布于MRS固体培养皿上计数;pH值测定方法:用pH计测定发酵液pH。
1.3.6 统计分析
采用SAS9.2统计软件分析其响应面回归数据及因素方差分析。
2 结果与分析
2.1 发酵菌株的确定及生长曲线测定
2.1.1 发酵菌株的确定
将筛选的一株德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)和一株唾液链球菌嗜热亚种(Streptococcus salivarius subsp.thermophilus)分别发酵和1∶1组合发酵,测得葛根总黄酮和EPS含量如表2所示。由表2可,嗜热链球菌(S.t)的葛根总黄酮和EPS含量相对较高。因此,将其作为发酵菌株。
表2 各菌株发酵液中总黄酮和胞外多糖产量
Table 2 Yield of total flavonoids and exopolysaccharides in fermentation broth of each strain

2.1.2 培养基确定及乳酸菌生长曲线的测定结果
由图1、2、3可知,脱脂乳∶葛根液为1∶2(V/V)时,乳酸菌活菌数在15 h左右>0.4×109个/mL,而其他两组培养基,乳酸菌在整个发酵期间内活菌数均<0.4×109个/mL。发酵液pH在发酵中后期几乎保持稳定。所以培养基中脱脂乳与葛根液比例为1∶2(V/V)时,嗜热链球菌生长最好。
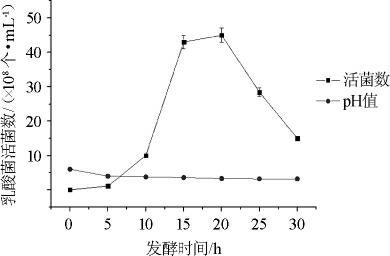
图1 脱脂乳∶葛根体积比1∶2时pH变化及嗜热链球菌生长曲线
Fig.1 pH change and growth curve of Streptococcus thermophilus cultured with skim milk and pueraria volume ratio 1∶2
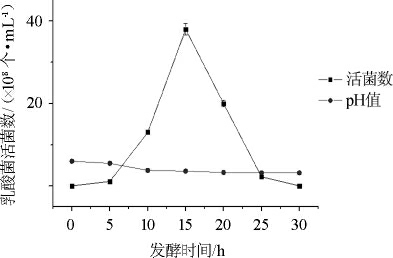
图2 脱脂乳∶葛根体积比1∶1时pH变化及嗜热链球菌生长曲线
Fig.2 pH change and growth curve of Streptococcus thermophilus cultured with skim milk and pueraria volume ratio 1∶1
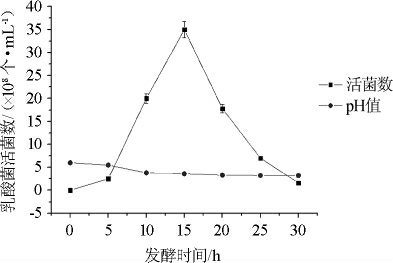
图3 脱脂乳:葛根体积比2:1时pH变化及嗜热链球菌生长曲线
Fig.3 pH change and growth curve of Streptococcus thermophilus cultured with skim milk and pueraria volume ratio 2:1
2.2 葛根发酵乳发酵条件的优化
2.2.1 发酵温度对葛根发酵乳的影响
由图4可知,随发酵温度升高,葛根总黄酮和EPS含量均是先增后减,在40 ℃时达到最高。葛根总黄酮含量最高达1.60 mg/mL,EPS含量最高达0.120 mg/mL。通过单因素差异显著性分析得到发酵温度对葛根总黄酮含量的影响显著性P1=0.000<0.01,温度对EPS含量的影响显著性P2=0.000<0.01,说明发酵温度对葛根发酵乳发酵影响极显著。
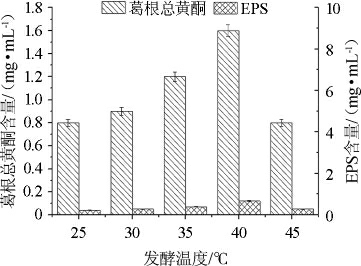
图4 发酵温度对发酵液中葛根总黄酮和胞外多糖含量的影响
Fig.4 Effect of fermentation temperature on total flavonoids and exopolysaccharides content in fermentation broth
2.2.2 初始pH值对葛根发酵乳的影响
由表3可知,发酵液初始pH值对葛根总黄酮含量的影响不大,尤其是在6.0~6.9变化时,葛根总黄酮最终含量差距甚微。不同的初始发酵液pH值,其胞外多糖最终含量差距较大,且初始pH值为6.3时,对嗜热链球菌胞外多糖的合成比较有利。通过单因素差异显著性分析得到初始pH值对葛根总黄酮含量的影响显著性P1=0.06>0.05,初始pH值对EPS含量的影响显著性P2=0.051<0.05,说明初始pH值对葛根发酵乳发酵的影响不显著。
表3 不同初始pH值对发酵液中葛根总黄酮和胞外多糖含量的影响
Table 3 Effect of different initial pH on total flavonoids and exopolysaccharides content in fermentation broth

2.2.3 接种量对葛根发酵乳的影响
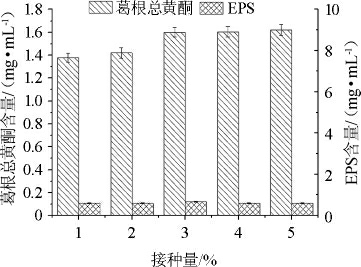
图5 不同接种量对葛根总黄酮和胞外多糖含量的影响
Fig.5 Effect of different inoculum on total flavonoids and exopolysaccharides contents in fermentation broth
由图5可知,葛根总黄酮含量随乳酸菌添加量的增加而逐渐升高。乳酸菌接种量为3%、4%、5%时,葛根总黄酮含量几乎保持不变,含量依次为1.50 mg/mL、1.51 mg/mL、1.57 mg/mL。EPS含量随着乳酸菌接种量的增加先升高后基本保持稳定,接种量为3%时,EPS含量最大,达到0.120 mg/mL。虽然乳酸菌接种量5%时的葛根总黄酮含量略高,但从节约成本角度讲,选择乳酸菌接种量为3%。
通过单因素差异显著性分析得到接种量对葛根总黄酮含量的影响显著性P1=0.1>0.05,接种量对EPS含量的影响显著性P2=0.052>0.05,说明接种量对葛根发酵乳发酵的影响不显著。
2.2.4 葡萄糖添加量对葛根发酵乳的影响
很多研究表明,当乳酸菌以葡萄糖为碳源时可以得到最高的胞外多糖产量[19-20]。因此探究葡萄糖添加量对其EPS和葛根黄酮含量也很重要。葡萄糖添加量为添加的葡萄糖质量占葛根脱脂乳质量的百分数。
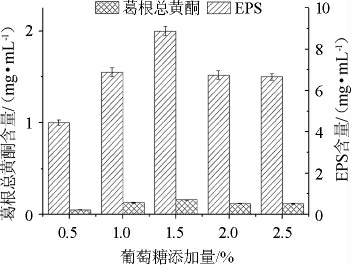
图6 葡萄糖添加量对葛根总黄酮和胞外多糖含量的影响
Fig.6 Effect of glucose addition on total flavonoids and exopolysaccharides contents in fermentation broth
由图6可知,随着葡萄糖添加量的增加,EPS和葛根总黄酮含量均是先上升后下降,且葡萄糖添加量为1.5%时,两者含量都达到最大值,分别为2.00 mg/mL和0.160 mg/mL。通过单因素差异显著性分析得到葡萄糖添加量对葛根总黄酮含量的影响显著性P1=0.004<0.01,葡萄糖添加量对EPS含量的影响显著性P2=0.000<0.01,说明葡萄糖添加量对葛根发酵乳发酵的影响极显著。
2.2.5 发酵时间对葛根发酵乳的影响
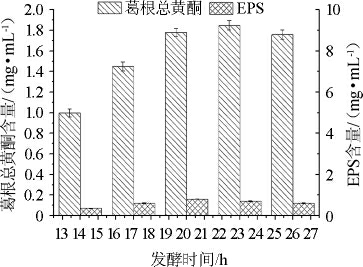
图7 发酵时间对葛根总黄酮和胞外多糖含量的影响
Fig.7 Effect of the fermentation time on total flavonoids and exopolysaccharides contents in fermentation broth
由图7可知,葛根总黄酮含量和EPS含量在发酵时间为14~26 h之间都先上升后降低,在发酵20 h后保持平缓的趋势。发酵时间为20 h时,葛根总黄酮含量为1.78 mg/mL,EPS含量达到最大为0.160 mg/mL。葛根总黄酮在23 h达到最大为1.85 mg/mL,此时EPS含量为0.160 mg/mL。通过单因素差异显著性分析得到发酵时间对葛根总黄酮含量的影响显著性P1=0.012<0.05,发酵时间对EPS含量的影响显著性P2=0.000<0.01,说明发酵时间对葛根发酵乳发酵的影响显著。
2.2.5 Box-Behnken试验设计及回归分析
由单因素试验可知,发酵温度、发酵时间、葡萄糖添加量对EPS和葛根总黄酮含量影响较大,因此选此3因素进行响应面优化试验,再根据各因素的试验结果选取3个水平。
Box-Behnken试验结果与分析见表4,方差分析见表5和表6。
表4 Box-Behnken试验设计及结果
Table 4 Design and results Box-Behnken experiments

表5 以葛根总黄酮为评价指标的响应面试验方差分析
Table 5 Variance analysis of response surface using total flavonoids of pueraria as evaluation index

表6 以胞外多糖为评价指标的响应面试验方差分析
Table 6 Variance analysis of response surface using exopolysaccharides of pueraria as evaluation index

2.2.6 葛根总黄酮含量的响应面分析
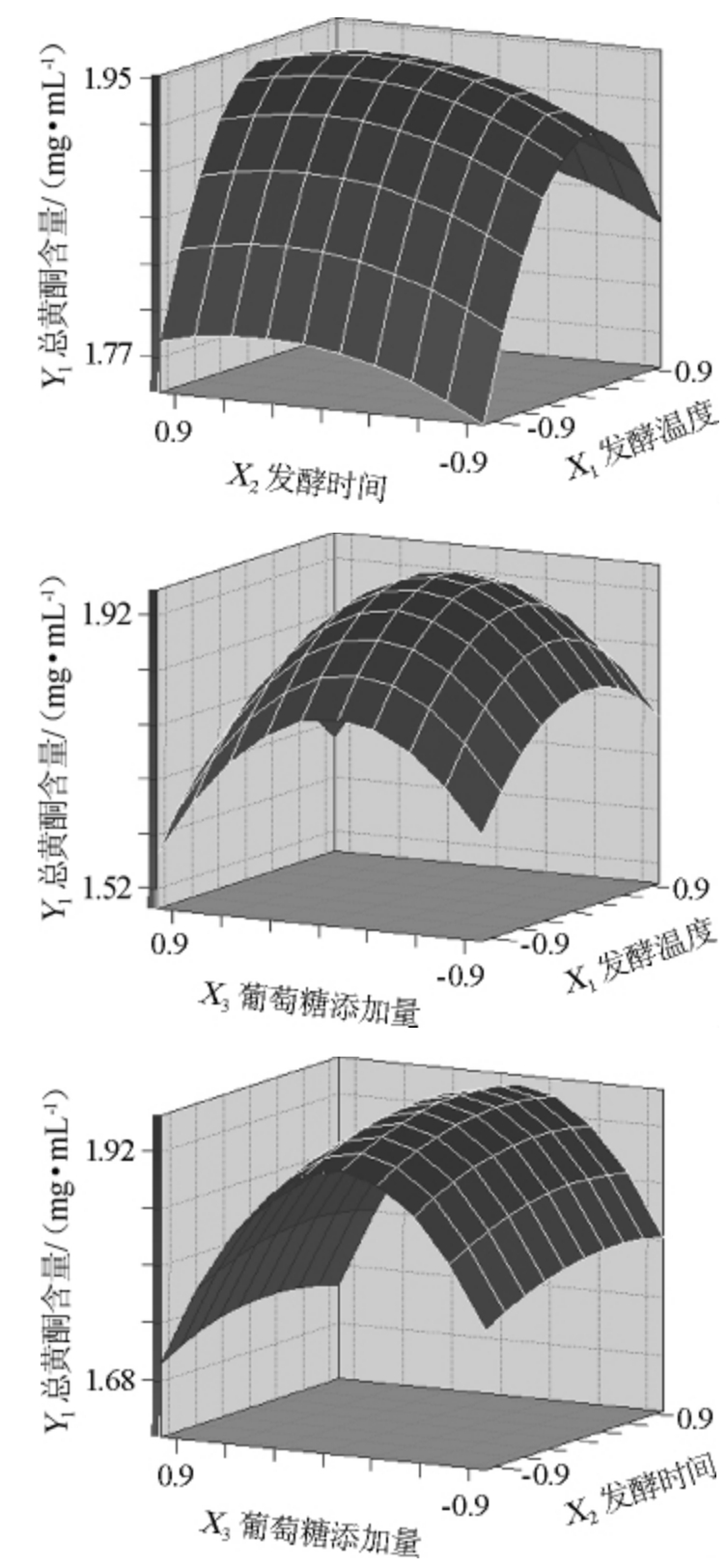
图8 发酵温度、发酵时间、葡萄糖添加量交互作用对葛根总黄酮含量影响的响应曲面及等高线
Fig.8 Response surface and contour line of effects of interaction between fermentation temperature,time and glucose addition on total flavonoids contents of pueraria
由图8可知,当葡萄糖添加量为1.5%时,随着温度的升高,葛根总黄酮含量先升后降,当温度为40.29 ℃,培养时间为22.68 h时,葛根总黄酮含量最大。X2=22 h时,X1在37~40.29 ℃范围内,X3=1.41%时,葛根总黄酮含量最大。X1=40 ℃时,葡萄糖添加量<1.41%时,葛根总黄酮含量随时间的延长先增大后减少,在培养时间为22.68 h时最大。
采用SAS9.2统计软件分析,得X1=0.0932 5,X2=0.223 67,X3=-0.179 83为最优水平代码,即最佳发酵条件为:葡萄糖添加量为1.4%,发酵时间22.68 h,发酵温度40.29 ℃,理论上葛根总黄酮的产量为1.959 478 mg/mL。进行验证试验,采用响应面分析得出的最优条件进行发酵试验,设三个平行试验,葛根总黄酮的平均值为1.95 mg/mL,与理论预测值误差较小。
2.2.7 胞外多糖含量的响应面分析

图9 发酵温度、发酵时间、葡萄糖添加量对胞外多糖含量影响的响应曲面及等高线
Fig.9 Response surface and contour line of effects of interaction between fermentation temperature,time and glucose addition on exopolysaccharides contents of pueraria
由图9可知,X3=1.5%时,温度在37~38.7 ℃范围内,当培养时间为19.8 h时,胞外多糖产量最大。当温度超过38.7 ℃时,其响应面曲线呈现陡峭趋势,随着温度的升高,胞外多糖含量降低。当温度超过38.7 ℃时,乳酸菌细胞增殖快。而合成细胞壁和EPS都需要消耗磷酸类异戊二烯[21-22],因此EPS的含量就会随之降低。X2=22 h时,X3在1%~1.38%范围内,温度高为38.7 ℃时,EPS的含量最大。当X3>1.38%时,EPS的含量急剧降低,这是因为X3>1.38%时,嗜热链球菌的生长和代谢由于葡萄糖效应的产生而受到了抑制[21]。当X1=40 ℃时,X3在1%~1.38%范围内,随着X2增大,EPS含量逐渐增大,当X2=25 h左右达到最高值。
葡萄糖添加量和温度对EPS含量的影响要大于培养时间的影响。经分析,得到最优化水平代码X1=-0.456 37,X2=-0.735 87,X3=-0.233 59,即葡萄糖添加量为1.38%,培养温度38.7 ℃,发酵时间19.8 h,理论上EPS产值可达0.159 69 mg/mL。进行验证试验,采用响应面分析得出的最优条件进行发酵试验,设三个平行试验,EPS含量为0.155 mg/mL,与理论预测值误差较小。
2.2.8 嗜热链球菌发酵条件的综合分析
从表5、表6中可知,发酵温度F1(20)<发酵温度F2(98),葡萄糖添加量F1(174)<葡萄糖添加量F2(288),由此可知,这两个因素对EPS产率的影响大于对葛根总黄酮的影响。综合考虑,确定葡萄糖添加量为1.4%,发酵温度为39 ℃。由表5可知,发酵时间的P>0.05,即发酵时间对葛根总黄酮影响不显著,因此选择较短的时间20 h。
添加1.4%的葡萄糖,在39 ℃发酵唾液链球菌嗜热亚种20 h,发酵结束后测定葛根总黄酮和EPS含量,分别为(1.91±0.1)mg/mL、(0.155±0.02)mg/mL。
3 结论
试验从酸乳中筛选获得一株产胞外多糖的嗜热链球菌,且脱脂乳和葛根糖化液体积比例为1∶2时,此菌生长情况最好,这可能是葛根中含有对嗜热链球菌生长具有促进作用的某种生长因子。嗜热链球菌的最佳发酵条件:发酵温度为39 ℃,发酵时间为20 h,葡萄糖添加量为1.4%。在此优化条件下,葛根发酵乳总黄酮含量为1.91 mg/mL,EPS含量为0.155 mg/mL。
[1]卜雕雕,张丹,王昌利.响应面法优化药对葛根-川穹提取工艺[J].辽宁中医药大学学报,2019,(4):54-57.
[2]张艳君,吴宏辉,张海燕,等.法测定葛黄汤中葛根素含量[J].临床医学文献电子杂志,2019,6(24):180-180.
[3]赵花,宁科迪,魏建华,等.葛根有效成份提取新工艺研究[J].人参研究,2019,(1):31-33.
[4]BRAQUET P.The ginkgolides potent platelet activating factor antagonists isolated from Ginkgo biloba L.[J].Grags Future,1987,12(7):643-643.
[5]张慧丽.复方嗜酸乳杆菌片联合蒙脱石散治疗秋季腹泻患儿的临床疗效[J].中国药物经济学,2019,14(4):84-86.
[6]ZHAO R,DUAN G,YANG T,et al.Purification,characterization and antibacterial mechanism of bacteriocin from Lacidophilus XH1[J].Trop J Pharmaceut Res,2015,14(6):989-995.
[7]杨天佑,段改丽,赵瑞香,等.嗜酸乳杆菌细菌素的生物学特性[J].食品科学,2013,34(17):197-200.
[8]AHMED Z,WANG Y P,CHENG Q L,et al. Lactobacillus acdophilus bacteriocin,from production to their application:an overview[J].Afr J Biotechnol,2010,9(20):2843-2850.
[9]张娜娜,刘洋,等.乳酸菌饮料中嗜酸乳杆菌的实时荧光定量PCR 检测方法[J].食品科学,2019,40(8):27-32.
[10]HE D N,ZHU H M,LAI W D.Influence of active Lactobacillus beverage on intestinal flora of human[J].Chinese J Microecol,2006,18(6):454-456.
[11]李成涛,吕嘉枥.乳酸菌及其发酵乳制品的发展趋势[J].中国酿造,2005,24(8):5-7.
[12]闫肃,吕嘉枥,郜洪涛.乳酸菌在食品工业中的应用[J].中国酿造,2010,29(12):1-3.
[13]单尹佩,徐波.我国乳酸菌饮料产业化现状及发展策略[J].科技广场,2011(12):72-75.
[14]杨建珍,王浩.蜂胶保健食品中总黄酮测定方法研究[J].中国自然医学杂志,2007,9(4):349-349.
[15]黄诚,尹红,周长春,等.葛根酸乳加工工艺优化[J].食品科学,2010,31(12):297-300.
[16]马静,裴家伟,吴荣荣,等.影响乳酸菌胞外多糖产量的因素研究[J].中国乳品工业,2003,31(5):12-16.
[17]杨建珍,王浩.蜂胶保健食品中总黄酮测定方法研究[J].中国自然医学杂志,2007,9(4):349.
[18]顾瑞霞.乳酸菌EPS 生物合成及生理功能特性的研究[D].哈尔滨:东北农业大学,2000.
[19]钟颜麟,彭志英,赵谋明.乳酸菌胞外多糖的研究[J].中国乳品工业,1999(4):7-10.
[20]顾瑞霞,张文.乳酸菌胞外多糖的研究进展[J].中国乳品工业,1999(2):43-46.
[21]步洪强.结核分枝杆菌DXS 和DXR 抑制剂高通量筛选模型的建立与应用[D].北京:北京协和医学院,2014.
[22]赵玉臣,王迎俊,王忠凤.乳酸菌胞外多糖[J].中国乳业,2003(4):32-35.
[23]刁虎欣,赵大健.细菌胞外多糖生物合成多水平调控[J].微生物学杂志,1990(z1):136-141.