保健酒在中国已有数千年历史。随着科学技术的进步,保健酒的制备工艺从中药浸酒的传统工艺发展到利用萃取、浸提和生物工程等现代化手段,提取中药中的有效成份制成高含量的功能药酒。药酒的品种也越来越多,生产者将酒与人参、鹿茸、海马、牛鞭等中药及动植物相结合,制成声称具有强身健体、缓解疲劳的保健酒。但近年来媒体陆续报导有不法商家向保健酒中非法添加西地那非等5型磷酸二酯酶(phosphodiesterase-5)抑制剂及其衍生物,以达到壮阳、滋补、强身、保健等功效[1-2]。
国家已规定严禁向食品中添加那非类物质,误食那非类药物易引起一定的不良反应,如头痛、消化不良、肌肉疼痛、鼻塞、皮疹和视觉障碍等症状,尤其是心血管疾病和糖尿病患者若长期误食甚至会造成突然死亡[3]。为更加全面地保护消费者的健康安全,国家监管部门自2006年至今相继颁布了8个关于那非类物质补充检验方法[4-11]。2006-2017年发布的补充检验方法检测的那非类物质为2~11种,采用的方法多为液相色谱法、液质联用法等[12]。2018年发布的BJS 201805《食品中那非类物质的测定》可同时检测90种那非类物质,采用的方法是超高效液相色谱-三重四极杆串联质谱法、超高效液相色谱-串联高分辨质谱法。除此,已有文献报道使用拉曼光谱法[13-14]、电喷雾-离子迁移谱法[15]、高效液相色谱法[16]、高效液相色谱飞行时间质谱联用法[17]、酶联免疫法[18]、超高效液相色谱静电场轨道阱高分辨质谱法[19]来测定那非类物质。
本实验建立一种适用于快速监测保健药酒中的那非类物质的残留情况的监测方法,为保健药酒中的那非类物质的监管和产品质量的控制提供技术支持。
1 材料与方法
1.1 材料与试剂
28种那非对照品(纯度均>98%):加拿大TRC公司(见表1);甲醇、乙醇、乙腈(均为色谱级):德国Merck公司;N-丙基乙二胺(primary secondary amine,PSA)、C18和石墨化碳黑(graphitized carbon blacks,GCB)吸附剂:美国Agilent公司;超纯水(18.2 MΩ):由Millipore纯水仪制备;保健酒样品:市售。
表1 28种那非类物质标准品的信息
Table 1 Information of 28 nafils substances standard
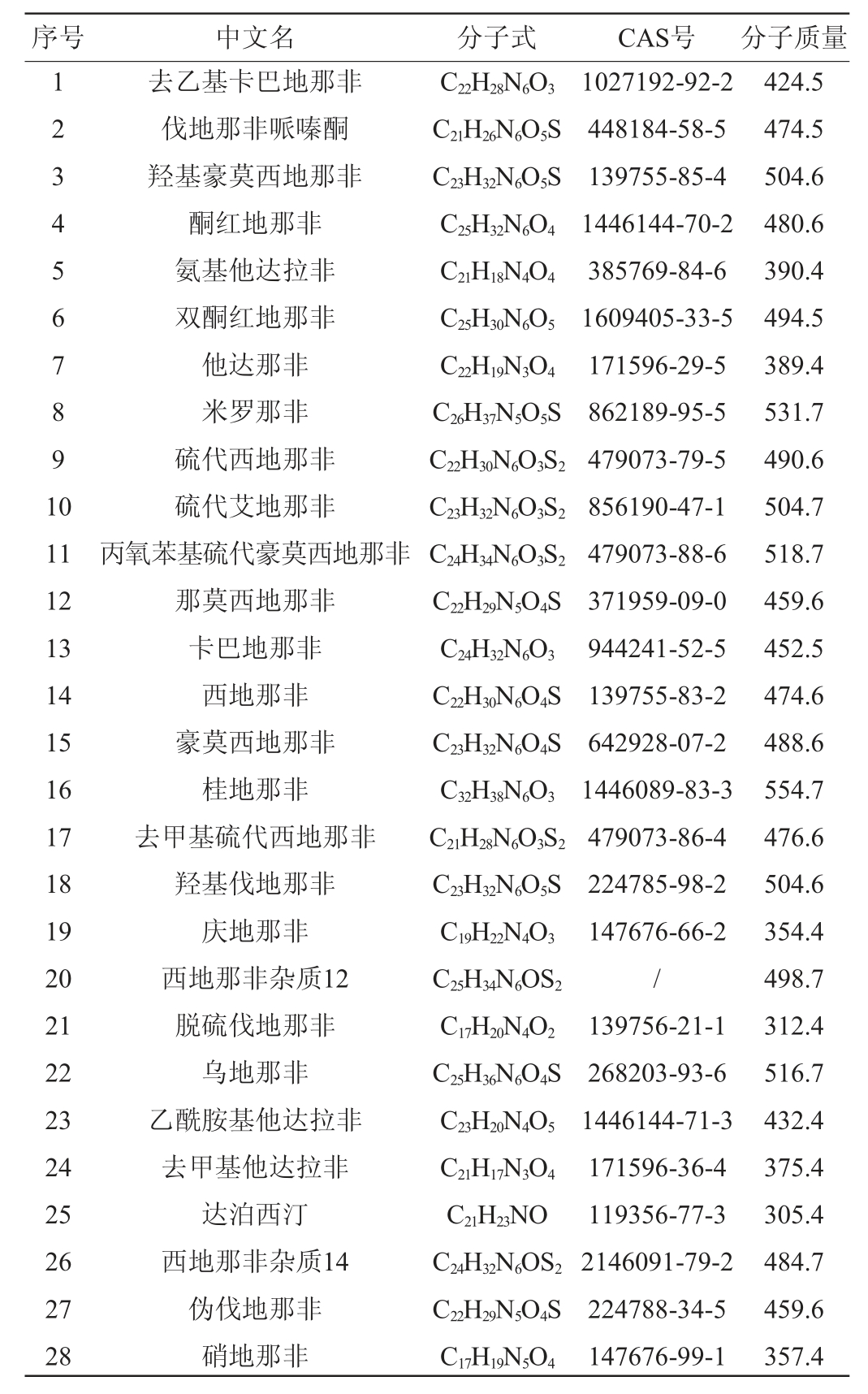
注:“/”表示无CAS号。
1.2 仪器与设备
U 3000高效液相色谱仪、TSQ Endura三重四极杆质谱仪、Thermo Scientific Hypersil GOLD色谱柱(100 mm×2.1 mm,1.9 μm):美国Thermo Scientific公司;菲罗门Kinetex PFP色谱柱(50 mm×2.0 mm,2.6 μm):美国菲罗门公司;Waters UPLC TM BEH C18色谱柱(50 mm×2.1 mm,1.7 μm):美国Waters公司;MS2 Minshaker涡旋振荡器:德国IKA公司;3K15高速离心机:美国Sigma公司;KDC-400低速离心机:科大创新公司;KQ-500E超声波清洗器:昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 检测方法
色谱条件为色谱柱:Thermo Scientific Hypersil GOLD(100mm×2.1 mm,1.9μm);流动相:A为含0.1%甲酸的乙腈溶液,B为0.1%甲酸水溶液;流动相梯度洗脱程序:0~15 min,95%~5%B;15.1~22 min,5%B,22.1~26 min,5%~95%B;进样体积:5 μL;流速:0.30 mL/min;柱温:35 ℃。
质谱条件为离子源:电喷雾离子(electrosprayionization,ESI)源;监测方式:多反应监测(multiple reaction monitoring,MRM)模式;电喷雾电压:正离子4000V;离子源温度:333℃;雾化温度:317 ℃;鞘气流速:40 arb;辅气流速:12 arb。28种化合物相应的母离子、子离子和碰撞能量(collision energy,CE)见表2。
表2 28种化合物的母离子、子离子和碰撞能量
Table 2 Precursor ions,product ions and collision energy of 28 compounds
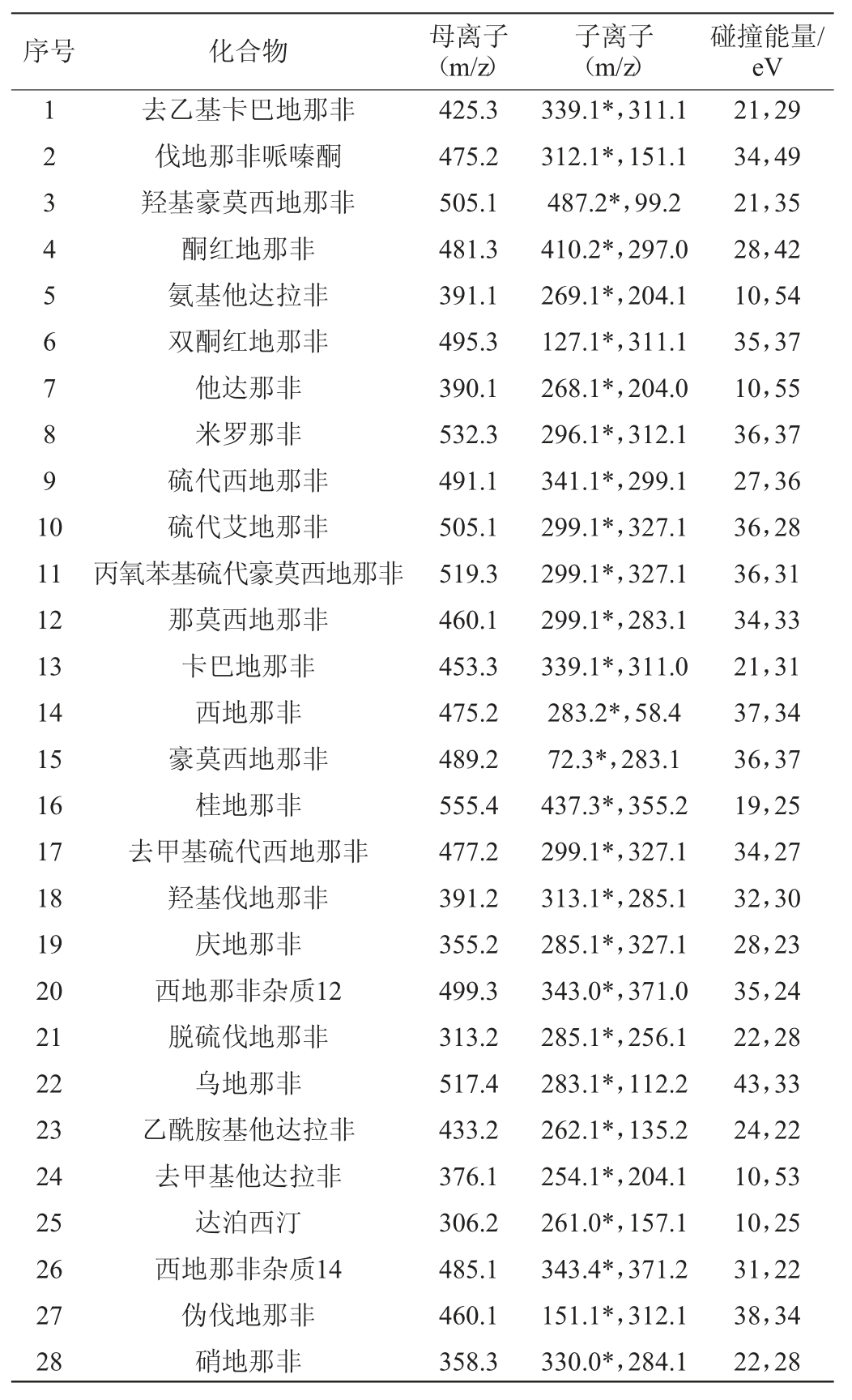
注:“*”为定量离子。
1.3.2 样品的前处理
取保健药酒样品适量摇匀,准确吸取1 mL置于50 mL容量瓶中,加适量甲醇,超声提取15min,放冷至室温,用甲醇定容后,转移到高速离心管,加入吸附剂,涡旋20 s,4 000 r/min离心2 min,取上清液过0.22 μm滤膜后,供测定。
1.3.3 标准曲线绘制
分别精密称取28种那非物质标准品,用甲醇制成质量浓度为1 μg/mL标准储备液,4 ℃贮存。分别吸取适量的标准储备液,用空白基质液逐级稀释成质量浓度分别为10 μg/L、20 μg/L、50 μg/L、100 μg/L、200 μg/L的系列混合标准溶液。
2 结果与分析
2.1 提取条件的优化
为进一步去除提取液中的干扰杂质,本实验采用分散固相萃取吸附剂进行净化,分别使用分散固相萃取吸附剂PSA、GCB、C18对提取液进行净化,并考察净化后各化合物的加标回收率,结果显示,使用吸附剂PSA时的回收率为90.3%~112.1%,使用吸附剂C18的回收率为69.9%~127.9%,而使用吸附剂GCB时,回收率很低,且各化合物的回收率差异很大。由此数据可见,使用吸附剂PSA的回收率较为理想,故选择PSA为吸附剂净化提取液。
2.2 色谱条件的优化
28种那非类物质含有极性化合物、中等极性化合物、非极性化合物,需要选择合适的色谱柱将其同时分离。本实验考察了菲罗门Kinetex PFP(50 mm×2.0 mm,2.6 μm)、Waters UPLC TM BEH C18(50 mm×2.1 mm,1.7 μm)和Thermo Scientific Hypersil GOLD(100 mm×2.1 mm 1.9 μm)3种色谱柱的分离效果。在KinetexPFP、WatersUPLCTMBEHC18色谱柱上,由于硅羟基的作用造成峰形延展拖尾严重,可能是部分那非的极性基团与色谱柱上未封尾的活性基团产生次级作用;Thermo Scientific Hypersil GOLD(100 mm×2.1 mm 1.9 μm)色谱柱对硅羟基进行双封尾,各待测化合物在色谱柱上的峰形对称,基线平稳。因此,选择Thermo Scientific Hypersil GOLD(100 mm×2.1 mm 1.9 μm)色谱柱进行后续研究。
2.3 质谱条件的优化
将质量浓度为1 μg/mL的那非类化合物单标标准溶液,在电喷雾离子源条件下分别进行正离子和负离子模式全扫描分析,28种化合物的电喷雾离子化效果均较好,均在正离子模式下获得响应最佳的准分子离子峰,并且通过选择离子监测方式分别优化每个化合物的碎裂电压,然后采用子离子全扫描分析,优化碰撞能量,经过优化,得出最佳质谱条件如“1.3.1”所述。
2.4 回归方程、线性关系、检出限、定量限及方法学考察
在优化条件下,对那非混合标准溶液进行测试。以目标化合物的峰面积(y)为纵坐标,对应的质量浓度(x,μg/L)为横坐标进行线性回归,结果见表3。由表3可知,28种化合物在10~200 μg/L范围内线性关系良好,相关系数(R2)≥0.992 0。以3倍信噪比(S/N=3)计算检出限(limitof detection,LOD),S/N=10计算定量限(limit of quantity,LOQ),得到28种那非类化合物的LOD为0.01~0.12 mg/L,LOQ为0.03~0.36 mg/L,表明本方法具有较高的灵敏度。
选取阴性的保健药酒试样,分别添加低(0.1 mg/L)、中(0.2 mg/L)、高(0.5 mg/L)3个水平的那非混合标准溶液,每个水平做6个平行样,计算加标回收率和相对标准偏差(relative standard deviation,RSD),结果见表3。
表3 28种化合物的线性关系、检出限、定量限和加标回收率及相对标准偏差
Table 3 Linear relationship,detection limits,quantitation limits,adding standard recovery rate and relative standard deviation of 28 compounds
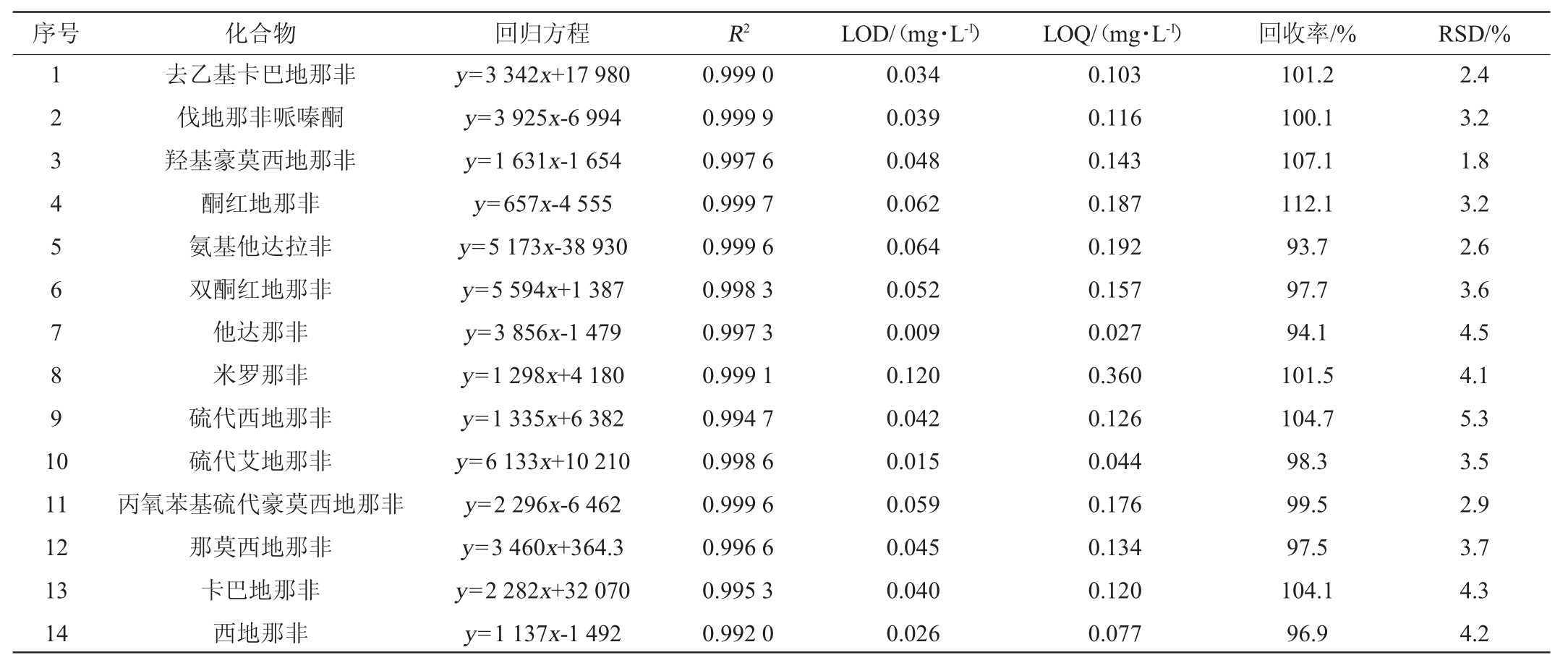
续表

由表3可知,28种化合物的平均回收率为90.3%~112.1%,相对标准偏差(RSD)为1.8%~5.3%。回收率及精密度均符合GB/T 27404—2008《实验室质量控制规范食品理化检测》[20]要求。
2.5 实际样品的检测
对市售的10批次保健药酒样品进行检测,其中6批次保健药酒检出西地那非,含量分别为0.02 mg/L、0.04 mg/L、0.06 mg/L、0.19 mg/L、0.19 mg/L、4.38 ml/L。
3 结论
本研究建立了保健酒中28种那非的分散固相萃取净化超高效液相色谱-质谱检测法,实验优化了高效液相色谱分离条件和质谱参数,优选出乙醇溶液提取和PSA净化体系。方法学评价表明该方法回收率(90.3%~112.1%)和精密度(1.8%~5.3%,n=6)良好,28种目标化合物的方法检出限在0.01~0.12 mg/L之间;定量限在0.03~0.36 mg/L之间。该方法准确、灵敏,前处理简单、适用性好,适用于快速监测保健药酒中的那非类物质的残留情况,为保健药酒中的那非类物质的监管和产品质量的控制提供了技术支持。
[1]段琼,马春艳,封淑华,等.保健酒及酒类制品中非法添加PDE-5 抑制剂及其衍生物的监测及结果分析[J].药物分析杂志,2017,37(2):277-282.
[2]李锐,陈国彪.UPLC-Q-TOF-MS 法快速检测补肾壮阳类中成药中11 个PDE5 型抑制剂类药物[J].药物分析杂质,2014,34(5):879-884.
[3]孙婷婷,徐彦宏,张雪梅,等.HPLC 法快速筛查保健酒中那非药物及质谱确证[J].食品研究与开发,2018,39(17):197-203.
[4]国家食品药品监督管理局.液质联用(HPLC/MS/MS)分析鉴定西地那非和他达那非的补充检验方法[S].北京:中国标准出版社,2006.
[5]国家食品药品监督管理局.补肾壮阳类中成药中西地那非及其类似物的检测[S].北京:中国标准出版社,2008.
[6]国家食品药品监督管理局.补肾壮阳类中成药中PDE5 型抑制剂的快速检测方法[S].北京:中国标准出版社,2009.
[7]国家食品药品监督管理总局.食药监食监三[2016]28 号附件7 缓解体力疲劳类保健食品中非法添加物质的检验方法[S].北京:中国标准出版社,2016.
[8]国家食品药品监督管理总局.BJS201601 食品中那非类物质的测定[S].北京:中国标准出版社,2016.
[9]国家食品药品监督管理总局.BJS201704 食品中去甲基他达拉非和硫代西地那非的测定高效液相色谱-串联质谱法[S].北京:中国标准出版社,2017.
[10]国家食品药品监督管理总局.BJS201710 保健食品中75 种非法添加化学药物的检测[S].北京:中国标准出版社,2017.
[11]国家食品药品监督管理总局.BJS201805 食品中那非类物质的测定[S].北京:标准出版社,2018.
[12]张长华,刘晓玲,张欣.液相色谱串联质谱分析酒类产品中他达那非等11 种非法添加药物方法研究[J].酿酒,2017,44(4):108-111.
[13]郑娟梅,余婉松等.表面增强拉曼光谱法快速测定保健酒中西地那非[J].食品安全质量检测学报,2018,9(21):5659-5665.
[14]刘元瑞,葛海生,等.薄层原位表面增强拉曼光谱法检测中成药和保健品中添加的西地那非[J].药物分析杂质,2014,34(7):1241-1246.
[15]骆和东,张璨雯,李平,等.电喷雾-离子迁移谱法快速筛查保健酒饮料中3 种壮类药物[J].中国食品卫生杂质,2016,28(3):339-343.
[16]林芳,李涛,王一欣,等.超高效液相色谱法同时测定降糖类保健食品中非法添加的13 种化学药物[J].食品科学,2016,37(18):178-184.
[17]康宁,高媛惠,高利珍.高效液相色谱-串联飞行时间质谱法检测安神类保健食品中非法添加物[J].食品与机械,2018,34(10):49-54.
[18]李瑞婷,陆建超,王弘,等.直接竞争酶联免疫吸附法用于糖浆类保健食品中西地那非检测的研究[J].食品工业科技,2014,35(24):84-88.
[19]韩志,龚蕾,等.轨道离子阱快速筛查及定量分析保健食品中73 种非法添加成分[J].食品与机械,2019,35(7):74-79,116.
[20]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27404—2008 实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.