柚子(Citrus maxima(Burm)Merr.)又名文旦,是芸香科柑橘亚科柚子属植物。柚子营养丰富,富含有机酸、维生素、矿物质、黄酮类化合物等,具有抗动脉粥样硬化[1]、降血压[2]、降血脂[3]、抗炎[4-7]、抗氧化[8-10]、抗癌[11]等作用,保健价值高。
广东省是我国柚子主产区之一,2017年仅梅州市柚子产量就达87.1万t,占我国柚产量的25%左右。梅州蜜柚果肉约占果实鲜质量的70%,酸甜多汁[12-13],目前以鲜食为主,年加工量不足产量1%,严重制约了梅州蜜柚产业的进一步发展。将柚子果肉开发成果汁比较常见,但将其加工成果醋等产品较少,且关于蜜柚果醋的研究多集中于发酵工艺的优化,对发酵过程中营养成分及品质变化的研究鲜见报道。
柚子苦味物质主要包括黄烷酮糖苷类化合物和类柠檬苦素两大类,其中类柠檬苦素的苦味阈值远低于黄烷酮糖苷类化合物[14]。研究表明[15],柑橘类水果中柠檬苦素含量极少,但是由于其前体柠檬苦素酸A环内酯(limonoate A ring lactone,LARL)的存在,榨汁时LARL从果实中溶出,在酸性条件下或加热条件下,LARL会转化为柠檬苦素,致使榨汁前不苦的果汁慢慢变苦,严重影响口感。因此,柑橘类水果发酵制果醋的生产工艺中,脱苦研究尤为关键。目前国内外报道了吸附法[16]、包埋法[17]、酶法[18]等脱苦方法,但吸附法会损失大量的营养成分,包埋法容易造成柚子产品返苦,酶法脱苦主要针对柚皮苷,对柠檬苦素无影响[18]。有研究表明[19-21],乳酸菌能降低胡柚果汁的柠檬苦素和柚皮苷的含量,肠膜明串珠菌(Leuconostoc mesenteroides)具有耐低pH和高乙醇浓度的特性,添加肠膜明串珠菌还能使酸度趋向柔和,风味得到改善。
本研究以梅州蜜柚为原料,在柚果醋发酵初始阶段将肠膜明串珠菌(Leuconostoc mesenteroides)与酿酒酵母(Saccharomyces cerevisiae)同时接入发酵罐,研究蜜柚果醋发酵过程中有机酸,黄酮类化合物及柠檬苦素的变化,探究肠膜明串珠菌对蜜柚果醋酸味,苦味等感官品质以及抗氧化能力的影响。以期为梅州蜜柚果醋的工业生产提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
梅州蜜柚:2018年10月采摘于广东梅州。肠膜明串珠菌(Leuconostoc mesenteroides):广东省微生物菌种保藏中心;BO213酿酒酵母(Saccharomyces cerevisiae):法国Laffort公司;巴氏醋酸菌(Pasteuria acetate)AS1.41:广东省微生物菌种保藏中心。
1.1.2 化学试剂
甲酸(色谱纯)、乙腈(色谱纯):德国Merck公司;圣草次苷(纯度99.26%)、柚皮苷(纯度98.06%)、野漆树苷(纯度99.61%)、芦丁(纯度98.00%)、橙皮素(纯度98.90%)、柠檬苦素(纯度98.30%)、对羟基苯甲酸(纯度99.00%)、咖啡酸(纯度99.99%)、芥子酸(纯度98.60%)、乳酸(纯度98.50%)、乙酸(纯度98.90%)、柠檬酸(纯度98.00%)标准品:上海源叶生物科技有限公司;间苯三酚(纯度98.90%):山东西亚化学股份有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
MRS肉汤培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
UV-1800型分光光度计、LC-20A高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;PB-10型pH计:德国赛多利斯公司;Uplc1290-6540BQ-TOF高效液相色谱四级杆飞行时间质谱联用仪(highperformance liquid chromatography system with quadrupole-time of flightmass spectrometer,HPLC-QTOF-MS):美国安捷伦公司;MultiskanFC多功能酶标仪:美国赛默飞世尔公司;UV1800型紫外可见分光光度计:日本岛津公司;PB-10型pH计:德国Sartorius公司;ZD-2酸碱滴定仪:上海仪电科技股份有限公司;RP-101 折光仪:日本爱宕有限公司;Infinite M200PRO酶标仪:瑞士TECAN公司;JW-1042低速离心机:安徽嘉文仪器装备有限公司;HWS电热恒温水浴锅:上海一恒科学仪器有限公司;PB-J-S02E破壁料理机:江门市贝尔斯顿电器有限公司;SPX-250B-Z型生化培养箱:上海博讯实业有限公司医疗设备厂;ZHWY恒温振荡培养器:上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 蜜柚果醋酿造工艺流程及操作要点
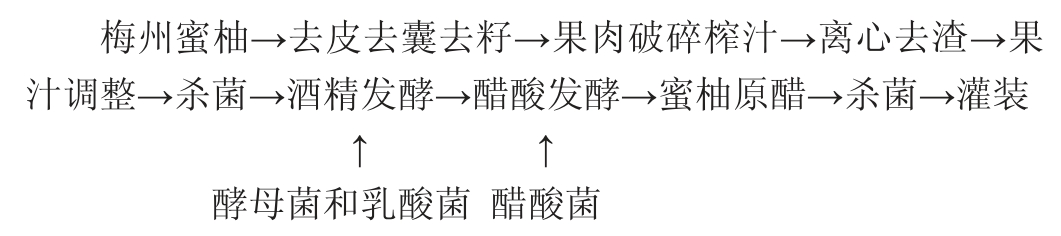
操作要点:
蜜柚汁的制备:将蜜柚去皮、去囊、去籽,果肉破碎榨汁之后,3 000 r/min离心5 min去渣,得到蜜柚果汁清汁用以发酵。
果汁成分调整[22]:用柠檬酸钠调pH到4.0,再加入蔗糖使可溶性固形物达15.0°Bx。
酵母菌的活化:根据BO213酿酒酵母推荐接种量0.3 g/L,称取0.6 g BO213酿酒酵母,加入30 mL含4%蔗糖溶液中,35~37 ℃活化20 min。
肠膜明串珠菌的活化复壮:在灭菌后的50 mL MRS肉汤中接入于-20 ℃冻藏的乳酸菌100 μL,37 ℃条件下静置培养(18±1)h。
酒精发酵:酵母活化液起泡后直接接入含2 L蜜柚果汁的发酵罐,同时接入1%活化肠膜明串珠菌于发酵罐,开始酒精发酵。另设单独酿酒酵母发酵为对照组,温度调节至(28±1)℃发酵,每隔24 h取样一次,柚果汁酒精发酵时间为48 h左右。
醋酸菌的活化:称取葡萄糖1 g,酵母粉1 g,水100 g加入三角瓶中,灭菌后加入3 mL无水乙醇及巴氏醋酸菌(Pasteuria acetate)AS1.41,置于30 ℃、150 r/min条件下振荡培养箱培养(48±1)h。
醋酸发酵:接种5%活化醋酸菌,发酵醪转入浅盘于(30±1)℃开始醋酸发酵,用多层滤布封口,24 h取样一次,检测其酒精度,发酵72 h左右得到蜜柚原醋。
杀菌:蜜柚原醋在95 ℃条件下灭菌5 min,得到成品。
1.3.2 分析检测
pH值采用pH计直接测定;总酸(以醋酸计)的测定采用直接滴定法[23];总糖采用直接滴定法[24];酒精度的测定采用酒精计;总黄酮含量的测定采用硝酸铝比色法[25];有机酸含量的测定采用HPLC法,其色谱条件:C18色谱柱(4.6 mm×250mm,5μm);柱温30℃;检测波长210nm;流动相0.1 mol/L的(NH4)2HPO4(pH2.70);流速1 mL/min;进样量10 μL;检测器为二极管阵列检测器(diode-array detector,DAD);酚类化合物的鉴定采用HPLC-QTOF-MS法,其HPLC色谱条件:C18色谱柱(100 mm×2.1 mm,1.8 μm),流动相A 乙腈,流动相B水(含0.2%甲酸),梯度洗脱程序:乙腈初始浓度为0%,10 min后升至60%,15 min时升至90%,16 min时降至10%并保持4 min。进样量5 μL,检测波长280 nm,流速:0~16 min为0.400 mL/min,到20 min时升至1 mL/min。柱温保持40 ℃。MS条件:电喷雾电离(electrospray ionization,ESI)离子源,正负离子扫描模式,毛细管电压4.5 kV;雾化器压力1.5 bar;干燥温度300℃,干燥气体流速8.0L/min,质量扫描范围100~1 100 m/z。黄酮类及酚酸类含量的测定采用HPLC法,其色谱条件分别为:Wondasil C18色谱柱(250 mm×4.6 mm,5 μm),流动相A(4%磷酸溶液),流动相B(乙腈),梯度洗脱程序如下:0~10 min,8% B;10~55 min,8%~18% B;55~55.01 min,18%~70%B;55.01~60 min,70%B,60~60.01 min,70%~8%B;60.01~66 min,8%B;每个样品之间平衡10 min,进样量10 μL,流速1 mL/min,检测波长210 nm、255 nm、287 nm、322nm;柱温35℃,外标法标曲质量浓度范围为2.5~100mg/L;Waters C18色谱柱柱(250 mm×4.6 mm,5 μm);流动相A(超纯水),流动相B(甲醇),梯度洗脱程序如下:0~10 min,40%~60%B;10~15 min,60%~80%B;15~20 min,80%~60% B;20~25 min,60%~40% B,25~30 min,40% B;每个样品之间平衡10 min,进样量10 μL,流速0.8 mL/min,检测波长330 nm、280 nm,柱温30 ℃,外标法标曲质量浓度范围为2.5~100 mg/L。
1.3.3 抗氧化活性测定
(1)清除DPPH·能力的测定
参考林羡等[26]的方法,用酶标仪测定样品在波长517 nm处的吸光度值。DPPH·清除率计算公式如下:
式中:A1为对照组吸光度值;A0为试剂空白组吸光度值;Ai为样品组吸光度值;Aj为样品空白组吸光度值。
(2)氧自由基吸收能力的测定
氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)的测定参考STEED L E等[27]的方法进行,采用Trolox为标准品,样品的ORAC值以Trolox当量(Trolox equivalent,TE)表示(μmol TE/g)。
1.3.4 感官评价
参考国标GB/T 18187—2000《酿造食醋》对蜜柚果醋进行感官评分,选取10名经验丰富的品鉴人员做蜜柚果醋的感官分析,分别从色泽,口味,气味和组织状态进行打分,以每一项平均值的总和作为醋品质综合评分[28],蜜柚果醋感官评价标准见表1。
表1 蜜柚果醋感官评分标准
Table 1 Sensory evaluation standards of pomelo vinegar

1.3.5 统计分析
数据采用统计软件SPSS17.0进行方差分析,结果以平均值±标准偏差表示,并用Origin8.5软件制图。
2 结果分析
2.1 蜜柚果醋发酵过程中总糖、酒精度、pH、总酸的变化
0~48 h为酒精发酵阶段,48~120 h为醋酸发酵阶段,发酵过程中总糖、酒精度、pH总酸的变化结果见图1。
由图1A可知,发酵前48 h混菌发酵组及对照组中总糖含量均随着发酵的进行迅速降低,分别由132.63 g/L降为4.71 g/L和10.42 g/L,结果表明,酒精发酵阶段混菌发酵组总糖消耗量较对照组要大,这可能由于肠膜明串珠菌也参与消耗总糖。发酵时间>48 h之后,总糖含量趋于稳定,发酵120 h时总糖含量分别为0.76 g/L和1.18 g/L。为了使混菌发酵组和对照组同时进行醋酸发酵,且发酵到48 h时混菌发酵组和对照组总糖基本消耗完全,酒精度也均达到最大值,因此选择在发酵48 h时同时接入醋酸菌。
由图1B可知,发酵0~48 h混菌发酵组及对照组中酒精度呈上升趋势,发酵至48h时酒精度均达到最大值,且混菌发酵组酒精度为7.87%vol,显著低于对照组的酒精度8.33%vol(P<0.05),可能由于混菌发酵组中的少量总糖被乳酸菌利用,这一部分的总糖并没有转化成酒精。发酵时间>48 h之后,醋酸菌利用乙醇产生醋酸,使混菌发酵组及对照组中酒精度呈下降趋势,发酵至120 h,混菌发酵组和对照组的酒精度分别为0.37%vol和0.10%vol,表明醋酸发酵基本结束。
由图1C可知,蜜柚果汁的最初pH值为3.97,在酒精发酵阶段(0~48 h),混菌发酵组的pH值呈上升趋势,在48 h达到4.41,可能是与混菌发酵组的柠檬酸的降解以及乳酸的增加有关,而对照组则略微下降为3.90。在醋酸发酵阶段(48~120 h),两组pH值均呈下降趋势,这是由于此阶段产生大量醋酸有关,发酵结束时,混菌发酵组和对照组的pH值分别为3.82和3.56。
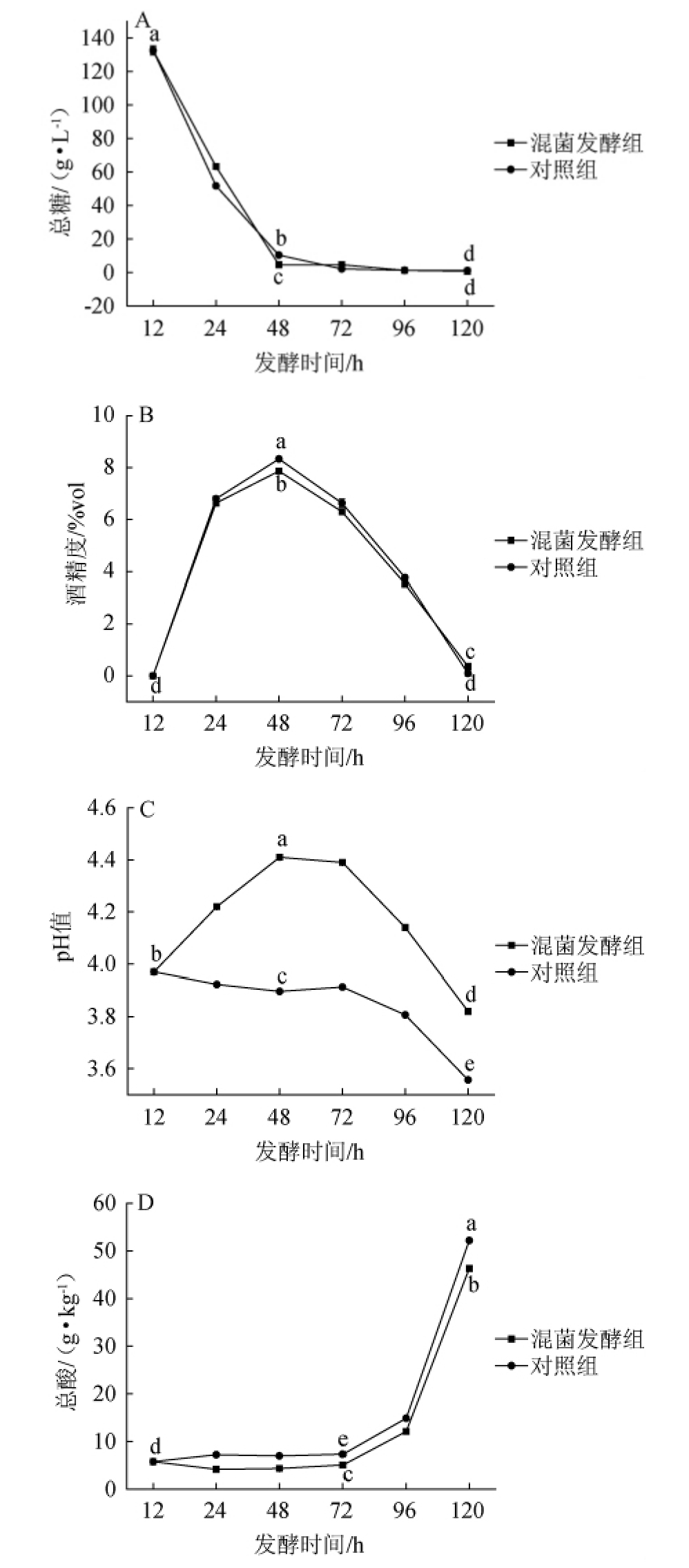
图1 不同发酵组中总糖(A)、酒精度(B)、pH值(C)和总酸(D)含量的变化
Fig.1 Changes of total sugars (A),alcohol (B),pH value (C) and total acids (D) contents in different fermentation groups
对混菌发酵组和对照组在发酵0 h(柚果汁),48 h(柚果酒),120 h(柚果醋)进行显著性分析,不同字母之间具有显著性差异(P<0.05)。下同。
由图1D可知,蜜柚果汁的初始总酸含量为5.78 g/kg,发酵0~72 h期间,混菌发酵组的总酸含量始终低于对照组,可能是由于混菌发酵组的柠檬酸被大量消耗有关。发酵72~96 h期间由于醋酸菌开始生长繁殖,消耗酒精产生醋酸,所以总酸含量开始呈现缓慢上升趋势,发酵96~120 h期间,醋酸菌大量繁殖,醋酸转化速率相应加快,所以呈现快速升高的趋势。发酵过程中总酸的变化与pH值的变化呈负相关,醋酸发酵结束时混菌发酵组和对照组的总酸含量分别达到46.30 g/kg和52.19 g/kg。
2.2 蜜柚果醋发酵过程中有机酸的变化
0~48 h为酒精发酵阶段,48~120 h为醋酸发酵阶段,发酵过程中有机酸变化结果见图2。
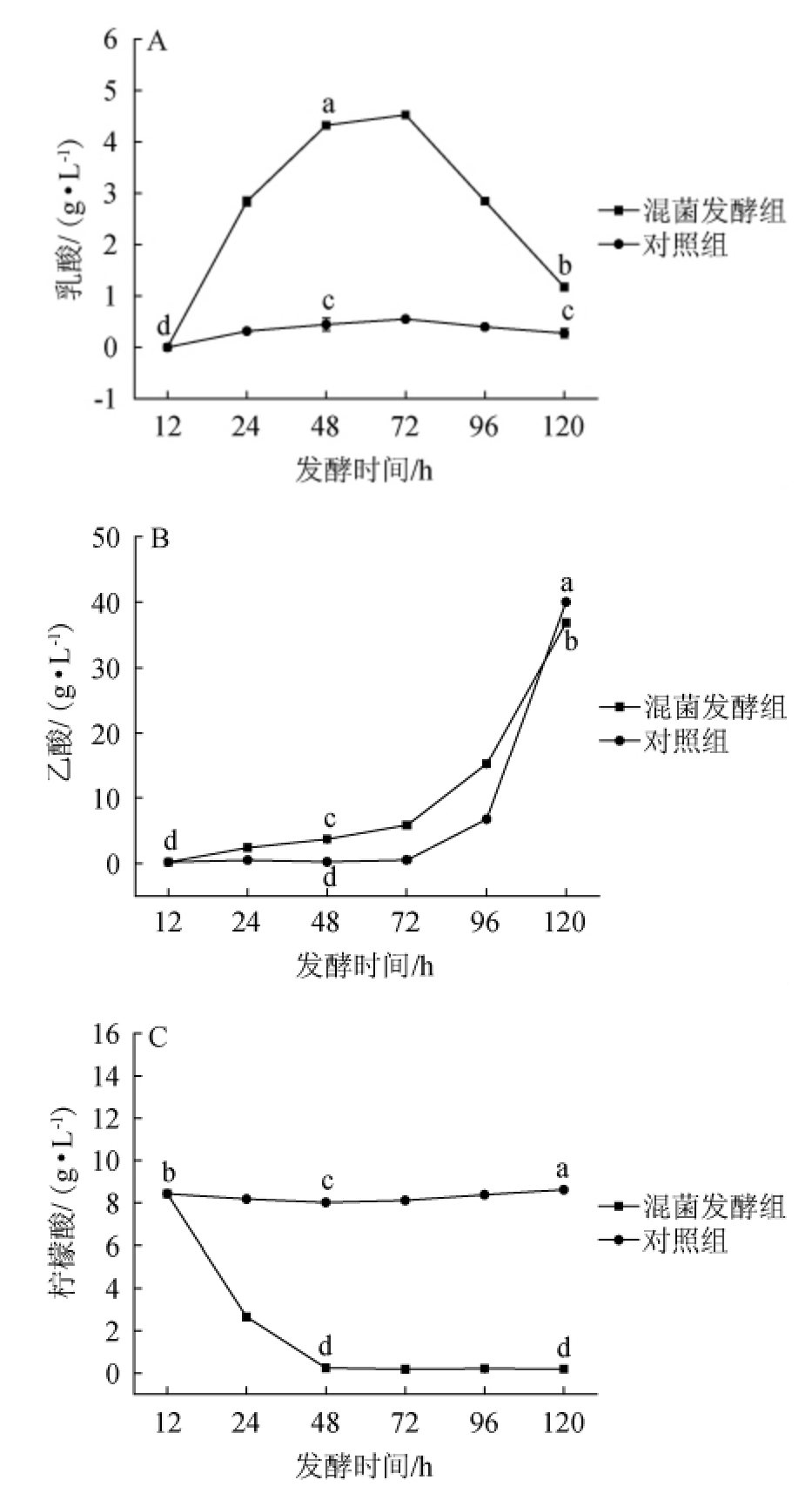
图2 不同发酵组中乳酸(A)、乙酸(B)、柠檬酸(C)含量的变化
Fig.2 Changes of lactic acid (A),acetic acid (B),citric acid (C)contents in different fermentation groups
由图2A可知,在酒精发酵期间(0~48 h),混菌发酵组的乳酸含量明显增加,在发酵时间48 h时乳酸含量升至4.32 g/L,显著高于对照组(P<0.05),发酵时间>48 h之后,乳酸含量总体呈下降趋势,发酵120 h时下降至1.17 g/L,而对照组发酵过程中乳酸含量无显著变化(P>0.05)。这可能是肠膜明串珠菌进行了柠檬酸-乳酸发酵。醋酸发酵后,混菌发酵组的乳酸含量明显降低,这可能是因为醋酸发酵过程中乳酸被氧化或与乙酸反应转化为乳酸乙酯[29]。
由图2B可知,在发酵48 h时混菌发酵组的乙酸含量显著高于对照组(P<0.05),可能由于肠膜明串珠菌在酒精发酵阶段产生乙酸;进入醋酸发酵后,两组的乙酸含量迅速增加,在发酵120 h 时,混菌发酵组和对照组的乙酸含量分别达到36.86 g/L,40.02 g/L,且混菌发酵组的乙酸含量显著低于对照组(P<0.05),这可能因为对照组酒精发酵阶段积累的酒精充分转化为乙酸,使对照组的乙酸含量最终高于混菌发酵组。
由2C可知,在酒精发酵期间(0~48 h),柠檬酸含量明显降低,在发酵48 h时,柠檬酸含量降至0.24 g/L,显著低于对照组(P<0.05),发酵48 h之后,柠檬酸含量趋于平稳。对照组发酵过程中柠檬酸含量没有下降。这可能是由于混菌发酵组的肠膜明串珠菌消耗了柠檬酸产生其他物质以及用于自身的生长消耗。
2.3 蜜柚果醋发酵过程中总黄酮,ORAC值和DPPH自由基清除能力的变化
0~48 h为酒精发酵阶段,48~120 h为醋酸发酵阶段,发酵过程中总黄酮,ORAC值和DPPH自由基清除能力的变化结果见图3。
由图3A可知,混菌发酵组和对照组的总黄酮含量整个发酵阶段均呈先下降后上升的趋势,分别在24 h和48 h开始上升,在醋酸发酵阶段呈现明显上升趋势,说明加入肠膜明串珠菌进行混菌发酵加快总黄酮的积累。发酵120 h时,混菌发酵组和对照组的总黄酮含量达到0.59 g/L和0.56 g/L,较蜜柚果汁总黄酮含量分别上升了78.79%和69.70%,且混菌发酵组总黄酮含量显著高于对照组(P<0.05)。说明醋酸发酵有利于柚果醋黄酮物质含量的增加,在发酵初期添加肠膜明串珠菌,总黄酮含量增加更为明显。
由图3B可知,对照在整个发酵过程中清除DPPH自由基能力始终呈现下降趋势,而混菌发酵组在进入醋酸发酵后的清除DPPH自由基能力逐渐上升,发酵120 h时,混菌发酵组的清除DPPH自由基能力为43.94%,显著高于对照组的40.10%(P<0.05),说明肠膜明串珠菌参与柚果醋的酿造增强了醋酸发酵阶段的清除DPPH自由基能力。
由图3C可知,混菌发酵组和对照组的ORAC值在酒精发酵期间均呈上升趋势,混菌发酵组的ORAC值在发酵48 h时达到最大值29.53 μmol TE/g,显著低于对照的33.32 μmol TE/g(P<0.05)。但进入醋酸发酵之后,由于醋酸发酵阶段应处于有氧环境,两组的ORAC值均呈现下降趋势,其中对照组下降较快,发酵120 h后,混菌发酵组的ORAC值显著高于对照组(P<0.05),这说明肠膜明串珠菌能增强了柚果醋的抗氧化能力。
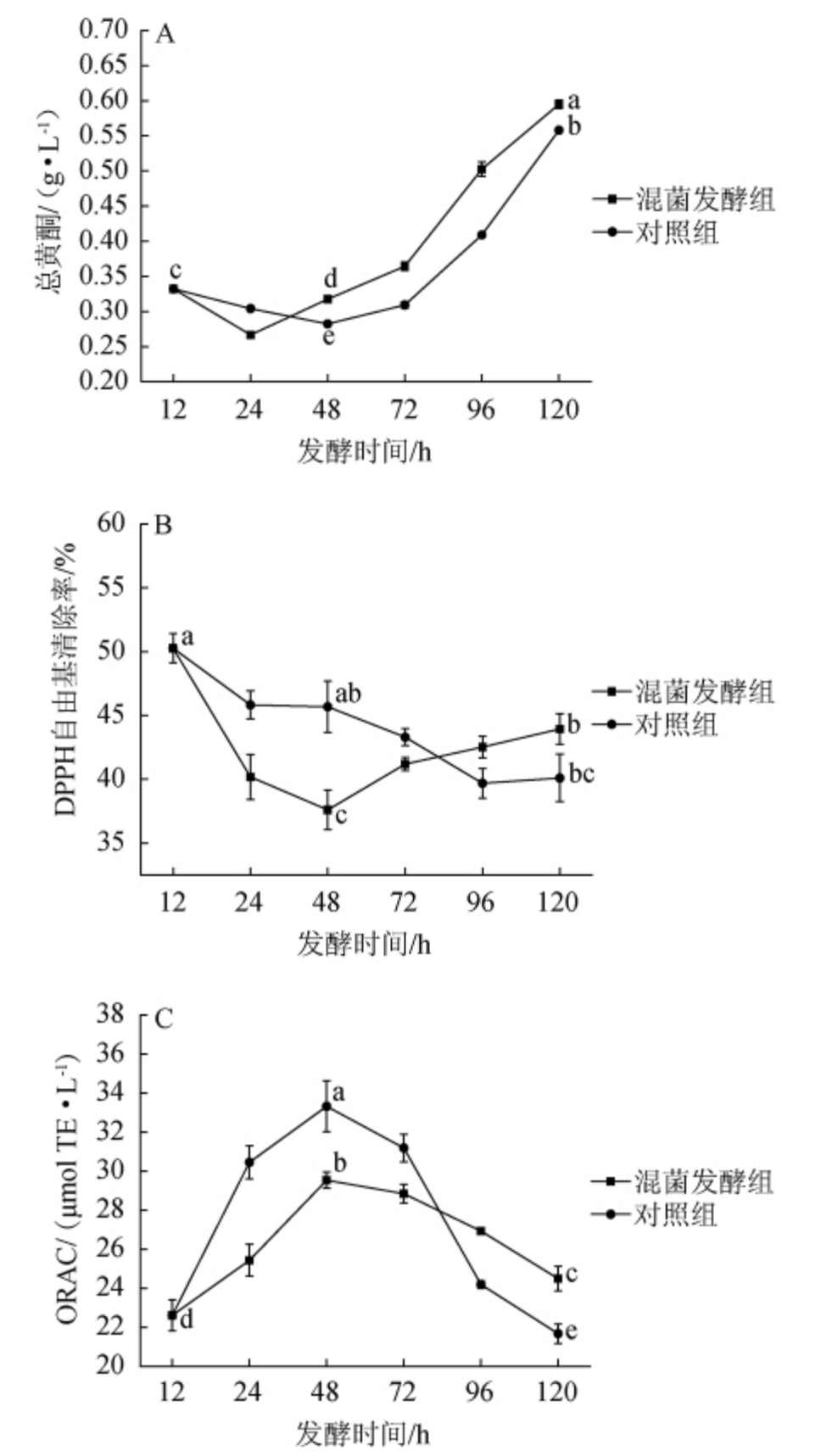
图3 不同发酵组总黄酮含量(A)、DPPH自由基清除率(B)、氧化自由基吸收能力值(C)的变化
Fig.3 Changes of total flavonoids contents (A),DPPH free radical scavenging rate (B) and oxygen radical absorption capacity value (C) in different fermentation groups
2.4 蜜柚果醋中酚类化合物
为了研究发酵对柚子多酚以及苦味成分的影响。采用HPLC-QTOF-MS法测定混菌发酵组和对照组的酚类化合物,结果见表2。由表2可知,共鉴定出9种酚类物质和1种类柠檬苦素,包括5种黄酮类化合物:圣草次苷、柚皮苷、野漆树苷、芦丁、橙皮素;4种酚酸类物质:对羟基苯甲酸、咖啡酸、间苯三酚、芥子酸;1种类柠檬苦素:柠檬苦素。
蜜柚果醋发酵过程中酚类化合物含量的变化见表3。由表3可知,柚果汁中酚类组成最少,柚果酒中新增咖啡酸,而柚果醋中新增对羟基苯甲酸和芥子酸,其中混菌发酵组醋酸发酵结束时对羟基苯甲酸含量为5.07 mg/L,显著高于对照组(P<0.05)。酒精发酵阶段,间苯三酚、野漆树苷、芦丁、橙皮素均呈上升趋势,其中混菌发酵组野漆树苷和芦丁上升较快,表明发酵初期添加肠膜明串珠菌能增加野漆树苷和芦丁的释放,而醋酸发酵阶段,对照组间苯三酚、野漆树苷、芦丁继续上升,但橙皮素则显著下降,与混菌发酵组趋势相反。上述结果表明,肠膜明串珠菌能改变柚果醋酚类化合物的组成,增加对羟基苯甲酸和橙皮素的含量,减少野漆树苷和芦丁的含量,这可能与肠膜明串珠菌和酵母菌、醋酸菌的相互作用有关,其机理尚待进一步阐明。
表2 蜜柚果醋中酚类化合物鉴定
Table 2 Identification of phenolic compounds in pomelo vinegar
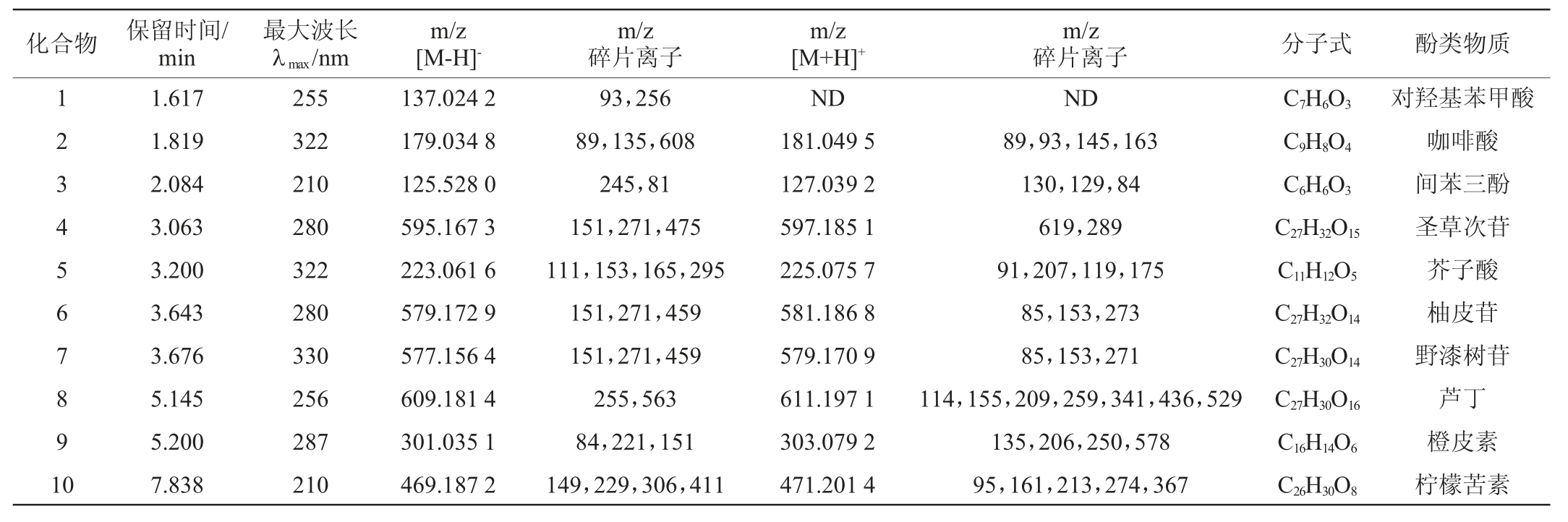
注:对羟基苯甲酸和芥子酸在发酵0 h和发酵48 h未检出;咖啡酸在发酵0 h未检出;ND表示未检出。
表3 混菌发酵组和对照组中酚类物质的含量变化
Table 3 Changes of phenolic compounds contents in mixed-strains fermentation group and control group mg/L

注:“-”表示未检出;柚果汁、柚果酒、柚果醋分别为发酵0 h,发酵48 h,发酵120 h。
柚皮苷和柠檬苦素是柚果汁中两种主要的苦味物质,常规酒精发酵和醋酸发酵对其影响较小,添加肠膜明串珠菌后,柚皮苷在酒精发酵阶段降解较多,下降幅度为38.4%,醋酸发酵阶段含量略有上升;而柠檬苦素在酒精发酵阶段略有下降,在醋酸发酵阶段下降较多,下降幅度为44.7%。以上结果表明,在柚子果醋发酵初始阶段添加肠膜明串珠菌,可起到降低柚子果醋苦味的作用。
2.5 蜜柚果醋的感官评价
蜜柚果醋的感官评价结果见表4。由表4可知,对色泽和组织状态方面,对照组的评分均高于混菌发酵组,但在统计学上并没有显著性差异(P>0.05)。另外混菌发酵组在滋味的分数显著高于对照组(P<0.05)。混菌发酵组和对照组的总分分别为82.7分和78.6分,加入肠膜明串珠菌有利于柚果醋品质的提升。混菌发酵组丰富了有机酸组成,使口感更加柔和,降低了苦味物质的含量,更容易被人接受。
表4 混菌发酵组和对照组柚果醋样品的感官评分
Table 4 Sensory scores of pomelo vinegar samples in mixed-strains fermentation group and control group

3 结论
与对照组相比,肠膜明串珠菌与酵母菌混菌发酵可消耗柠檬酸,增加柚果醋中乳酸含量,减少乙酸的刺激感;显著增加氧化自由基吸收能力(ORAC值)和1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力(P<0.05);显著提升柚果醋中总黄酮含量(P<0.05)。从柚果醋中共鉴定出9种酚类化合物和1种柠檬苦素,其发酵过程中新生成了对羟基苯甲酸,咖啡酸和芥子酸。与柚果汁相比,果醋中对羟基苯甲酸、芥子酸、咖啡酸、间苯三酚、野漆树苷、芦丁和橙皮素含量均上升,其中混菌发酵组的柚果醋中对羟基苯甲酸和橙皮素显著高于对照组(P<0.05)。此外,混菌发酵还能显著降低柚皮苷和柠檬苦素,从而降低柚果醋的苦味。以上结果可为梅州蜜柚果醋酿造工业提供一定的理论基础。
[1]BI C,JIANG Y,FU T,et al.Naringin inhibits lipopolysaccharide-induced damage in human umbilical vein endothelial cells via attenuation of inflammation,apoptosis and MAPK pathways[J].Cytotechnology,2016,68(4):1473-1487.
[2]BHARTI S,RANI N,KRISHNAMURTHY B,ARYA D S.Preclinical evidence for the pharmacological actions of naringin:a review[J].Planta Med,2014,80(6):437-451.
[3]KIM H K,JRONG T S,LEE M K,et al.Lipid-lowering efficacy of hesperetin metabolites in high-cholesterol fed rats[J].Clin Chim Acta,2003,327(1-2):129-137.
[4]LI C,SCHLUESENER H.Health-promoting effects of the Citrus flavanone hesperidin[J].Crit Rev Food Sci Nutr,2016,57(3):613-631.
[5]YI L Z,MA S S,REN D B.Phytochemistry and bioactivity of Citrus flavonoids:a focus on antioxidant,anti-inflammatory,anticancer and cardiovascular protection activities[J].Phytochem Rev,2017,16(3):479-511.
[6]KHAN M K,ZILL E H,DANGLES O.A comprehensive review on flavanones,the major citrus polyphenols[J].J Food Compos Anal,2014,33(1):85-104.
[7]SRIDHARAN B,MEHRA Y,GANESH R N,VISWANATHAN P.Regulation of urinary crystal inhibiting proteins and inflammatory genes by lemon peel extract and formulated citrus bioflavonoids on ethylene glycol induced urolithic rats[J].Food Chem Toxicol,2016,94(8):75-84.
[8]ZOU Z,XI W P,HU Y,et al.Antioxidant activity of Citrus fruits[J].Food Chem,2016,196(4):885-896.
[9]ISLAM M Z,HOQUE M M,ASIFULALAM S M,et al.Chemical composition,antioxidant capacities and storage stability of Citrus macroptera and Garcinia pedunculata fruits[J].Emirat J Food Agr,2015,27(3):275-282.
[10]YU E A,KIM G S,JEONG S W,et al.Flavonoid profile and biological activity of Korean citrus varieties(II):Pyunkyul(Citrus tangerine Hort.ex Tanaka)and overall contribution of its flavonoids to antioxidant effect[J].J Funct Food,2014,6(1):637-642.
[11]YOSHINAGA A,KAJIYA N,OISHI K,et al.NEU3 inhibitory effect of naringin suppresses cancer cell growth by attenuation of EGFR signaling through GM3 ganglioside accumulation[J].Eur J Pharmacol,2016,782(7):21-29.
[12]张怡.福建特产柚子加工及综合利用技术的研究[D].福州:福建农林大学,2009.
[13]冯翀.高透光率柚子汁加工工艺的研究[D].福州:福建农林大学,2009.
[14]STINCO C M,FERNANDEZ V R,HERNANZ D,et al.Industrial orange juice debittering:Impact on bioactive compounds and nutritional value[J].J Food Eng,2013,116(1):155-161.
[15]汪钊,何晋浙,郑裕国,等.柑桔果醋加工中柠檬苦素的微生物酶降解研究[J].中国酿造,2002,21(4):21-23.
[16]冯先桔,程绍南,陈友清,等.日产HP-20 吸附树脂在胡柚汁脱苦上的应用研究[J].浙江柑橘,2002,19(1):31-32.
[17]KONNA A,MIYAWAKI M,MISAKI M,et al.Bitterness reduction of citrus fruits by β-cyclodextrin[J].Agr Biol Chem,1981,45(10):2341-2342.
[18]PO C,FU S,YUAN T.Monitoring enzymatic debittering in grapefruit juice by high performance liquid chromatograph[J].J Food Drug Anal,2001,9(2):115-120.
[19]罗水忠,罗建平,潘利华,等.乳酸菌原位生物降解胡柚果汁中柠檬苦素的研究[J].农业机械学报,2008,39(4):87-90.
[20]张佳涛,漆叶琼,潘向辉,等.肠膜明串珠菌肠膜亚种Z_25 在苹果酒中发酵特性的研究[J].食品工业科技,2011,32(11):201-204,440.
[21]姚永红,吕兆林,林西,等.肠膜明串珠菌在苹果酒苹果酸乳酸发酵中的应用探讨[J].中国酿造,2011,30(2):53-56.
[22]YANG C,YAO H,YE B.Effects of mixed cultures of Saccharomyces cerevisiae and Lactobacillus plantarum in alcoholic fermentation on the physicochemical and sensory properties of citrus vinegar[J].LWT-Food Sci Technol,2017,84(10):753-763.
[23]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12456—2008 食品中总酸的测定[S].北京:中国标准出版社,2008.
[24]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒,果酒通用分析方法[S].北京:中国标准出版社,2006.
[25]王飞飞.重楼茎叶总黄酮的提取纯化工艺及抗氧化活性研究[J].安徽农业科学,2019,47(9):164-167.
[26]林羡,徐玉娟,肖更生,等.干燥方式对辣木叶营养活性成分、抗氧化活性及色泽的影响[J].热带作物学报,2018,39(12):2465-2472.
[27]STEED L E,TRUONG V D.Anthocyanin content,antioxidant activity,and selected physical properties of flowable purple-fleshed sweetpotato purees[J].J Food Sci,2008,73(5):215-218.
[28]WANG Z,LI T,LIU F,et al.Effects of ultrasonic treatment on the maturation of Zhenjiang vinegar[J].Ultrasonics-Sonochem,2017,39(11):272-280.
[29]MORALES M L,GONZALEZ A G,TRONCOSO A M.Ion-exclusion chromatographic determination of organic acids in vinegars [J].J Chromatogr A,1998,822(1):45-51.