中国酒曲历史悠久,用曲酿酒是国内白酒的特色之一,是固态发酵蒸馏酒的重要保障,其中包含大量不同的菌系及其产生的多种酶类。现代研究表明,白酒酒体中所含有的物质组成十分复杂,其中98%~99%约为乙醇水溶液,1%~2%为各种香味成分[1]。而正是这含量很低的香味成分决定了白酒品质的优劣。在众多的香味成分中,酯类物质对白酒风味起重要作用,如浓香型白酒(五粮液)的主要香味物质是己酸乙酯、清香型白酒(汾酒)主要香味物质为乙酸乙酯和乳酸乙酯[2]。
一般而言,酯类物质产生主要有两种途径,一种是微生物在代谢过程中本身产生酯类物质,另一种重要途径是在发酵过程中各种微生物产生的酯化酶将周围环境中的有机酸和醇类催化合成酯类物质[3]。酯化酶产生菌是具有酸醇酯化能力特殊功能的特定微生物,酯化酶产生菌大多为真菌,研究表明,将酯化力高的菌种运用在白酒中,可以明显提高白酒质量,使口感醇厚,香味浓郁。孙晓璐等[4]以中温大曲为原料,筛选出了产酯化酶犁头霉(Absidia orchidis),其酯化力达到9.32 g/L;周榆林等[5]从郎酒酒糟中筛选得到了1株耐酸产酯香枯草芽孢杆菌(Bacillus subtilis)ZP-28;宫若楠等[6]从衡水老白干酒大曲中分离筛选得到1株高酯化力毛霉8号,最高酯化力为263.55 mg/g麸曲(以乙酸乙酯计)。但是目前,由于环境和地域差异,筛选出的菌株不利于全国性推广使用。因此,高酯化力菌株的筛选具有重要的意义。
本研究以酯化力最高的梁山大曲为原料,酯化力为考察指标,从中筛选高酯化力菌株,并通过形态观察、生理生化试验及分子生物学试验对其进行鉴定,为其在优质酒的领域的应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与试剂
中温大曲(1#、2#)、中高温大曲(1#、2#):山东梁山徐坊大曲有限公司。
蛋白胨、酵母膏、牛肉膏(均为生化试剂):北京奥博星科技有限公司;氯霉素(纯度99%)、氨苄青霉素(纯度98%):上海索宝来生物科技有限公司;制霉菌素(纯度97%)、脱氧胆酸钠(纯度98%):罗恩试剂有限公司;三丁酸甘油酯(纯度95%)、乳酸石炭酸染液(纯度99%):上海阿拉丁试剂有限公司;3%聚乙烯醇(分析纯):国贸集团化学试剂有限公司;Ezup柱式真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:生工生物工程(上海)有限公司。
1.1.2 培养基
细菌培养基[7]:牛肉膏3%,蛋白胨10%,氯化钠5%,琼脂20%,蒸馏水1 000 mL,三丁酸甘油酯0.4%,制霉菌素25 μg/mL,pH 7.0~7.2。
酵母培养基[8]:酵母粉10%,蛋白胨20%,葡萄糖20%,氨苄青霉素50 μg/mL,琼脂2%,三丁酸甘油酯0.4%,蒸馏水1 000 mL,pH 6.0。
马铃薯葡萄糖琼脂(potatodextrose agar,PDA)培养基[9]:马铃薯20%、蔗糖2%、琼脂2%、三丁酸甘油酯0.4%,氯霉素25μg/mL,蒸馏水1000mL,自然pH值,脱氧胆酸钠1mg/mL。
基础发酵培养基:麸皮15 g,蒸馏水21 mL。
初筛培养基[10]:三丁酸甘油酯乳化液20%,蒸馏水980 mL,琼脂20%。
3%聚乙烯醇-三丁酸甘油酯乳化液[11]:将3%聚乙烯醇与三丁酸甘油酯以体积比4∶1的比例在高速匀浆机处理9 min。
查氏酵母膏琼脂(czapek yeast extract agar,CYA)培养基[12]:磷酸氢二钾1‰,硝酸钠3‰,氯化钾0.5‰,硫酸镁0.2‰,七水合硫酸亚铁0.01‰,酵母提取物5‰,蔗糖3%,琼脂1.5%,蒸馏水1 000 mL。
25%甘油硝酸盐琼脂(25%glycerol nitrate agar,G25N)培养基[13]:磷酸氢二钾1‰,硝酸钠3‰,氯化钾0.5‰,硫酸镁0.2‰,七水合硫酸亚铁0.01‰,酵母提取物5‰,蔗糖3%,琼脂1.5%,甘油25%,蒸馏水750 mL。
以上培养基灭菌条件均为121 ℃、20 min,抗生素均为灭菌后倒平板前加入。
1.2 仪器与设备
YXQ-LS-50SII立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;SW-CJ-2G无菌操作台:苏州净化设备有限公司;HNY-2102C恒温培养振荡器:天津欧诺仪器股份有限公司;Gzone5F抑菌圈及菌落计数测量仪:杭州讯数科技有限公司;XSP-2CA双目显微镜:上海光学仪器厂;Verity 96well聚合酶链式反应(polymerase chain reaction,PCR)仪:生工生物工程(上海)有限公司;牛津杯:上海申源科学仪器有限公司。
1.3 方法
1.3.1 大曲水分含量及酯化力的测定
分别取中温大曲(1#、2#)、中高温大曲(1#、2#)各2块,首先,将大曲置于101~105 ℃烘干,根据烘干前后质量差,计算出水分含量。然后,参照轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》[14]测定其酯化力,选取酯化力高的大曲进行菌株的筛选。
1.3.2 高酯化力菌种的分离纯化取曲粉2 g,加入18 mL无菌水,30 ℃、200 r/min条件下振荡2 h,静置30 min。吸取0.5 mL曲液到4.5 mL无菌水中进行稀释,按10倍系列梯度稀释至10-5,吸取200 μL稀释度为10-3~10-5的稀释曲液,均匀涂布于3种固体培养基(细菌培养基、酵母培养基、PDA,每种培养基做3个平行)中,细菌置于37 ℃恒温箱中培养48 h,酵母置于28 ℃培养48 h,霉菌置于30 ℃培养箱培养5 d。从长好的平板上挑取不同的菌落于相应平板上分离后,再进行多次纯化,直至平板培养基上为单菌落。
1.3.3 高酯化力菌种的筛选
(1)初筛
从平板上挑取一环生长良好的菌种(细菌和酵母)接入相应的液体培养基试管中,于相应温度、180 r/min条件下培养24 h,即为粗酶制剂,霉菌直接制作孢子悬浮液即可。于初筛培养基中放入3~4个牛津杯,分别取粗酶制剂100 μL加入牛津杯中,于相应的温度下培养,观察孔周围是否会有透明圈以及透明圈的大小,用抑菌圈测量仪测出透明圈直径(D)及菌落直径(d),计算D/d值。选择D/d值大的菌株进一步复筛。
(2)复筛
将初筛获得的菌株制成孢子悬浮液(5.7×107个/mL),将孢子悬浮液以10%(V/V)接种量接入基础发酵培养基中,30 ℃条件下培养6~7 d,于35~40 ℃的烘箱中烘干,粉碎,保存备用。取5 g菌粉,参照QB/T 5188—2017《酿造红曲》[15]测定菌株的酯化力。
1.3.4 高酯化力菌种的鉴定
(1)形态学鉴定
菌落形态观察:采用点种法将菌株分别接种于PDA培养基、CYA培养基和G25N培养基,30 ℃培养4 d,每天观察菌落的颜色、形状、菌丝情况。显微形态观察:在载玻片上滴加一滴生理盐水,用接种针挑取少量菌丝置于生理盐水中,缓慢烘干,滴加一滴乳酸石炭酸棉兰染液,染色2 min,盖上盖玻片,置于光学显微镜下观察菌株的菌丝结构、孢子、闭囊壳与子囊孢子的大小。
(2)生理生化鉴定
碳源同化实验[16]:分别采用麦芽糖、果糖、乳糖、蔗糖、阿拉伯糖替代PDA培养基中的葡萄糖,取100 μL孢子悬浮液接种于平板中,30℃条件下培养3~4d,观察菌株的生长状况。
氮源同化实验[16]:分别采用牛肉膏、酵母粉、尿素、豆粉、亚硝酸钾和硫脲替代PDA培养基中的蛋白胨,取100 μL孢子悬浮液接种于平板中,30 ℃条件下培养3~4 d,观察菌株的生长状况。
耐酸性实验[17]:分别调节PDA培养基的pH值为4、5、6、7、8、9、10、11,取100 μL孢子悬浮液接种于PDA培养基中,30 ℃条件下培养3~4 d,观察菌株生长状况。
耐乙醇实验[18]:在PDA培养基中分别加入3%、6%、9%、12%、15%、18%的无水乙醇,取100μL孢子悬浮液接种于PDA培养基中,30 ℃条件下培养3~4 d,观察菌株生长状况。
(3)分子生物学鉴定
用Ezup柱式真菌基因组DNA抽提试剂盒提取菌株的DNA,以其为模板,采用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。PCR扩增体系:模板0.5 μL,10×Buffer 2.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(各2.5mmol/L)1.0μL,DNA聚合酶0.2μL,上下游引物各0.5 μL,双蒸水(ddH2O)补充至25 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后送至上海生工生物有限公司测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行Blast比对,选取同源性较高的模式菌株的ITS序列,利用MEGA7软件中的邻接(neighbor joining,NJ)法构建系统发育树[19-20]。
2 结果与分析
2.1 大曲酯化力和含水量测定结果
中温、中高温大曲的含水量及酯化力测定结果见表1。
表1 大曲酯化力和含水量测定结果
Table 1 Determination results of esterification power and moisture of Daqu

由表1可知,中温大曲2#的含水量(12.30±0.23)%及酯化力(712.8±0.68)U均最高,因此,选择中温大曲2#为目标大曲。
2.2 大曲中高酯化力菌株的筛选
2.2.1 初筛
通过分离纯化后,从中温大曲2#中初步分离出3株细菌(X1~X3)、1株酵母(J1)、6株霉菌(Z1~Z6)。以三丁酸甘油酯为底物对菌株进行初筛,结果见表2。
表2 高酯化力菌株初筛结果
Table 2 Preliminary screening results of strain with high esterification power

续表
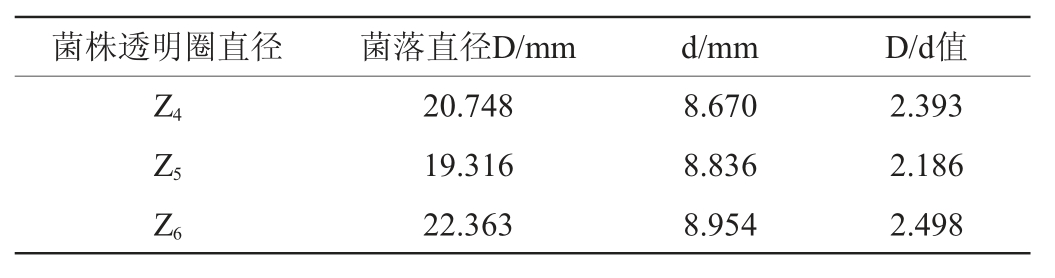
由表2可知,10株菌株的D/d值为1.555~2.686,均具有水解三丁酸甘油酯的能力,其中,霉菌的D/d值最大,选取其中D/d值较大的5株霉菌(Z1、Z2、Z3、Z4、Z6)进行复筛。
2.2.2 复筛
菌株Z1、Z2、Z3、Z4、Z6的酯化力测定结果见表3。
表3 高酯化力菌株复筛结果
Table 3 Secondary screening results of strain with high esterification power

由表3可知,菌株Z1的酯化力最高为66.943 mg/g·100 h,且高于QB/T 5188—2017《酿造红曲》规定的30 mg/g·100 h。因此,选定该菌株为目标菌株进行菌种鉴定,并编号为YL-1。
2.3 菌株YL-1的鉴定
2.3.1 形态学鉴定
(1)个体形态观察
菌株YL-1在PDA培养基、CYA培养基和G25N培养基上的菌落及菌丝形态见表4。
表4 菌株YL-1的菌落形态特征
Table 4 Colony morphological characteristics of strain YL-1

由表4可知,菌株YL-1在培养基上生长旺盛,菌丝浓密呈现白色;菌落平坦,呈圆形,直径可达到5 cm,在PDA培养基表面和背面呈现橙黄色,CYA培养基表面和背面呈橙红色,G25N培养基表面呈白色。菌株的菌丝有横隔、分枝,内含有多核,孢子主要生长在菌丝的顶端,闭囊壳呈球形,且闭囊壳内还有许多子囊,子囊也呈现为球形。结合《菌种鉴定手册》[21]初步判断该菌株为红曲霉(Monascus)。
2.3.2 生理生化鉴定
(1)碳氮源同化实验结果
菌株YL-1的碳氮源同化实验结果见表5。由表5可知,菌株YL-1可利用果糖、麦芽糖、乳糖、蔗糖、阿拉伯糖、葡萄糖,且对麦芽糖和葡萄糖的利用效果最好。菌株YL-1可利用牛肉膏、酵母粉、豆粉等有机氮源以及尿素,但不能利用硫脲、亚硝酸钾等无机氮源。
表5 菌株YL-1碳氮源同化实验结果
Table 5 Results of carbon and nitrogen source assimilation experiments of strain YL-1
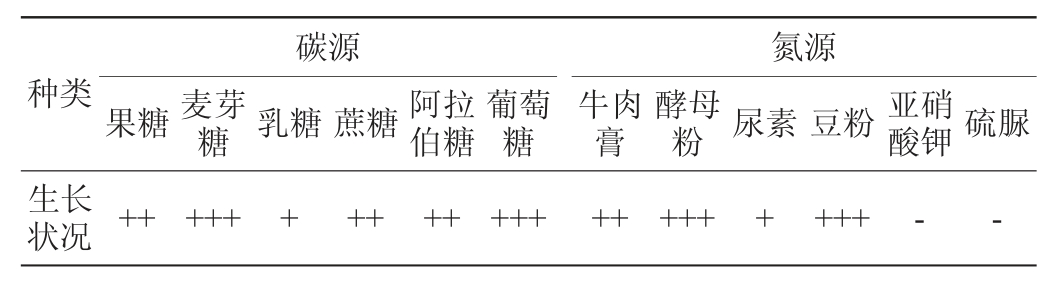
注:“+++”表示菌落生长良好,菌丝浓密;“++”表示菌落生长一般,菌丝稀疏;“+”表示平板有菌生长;“-”表示无菌落生长。下同。
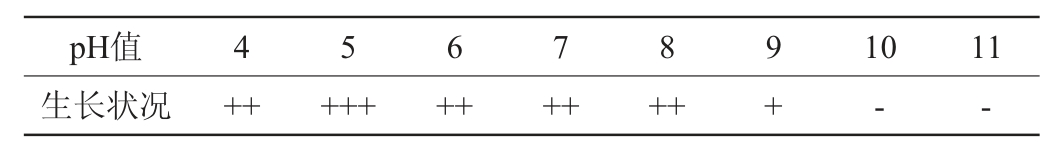
(2)耐酸性实验结果
菌株YL-1的耐酸性实验结果见表6。由表6可知,菌株YL-1具有一定的耐酸能力,在pH为4时生长状况良好,这与红曲霉嗜酸性一致[22],可判定该菌株为红曲霉(Monascus)。
表6 菌株YL-1耐酸性实验结果
Table 6 Results of acid tolerance experiments of strain YL-1
(3)耐乙醇实验结果
菌株YL-1的耐乙醇实验结果见表7。由表7可知,菌株YL-1耐乙醇能力非常高,可在15%的乙醇含量下生长。
表7 菌株YL-1耐乙醇实验结果
Table 7 Results of ethanol tolerance experiments of strain YL-1

2.3.3 分子生物学鉴定
菌株YL-1的系统发育树见图1。

图1 基于ITS基因序列菌株YL-1的系统发育树
Fig.1 Phylogenetic tree of strain YL-1 based on ITS gene sequences
由图1可知,菌株YL-1与丛毛红曲霉(Monascus pilosus)CBS 286.34(MH855520.1)及红色红曲霉(Monascus ruber)CGMCC 3.4701(MK359688.1)聚于一支,亲缘关系最近,结合形态学鉴定与生理生化鉴定,鉴定该菌株为丛毛红曲霉(Monascus pilosus)。
3 结论
本实验以梁山中温大曲为原料,筛选得到一株酯化力高的菌株YL-1,酯化力为66.94 mg/g·100 h,远高于轻工行业标准QB/T 5188—2017《酿造红曲》中规定的酯化力(30 mg/g·100 h)。通过形态学观察、生理生化实验及分子生物学鉴定,确定该菌株为丛毛红曲霉(Monascus pilosus)。
[1]徐军.浓香型枝江白酒香味成分的分析研究[D].武汉:华中农业大学,2019.
[2]贾巧唤,任石苟.浅述酸、酯、醇等成分对白酒的影响[J].食品工程,2008(4):12-13.
[3]刘宾.霉菌酯化酶作用规律及应用技术研究[D].泰安:山东农业大学,2008.
[4]孙晓璐,王明跃,张源.白酒大曲产酯化酶犁头霉的分离鉴定及产酶条件优化[J].食品与机械,2018,34(10):40-44.
[5]周榆林,陈剑,钟明叶,等.一株耐酸高酯化力细菌的鉴定及发酵条件研究[J].酿酒科技,2018(12):27-32.
[6]宫若楠,曹冉,王永芳,等.衡水老白干酒大曲分离具有酯化力霉菌及其特性研究[J].中国酿造,2017,36(11):68-72.
[7]王霜.产酱香功能芽孢杆菌的筛选及浓酱兼香型白酒复合功能强化曲的研究[D].武汉:武汉轻工大学,2017.
[8]曾超.酱香白酒酿造过程中厌氧细菌的特性研究[D].贵州:贵州大学,2016.
[9]赵吉兴,李耀,李凯.红曲霉固体发酵生产酿造增香发酵剂的研究与应用[J].中国酿造,2013,32(3):114-117.
[10]杜春迎.浓香型大曲中高产酯化酶菌株的筛选及产酶条件优化[D].哈尔滨:黑龙江大学,2012.
[11]侯小歌,张杰,孙忠科,等.大曲产酯化酶芽孢菌的分离鉴定及其发酵条件优化研究[J].轻工学报,2018,33(4):13-20.
[12]倪莉,吴智广,张雯.福建红曲中的红曲霉的生理生化特性研究[J].福州大学学报(自然科学版),2009,37(6):929-934.
[13]李志强,刘颖,林风,等.福建古田红曲生产用红曲霉菌主要种类的鉴别[J].食品与发酵工业,2017,43(5):64-69.
[14]中华人民共和国工业和信息化部.QBT4257—2011 酿酒大曲通用分析方法[S].北京:中国轻工业出版社,2011.
[15]中华人民共和国工业和信息化部.QB/T 5188—2017 酿造红曲[S].北京:中国轻工业出版社,2017.
[16]邢丽.红曲酿造发酵剂的研发与应用研究[D].济南:齐鲁工业大学,2019.
[17]汤有宏,王志强,唐林,等.大曲酯化力测定参数的探讨与优化[J].酿酒,2015,42(5):54-57.
[18]吴巧玉.高产淀粉酶红曲霉菌株的筛选鉴定、条件优化及酶学性质的研究[D].金华:浙江师范大学,2016.
[19]田慧敏,尹元.内蒙古四个毒丝盖伞形态学及rDNA-ITS 鉴定[J].食用菌,2018,40(5):9-13.
[20]徐玲玲,张丹丹,张焱.两种微生物菌肥细菌菌种分离、鉴定及活性研究[J].辽宁农业科学,2019(1):22-25.
[21]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:129-132.
[22]方跃进.红曲霉在我国白酒生产中的作用[J].中国酿造,2013,32(4):133-135.