黄瓜原名胡瓜[1],原产地为印度,是葫芦科中广泛栽培的植物[2]。黄瓜含有丰富的糖、蛋白质和维生素等人体所需的营养物质[3]。根据何念武等[4]研究发现,黄瓜具有抗衰老、美白嫩肤以及防治酒精中毒[5]等功效。此外,BALKEMABOOMSTRA A G等[6]研究发现,黄瓜所特有的葫芦素C具有预防癌症和糖尿病的功能。
牛奶是人类重要的营养来源[7],内含丰富的乳糖[8]和乳蛋白[9]。以牛奶和保加利亚乳杆菌(Lactobacillus bulgaricus)为原料通过乳酸发酵而得到的产品较多[10],如红枣酸奶[11],蓝莓枸杞酸奶等[12]。这些产品深受广大消费者的喜爱。
近年来,随着经济的发展,人们的生活水平逐步提高,国内的科技工作者已经就一些蔬菜原料进行乳酸菌发酵研究,得到了初步的进展。在国外,希腊、德国等一些国家进行了发酵蔬菜汁的研究,单一成分的发酵乳制品已不能满足人们对食品的营养需求。SILVA V L M等[13-14]对蓝莓发酵乳、苹果葡萄干发酵乳进行了研究。本研究以黄瓜和牛奶的混合物为研究对象,采取液态发酵方法研究发酵液的营养物质及生物活性,并采用气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)对发酵液的香气成分进行分析。由于黄瓜中富含叶酸,牛奶含有能与叶酸结合的蛋白质。将黄瓜和牛奶相结合能够提高叶酸的生物利用度和稳定性[15]。同时在原料中加入黄瓜能使凝固型酸奶散发一种黄瓜特有的清香味,增加酸奶的感官品质,丰富花色酸奶的种类,拓宽复合乳酸饮品市场,满足人类丰富的饮食需求,也能为黄瓜的深加工提供一个新的思路。
1 材料与方法
1.1 材料与试剂
新鲜黄瓜、鲜牛奶:市售;高纯度保加利亚乳杆菌菌粉:法国丹尼斯克公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS)试剂盒:碧云天生物技术公司;无水碳酸钠、氢氧化钠、盐酸、乙醇、硫酸亚铁、过氧化氢、水杨酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、乙二胺四乙酸二钠、焦性没食子酸等(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
SB-5200超声波清洗机:北京市永光明医疗仪器有限公司;STARTER3100 pH计:普兰德(上海)贸易有限公司;AL204型电子天平:梅特勒托利多仪器有限公司;CR22GIII高速冷冻离心机:日本Hitachi公司;Lambda25紫外分光光度计:德国PERKINELMER公司;UV-4802型紫外全扫描分光光度计:武汉利天科技仪器有限公司;SpectraMax M2e酶标仪:美国Molecular Devices公司;7890A/5957C气相色谱质谱仪:美国Aglient科技有限公司。
1.3 实验方法
1.3.1 黄瓜汁乳酸菌发酵工艺流程及操作要点

操作要点:
(1)选用成熟且组织脆嫩,肉质新鲜的黄瓜,洗净表皮污泥杂质和残留农药。将洗净的黄瓜,放入75~85 ℃热水中热烫3~5 min,将热烫后的黄瓜沥干,切除两端瓜蒂,切成1~2 cm3的碎块用打浆机打浆,将打浆完毕的黄瓜汁倒入200目滤布中进行初滤,经初滤后的黄瓜汁再由抽滤器抽滤,得到无残渣的黄瓜汁。
(2)混料:将2 100 mL黄瓜汁、900 mL纯牛奶、180 g白糖,依次加入洁净的发酵罐中,用干净的玻璃棒搅拌均匀。
(3)灭菌:将发酵罐盖好放在高压灭菌锅内,121 ℃灭菌20 min。取出后置于室温冷却至30~40 ℃左右,用于接种。
(4)接种:醪液冷却后,在无菌台中取一小匙该种菌粉加入发酵罐中,接种量为0.01%,随后盖紧盖子,并在发酵罐盖子上进行水封,避免在培养过程中遭到杂菌感染。菌种添加量为0.01%,发酵温度37 ℃,发酵时间3 d。发酵完毕后调配、灌装,85 ℃灭菌20 min后即得成品。
1.3.2 pH值的测定
采用STARTER3100 pH计测定发酵液的pH值。
1.3.3 总酸的测定采用GB/T 12456—2008《食品中总酸的测定》中酸碱滴定法测定发酵液中总酸含量[16]。
1.3.4 总酚的测定
根据文献[17],采用福林酚法测定发酵液中总酚含量。
标准曲线绘制:精确称取干燥至质量恒定的没食子酸10.0 mg,溶解后加水定容至100 mL,配成0.1 mg/mL的没食子酸标准溶液。准确吸取没食子酸标准溶液0、0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL于10 mL刻度试管中,加5.0 mL蒸馏水,再加0.5 mL福林酚试剂,摇匀1 min后再加入1.5 mL 20%碳酸钠溶液,于室温反应2 h。以0号管为空白,在波长760 nm处测定对照品溶液的吸光度值。以没食子酸质量(μg)为横坐标,吸光度值为纵坐标绘制没食子酸标准曲线。
准确称取样品0.4 mL,配成1.0 mg/mL的水溶液,精密量取1.0 mL于10 mL刻度试管中,按标准曲线制备操作步骤于波长760 nm处进行吸光度值的测定(样液如有沉淀,应过滤后测定)。查标准曲线或用线性方程计算,最后算出总酚含量,每个样品重复测定3次。
1.3.5 总糖的测定
采用3,5-二硝基水杨酸比色法[18]。精确称取干燥至恒质量的葡萄糖10.0 mg,溶解后加水定容到100 mL,配制成0.1 mg/mL的标准葡萄糖溶液,准确吸取葡萄糖标准溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL于10 mL刻度试管中,分别加入蒸馏水1.0 mL、0.8 mL、0.6 mL、0.4 mL、0.2 mL、0,再分别加入0.5 mL苯酚溶液0.5 mL,再加入2.5 mL的浓硫酸,冷却后,以0号管为空白,在波长490 nm处测定对照品溶液的吸光度值。以葡萄糖溶液质量浓度为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线。
准确吸取样品0.1 mL,按标准曲线制备操作步骤于波长490 nm处进行吸光度值的测定。按照标准曲线线性方程计算,最后算出总糖含量,每个样品重复测定3次。
1.3.6 乳酸的测定
采用GB/T23877—2009《饲料酸化剂中柠檬酸、富马酸和乳酸的测定高效液相色谱法》[19]中和滴定法进行测定。
1.3.7 抗氧化性实验
(1)羟自由基清除率的测定
采用水杨酸法[20]测定羟自由基清除率。在10 mL刻度具塞试管中依次加入6 mol/L的FeSO4溶液2 mL、不同质量浓度(0.5 mg/mL、1 mg/mL、3 mg/mL)的样品溶液2 mL和6 mol/L的H2O2溶液2mL,混合摇匀,静置10 min,再加入2 mL的6 mol/L水杨酸溶液,混合摇匀,静置30 min,于波长510 nm处测定其吸光度值,同时以维生素C(vitamin C,VC)为阳性对照。空白对照的吸光度值记为A0;无水杨酸时样品的吸光度值记为A1;加入样品后的吸光度值记A2。羟自由基清除率按下式计算:
(2)DPPH自由基清除率的测定[21]
取一定量的DPPH粉末,用无水乙醇将其配成浓度为0.15 mol/LDPPH无水乙醇溶液,在黑暗中低温保存。取2 mL DPPH无水乙醇溶液和0.2 mL样品溶液加1.8 mL无水乙醇溶液,并将在517 nm处测量的吸光度值记录为A1。用等量的无水乙醇代替样品溶液作为样品背景组,并将吸光度值记录为A0。使用等量的无水乙醇代替DPPH无水乙醇溶液作为空白对照,并将吸光度值记录为A2,同时以VC为阳性对照[22]。DPPH自由基清除率按下式计算:
(3)ABTS法测定抗氧化能力[23]
在波长735 nm处测定各个浓度的Trolox标准溶液吸光度值。得到并根据标准曲线(A=-0.778 9C+1.224 5(R2=0.999 3))计算出样品的总抗氧化能力,样品抗氧化能力以trolox-equivalent antioxidant capacity(TEAC)来表示,同时以VC为阳性对照。
1.3.8 气相色谱-质谱法分析发酵液挥发性成分[24]
(1)挥发性物质的提取:取8 mL离心后的样品于50 mL顶空瓶中,样品于55 ℃的孵化温度条件下孵化60 min,振荡转速为250 r/min,振荡开10 s关1 s。结束后吸取1 000 μL的气体进行解析。
(2)色谱条件:DB-5MS(30 m×0.25 mm,0.25 m)色谱柱;气化温度250 ℃;初始柱温40 ℃;升温程序:40 ℃保持1 min,以5 ℃/min升至250 ℃,保持10 min;高纯载气(He);流速1.0 mL/min;进样量1 μL;进样口不分流。
(3)质谱条件:电子电离(electron ionization,EI)源;离子源温度240 ℃;电子能量70 eV;四极杆温度150 ℃;质量扫描范围35~500 m/z[25]。
1.3.9 数据处理
采用SPSS19.0软件,对试验结果进行统计分析,利用方差分析进行各试验组间的显著性检验。
2 结果与分析
2.1 pH和总酸含量的变化
由图1可知,随着发酵的进行,发酵液的pH值整体呈下降趋势,最终稳定在4.0左右。pH值的下降是由发酵液中有机酸浓度的增加引起的,主要原因是乳酸含量的增加[26]。pH值随着有机酸浓度的增加而逐渐降低,因此pH值的下降和总酸含量的上升在时间上表现出一致性。发酵液的总酸含量总体呈上升趋势,在第13天后维持在50.5 g/L左右。此结果说明黄瓜汁乳酸菌发酵在7 d内基本完成。

图1 发酵时间对发酵液总酸含量和pH值的影响
Fig.1 Effect of fermentation time on total acid contents and pH value of fermentation broth
2.2 总糖含量的变化
发酵时间对发酵液总糖含量的影响见图2。由图2可知,总糖含量先降后升,从开始发酵至发酵第3天,总糖含量呈下降趋势,在第3天含量为72.53 g/L,随后上升。在第5天时总糖含量达到最高,含量为89.15 g/L,随后逐渐下降。糖是发酵过程中微生物生长和代谢的主要碳源,在发酵初期,乳酸菌繁殖会消耗大量糖分,此时总糖含量呈下降趋势;随着发酵时间的延长,乳酸菌分泌大量的酶降解发酵液中碳水化合物并产生大量可溶性糖,糖的产生量大于乳酸菌对糖的消耗量,使总糖含量上升;在发酵后期,由于乳酸菌数量逐渐增多,对糖的消耗量大于可溶性糖的产生量,因此总糖含量呈下降趋势[27]。
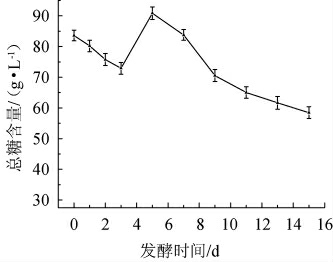
图2 发酵时间对发酵液总糖含量的影响
Fig.2 Effect of fermentation time on total sugar contents of fermentation broth
2.3 总酚含量的变化
发酵时间对发酵液总酚含量的影响见图3。由图3可知,发酵罐中的总酚含量在发酵初期呈下降趋势,在第2天含量最低,为0.138 mg/mL,随后逐渐上升,最终稳定在0.198 mg/mL。在发酵初期,体系中的溶氧量高,多酚类物质氧化较快,从而促使总酚含量下降。乳酸菌数迅速增加,由于酪蛋白水解、多肽及多酚物质的分解加速,酸奶中游离氨基酸、多酚的质量浓度也急剧上升。发酵液中形成固定了游离的水分,蛋白酶、多肽酶类及多酚的运输和活性以及物质运输受到了很大的限制,游离氨基酸和多酚质量浓度增加缓慢[28]。
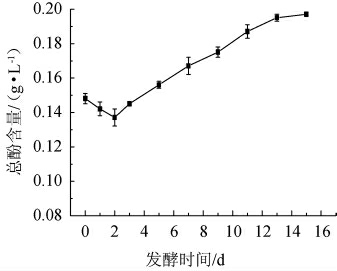
图3 发酵时间对发酵液总酚含量的影响
Fig.3 Effect of fermentation time on total phenolic contents of fermentation broth
2.4 乳酸含量的变化
发酵时间对发酵液乳酸含量的影响见图4。由图4可知,乳酸含量的变化整体呈上升趋势,在第3天含量达最高为5.5 g/L,随后缓慢下降最终稳定在5.0 g/L左右。在发酵液发酵过程中,保加利亚乳杆菌和嗜热链球菌利用乳糖进行生长繁殖,产生大量乳酸,随着发酵时间的延长,发酵液总酸含量增加,菌体的生长逐渐受到抑制,乳酸含量也逐步平稳[29]。
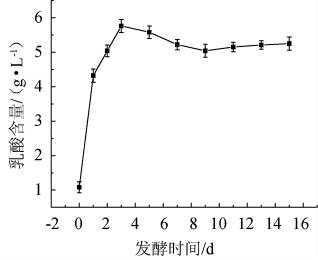
图4 发酵时间对发酵液乳酸含量的影响
Fig.4 Effect of fermentation time on lactic acid contents of fermentation broth
2.5 抗氧化性的变化
2.5.1 清除羟基自由基
羟自由基是生物体中重要的活性氧自由基之一,具有较强的氧化性,对人体具有一定的危害[30],由图5可知,发酵液中的羟自由基清除率随着发酵时间的增加逐渐升高。在发酵末期,羟自由基清除率最高可达87%,高于7 μg/mL VC对羟基自由基的清除率,这是因为发酵液中的总酚含量较高且黄瓜多糖具有较高的羟基自由基清除能力[31]。

图5 黄瓜汁乳酸菌发酵产物(A)和VC(B)的羟自由基清除率变化
Fig.5 Changes of hydroxyl free radical scavenging rate of lactic acid bacteria fermentation products of cucumber juice (A) and VC (B)
2.5.2 DPPH自由基清除能力
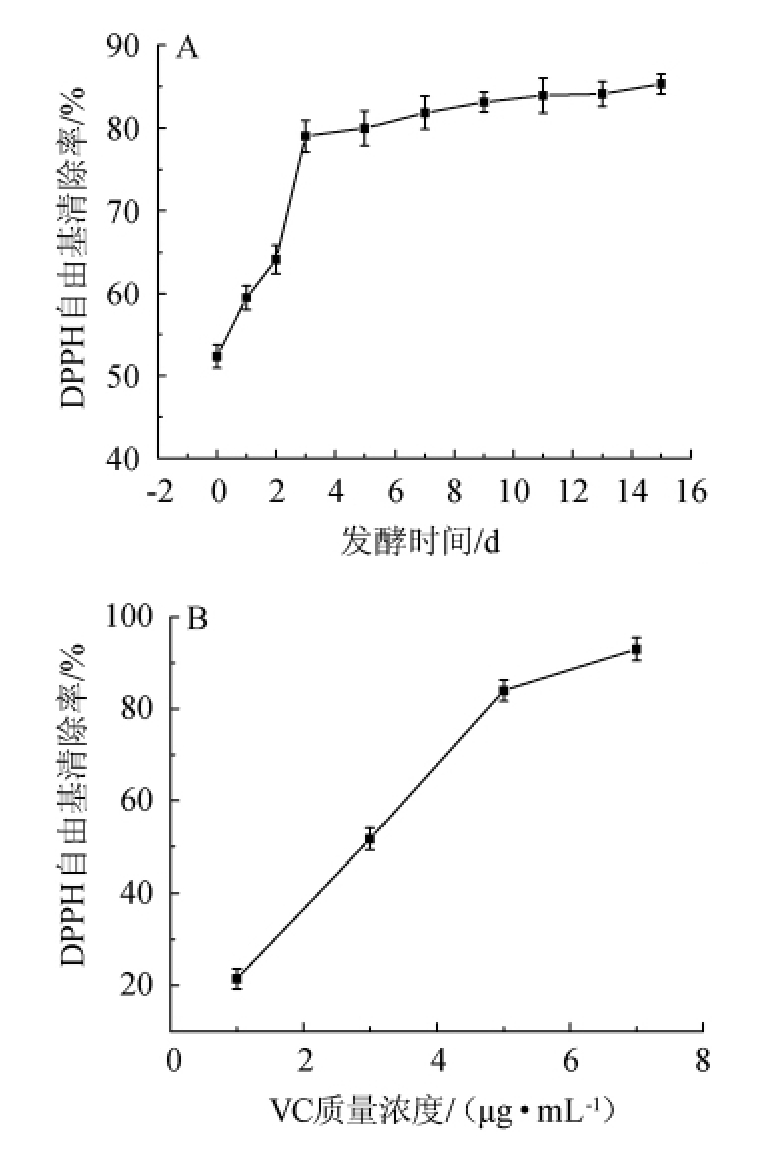
图6 黄瓜汁乳酸菌发酵产物(A)和VC(B)的DPPH自由基清除率变化
Fig.6 Changes of DPPH free radical scavenging rate of lactic acid bacteria fermentation products of cucumber juice(A)and VC(B)
DPPH是一种稳定的自由基,它的存在会对生物体造成一定的危害[32]。由图6可知,DPPH自由基清除率随着发酵时间的增加逐渐升高,发酵末期最高达85.12%,与7 μg/mL VC对DPPH自由基的清除率接近。
2.5.3 总抗氧化能力
根据相关研究结果表明,物质的抗氧化能力越强,更有利于减少机体的相关细胞损伤[33]。由图7可知,总抗氧化能力在前3天大幅提升,在后期增长趋势逐渐趋于平缓,总抗氧化能力最高与0.85 mmol/L的Trolox的抗氧化能力相同,高于0.70 mmol/L VC的总抗氧化能力。这种变化趋势是因为发酵乳经过乳酸菌的发酵作用,产生了许多具有生物活性的物质,使发酵乳具有了一定的抗氧化性[28,34]。

图7 黄瓜汁乳酸菌发酵产物(A)和VC(B)的总抗氧化能力变化
Fig.7 Changes of total antioxidant activity of lactic acid bacteria fermentation products of cucumber juice (A) and VC (B)
2.6 GC-MS分析挥发性成分
经气相色谱质谱联用仪定性分析发酵液,共检测出22个峰,主要挥发性成分组成及其相对含量(占挥发性成分总量的比例)见表1,发酵液中共鉴定出22 种挥发性风味物质,其中烃类、酯类、酮类、醛类、酸类、醇类以及胺类分别为6、6、1、3、2、2 种和2种。由表1计算得,该挥发性成分中烷类占比68.4%,酯类占比10.61%,酮类占比0.98%,醛类占比9.79%,酸类占比5.03%,醇类占比1.99%,胺类占比3.2%。但检出物质并不全是香气成分,比如胆甾-3,5-二烯。发酵液的主要香气物质为壬醛、癸醛、癸酸乙酯、2-氨基-1-苯基-乙酮等。

图8 发酵液中挥发性成分气相色谱图
Fig.8 Gas chromatogram of aroma components in fermentation liquor
表1 发酵液中主要挥发性成分及相对含量
Table 1 Volatile components and relative contents in fermentation broth

由图8和表1可知,黄瓜发酵液的挥发性成分中烷类化合物和酯类化合物含量较高,酸类化合物和酮类化合物含量较低。一般认为酸奶中的主要香气成分为酸类化合物、酮类化合物和醛类化合物等。出现该差异的原因可能是由于部分香气成分存在于发酵液中未被检测出,有待进一步检测。
3 结论
以黄瓜和牛奶为原料,利用保加利亚乳杆菌对黄瓜牛奶混合物进行发酵,采用的发酵工艺条件为:黄瓜汁与纯牛奶的体积比为7∶3,接种量0.01%,初始pH值6.1,发酵温度37 ℃,发酵时长3 d。在该工艺下发酵所得的黄瓜汁乳酸菌发酵乳的总酸最终含量为50.5g/L,总酚含量为0.165 mg/mL,其羟自由基清除率最高可达87%,DPPH 自由基清除率可达85.12%,总抗氧化能力最高与0.85 mmol/L的Trolox的抗氧化能力相同,高于0.70 mmol/L VC的总抗氧化能力。黄瓜发酵液的挥发性成分中烷类占比68.4%,酯类占比10.61%,酮类占比0.98%,醛类占比9.79%,酸类占比5.03%,醇类占比1.99%,胺类占比3.2%。其中烷类化合物和酯类化合物含量较高,酸类化合物和酮类化合物含量较低。由于本实验中采用的灭菌方法耗时较长,今后可结合食品非热杀菌技术,采取合理的杀菌方式,提高生产效率,并能最大限度保留产品中的多酚、多糖等营养成分。
[1]李岳平,梁开杰,李美婷,等.黄瓜的营养成分、作用及嫁接技术[J].上海农业科技,2015(1):89-89.
[2]SHEKARI L,AROIEE H,MIRSHEKARI A,et al.Protective role of selenium on cucumber (Cucumis sativus L.) exposed to cadmium and lead stress during reproductive stage role of selenium on heavy metals stress[J].J Plant Nutr,2019,42(10):1-14.
[3]李培睿,张晓伟,王丽娜,等.凝固型黄瓜酸奶的研制[J].江苏农业科学,2015,43(11):357-359.
[4]何念武,杨兴斌,田灵敏,等.黄瓜多糖的体外抗氧化活性[J].食品科学,2011,32(19):70-74.
[5]MUKHERJEE P K,NEMA N K,MAITY N,et al.Phytochemical and therapeutic potential of cucumber[J].Fitoterapia,2013,84(1):227-236.
[6]BALKEMA-BOOMSTRA A G,ZIJLSTRA S,VERSTAPPEN F W A,et al.Role of cucurbitacin C in resistance to spider mite(Tetranychus urticae)in cucumber(Cucumis sativus L.)[J].J Chem Ecol,2003,29(1):225-235.
[7]YE A,CUI J,DALGLEISH D,et al.Effect of homogenization and heat treatment on the behavior of protein and fat globules during gastric digestion of milk[J].J Dairy Sci,2017,100(1):36-47.
[8]徐逢昌.奶类的营养价值及保健作用[J].中国乳业,2002(10):30-30.
[9]陆东林,张丹凤,刘新丽,等.牛奶中的氨基酸含量及其营养价值[J].中国乳业,2002(2):24-25.
[10]KREN V,WALTEROVÁ D.Silybin and silymarin-New effects and applications[J].Biomed Papers,2005,149(1):29-41.
[11]FENG C,WANG B,ZHAO A,et al.Quality characteristics and antioxidant activities of goat milk yogurt with added jujube pulp[J].Food Chem,2019,277:238-245.
[12]成堃,马延新,王小霞,等.蓝莓枸杞风味酸奶的研制[J].中国酿造,2018,37(1):185-189.
[13]SILVA V L M,SILVA A C O,BRUNO R C,et al.Stability of polyphenols from blueberry(Vaccinium corymbosum L.)in fermented dairy beverage[J].J Food Process Preserv,2017,41(6):e13305.
[14]BOSNEA L A,KOPSAHELIS N,KOKKALI V,et al.Production of a novel probiotic yogurt by incorporation of L.casei,enriched fresh apple pieces,dried raisins and wheat grains[J].Food Bioprod Process,2017,102:62-71.
[15]GANGADHARAN D,NAMPOOTHIRI K M.Folate production using Lactococcus lactis ssp cremoris with implications for fortification of skim milk and fruit juices[J].LWT-Food Sci Technol,2011,44(9):1859-1864.
[16]国家质量监督检验检疫总局.GB/T 12456—2008 食品中总酸的测定[S].北京:中国标准出版社,2008.
[17]VRHOVSEK U,RIGO A,TONON D,et al.Quantitation of polyphenols in different apple varieties[J].J Agr Food Chem,2004,52(21):6532-6538.
[18]王鹏亭,赵宗杰,周荣灵,等.3,5-二硝基水杨酸法测定樟芝中多糖的含量[J].食品研究与开发,2016,37(9):163-167.
[19]国家质量监督检验检疫总局.GB/T 23877—2009 饲料酸化剂中柠檬酸、富马酸和乳酸的测定高效液相色谱法[S].北京:中国标准出版社,2009.
[20]孙旭,姜泽东,杜希萍,等.乳酸菌发酵对茶花粉营养成分及生物活性的影响[J].食品工业科技,2018,39(3):44-47.
[21]ROY M K,KOIDE M,RAO T P,et al.ORAC and DPPH assay comparison to assess antioxidant capacity of tea infusions:relationship between total polyphenol and individual catechin content[J].Int J Food Sci Nutr,2010,61(2):109-124.
[22]张迪,刘洋,李书艺.响应面试验优化复合酶法提取青蛇果多酚工艺及其抗氧化活性[J].食品科学,2016,37(4):51-57.
[23]ALARA O R,ABDURAHMAN N H,UKAEGBU C I,et al. Vernonia cinerea leaves as the source of phenolic compounds,antioxidants,and antidiabetic activity using microwave-assisted extraction technique[J].Ind Crop Prod,2018,122:533-544.
[24]屈乐轶,马永昆,李祥波.基于GC-MS 和嗅闻联用的不同品种黑莓果酒香气成分分析[J].中国酿造,2009,28(6):146-149.
[25]李维妮,郭春锋,张宇翔,等.气相色谱-质谱法分析乳酸菌发酵苹果汁香气成分[J].食品科学,2017,38(4):146-154.
[26]WANG W,MENG B,LU X,et al.Extraction of polycyclic aromatic hydrocarbons and organochlorine pesticides from soils:a comparison between Soxhlet extraction,microwave-assisted extraction and accelerated solvent extraction techniques[J].Anal Chim Acta,2007,602(2):211-222.
[27]王全利,何四云,贺习耀,等.酸奶发酵过程中游离氨基酸含量的分析[J].湖北农业科学,2014,53(13):3137-3140.
[28]宋慧,马利华,陈学红,等.猕猴桃、茉莉花复合益生菌酸奶加工工艺及抗氧化性的研究[J].中国乳品工业,2017,45(6):61-64.
[29]陈玉峰,王世强.红枣酸奶的研制及枣汁对酸奶发酵过程的影响[J].湖南农业科学,2012(12):31-32.
[30]BLOIS,MARSDEN S.Antioxidant determinations by the use of a stable free radical[J].Nature,1958,181(4617):1199-1200.
[31]CHEN L,HUANG G,HU J.Preparation,deproteinization,characterisation,and antioxidant activity of polysaccharide from cucumber(Cucumis saticus L.)[J].Int J Biol Macromol,2017,108:408-411.
[32]蒋方程,李傲然,何静仁,等.不同品种山药的营养成分分析及其水提物的体外抗氧化能力研究[J].食品工业科技,2018,39(4):6-11.
[33]李江涛,韩文芳,王睿璨,等.山药水提物及制品体外抗氧化作用研究[J].食品科技,2013,38(9):146-149.
[34]郑苗,何佳,吕丹丹,等.复合乳酸菌发酵怀山药工艺及其抗氧化活性[J].中国酿造,2018,37(2):106-110.