苯乳酸(phenyllactic acid,PLA)是一种新型广谱生物防腐剂,能抑制多种细菌[1-3]和真菌[4-5]的生长。20世纪90年代,WILKINS A等[6]就认为蜂蜜中的PLA是抑菌物质之一。DIEULEVEUXV等[7]报道了以白地霉(Geotrichum candidum)为熟化剂制作的干酪对单增李斯特菌(Listeria monocytogenes)具有抑制作用,经纯化和分析确定PLA是主要的抑菌物质。研究还发现,PLA拥有与丹参素相似的药理功能,具有用作抑制血小板聚集和治疗急性心肌梗死药物的潜力[8]。因此PLA在食品防腐和医药行业具有良好的应用前景。
PLA可通过化学合成或微生物转化法制备。其中,微生物转化法具有环境友好、副产物少等优点[9],一直是国内外研究的热点。目前,已经发现白地霉[7]、多种乳酸菌[10-12]和凝结芽孢杆菌(Bacillus coagulans)[13]等均可产生PLA,但PLA产量都不高,还无法实现工业化生产[14]。
食醋是一种世界性的酸性调味品。按照原料的不同,食醋可分为以高粱、稻谷、小麦等谷物为主要原料酿造的谷物醋,以及以葡萄、苹果等水果为原料酿造的果醋。我国的四大传统名醋山西老陈醋、镇江香醋、四川保宁麸皮醋和福建永春红曲醋,以及日本的黑醋是谷物醋的典型代表;而意大利的香醋(Balsamic vinegar)、西班牙的雪莉醋(Sherry vinegar)和美国的苹果醋等则是水果醋的典型代表[15]。
无论是谷物醋还是果醋,特别是以传统工艺酿造的,都富含功能性成分,具有多种生理功能。如食醋中的阿魏酸(ferulic acid)[16]、没食子酸(gallic acid)均表现出很好的抗氧化作用;而川穹嗪(ligustrazine)则具有改善血液循环的作用[17]。这些功能成分可由食醋酿造过程中的微生物产生[18-19],也可来自原料或由酿造工艺决定[20-21]。尽管食醋中多种功能性成分已被报道,但是仍有更多功能性成分有待发掘。
大量研究表明,采用传统工艺酿造的食醋具有多种生理功能,但对应的功能性化合物研究较少[22]。为此,该研究对传统山西老陈醋中的功能性成分一苯乳酸开展了系统分析,并进一步对市售食醋进行分析,确定PLA广泛存在酿造食醋中。本研究发掘了食醋新的功能化合物,为食醋新功能的开发提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 实验样品
山西老陈醋发酵过程中的样品:由山西老陈醋集团有限公司、山西紫林醋业股份有限公司提供。77种食醋样品:中国食醋样品由各厂家提供或购买于超市;国外食醋样品由瑞士日内瓦大学(Université de Genève)的François Barja教授、意大利摩德纳雷焦艾米里亚大学(University of Modena and Reggio Emilia)的Paolo Giudici教授、西班牙科多巴大学(University of Cordoba)的Isidoro García García教授提供或购买于瑞士和法国等国家的超市。
1.1.2 主要试剂
氘代甲醇:美国Sigma-Aldrich公司;PLA标准品(纯度99%):上海阿拉丁生化科技股份有限公司。甲醇、甲酸和乙腈等其他试剂均为国产分析纯。
1.2 仪器与设备
600MHz DD2超导核磁共振波谱仪、Agilent 1100 液相二级质谱:美国Agilent公司;LC-6AD半制备高效液相色谱仪、LC-20A高效液相色谱仪:日本岛津公司;SIM CVCFD5冷冻干燥机:美国西盟国际公司;KQ-400KDE型高功率数控超声波清洗器:中国昆山市超声仪器有限公司。
1.3 方法
1.3.1 制备山西老陈醋的乙酸乙酯萃取物
参照CHEN H等[23]的方法,制备山西老陈醋的乙酸乙酯提取物。1 kg山西老陈醋经冷冻干燥后,加入1 L无水乙醇,超声提取(300 W)30 min,重复5次,合并乙醇提取液。于35 ℃真空浓缩后,以蒸馏水稀释,定容至0.5 L,再以0.5 L的乙酸乙酯萃取,重复3次,合并萃取液。于35 ℃真空浓缩至干,浓缩物以无水乙醇定容至1 L,用于食醋成分的分离。
1.3.2 乙酸乙酯提取物的分离制备
将乙酸乙酯提取物通过半制备高效液相色谱分离得到7个组分,V1~V7。液相色谱条件:Inertsil ODS-3 色谱柱(5 μm,14 mm×250 mm);流动相:水∶甲醇=50∶50(V/V),洗脱时间:25 min;流速:6 mL/min;进样量:50 μL;检测器:紫外检测器;检测波长:280 nm。
由于只有V7组分的峰形单一,因此收集V7组分,真空浓缩去除甲醇后,冻干并保存于-20 ℃,备用。
1.3.3 V7组分的LC-MS/MS鉴定
参照陈亨业[24]报道的方法,采用液相色谱-串联质谱(liquidchromatogram-tandemmassspectrometry,LC-MS/MS)对上述制备得到的V7组分进行纯度和质荷比信息的测定。LC-MS/MS条件:SpursilC18-EP色谱柱(5μm,4.6mm×250mm);流动相:甲酸水溶液(0.1%)∶甲醇为65∶35(V/V);洗脱时间:60 min;流速:1 mL/min;进样量:5 μL;质谱离子化模式:电喷雾离子化负离子模式;质荷比检测范围:50~800 m/z。
1.3.4 V7组分的核磁共振鉴定
由1.3.3的分析结果发现,在1.3.2中半制备高效液相色谱仪制备得到的V7组分纯度高,成分单一,因此采用核磁共振对其进行了进一步分析。具体方法为以氘代甲醇将V7组分溶解后,通过一维的1H谱、13C谱和DEPT-135谱以及二维的1H-1H COSY谱、1H-13C HSQC谱和1H-13C HMBC谱,对其结构进行解析。
1.3.5 食醋PLA含量测定
采用高效液相色谱法对各食醋样品中的PLA含量进行了测定,以PLA标准品为外标。食醋样品经适当稀释,高速离心(2 000×g,5 min)后过0.22 μm滤膜,滤液直接进样。高效液相条件:Spursil C18-EP 色谱柱(5 μm,4.6 mm×250 mm);流动相:0.1%的甲酸水溶液(A)和乙腈(B);梯度洗脱程序:0~15 min,80%A;15~17 min,10%A;17~20 min,10%A;20.01~25 min,80%A;流速:1 mL/min;进样量:10 μL;柱温:40 ℃;检测器:二极管阵列检测器;检测波长:205 nm。
1.3.6 数据分析
所有实验数据均用Excel 2010分析,并以平均值或平均值±标准差表示。化合物的分子结构式采用Chembio Draw Ultra 12.0绘制。
2 结果与分析
2.1 山西老陈醋乙酸乙酯萃取物中组分的分离
预备实验发现山西老陈醋的乙醇提取物组成成分非常复杂,故本研究将食醋的乙醇提取物用乙酸乙酯萃取后,再通过半制备高效液相色谱进行分离和制备。结果发现,乙酸乙酯萃取物大致可分为V1~V7共7个组分,结果见图1。其中V1~V6的组分成分仍非常复杂,而V7组分相对比较单一(见图1),故后续仅收集V7组分进行进一步分离鉴定。
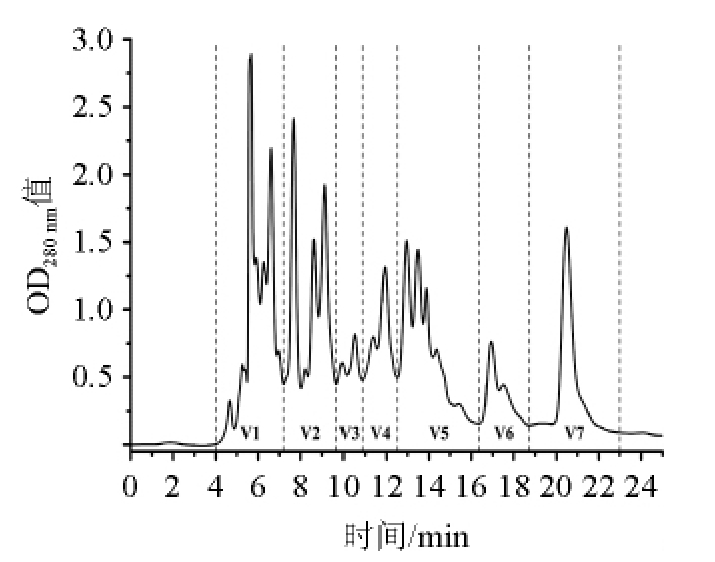
图1 山西老陈醋乙酸乙酯萃取物中的组分分离
Fig.1 Separation of components from ethyl acetate extract of Shanxi aged vinegar
2.2 V7组分中化合物的结构鉴定
采用LC-MS/MS和核磁共振(nuclear magnetic resonance spectroscopy,NMR)的一维和二维谱对上述得到的V7组分化合物的化学结构进行了解析。该化合物的LC-MS/MS分析(图2)与NMR的1H-13C HMBC鉴定(图3)结果一致,而且NMR还进行了1H、13C,DEPT-135、1H-1H COSY、1H-13C HSQC分析,结果与1H-13C HMBC鉴定结果也完全一致(结果未显示)。由LC-MS/MS和NMR分析结果判定V7化合物为苯乳酸。

图2 V7化合物的LC-MS/MS分析结果
Fig.2 LC-MS/MS analysis results of V7 component
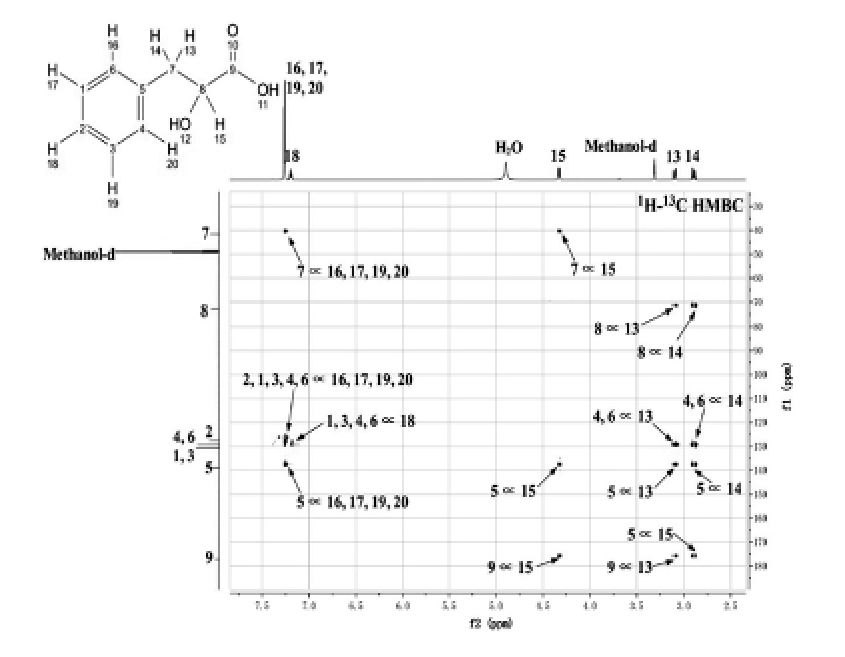
图3 V7组分的1H-13C HMBC核磁共振光谱图
Fig.3 NMR spectra of V7 component by 1H-13C HMBC spectrum
2.3 PLA在食醋生产过程中的变化
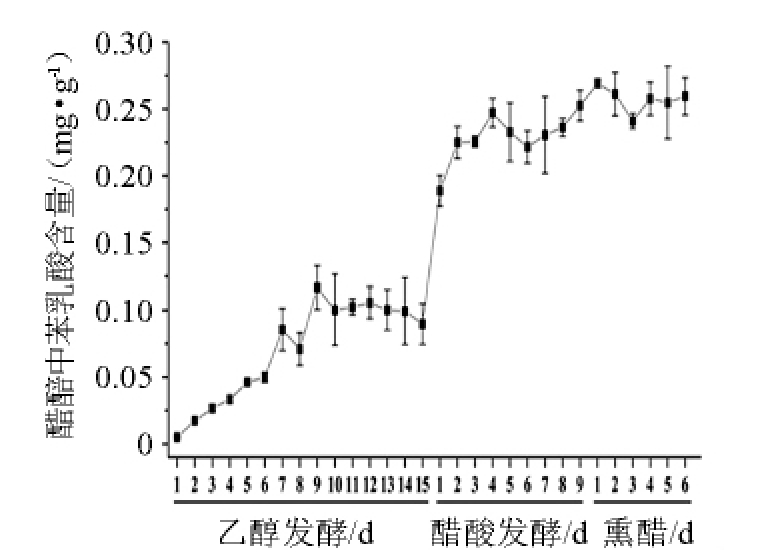
图4 山西老陈醋发酵过程中苯乳酸浓度的变化
Fig.4 Phenyllactic acid concentration of Shanxi aged vinegar during the fermentation process
对山西老陈醋PLA的来源进行探讨,发酵过程中PLA质量浓度的变化结果见图4。在山西老陈醋原辅料,包括高粱、谷壳、大麦等未检测到PLA(结果未显示)。由图4可知,PLA主要产生于乙醇和醋酸发酵过程,特别是进入醋酸发酵阶段,PLA含量明显提高,而煎醋过程对PLA无明显影响。
2.4 食醋中PLA的分析
由2.3的分析结果可知,山西老陈醋中的PLA可能主要来自发酵微生物,故推测其他食醋也应该含有PLA。本研究采集了来自9个不同国家的77种谷物醋和果醋,采用高效液相色谱法对PLA的含量进行了分析。以外标法确定PLA含量与峰面积的标准曲线为y=34 715x-49.887(R2=0.999 2),测得食醋样品检测结果见表1。结果显示,在73种食醋中均检测到PLA,其中谷物醋中PLA的含量(0~979.97 mg/L)普遍高于果醋中的含量(0~22.77 mg/L),尤其是我国传统发酵的谷物醋。
表1 各种食醋中苯乳酸的含量
Table 1 Phenyllactic acid contents in different vinegars

续表
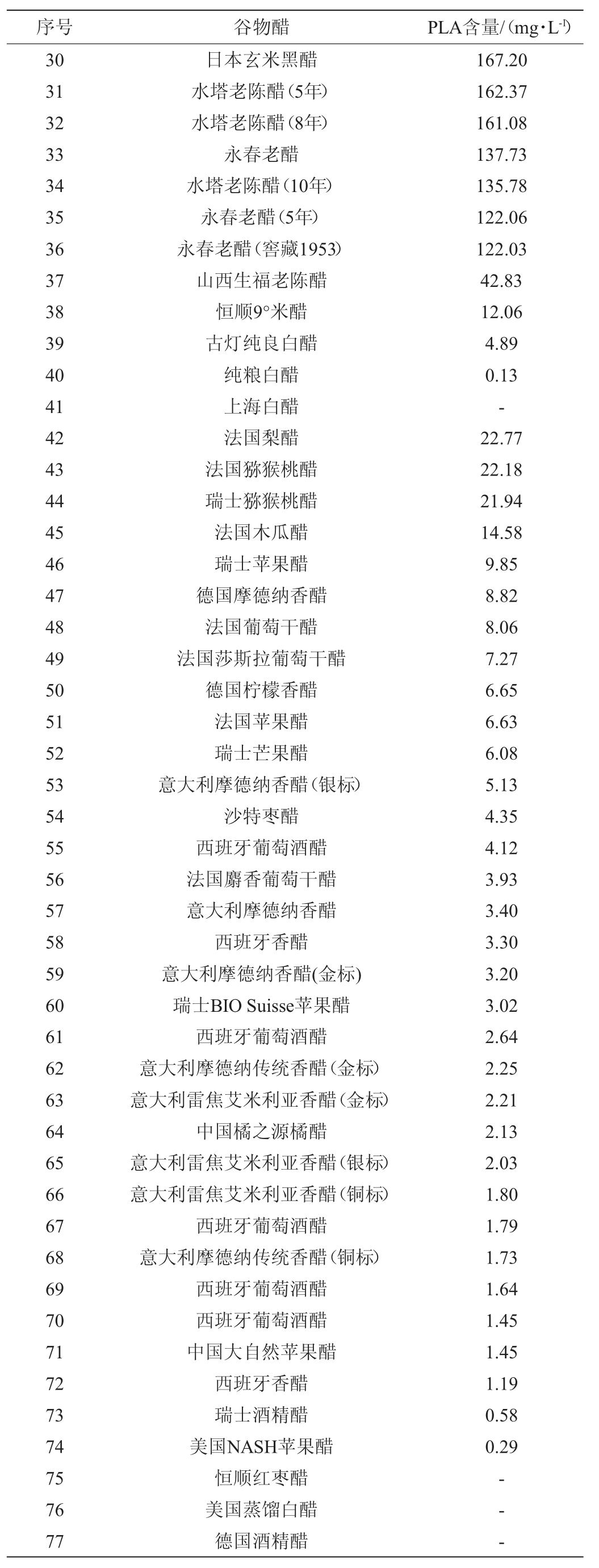
注:“-”表示未检出。
3 讨论
本研究在分析山西老陈醋功能成分时发现了PLA,并在来自不同国家的73个食醋样品中均检测到PLA,说明PLA普遍存在于酿造醋中。苯乳酸是一种光谱的生物防腐剂,所以食醋能够用于消毒和食品防腐等[22],可能与食醋中存在PLA有关。
目前报道产PLA的微生物以乳酸菌居多,特别是植物乳杆菌(Lactobacillus plantarum)[11,25]。本研究发现我国以传统方法酿造的食醋中PLA的浓度皆高于果醋,还高于其他发酵食品,如中国泡菜[26]和酸面团[27],这应该与食醋酿造过程参与的微生物类群丰富,代谢过程更复杂有关。采用高通量测序分析山西老陈醋[28]、镇江香醋[29]以及天津独流陈醋[30]的微生物菌群,主要微生物均为乳酸杆菌属的植物乳杆菌和醋杆菌属的巴斯德醋杆菌(Acetobacter pasteurianus),低丰度微生物在不同地域食醋酿造过程中有所不同。本研究对山西老陈醋PLA的来源进行探究,发现PLA虽然在乙醇发酵阶段开始产生,但产量不高,而进入醋酸发酵阶段,PLA的含量显著增加。所以推测乳酸菌对PLA的产生起到了一定作用,醋酸菌作为醋酸发酵阶段主要产酸微生物,应该发挥了积极的作用。
传统酿造的食醋具有多种生理功能,但对应的功能成分知之不多[21]。本研究尽管首次确定山西老陈醋乙酸乙酯提取物中V7组分为PLA,但其他组分是什么,具有什么功能,还有待进一步研究。
4 结论
本研究从山西老陈醋中发掘到一种具有广谱抑菌功能的化合物—PLA,并初步证实PLA是食醋酿造过程中产生的。在此基础上,分析发现PLA普遍存在于酿造食醋中,且谷物醋中的PLA明显高于果醋,特别是我国传统四大名醋中PLA含量非常丰富。本研究成果丰富了食醋的功能成分谱,为开发食醋功能,增加食醋的附加值提供了新思路。
[1]WANG F T,WU H H,JIN P P,et al.Antimicrobial activity of phenyllactic acid against Enterococcus faecalis and its effect on cell membrane[J].Foodborne Pathog Dis,2018,15(10):645-652.
[2]NING Y,YAN A,YANG K,et al.Antibacterial activity of phenyllactic acid against Listeria monocytogenes and Escherichia coli by dual mechanisms[J].Food Chem,2017,228:533-540.
[3]LIU F,WANG F,DU L,et al.Antibacterial and antibiofilm activity of phenyllactic acid against Enterobacter cloacae[J].Food Control,2018,84:442-448.
[4]ZAVALETA O C,MALO A L,MENDOZA A H,et al.Antifungal activity of lactobacilli and its relationship with 3-phenyllactic acid production[J].Int J Food Microbiol,2014,173:30-35
[5]WANG H K,YAN Y H,WANG J M,et al.Production and characterization of antifungal compounds produced by Lactobacillus plantarum IMAU10014[J].PLoS One,2012,7(1):294-252.
[6]WILKINS A,LU Y,TAN S.Extractives from New Zealand honeys.4.Linalool derivatives and other compounds from nodding thistle (Carduus nutans)honey[J].J Agr Food Chem,1993,41(6):873-878.
[7]DIEULEVEUX V,VAN DER PYL D,CHATAUD J,et al.Purification and characterization of anti-Listeria compounds produced by Geotrichum candidum[J].Appl Environ Microbiol,1998,64(2):800-803.
[8]DONG C,WANG Y,ZHU Y Z.Asymmetric synthesis and biological evaluation of Danshensu derivatives as anti-myocardial ischemia drug candidates[J].Bioorg Med Chem,2009,17:3499-3507.
[9]XIAO Z J,LV C J,GAO C,et al.A novel whole-cell biocatalyst with NAD+regeneration for production of chiral chemicals[J].PLoS One,2010,5(1):e8860.
[10]GUIMARÃES A,SANTIAGO A,TEIXEIRA J A,et al.Anti-aflatoxigenic effect of organic acids produced by Lactobacillus plantarum[J].Int J Food Microbiol,2018,264:31-38.
[11]ZHANG X,ZHANG S,SHI Y,et al.A new high phenyl lactic acid-yielding Lactobacillus plantarum IMAU10124 and a comparative analysis of lactate dehydrogenase gene[J].FEMS Microbiol Lett,2014,356(1):89-96.
[12]RODRÍGUEZ-PAZO N,DA SILVA SABO S,SALGADO-SEARA J M.Optimisation of cheese whey enzymatic hydrolysis and further continuous production of antimicrobial extracts by Lactobacillus plantarum CECT-221[J].J Dairy Res,2016,83(3):402-411.
[13]ZHENG Z J,MA C Q,GAO C,et al.Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells of Bacillus coagulans SDM[J].PLoS One,2011,6(4):e19030.
[14]SCHNURER J,MAGNUSSON J.Antifungal lactic acid bacteria as biopreservatives[J].Trends Food Sci Technol,2005,16(1-3):70-78.
[15]SOLIERI L,GIUDICI P.Vinegars of the world[M].Milan:Springer,2009:110-115.
[16]NARASHIMHAN A,CHINNAIYAN M,KARUNDEVI B.Ferulic acid exerts its antidiabetic effect by modulating insulin-signalling molecules in the liver of high-fat diet and fructose-induced type-2 diabetic adult male rat[J].Appl Physiol Nutr Metab,2015,40(8):769-781.
[17]REN Z,MA J,ZHANG P,et al.The effect of ligustrazine on L-type calcium current,calcium transient and contractility in rabbit ventricular myocytes[J].J Ethnopharmacol,2012,144(3):555-661.
[18]BABA N,HIGASHI Y,KANEKURA T.Japanese black vinegar"Izumi"inhibits the proliferation of human squamous cell carcinoma cells via necroptosis[J].Nutr Cancer,2013,65(7):1093-1097.
[19]桂青.山西老陈醋酿造过程中主要成分变化规律的研究[D].武汉:华中农业大学,2013.
[20]YANG L,WANG X,YANG X.Possible antioxidant mechanism of melanoidins extract from Shanxi aged vinegar in mitophagy-dependent and mitophagy-independent pathways[J].J Agr Food Chem,2014,62(34):8616-8622.
[21]TAGLIAZUCCHI D,VERZELLONI E,CONTE A.Contribution of melanoidins to the antioxidant activity of traditional balsamic vinegar during aging[J].J Food Biochem,2010,34(5):1061-1078.
[22]CHEN H,CHEN T,GIUDICI P,et al.Vinegar functions on health:constituents,sources,and formation mechanisms[J].Compr Rev Food Sci Food Safety,2016,15(6):1124-1138.
[23]CHEN H,ZHOU Y,SHAO Y,et al.Free phenolic acids in Shanxi aged vinegar:changes during aging and synergistic antioxidant activities[J].Int J Food Propert,2016,19(6):1183-1193.
[24]陈亨业.山西老陈醋对晚期糖基化终末产物形成的抑制及产PLA 醋酸菌的发现[D].武汉:华中农业大学,2018.
[25]VALERIO F,LAVERMICOCCA P,PASCALE M,et al.Production of phenyllactic acid by lactic acid bacteria:an approach to the selection of strains contributing to food quality and preservation[J].FEMS Microbiol Lett,2004,233:289-295.
[26]LI X,NING Y,LIU D,et al.Metabolic mechanism of phenyllactic acid naturally occurring in Chinese pickles[J].Food Chem,2015,186:265-270.
[27]RYAN L,BELLO F D,CZERNY M,et al.Quantification of phenyllactic acid in wheat sourdough using high resolution gas chromatography-mass spectrometry[J].J Agr Food Chem,2009,57(3):1060-1064.
[28]LI S,LI P,LIU X,et al.Bacterial dynamics and metabolite changes in solid-state acetic acid fermentation of Shanxi aged vinegar[J].Appl Microbiol Technol,2016,100(10):4395-4411.
[29]WANG Z M,LU Z M,YU Y J,et al.Batch-to-batch uniformity of bacterial community succession and flzvor formation in the fermentation of Zhenjiang aromatic vinegar[J].Food Microbiol,2015,50:64-69.
[30]NIE Z Q,ZHENG Y,WANG M,et al.Exploring microbial succession and diversity during solid-state fermentation of Tianjin duliu mature vinegar[J].Bioresour Technol,2013,148:325-333.