微生物絮凝剂(microbial flocculant)是由微生物细胞成分提取或新陈代谢产生,能使废水中污染颗粒物、胶体悬浮物、有害微生物等微粒发生凝集、沉淀的一类特殊活性有机物[1],其主要成分为脂类[2]、蛋白质[3]、多糖[4]、核酸[5]等。具有安全无污染、材料环保、容易降解等优点[6],在绿色环保、农业安全、医药卫生等领域具有无限良好的应用前景。法国生物学家微生物学之父PASTEUR L最早在酵母菌中发现微生物的絮凝特性[7];NAKAMURA J等[8-9]陆续从自然界分离到具有絮凝特性的酱油曲霉(Aspergillus sojae)AJ 7002和红平红球菌(Rhohococcus erthropolis),分离提取活性物并制成絮凝剂,用于处理污泥、畜产废水、废水脱色及砖场生产废水,取得了良好的治理效果;LEE S H等[10]采用多步沉淀法从Archuadendron sp.TS-49中分离得到絮凝剂,检测其成分为己糖胺和蛋白质;HE J等[11]培养盐单胞菌(Halomonas sp.)制备絮凝剂HBF-3并研究其絮凝桥联作用;YIN Y J等[12]从克雷伯氏菌(Klebsiella sp.)中提取到絮凝剂ZZ-3,并证实其多糖成分和絮凝机理。目前,科研人员已从不同环境中分别分离出多种具有絮凝特性的微生物,涵盖微生物种属数十个[13-16]。目前主要问题是高产菌株难获得、不稳定、微生物絮凝剂的产量太低,导致生产应用成本过高,限制了的商业的实际应用。选育微生物高产絮凝剂菌株是微生物絮凝剂可以得以早日应用和产量增加的方法,已成为环境微生物领域研究的新热点。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术是近年来开发应用的一种新生物育种技术,利用激发态物质在强电场中产生的等离子体使生物细胞胞内遗传物质突变,从而让生物体产生新性状和稳定遗传的特性[17]。与其他育种技术相比,该技术具有辐射均匀、工作温度低(<40 ℃)、操作安全简便等特点,现已应用于农作物玉米[18]、大豆[19]、小麦[20]等生长抗逆性研究。此外,大量研究显示,采用ARTP技术对酵母[21-22]、细菌[23-24]、真菌[25-26]等进行诱变选育,突变菌株发酵后酶和激素等代谢物的产量均有所提高。但是,以ARTP技术选育高絮凝菌株的研究鲜见报道。
本研究采用ARTP诱变技术对黑曲霉(Aspergillus niger)xj进行诱变,旨在研究ARTP对微生物产絮凝剂的影响,以期筛选出絮凝活性高、遗传稳定的菌株,为ARTP在微生物絮凝菌株选育方面提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
黑曲霉(Aspergillus niger)xj:贵州大学生命科学院微生物所分离、鉴定,保藏于中国典型培养物保藏中心(China center for type culture collection,CCTCC)(保藏号:CCTCC NO.M 206021)。
1.1.2 试剂
高岭土、吐温80、葡萄糖、盐酸、氢氧化钠(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[27]:马铃薯200 g切碎成块状煮20 min,纱布过滤加葡萄糖20 g,琼脂20 g,加水至1 000 mL,调节pH值7.0,121 ℃高压灭菌30 min。马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:PDA培养基中不添加琼脂。
1.2 仪器与设备
ⅡS型ARTP诱变育种仪:江苏无锡源清天木生物科技有限公司;DP-350漩涡振荡仪:北京亚欧德鹏科技有限公司;TGL-16M台式高速冷冻离心机:上海卢湘仪离心机仪器有限公司;PHS-3C精密酸碱计:上海大普仪器有限公司;BIOMATE 3S紫外可见光分光光度计:赛默飞世尔科技有限公司。
1.3 方法
1.3.1 黑曲霉xj孢子悬液的制备
取斜面保存的黑曲霉xj划线接种于PDA培养基平板,28 ℃恒温培养5~7 d,待平板表面长满黑曲霉菌体,用接种环轻轻刮取表面的孢子,加入1 g/L吐温80冲洗2~3次。吸取孢子悬液转移至装有少量玻璃珠的锥形瓶中,室温振荡10 min使孢子充分分散,脱脂棉过滤,得到黑曲霉菌丝。继续采用吐温80稀释孢子悬浮液,通过血球计数板[28]计算黑曲霉孢子浓度,调整孢子悬浮液终浓度为1×107 CFU/mL。
1.3.2 常压室温等离子体诱变方法
取10 μL黑曲霉xj孢子悬浮液,均匀涂布于无菌金属载片表面,风干,将金属载片置于ARTP诱变育种仪内分别诱变30 s、60 s、90 s、120 s、150 s、180 s、210 s、240 s、270 s、300 s,其他诱变条件为诱变功率120 W、氦气(He)通气量10 L/min、辐射距离2 mm。诱变结束后将金属载片转移至装有无菌水的EP管中,在漩涡振荡仪上充分振荡以形成新的黑曲霉孢子悬液,用无菌涂布棒将不同处理时间下的黑曲霉孢子悬浮液稀释涂布于PDA培养基平板,28 ℃恒温培养24 h。以未处理样品(0 s)为对照,通过平板菌落计数法[29]计算诱变致死率,绘制菌株致死率曲线,其计算公式如下:
同时,考察诱变菌株所产絮凝剂对高岭土悬液的絮凝率,并计算正突变率,其计算公式如下:
最后,根据致死率及正突变率确定最佳诱变时间。
1.3.3 絮凝率的测定
絮凝剂的制备:取5mL孢子悬浮液(1×107CFU/mL)接种于PDB培养基中,装液量为100 mL/250 mL,30 ℃、120 r/min条件下振荡培养72 h,过滤,取发酵液,10 000 r/min冷冻离心10 min,上清液即为絮凝剂。
絮凝率的测定:取4 mL絮凝剂滴加入95 mL 0.4%的高岭土悬液中,以1 mL 1%CaCl2作为助凝剂,室温搅拌(400 r/min搅拌1 min,200 r/min搅拌5 min,80 r/min搅拌1 min),静置10 min,以滴加去离子水为对照,吸取液面1~2 cm处的液体,采用紫外分光光度计在波长550 nm处测定吸光度值,计算絮凝剂对高岭土悬液的絮凝率,其计算公式如下:
式中:A为对照的OD550nm值;B为样品的OD550nm值。
1.3.4 菌株絮凝活性的筛选
初筛:选取诱变菌株,制备絮凝剂,并计算其对高岭土悬液的絮凝率。
复筛:选取初筛诱变菌株中絮凝率≥80%的菌株,培养制备絮凝剂,并计算其对高岭土悬液的絮凝率,选取絮凝率≥80%菌株作为研究对象[30]。
1.3.5 菌株生物量的测定
选取复筛诱变菌株中絮凝率≥80%的菌株,对其进行同期发酵培养,通过测定菌体生长量来观测菌株生长状况[30]。
1.3.6 遗传稳定性分析
微生物的突变或退化极不稳定,为检验突变株在生产过程中的遗传稳定性,选取高絮凝突变株与原始黑曲霉xj接种于PDB培养基,装液量为100 mL/250 mL,30 ℃、120 r/min条件下振荡培养72 h,测定絮凝率,传代培养7次后,考察发酵液絮凝活性的稳定性。
2 结果与分析
2.1 ARTP诱变致死率和突变率曲线
大量研究表明,在常压室温等离子体诱变仪诱变育种过程中,气流量、照射距离、放电强度和照射时间是影响菌株诱变效率的显著因素[31]。为保证等离子体在40 ℃以下进行,设定氦气(He)通气量10 L/min、辐射距离2 mm、诱变功率100 W,在此条件下,等离子体诱变的辐射强度由工作时长决定[12,17]。不同诱变时间(0~300 s)条件下,黑曲霉xj的正突变率和致死率见图1。

图1 常压室温等离子体诱变时间对黑曲霉孢子致死率、正突变率的影响
Fig.1 Effect of atmospheric and room temperature plasma mutation time on lethality and positive mutation rate of Aspergillus niger spore
由图1可知,黑曲霉(Aspergillus niger)xj致死率与等离子体照射时间有明显的剂量累积效应,菌体的致死率随着照射时间的延长而升高。当照射时间>90 s之后,黑曲霉xj致死率>90%;当照射时间为150~300 s,致死率接近100%。诱变时间过长容易致死,而诱变时间过短不易发生突变。黑曲霉xj正突变率对着诱变时间的延长呈先升高后降低的趋势,当照射时间为90 s时,正突变率最高为27.8%。综合考虑正突变率与致死率,选择90 s为黑曲霉xj的最佳诱变时间。等离子体具有不定向性和随机性,据文献报道[32],菌株正突变率高,致死率>90%时,菌落易分散、生长较好、挑选单菌落方便。因此,主要选取正突变率高、致死率>90%的平板对絮凝剂高产菌株进行筛选。
2.2 高产絮凝剂菌株的筛选
通过初筛共获得416株对高岭土悬液具有絮凝活性的菌株,部分菌株的絮凝率见表1。
由表1可知,突变菌株的絮凝率均高于出发菌株,其中30株突变菌株的絮凝率较高,均>80%,较初始菌株提高了13.03%~25.99%。选取这30株突变菌株进行复筛,进一步测定絮凝率絮凝率>80%的菌株,结果见表2。
表1 产絮凝剂突变菌株的初筛部分结果
Table 1 Partial results of preliminary screening of flocculant-producing mutant strains
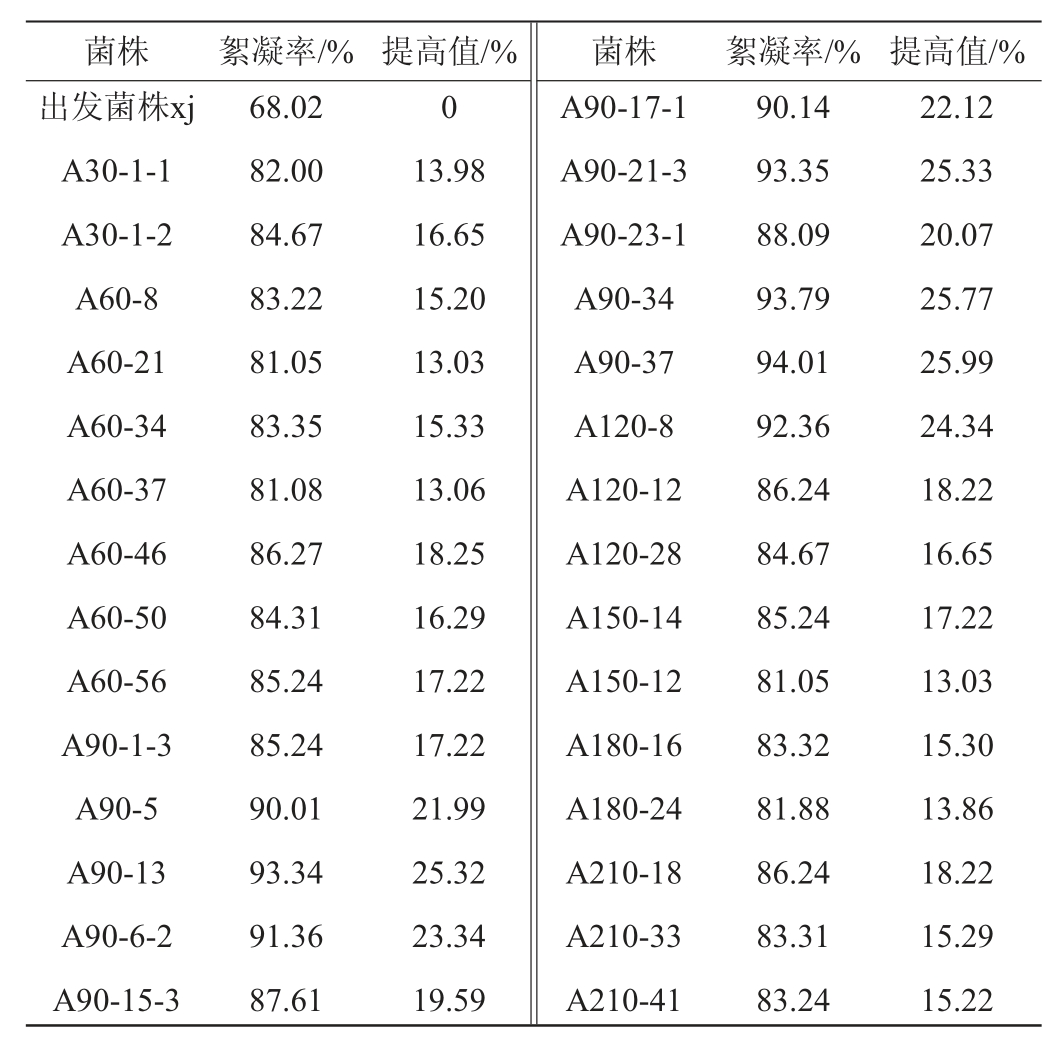
表2 产絮凝剂突变菌株的复筛结果
Table 2 Results of secondary screening of flocculant-producing mutant strains

由表2可知,复筛后只有10株菌株絮凝率>80%,表明初筛、复筛两次都有较好活性。其中突变菌株A90-37的絮凝率最高,为(94.96±0.15)%,较原始菌株高27.03%;其次为突变菌株A90-34,絮凝率为(94.12±0.16)%,较原始菌株高26.19%。为进一步研究复筛后菌株生长状况与活性,对10株菌同步发酵,测定生物量,结果见图2。
由图2可知,所有突变菌株的生长趋势与原始菌株一致,且较原始菌株生长较快,其中菌株A90-34与A90-37的生长最为迅速,与其活性较高呈一定相关性。

图2 原始菌和突变株的生长曲线
Fig.2 Growth curves of original strain and mutant strain
2.3 高产絮凝剂菌株的遗传稳定性分析
微生物菌株的遗传稳定性在实际的发酵生产应用中至关重要,突变菌株在传代生产絮凝剂过程中可能会发生回复突变,出现表型延迟或退化现象,从而导致高产诱变的菌株传代后出现生产性能衰退[33],因此需对菌株传代过程进行考察,确定其遗传过程中是否具有稳定性。为验证突变株遗传稳定性,对突变菌株进行7代连续发酵培养,并检测每一代发酵液的絮凝活性,结果见表3。
由表3可知,突变菌株A90-34和A90-37的P值>0.05,即菌株连续传代7次,絮凝率无显著差异(P>0.05),具有较良好的遗传稳定性,且絮凝率较高,为92%~95%。
表3 突变菌株的遗传稳定性
Table 3 Genetic stability of mutant strains

3 结论
本研究采用常压室温等离子体(ARTP)技术诱变黑曲霉(Aspergillus niger)xj,最佳诱变照射时间为90 s,通过摇瓶发酵培养筛选出2株高产絮凝剂的突变菌株A90-34和A90-37,其对高岭土悬液的絮凝率分别为94.12%和94.96%,与原始菌株相比,分别提高26.19%、27.03%,连续传代7次仍具有良好的遗传稳定性,絮凝率维持在92%~95%。
[1]林杨,刘淼,林锋,等.微生物絮凝剂研究进展及其在食品工业中的应用[J].中国酿造,2018,37(1):1-6.
[2]MARVASI M,VISSCHER P T,CASILLAS M L,et al.Exopolymeric substances(EPS)from Bacillus subtilis:polymers and genes encoding their synthesis[J].FEMS Microbiol Lett,2010,313(1):1-9.
[3]FLEMMING H C,SCHMITT K C,MARSHALL J.Sorption properties of biofilms[J].Water Sci Technol,1996,37(4-5):207-210.
[4]DOMINGUES V S,MONTEIRO A S,FERREIRA G F.Solid flocculation and emulsifying activities of the lipopolysaccharide produced by Trichosporon mycotoxinivorans CLA2[J].Appl Biochem Biotech,2016,182(1):367-381.
[5]MOSCOSO M,GARCIA R,LOPEZ E.Biofilm formation by Streptococcus pneumoniae:role of choline,extracellular DNA,and capsular polysaccharide in microbial accretion[J].J Bacteriol,2006,88(22):7785-7795.
[6]LI Y,XU Y,LIU L,et al.Flocculation mechanism of Aspergillus niger on harvesting of Chlorella vulgaris biomass[J].Algal Res,2017,25:402-412.
[7]LI Y,XU Y,LIU L,et al.First evidence of bioflocculant from Shinella albus with flocculation activity on harvesting of Chlorella vulgaris biomass[J].Bioresource Technol,2016,218:807-815.
[8]NAKAMURA J,MIYASHIRO S,HIROSE Y.Purification and chemical analysis of microbial cell flocculant produced by Aspergillus sojae AJ7002[J].Agric Biol Chem,1976,40(3):619-624.
[9]KURANE R,TAKEDA K,SUZUKI T.Screening for and characteristics of microbial flocculants[J].Agr Biol Chem,1986,50(9):2301-2307.
[10]LEE S H,SANG O L,JANG K L,et al.Microbial flocculant from Arcuadendron sp.TS-49[J].Biotechnol Lett,1995,17(1):95-100.
[11]HE J,ZOU J,SHAO Z Z,et al.Characteristics and flocculating mechanism of a novel bioflocculant HBF-3 produced by deep-sea bacterium mutant Halomonas sp.V3a[J].World J Microbiol Biotechn,2009,26(6):1135-1141.
[12]YIN Y J,TIAN Z M,TANG W,et al.Production and characterization of high efficiency bioflocculant isolated from Klebsiella sp.ZZ-3[J].Bioresource Technol,2014,171:336-342.
[13]李婵娟,严鹤松.微生物絮凝剂产生菌的筛选及其絮凝特性研究[J].湖北农业科学,2014,53(14):3283-3286.
[14]韩宴秀,莫创荣,周云新,等.絮凝剂产生菌克雷伯氏杆菌的筛选、鉴定及培养条件优[J].科学技术与工程,2014,18(14):177-182.
[15]AHMAD H R A,AZNI I,HAMID H R A,et al.Flocculation behavior and mechanism of bioflocculant produced by Aspergillus flavus[J].J Environ Manage,2015,150:466-471.
[16]SANJUKTA S,NEHA B,MIHIRJYOTI P,et al.Bioflocculant production and biosorption of zinc and lead by a novel bacterial species, Achromobacter sp.TERI-IASST N,isolated from oil refinery waste[J].Chemosphere,2014,113:116-124.
[17]赵东晓,杜建勋,董亚茹,等.常压室温等离子体对NaCl 胁迫下胡麻种子萌发及幼苗生理特性的影响[J].核农学报,2018,32(8):1466-1476.
[18]骆美洁,赵衍鑫,宋伟,等.常压室温等离子体对玉米种子及花粉萌发的影响[J].分子植物育种,2016,14(5):1262-1267.
[19]LI L,JIANG J F,LI J G,et al.Effects of cold plasma treatment on seed germination and seedling growth of soybean[J].Sci Rep,2014,5859:58-59.
[20]JIANG J F,HE X,LI L,et al.Effect of cold plasma treatment on seed germination and growth of whea[J].Plasma Sci Technol,2014,16(1):54-58.
[21]康富帅,颜兵,吕南拳,等.低嘌呤酿酒酵母的ARTP 法诱变育种[J].现代食品科技,2014,30(2):188-191.
[22]顾鹏飞,李萌,朱瑞宇,等.双缺陷型毕赤酵母X33 突变株的诱变育种[J].食品与生物技术学报,2016,35(2):129-135.
[23]BAO H J,LIU R M,LIANG L Y.Succinic acid production from hemicellulose hydrolysate by an Escherichia coli mutant obtained by atmospheric and room temperature plasma and adaptive evolution[J].Enzyme Microb Tech,2014,66(11):10-15.
[24]李刚,王俊,孙斌,等.应用Logistic 模型和王-兰-丁模型分析桑丁香假单胞菌突变株M90-1-的冠菌素产量提升因素[J].蚕业科学,2014,40(5):872-878.
[25]祁田甜,张婵,胡济美,等.常压室温等离子体诱变技术选育高产Monacolin K 紫色红曲霉突变株[J].食品科学,2015,36(9):66-70.
[26]自振滔,石文昊,李钰茜,等.利用等离子诱变技术改造纤维素酶生产丝状真菌工业菌株[J].中国酿造,2013,32(S1):5-8.
[27]梁美丹,肖剑,易云婷,等.食品微生物能力验证霉菌酵母菌计数—检验方法比较[J].轻工科技,2015,31(7):5-6.
[28]尚晓冬,李明容,王南,等.应用血球计数板检测灵芝破壁孢子粉破壁率的研究[J].食用菌学报,2005(2):37-40.
[29]马国善.食品微生物检验菌落总数测定方法的效果观察[J].中国医药指南,2018,16(20):47-48.
[30]熊星滢.淀粉废水培养黑曲霉产微生物絮凝剂及应用研究[D].成都:成都理工大学,2016.
[31]江耀祖,彭华松,张雪洪.基于ARTP 诱变和高通量筛选的绿针假单胞菌GP72 育种方法[J].微生物学通报,2017,44(10):2421-2427.
[32]HUA X F,WANG J,WU Z J,et al.A salt tolerant Enterobacter cloacae mutant for bioaugmentation of petroleum-and salt-contaminated soil[J].Biochem Eng J,2010,49(2):201-206.
[33]周德庆.微生物学教程[M].北京:高等教育出版社,2002:213-216.