海洋微生物生存于广阔的海洋,其生存环境具有低温、缺氧、高压、寡营养、高盐、低/无光照等特殊性,有更大的可能产生区别于常见的陆生微生物的结构新颖、作用机制独特的活性物质,因此成为化学、药学、生物学等领域关注的热点。
目前,对海洋微生物的生物活性研究涉及到抗菌、抗炎、抗病毒、抗肿瘤、抗污损和酶抑制等,涉及到的海洋微生物包括细菌、真菌、放线菌等[1-5]。其中,对海洋细菌抗菌作用的研究已有一些报道,主要物种有芽孢杆菌(Bacillus)、类芽孢杆菌(Paenibacillus)、假单胞菌(Pseudomonas)、粘细菌(Haliangium)、产碱杆菌(Alcaligenes)和海洋单胞菌(Marinomonas)等[6]。如王琦等[7]从连云港海域的海水中分离得到一株解淀粉芽孢杆菌(Bacillus amyloliquefaciens)GM-1,其对油菜菌核病菌(Sclerotinia scleotiorum)和白色念珠菌(Candida albicans)都有较强的抗菌作用,其中对白色念珠菌的抑菌带宽度为3.95 cm。张兴锋等[8]采用对峙生长法从红树内生细菌中筛选到1株海洋解淀粉芽孢杆菌CⅢ-1,其对金黄色葡萄球菌(Staphylococcus aureus)、溶藻弧菌(Vibrio alginolyticus)、青枯雷尔氏菌(Ralstonia solanacearum)、香蕉枯萎病菌(Fusarium oxysporum f.sp.cubense)、辣椒疫霉菌(Phytophthora capsici)等动植物病原菌均表现出较强的拮抗作用。李德全等[9]从海藻中分离获得的枯草芽孢杆菌(Bacillus subtillis)NH-8对草莓灰霉病有很好的抑制效果。薛珊珊等[10]从硇洲岛和徐闻珊瑚礁自然保护区潮间带采集海水和沉积物标本,从106株海洋细菌中筛选出44株具有抗菌活性的菌株,其中31株对枯草芽孢杆菌具有拮抗作用,11株对金黄色葡萄球菌具有拮抗作用,13株对大肠埃希氏菌(Escherichia coli)具有拮抗作用。JIN L M等[11-16]得到了多株具有抗菌活性的海洋微生物。但是,目前对不常见海域—北冰洋来源的海洋微生物的研究较少。
本试验以大肠埃希氏菌、金黄色葡萄球菌、鼠伤寒沙门氏菌(Salmonella typhimurium)、白色念珠菌、铜绿假单胞菌(Pseudomonas aeruginosa)、屎肠球菌(Enterococcus faecium)、肺炎克雷伯氏菌(Klebsiella pneumoniae)等多种食源性致病菌为指示菌,拟从北冰洋海域沉积物样品中分离筛选出一株对多种食源性致病菌具有广谱抗菌性的海洋细菌,并通过形态观察、生理生化试验及分子生物学技术进行鉴定。然后,以菌株发酵液对白色念珠菌的抑菌圈直径大小作为响应值,采用单因素试验和响应面试验优化菌株的培养条件,以期获得最佳的培养条件和更多的活性代谢产物,为今后继续研究该菌株的活性代谢产物奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
沉积物样品:中国第六次北极考察的北冰洋沉积物样品。
铜绿假单胞菌(PAO1)、白色念珠菌(SN250)、金黄色葡萄球菌(ATCC6538)、鼠伤寒沙门氏菌(CICC21484)、大肠埃希氏菌(ECMCC44102)、鲍曼不动杆菌(BNCC194496)、屎肠球菌(BNCC336951)、肺炎克雷伯氏菌(BNCC186113):本实验室保藏。
1.1.2 试剂
胰蛋白胨、琼脂、酵母提取物(均为生化试剂):北京奥博星生物技术责任有限公司;氯化钠、无水乙醇(均为分析纯):天津科密欧化学试剂有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
LB海水培养基:酵母提取物5 g,胰蛋白胨10 g,琼脂20 g,氯化钠10 g,海水1 L,pH 7.0。液体培养基中不加入琼脂。
LB固体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠5 g,琼脂20 g,去离子水1 L,pH 7.0。
营养肉汤(nutrient broth,NB)培养基:18 g,琼脂20 g,去离子水1 L,pH 7.0。
脑心浸液肉汤(brain heart infusion,BHI)培养基:38.5 g,琼脂20 g,去离子水1 L,pH 7.0。
MRS培养基:52.2 g,琼脂20 g,去离子水1 L,pH 7.0。以上培养基均在121 ℃条件下高压灭菌20 min。
1.2 仪器与设备
MLS-3020-湿热高压灭菌器:日本SANYO公司;SW-OJ-2FD洁净工作台:中国苏州安泰安气技术有限公司;Rota vapor R-200型旋转蒸发仪:瑞士BUCHI公司;HWY111型恒温培养振荡器:中国智诚分析仪器制造公司;MT-180B生化恒温培养箱:中国上海新苗医疗器械制造有限公司;3×32-well聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems ProFlex公司。
1.3 方法
1.3.1 北冰洋来源细菌的分离和纯化
北冰洋来源细菌的分离采用涂布平板法。称取0.5 g北冰洋沉积物样品,加入4.5 mL陈海水,混匀后静置2 h。再取0.5 mL此样品加入4.5 mL陈海水中,以此类推,配制成10-7~10-4稀释浓度的样品50 μL,涂布于LB海水培养基平板。28 ℃条件下培养1~2 d,获得单菌落。挑取单菌落,采用平板划线法纯化菌株,并进行编号。
1.3.2 抑菌谱的测定
将保藏的菌株划线于LB海水固体培养基上,37 ℃活化12 h,挑取单菌落接种于装有100 mL LB海水培养基的三角瓶中,180 r/min、37 ℃条件下振荡培养1 d,获得种子液。
将种子液按0.1%(V/V)的接种量接种到200 mL LB海水培养基中,37 ℃、180 r/min条件下培养24 h,4 ℃、6 000 r/min条件下离心10 min,取上清。然后50 ℃旋蒸至干,加入3 mL超纯水,用0.22 μm无菌滤膜过滤浓缩液,得到粗发酵液。
采用琼脂扩散法[12]测定发酵液对8种病原微生物(大肠杆菌、金黄色葡萄球菌、白色念珠菌、铜绿假单胞菌、鼠伤寒沙门氏菌、肺炎克雷伯氏菌、屎肠球菌和鲍曼不动杆菌)的抑菌活性,筛选获得广谱抗菌海洋细菌。
5种常见病原微生物(大肠杆菌、金黄色葡萄球菌、白色念珠菌、铜绿假单胞菌、鼠伤寒沙门氏菌)应用LB培养基;肺炎克雷伯菌应用NB培养基;鲍曼不动杆菌应用BHI培养基;屎肠球菌应用MRS培养基。
1.3.3 广谱抗菌海洋细菌的鉴定
形态观察及生理生化鉴定:参考《常见细菌系统鉴定手册》[17]和《伯杰细菌鉴定手册》[18]对广谱抗菌海洋细菌进行形态观察和生理生化鉴定。
分子生物学鉴定:将筛选出的菌株接种于LB海水培养基,28 ℃培养36 h。采用煮沸法[19]提取脱氧核糖核酸(deoxyribonucleic acid,DNA)。以其为模板,采用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492r(5'-AAGTCGTAACAAGGTAACG-3')对菌株的16S rDNA序列进行PCR扩增。PCR扩增体系:模板DNA 1.0 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)Mixture 1.0μL,rTaq酶(5U/μL)0.25μL,引物27F(10μmol/L)1.0μL,引物1492r(10 μmol/L)1.0 μL,10×Loading Buffer 4.0 μL,无菌双蒸水(ddH2O)补充至50 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min。PCR扩增产物于4 ℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测后,送至宝生物工程(大连)有限公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST比对,选取同源性较高的模式菌株的16S rDNA序列,利用MEGA 6.0软件中的邻接(neighbor joining,NJ)法构建系统发育树,以确定该菌株的分类地位。
1.3.4 发酵条件优化
单因素试验:将筛选菌株按1%接种量接种于LB海水培养基,37 ℃、180 r/min条件下分别培养12 h、24 h、36 h、48 h、60 h、72 h、84 h,初始pH值为7.0。采用琼脂扩散法分别测定菌株对白色念珠菌的抑菌活性,测3次,取平均值。采用单因素轮换法依次考察发酵温度(29 ℃、31 ℃、33 ℃、35 ℃、37 ℃、39 ℃)、初始pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)、转速(140 r/min、160 r/min、180 r/min、200 r/min、220 r/min)对菌株抗白色念珠菌活性的影响。
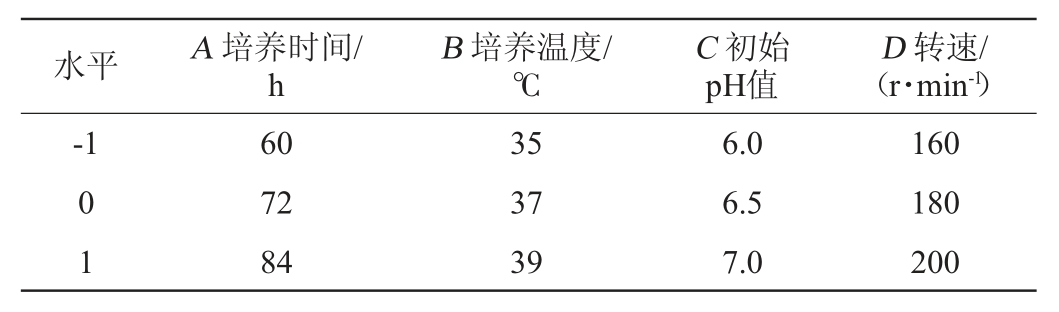
响应面试验:在单因素试验结果的基础上,以抑菌圈直径(Y)为响应值,选取培养时间(A)、培养温度(B)、初始pH值(C)、转速(D)为考察因素,设计4因素3水平的Box-Behnken试验[20-21],以-1、0、1分别代表自变量的低、中、高水平,各因素与水平见表1。
表1 发酵条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests for fermentation condition optimization
利用Design-expert.V 8.0.6软件对所得到的试验数据进行二次回归拟合,首先得到多元二次回归方程,然后根据回归方程进一步绘制响应面立体分析图,最后根据分析结果,确定菌株的最佳发酵条件。
2 结果与分析
2.1 北冰洋来源细菌的分离和纯化结果
从北冰洋沉积物样品中共筛得140个单菌落。
2.2 抑菌谱的测定结果
通过测定抑菌谱发现,52号菌株对白色念珠菌、金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌、鼠伤寒沙门氏菌、肺炎克雷伯氏菌都有一定的抑制作用,为一株广谱抗菌的菌株,其抑菌效果见表2。
表2 52号菌株抑菌谱测定结果
Table 2 Determination results of antimicrobial spectrum of strain NO.52
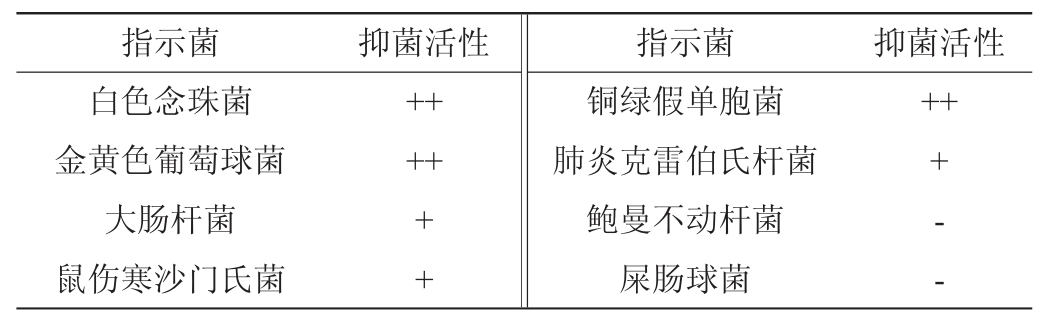
注:“+”表示抑菌圈直径为12~17 mm,低敏;“++”表示抑菌圈直径为17~22 mm,高敏;“-”表示无抑菌活性。
由表2可知,52号菌株对白色念珠菌、金黄色葡萄球菌及铜绿假单胞菌的抑菌活性较强,抑菌圈直径为17~22 mm;对大肠杆菌、鼠伤寒沙门氏菌、肺炎克雷伯氏杆菌的抑菌活性较弱,抑菌圈直径为12~17 mm;而对鲍曼不动杆菌及屎肠球菌无抑菌作用。
2.3 52号菌株的鉴定结果
2.3.1 形态学鉴定结果
52号菌株的菌落形态及细胞形态见图1。由图1可见,52号菌株的菌落呈微隆起的圆形,颜色呈黄白色,无褶皱;细胞呈短杆状。

图1 52号菌株的菌落(a)及细胞(b)形态
Fig.1 Colonial (a) and cell (b) morphology of strain NO.52
2.3.2 生理生化鉴定结果
52号菌株的生理生化试验结果见表3。由表3可知,革兰氏染色、硝酸盐试验、柠檬酸盐试验、V-P试验、接触酶试验、淀粉水解试验、葡萄糖产气试验、明胶液化试验结果均呈阳性;甲基红试验、吲哚试验、H2S试验和尿素试验结果均呈阴性。因此,初步鉴定52号菌株为芽孢杆菌属(Bacillus sp.)。
表3 52号菌株的生理生化特征
Table 3 Physiological and biochemical characteristics of strain NO.52

注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.3.3 分子生物学鉴定结果
52号菌株的系统发育树见图2。由图2可知,52号菌株与枯草芽孢杆菌(Bacillus subtilis)聚于一支,亲缘关系最近。结合形态观察及生理生化试验结果,将52号菌株鉴定为枯草芽孢杆菌(Bacillus subtilis)。

图2 基于16S rDNA基因序列52号菌株的系统发育树
Fig.2 Phylogenetic tree of strain NO.52 based on 16S rDNA gene sequences
2.4 发酵条件优化结果
2.4.1 单因素试验结果
培养时间、温度、初始pH值及转速对52号菌株抗白色念珠菌活性的影响见图3。
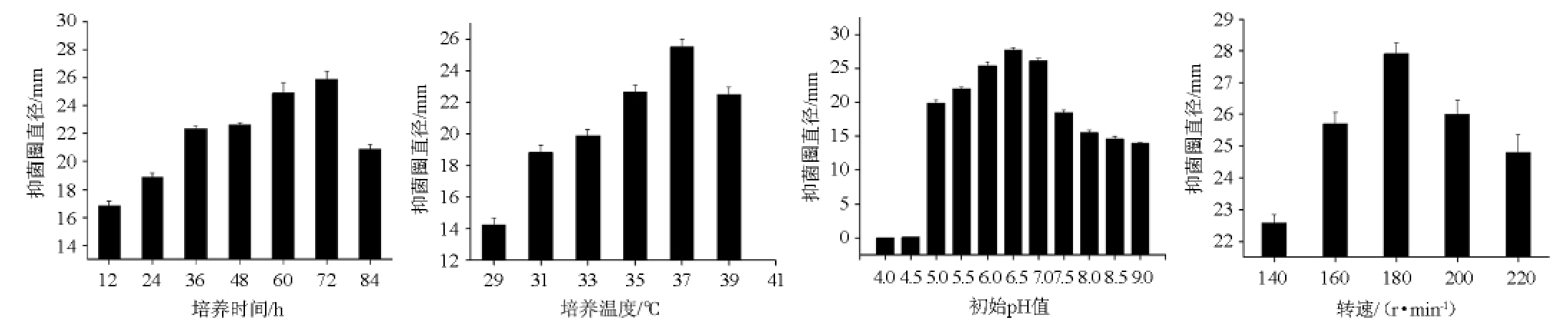
图3 不同培养条件对52号菌株抗白色念珠菌活性的影响
Fig.3 Effect of different culture conditions on anti-Candida albicans activity of strain NO.52
由图3可知,随着培养时间、培养温度、初始pH值及转速的增加,抑菌圈直径均呈现先增加后降低的趋势。当培养时间、培养温度、初始pH值及转速分别为72 h、37 ℃、6.5、180 r/min时,抑菌直径均达到最大,分别为25.81 mm、25.52 mm、27.91 mm、27.83 mm。因此,确定最佳培养时间、培养温度、初始pH值及转速分别为72 h、37 ℃、6.5、180 r/min。
2.4.2 响应面试验结果
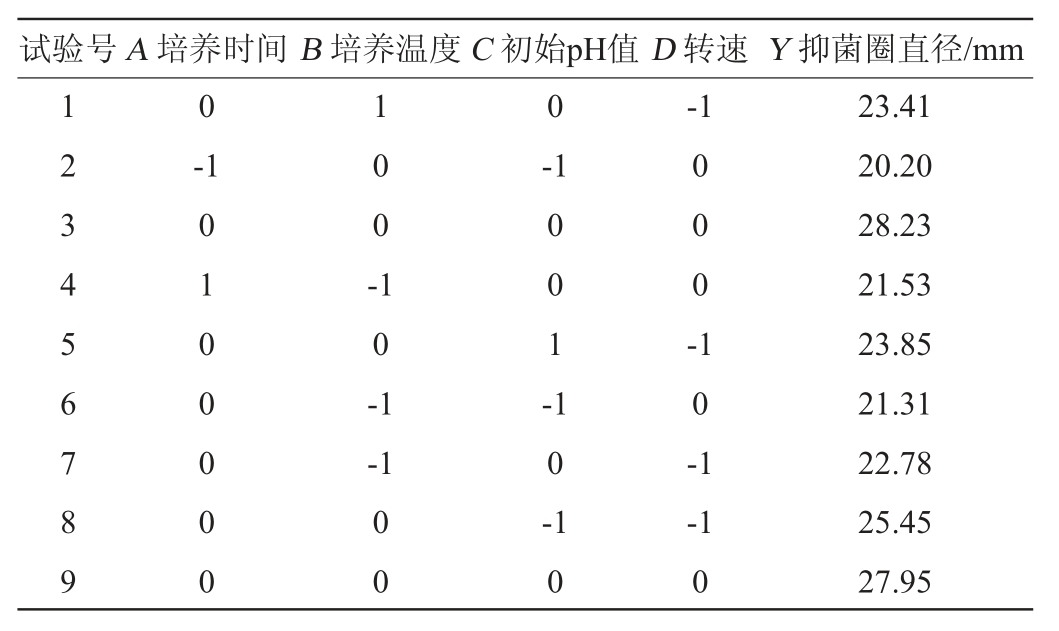
响应面试验结果与分析见表4,方差分析结果见表5。
表4 Box-Behnken试验结果与分析
Table 4 Results and analysis of Box-Behnken tests
续表
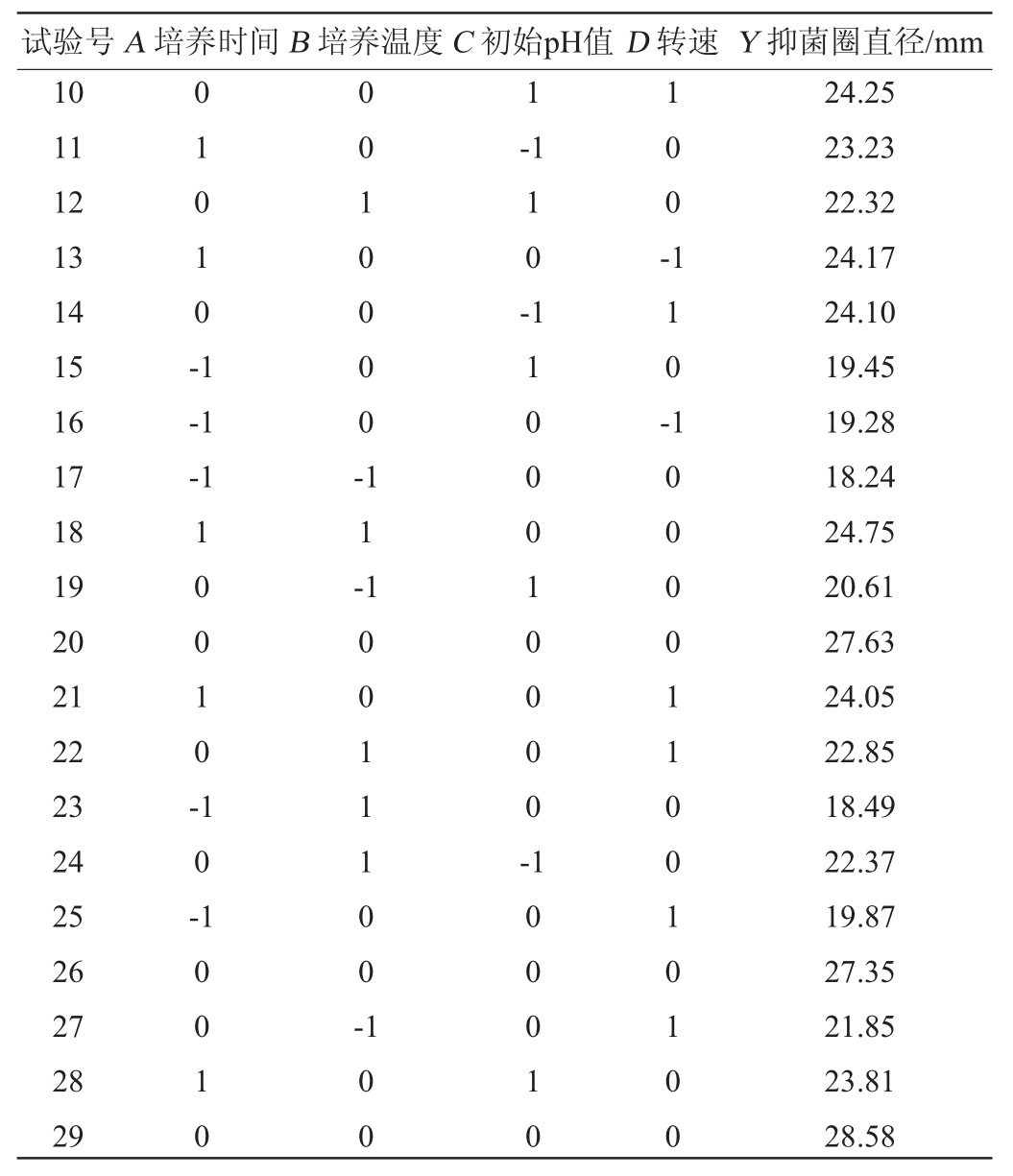
表5 回归模型的方差分析
Table 5 Variance analysis of regression model
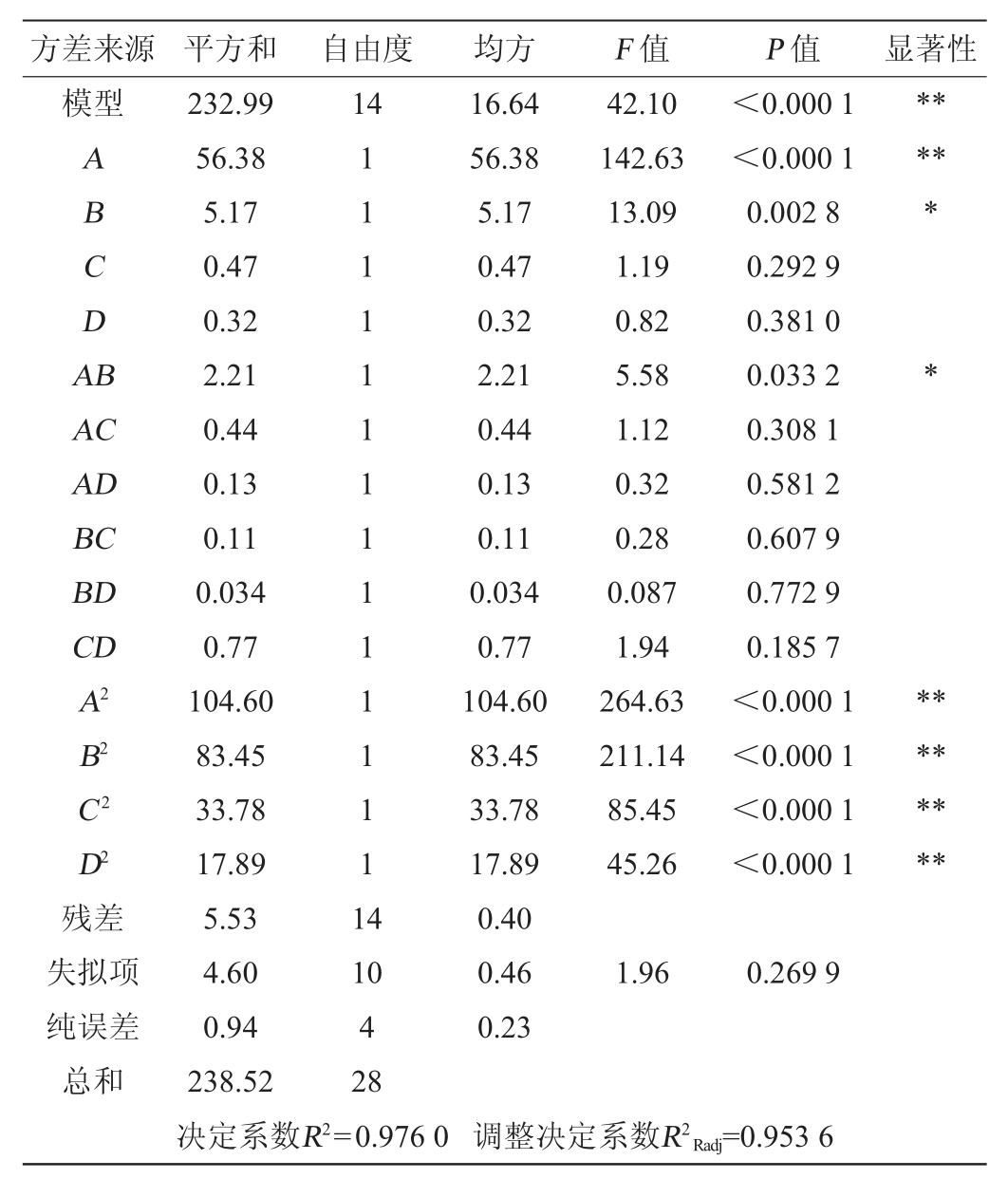
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
应用Design-Expert.V 8.0.6软件对表4的试验结果进行多元回归拟合,得到抑菌圈直径(Y)对自变量培养时间(A)、培养温度(B)、初始pH值(C)以及转速(D)的二次回归方程:Y=27.95+2.17A+0.66B-0.20C-0.16D+0.74AB+0.33AC-0.18AD+0.16BC+0.093BD+0.44CD-4.02A2-3.59B2-2.28C2-1.66D2。
由表5可知,模型的P值<0.01,极显著,说明模型构建成功,能反应响应值的变化。失拟项P值>0.05,不显著,说明回归方程拟合效果较好,模型选择恰当。决定系数R2=0.9760,调整决定系数R2adj=0.953 6,说明该模型的预测值与实际值具有较好的拟合性,可以用此模型对抑菌圈直径进行预测。各因素对抑菌圈直径影响的主次顺序为A>B>C>D,其中一次项A、二次项A2、B2、C2、D2对结果影响极显著(P<0.01),一次项B及交互项AB对结果影响显著(P<0.05),而其他项对结果影响不显著(P>0.05)。应用Design-Expert.V 8.0.6软件,绘制响应面立体分析图,结果见图4。由图4可知,响应面开口朝下,响应值随着各自变量值的增大先增大后减小,存在最大值,且交互作用AB影响显著。
通过Design-Expert.V 8.0.6软件对模型进行优化求解,得到52号菌株的最佳培养条件为培养时间75.38 h、培养温度36.24 ℃、培养基初始pH值6.29、转速178.71 r/min,预测的抑菌圈直径为32.56 mm。考虑到实际操作的可行性,将最佳培养条件修订为培养时间75 h、培养温度36 ℃、培养基初始pH值6.5、摇床转速178 r/min。在此最优条件下进行3组平行验证试验,结果表明,52号菌株对白色念珠菌抑菌直径达到30.23 mm,与预测理论值相对误差较小,说明回归模型预测值具有良好符合性,结果可信。

图4 各因素交互作用对52号菌株抗白色念珠菌活性的影响的响应面及等高线
Fig.4 Response surface plots and contour lines of interaction between each factors on anti-Candida albicans activity of strain NO.52
3 结论
从北冰洋沉积物样品中分离筛选出一株广谱抗菌的52号菌株,其对白色念珠菌、金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌、鼠伤寒沙门氏菌、肺炎克雷伯氏菌均有一定的抑制作用,经形态观察、生理生化试验及分子生物学技术鉴定为枯草芽孢杆菌(Bacillus subtilis)。通过单因素试验和响应面试验确定最佳培养条件为培养温度36 ℃、培养时间75 h、培养基初始pH值6.5、转速178 r/min。在此最优培养条件下,52号菌株对白色念珠菌的抑菌圈直径为30.23 mm。
[1]IMHOFF J F.Natural products from marine fungi-still an underrepresented resource[J].Mar Drugs,2016,14(1):19.
[2]金黎明,金鑫浩,侯熙彦,等.具有抗菌活性的海洋真菌天然产物研究进展[J].中国海洋药物,2017,36(4):66-74.
[3]BLUNT J W,COPP B R,KEYZERS R A,et al.Marine natural products[J].Nat Prod Rep,2015,32:116-211.
[4]樊梦霖,余伯阳,顾觉奋.海洋微生物抗菌活性物质研究进展[J].国外医药:抗生素分册,2014,35(4):145-148.
[5]赵成英,朱统汉,朱伟明.2010-2013 之海洋微生物新天然产物[J].有机化学,2013,33:1195-1234.
[6]孙晓磊,闫培生,王凯,等.深海细菌及其活性物质防控植物病原真菌的研究进展[J].生物技术进展,2015,5(3):176-184.
[7]王琦,汪晶晶,顾春霞,等.两株抗菌海洋细菌对白色念珠菌的抗菌作用稳定性研究[J].药物生物技术,2016,23(3):226-230.
[8]张兴锋,柳凤,何红,等.红树内生细菌CⅢ-1 菌株鉴定及其胞外抗菌蛋白性质[J].微生物学通报,2010,37(2):222-227.
[9]李德全,钱亚明,周鸣鸣,等.海洋细菌NH-8 防治草莓灰霉病机理及其抗菌物质分析[J].植物保护学报,2016,43(2):215-221.
[10]薛珊珊,刘颖文,王洁,等.湛江沿海潮间带产胞外抗菌活性海洋细菌的分离鉴定及生物多样性分析[J].基因组学与应用生物学,2017,36(5):2005-2014.
[11]JIN L M,QUAN C S,HOU X Y,et al.Potential pharmacological resources:natural bioactive compounds from marine-derived fungi[J].Mar Drugs,2016,14(4):76.
[12]王硕,孟庆丽,武天娇,等.抗金葡菌深海真菌的分离鉴定及抑菌谱研究[J].生物技术,2015,25(2):169-172.
[13]包艳春,陈苛蒙,徐哲,等.拮抗弧菌的海洋微生物的筛选[J].山东化工,2017,46(19):48-49.
[14]蔡思琦,韩佳延,金黎明.海洋真菌ZJ353 对植物病原菌的抑菌谱研究[J].山东化工,2016,45(17):25-26.
[15]赵晶,李天,金黎明,等.具有AHL 降解能力的海洋微生物的筛选与鉴定[J].大连民族学院学报,2015,17(1):35-38.
[16]张佳惠,赵晓蕾,赵胜楠,等.深海芽孢杆菌No.461 发酵条件的优化[J].山东化工,2015,44(18):118-119,122.
[17]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-386.
[18]BUCHANAN R E,GIBBONS N E.伯杰细菌鉴定手册(8 版)[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:729-736.
[19]许琼,李文静,田芯瑗,等.磁珠法和煮沸法核酸提取在HPV-DNA 分型中的比较[J].检验医学与临床,2018,15(6):764-767.
[20]梁宝东,魏海香,姜淑喆,等.大蒜皮降解芽孢杆菌属细菌J-5 发酵条件优化[J].食品科学,2016,37(21):202-208.
[21]张杰,侯潞丹,贺志斌.响应面试验优化杏鲍菇液体发酵菌种培养条件[J].食品科学,2017,38(6):147-152.