酿酒酵母(Saccharomyces cerevisiae)是一种单细胞真菌,作为重要的生产用微生物,在医药、食品和生物能源等方面被广泛应用[1-2]。酿酒酵母具有易于培养、繁殖迅速、代谢产物少、碳源利用率高以及可存活于较低pH环境的特点[3-4];并且,酿酒酵母被认为是安全的微生物,遗传背景清晰,基因操作技术成熟,是一种模式微生物,便于进行基因改造[5]。2,3-丁二醇(2,3-butanediol,2,3-BD)作为一种平台化合物,被广泛应用于食品、医药以及航空航天等领域。目前,2,3-BD的生产方法主要有化学合成法和生物转化法两种[6]。前者生产成本高、工艺繁琐、不易操作以及对环境污染严重等缺点而很难得到广泛应用[7]。而生物转化法是利用微生物发酵来生产2,3-BD,其生产成本低、条件温和以及易于操作,同时符合低碳、环保和经济的发展目标,受到越来越多的关注[8]。因此,以酿酒酵母作为出发菌株生产2,3-BD具有一定优势。
酿酒酵母在以葡萄糖为底物产2,3-BD的过程中,丙酮酸通过乙酰乳酸合成酶合成a-乙酰乳酸,其在微氧条件下能够自发脱羧生成双乙酰,在双乙酰还原酶的作用下生成乙偶姻并通过BDH转化为2,3-BD[9-10]。因此,生成2,3-BD的主要酶为2,3-丁二醇脱氢酶(2,3-butanediol dehydrogenase,BDH),乙偶姻作为2,3-BD的前体物质,可直接转化产生2,3-BD。因此,可通过研究乙偶姻的产生情况,来筛选出具有2,3-BD产生能力的菌株。GONZALEZ E等[11]通过减少2,3-BD的产生,发现其增加了乙偶姻的积累。MOES J等[12]研究发现,改变溶氧水平可使乙偶姻与2,3-BD进行相互转化。LI L等[13]将阴沟肠杆菌的BDH基因表达在了大肠杆菌中,使2,3-BD的产量大幅提高。检测2,3-BD的方法主要有色谱法,虽然可较直接测定其含量,但对设备要求较高,费时费力[14]。而由于2,3-BD可直接由乙偶姻转化产生,两者之间有着密不可分的关系。因此,利用一种快速简单的方法去检测乙偶姻的含量,以达到筛选2,3-BD生产菌株的目的。
本研究将39株W系列菌株(W4、W22、W23、W25、W27、W39、W41、W55、W57、W58、W61、W63、W65、W66、W67、W68、W70、W74、W82、W87、W96、W108、W109、W117、W119、W120、W121、W124、W130、W132、W135、W139、W140、W141、W143、W144、W148以及W149)、土壤样品中分离出的5株菌株(Y1、C1、Y2、Z1和E1),以及酒糟中分离出的1株菌株(J1)作为候选菌株,进行可产2,3-BD菌株的筛选。并使用形态学和分子生物学手段对高产2,3-BD的菌株进行鉴定,之后摇瓶发酵培养进行菌株发酵性能(OD600nm、pH、葡萄糖剩余量以及2,3-BD产量)的检测。其研究结果为酿酒酵母(S.cerevisiae)菌株的利用提供了理论基础与指导,并有助于深入了解2,3-BD产生的作用机制。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
菌株W4、W22、W23、W25、W27、W39、W41、W55、W57、W58、W61、W63、W65、W66、W67、W68、W70、W74、W82、W87、W96、W108、W109、W117、W119、W120、W121、W124、W130、W132、W135、W139、W140、W141、W143、W144、W148以及W149等:黑龙江大学微生物重点实验室提供;菌株Y1分离于鱼塘、菌株C1分离于菜园、菌株Y2分离于玉米场、菌株Z1分离于猪舍、菌株E1分离于鹅棚、菌株J1分离于酒糟;大肠杆菌(Escherichia coli)DH5α:黑龙江大学微生物重点实验室提供;pMDTM18-T(产品号6011):大连宝生物有限公司。
1.1.2 化学试剂
蛋白胨、酵母提取物、琼脂粉、酵母基础氮源培养基(yeast nitrogen base,YNB)(均为生化试剂)、氯化钠、葡萄糖、(NH4)2SO4、KH2PO4、无水CaCl2、K2HPO4、MgSO4·7H2O、(NH4)2HPO4(均为分析纯):天津市科密欧化学试剂有限公司;质粒小提试剂盒(目录号DP103)、酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒(目录号DP307-02)、普通琼脂糖凝胶DNA回收试剂盒(目录号DP209):天根生化科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)法蛋白含量测定试剂盒(目录号YW3-1):苏州科铭生物技术有限公司。
1.1.3 培养基
LB液体培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 7.0。121 ℃高压灭菌15 min。
LB固体培养基:于LB液体培养基中加入2%的琼脂粉。121 ℃高压灭菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:蛋白胨20 g/L,酵母提取物10 g/L,葡萄糖20 g/L,pH值自然。108 ℃高压灭菌20 min。
YPD固体培养基:于YPD液体培养基中加入2%的琼脂粉。108 ℃高压灭菌20 min。
发酵培养基:葡萄糖80 g/L,无氨基酵母氮源(yeast nitrogen base without amino acids,YNB)3.4 g/L,蛋白胨20 g/L,K2HPO43 g/L,KH2PO411.8 g/L,(NH4)2SO410 g/L,pH值自然。108 ℃高压灭菌20 min。
1.2 仪器与设备
LC20A高效液相色谱(high performance liquid chromatography,HPLC)仪:岛津国际贸易(上海)有限公司;JY92-2D超声波细胞粉碎机:宁波新芝有限公司;Alphalmager HP凝胶成像系统:美国Protein Simple公司;A560紫外可见分光光度计:翱艺仪器(上海)有限公司;ABI9700聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Life Technologies公司;PB-21 pH计:赛多利斯科学仪器有限公司。
1.3 方法
1.3.1 肌酸显色法筛选2,3-丁二醇产生菌
在碱性介质中,乙偶姻与含胍基的化合物反应生成红色物质,并且在α-萘酚存在的情况下可以促进并加速红色物质生成,利用这一化学特性对菌株进行筛选,筛选出具有明显显色的菌株用于后续试验。由于该红色络合物在波长520 nm处有光吸收,其吸光度值与乙偶姻浓度成正比,依此对发酵液中的乙偶姻同时进行了定量检测[15-16]。
乙偶姻标准曲线绘制:分别取质量浓度分别为0、0.1g/L、0.2 g/L、0.3 g/L、0.4 g/L的乙偶姻标准品溶液25 μL,加入5%α-萘酚1 mL,0.5%肌酸1 mL,10%NaOH 1 mL和ddH2O 7 mL,30 ℃、140 r/min培养30 min后在波长520 nm条件下测其吸光度值。
将活化至对数期的菌株,分别按5%的接种量接种到以80g/L葡萄糖为单碳源的发酵培养基中,装液量100mL/250mL,30 ℃、140 r/min发酵72 h。每隔12 h取样,按绘制标准曲线回归方程计算乙偶姻含量。
1.3.2 菌株的鉴定
根据《酵母菌分类学研究》第四版中的酵母菌鉴定标准方法,利用光学显微镜和体视镜进行观察,观察细胞的大小及形态、菌落质地、菌落颜色、菌落表面特征、菌落边缘和生殖特征等,进行形态学鉴定。
根据18S rDNA序列的保守性,采用真菌18S rDNA通用引物NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS8(5'-TCCGCAGCTTCACCTACGGA-3')进行PCR扩增,PCR扩增体系:模板DNA 2μL,上下游引物(1 pmol/μL)各1 μL,Prime STAR Max Premix(2X)12.5 μL,ddH2O 8.5 μL。PCR扩增条件:94 ℃预变性5 min;98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸60 s,共30个循环;72 ℃再延伸5 min。将利用琼脂糖凝胶回收试剂盒回收得到的PCR产物与pMDTM18-T载体连接,利用热激法转化至大肠杆菌(E.coli)DH5α感受态细胞中,并涂布于含有氨苄青霉素(终质量浓度为100 μg/mL)的LB平板上,挑取长势较好的白色单菌落进行菌落PCR鉴定(使用引物NS1和NS8),将验证正确的菌落接种至LB培养基中进行过夜培养,送至上海生工生物工程股份有限公司进行测序。将测序结果提交至美国国家生物信息中心(national center for biological information,NCBI)利用BLAST程序分析比对测序结果,寻找与目的序列相似性最高的已知分类地位的酵母菌,利用MEGA 6.0软件绘制系统发育树,判断种属分类地位。
1.3.3 菌株发酵性能探究
将活化至对数期的菌株,按5%的接种量和100mL/250mL的装液量,接种到底物质量浓度为80 g/L的发酵培养基中,30 ℃、140 r/min振荡培养72 h,每隔12 h取样一次,测定发酵液在波长600 nm条件下的吸光度值(OD600nm)和发酵液的pH值变化,用HPLC检测菌株底物消耗与产物生成情况,包括葡萄糖剩余量以及2,3-BD的产量。
1.3.4 BDH酶活检测
将活化至对数期的出发菌株按5%的接种量,接种到装液量为150mL/500 mL,底物质量浓度为80g/L的发酵培养基中,30 ℃、140 r/min振荡培养72 h,每隔12 h取样,13 000 r/min常温离心8 min收集菌体,加入1 mL pH 6.5磷酸盐缓冲液后再次离心弃上清,加入1.5 mL pH 6.5磷酸盐缓冲液,超声波破碎菌体(功率20%,超声3 s,间隔10 s,重复30次),4 ℃,8 000 r/min,离心10 min,收集上清并进行2,3-丁二醇脱氢酶(BDH)酶活测定[17]。2,3-丁二醇脱氢酶酶活定义:是指在最适条件下,在1 min内能转化1 μmol底物的酶量为1个酶活力单位(U/mg)。
2 结果与分析
2.1 肌酸显色法筛选2,3-丁二醇产生菌
从酿酒酵母代谢葡萄糖产2,3-BD的路径可以看出,乙偶姻是2,3-BD产生的最直接前体物质,菌株对乙偶姻的积累和转化间接反映出其生产2,3-BD的能力。因此,利用肌酸显色法对菌株进行筛选,W5、W25、W27、W39、W41、W58、W61、W87、W96、W108、W119、W135、W141、J1、Z1、Y2、C1和E1等18株菌株具有明显地显色效果。乙偶姻产量测定结果见图1。
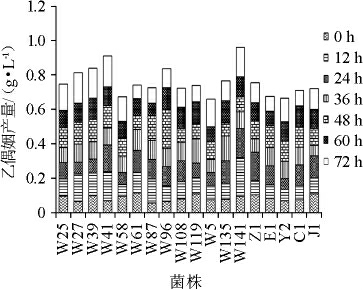
图1 乙偶姻产量测定结果
Fig.1 Detection results of acetoin content
由图1可知,乙偶姻的积累量呈现先增高后降低再增高的趋势,并且大部分菌株在发酵12 h时出现第一个积累点,这可能是由于在发酵之初菌株大量利用葡萄糖促进自身生长繁殖,使得乙偶姻得以积累。24 h到60 h的乙偶姻积累量逐渐降低,但在72 h时升高。12 h和72 h这两个时间点也成为了影响2,3-BD产量的关键点[18]。菌株W141乙偶姻产量最大为0.225 g/L(12 h),其次是W96,产量为0.223 g/L(48 h)。因此,选择菌株W141进行下一步实验。
2.2 菌株的鉴定
2.2.1 形态学鉴定
取稀释适当倍数的菌株W141的菌悬液于光学显微镜下观察细胞形态(图2A),细胞呈卵圆形、5~7 μm左右、繁殖方式为出芽繁殖;在体视镜下观察菌落形态(图2B),菌落为乳白色、湿润、隆起、菌落整体黏稠、表面较光滑、容易挑起、质地较均匀、直径在0.5~0.6 cm、正反面与边缘以及中心部位的颜色都很均一。

图2 菌株W141菌落形态(A)和细胞形态(B)
Fig.2 Colony morphology (A) and cell morphology (B) of strain W141
2.2.2 分子生物学鉴定
18S rDNA序列系统进化树分为多个簇,每簇之上又分出若干亚簇,表明酵母之间的遗传多样性。以菌株DNA为模板,PCR扩增菌株的18SrDNA基因,得到碱基长度为1702bp,结果见图3。

图3 菌株W141基于18S rDNA序列系统进化树
Fig.3 Phylogenetic tree of strain W141 based on 18S rDNA sequences
由图3可知,在此进化树中,菌株W141处于进化树的上部亚簇中,与酿酒酵母(S.cerevisiae)strainFJU-YS5(EF153845.1)的亲缘关系最近,序列的相似度达到99%。结合形态学观察结果,菌株W141被鉴定为酿酒酵母(Saccharomycescerevisiae)。
2.3 菌株发酵性能探究
将菌株活化至对数期,按5%的接种量接种到装液量为100 mL/250 mL,葡萄糖质量浓度为80 g/L的发酵培养基中,30 ℃、140 r/min振荡培养72 h,每12 h取样一次,测定pH、OD600nm、葡萄糖剩余量以及2,3-BD产量,结果见图4。
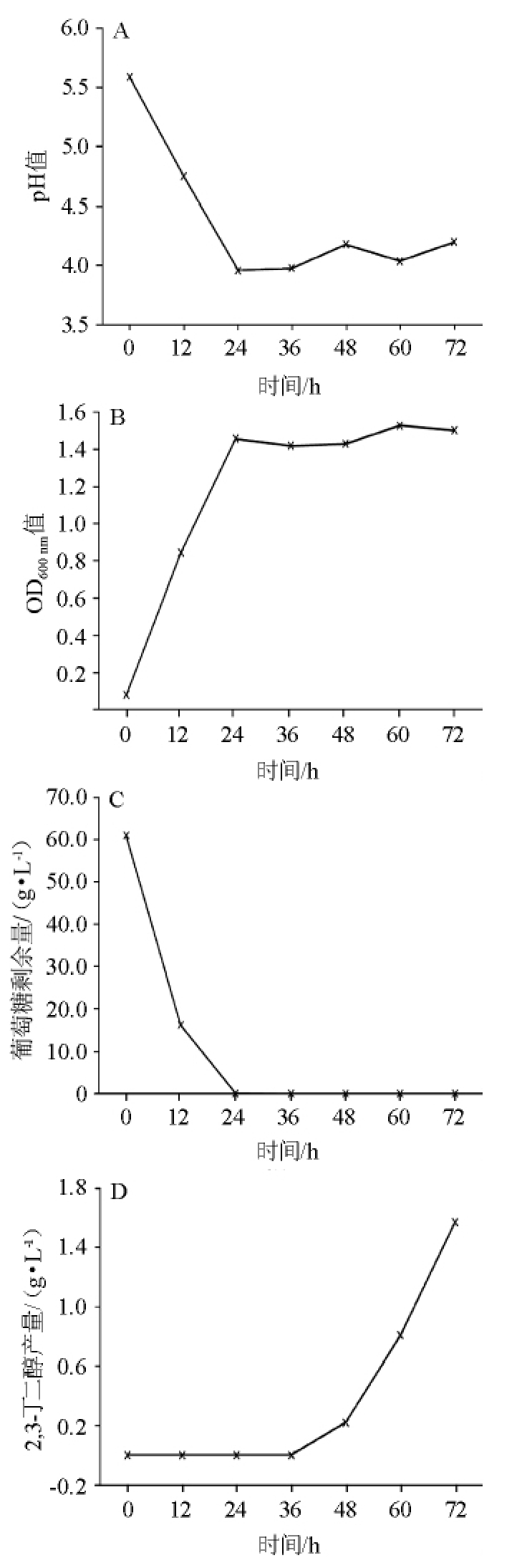
图4 发酵过程中pH(A)、OD600nm值(B)、葡萄糖剩余量(C)和2,3-丁二醇产量(D)的变化
Fig.4 Changes of pH (A),OD600nmvalue (B),glucose content (C) and 2,3-butanediol production (D) during fermentation
由图4A可知,在发酵之初发酵液的pH值为5.59,但在发酵时间为12~24 h,由4.75逐渐下降至3.96,之后在4.00左右逐渐趋于稳定,由于在以葡萄糖为底物发酵产2,3-BD的过程中,也产生了乳酸以及乙酸等酸性物质,使得发酵液中的pH有所下降,但是在发酵后期,发酵液中菌体生长也开始稳定,所以pH也变化不大。
由图4B可知,OD600nm值在前24 h内迅速增加至1.4,这可能是由于在前24 h处于菌株生长的对数生长期,所以OD600nm值增加明显。而后增长的并不明显,到了60 h小幅上升至1.5。OD600nm值的总体变化情况是,随发酵时间的延长不断增加,在24 h时达到最大并保持大致稳定。
由图4C可知,对于添加的80 g/L葡萄糖,在前12 h内的葡萄糖含量迅速消耗至16 g/L,并在第24 小时被消耗掉,这可能是由于在发酵前期菌株生长速度较快,需要吸收大量的葡萄糖来维持自身的生长,而后期菌株生长速度较平稳,所以葡萄糖的利用速度也较慢。
由图4D可知,而对于2,3-BD的生成情况来说,在第36 小时开始逐渐产生2,3-BD,并逐渐增加至最大值1.6 g/L(72 h),并且在60h至72h内产生的最多。由于发酵葡萄糖生产2,3-BD的代谢较复杂,也会产生其他物质,所以转化成2,3-BD也需要逐步进行,所以一开始并没有产生2,3-BD。NG C Y等[19]对酿酒酵母中的adh基因进行敲除后,2,3-BD的产量达到2.29 g/L,本研究结果与其尚有一定差距。
2.4 BDH酶活检测
BDH活性随发酵时间的变化情况见表1。
表1 发酵过程中2,3-丁二醇脱氢酶活性的变化
Table 1 Change of 2,3-butanediol dehydrogenase activity during fermentation

由表1可知,在整个72 h的发酵期间内,酿酒酵母(S.cerevisiae)W141的BDH活力呈逐渐增大的趋势,并从第36 小时增加明显,并在第72小时达到最高值0.025 7 U/mg。由于生成2,3-BD的主要酶为BDH,因此,酿酒酵母(S.cerevisiae)W141具有较好的2,3-BD生产能力。结合相关文献[20]可知,如果要进一步地增加2,3-BD的产量,可以过表达bdh基因,从而使BDH酶活增加,以达到增加2,3-BD产量的目的。
3 结论
本研究通过显色方法对可产2,3-BD菌株的筛选,通过形态学鉴定以及分子生物学鉴定对高产2,3-BD菌株进行分析,最后进行发酵检测。结果表明,菌株W141被鉴定为酿酒酵母(Saccharomyces cerevisiae),其BDH酶活力高,并且有一定地2,3-BD产量,可作为2,3-BD的生产菌株。而在酒糟、猪舍、玉米场、菜园和鹅棚等地分离的菌株也有一定的产2,3-BD的潜能。本研究所得结果对进一步筛选高产2,3-BD的酿酒酵母(Saccharomyces cerevisiae)菌株提供了技术支持,同时也扩大了该菌株的研究体系。
[1]SHI S,LIANG Y,ZHANG M M,et al.A highly efficient single-step,markerless strategy for multi-copy chromosomal integration of large biochemical pathways in Saccharomyces cerevisiae[J].Metab Eng,2016,33:19-27.
[2]GARG S K,JAIN A.Fermentative production of 2,3-butanediol:A review[J].Bioresource Technol,1995,51(3):103-109.
[3]KIM S J,SEO S O,JIN Y S,et al.Production of 2,3-butanediol by engineered Saccharomyces cerevisiae[J].Bioresource Technol,2013,146(10):274-281.
[4]YU B,SUN J,BOMMAREDDY R R,et al.Novel(2R,3R)-2,3-butanediol dehydrogenase from potential industrial strain Paenibacillus polymyxa ATCC 12321[J].Appl Environ Microb,2011,77(12):4230-4233.
[5]KIM J W,SEO S O,ZHANG G C,et al.Expression of Lactococcus lactis NADH oxidase increases 2,3-butanediol production in pdc-deficient Saccharomyces cerevisiae[J].Bioresource Technol,2015,191:512-519.
[6]LIAN J,CHAO R,ZHAO H.Metabolic engineering of a Saccharomyces cerevisiae strain capable of simultaneously utilizing glucose and galactose to produce enantiopure(2R,3R)-butanediol[J].Metab Eng,2014,23:92-99.
[7]SWINNEN S,KLEIN M,CARRILLO M,et al.Re-evaluation of glycerol utilization in Saccharomyces cerevisiae:characterization of an isolate that grows on glycerol without supporting supplements[J].Biotechnol Biofuels,2013,6(1):157-168.
[8]JI X J,HUANG H,OUYANG P K.Microbial 2,3-butanediol production:a state-of-the-art review[J].Biotechnol Adv,2011,29(3):351-364.
[9]NG C Y,JUNG M Y,LEE J,et al.Production of 2,3-butanediol in Saccharomyces cerevisiae by in silico aided metabolic engineering[J].Microb Cell Factor,2012,11(1):68.
[10]HAN S H,LEE J E,PARK K,et al.Production of 2,3-butanediol by a low-acid producing Klebsiella oxytoca NBRF4[J].New Biotechnol,2013,30(2):166-172.
[11]GONZALEZ E,ROSARIO FERNNDEZ M,MARCO D,et al.Role of Saccharomyces cerevisiae oxidoreductases Bdh1p and Ara1p in the metabolism of acetoin and 2,3-butanediol[J].Appl Environ Microb,2010,76(3):670-679.
[12]MOES J,GRIOT M,KELLER J,et al.A microbial culture with oxygensensitive product distribution as a potential tool for characterizing bioreactor oxygen transport[J].Biotechnol Bioeng,1985,27(4):482-489.
[13]LI L,WANG Y,ZHANG L,et al.Biocatalytic production of(2S,3S)-2,3-butanediol from diacetyl using whole cells of engineered Escherichia coli[J].Bioresource Technol,2012,115(4):111-116.
[14]JI X J,HUANG H,LI S,et al.Enhanced 2,3-butanediol production by altering the mixed acid fermentation pathway in Klebsiella oxytoca[J].Biotechnol Lett,2008,30(4):731-734.
[15]郭文逸,孙庆惠,宋丽娜,等.地衣芽孢杆菌高产2,3-丁二醇菌株的选育和发酵研究[J].生物技术通报,2014(8):159-163.
[16]任潇,纪晓俊,孙世闻,等.肌酸比色法快速测定发酵液中3-羟基丁酮的含量[J].食品科技,2009,34(8):260-263.
[17]李秀鹏,杨套伟,徐美娟,等.过量表达枯草芽孢杆菌乙偶姻还原酶提高2,3-丁二醇产量[J].食品与生物技术学报,2016,35(3):252-257.
[18]张彦青,贾士儒,张五九.响应面法优化酿酒酵母乙醛脱氢酶和乙醇脱氢酶酶活检测方法[J].中国酿造,2011,30(7):84-89.
[19]NG C Y,JUNG M Y,LEE J W,et al.Production of 2,3-butanediol in Saccharomyces cerevisiae by in silico aided metabolic engineering[J].Microb Cell Factor,2012,11(1):68-81.
[20]刘洋洋.酿酒酵母AS2.399 乙醛脱氢酶4 基因的克隆及酿酒酵母培养基的优化[D].武汉:华中农业大学,2012.