肉经冷冻处理不仅可以抑制肉中微生物的生长、钝化酶的活性、减少脂肪及蛋白的氧化[1-2],而且冷冻肉是各类肉制品生产的主要原料,是国内不同地区间及进出口贸易和流通的主要形式[3]。冷冻肉在加工和食用前需要经过解冻处理,肉在冻结过程中内部会形成大小不一的冰晶,造成细胞膜和组织结构的机械损伤[4],当冻结肉经解冻处理后可能会出现色泽和质地发生变化、质量减轻、气味恶化、蛋白质变性等问题[5-7]。因此冻结与解冻方式的选择对肉的品质起着非常重要的作用。高泽磊等[8]报道,液氮快速冷冻能有效提高鱼肉的品质。TOLGA D等[9]研究发现,微波解冻处理的沙丁鱼、凤尾鱼及海鲷鱼的鱼肉色泽变化较大。肌原纤维蛋白是猪肌肉的重要组成成分之一,约占猪肌肉总蛋白的55%,它不仅赋予肉制品特有的风味、营养和口感,还具有持水性、乳化性以及凝胶性等多重功能特性,决定产品的最终品质[10],冻藏过程中蛋白的变性,主要是肌原纤维蛋白发生变性,进而使蛋白质结构和功能特性降低[11]。夏秀芳等[12]研究发现,低温冻藏会引起肌原纤维特性发生明显变化。THANONKAEW A等[13]研究发现,-18 ℃冻结的乌贼肉糜,其肌球蛋白发生变性,进而使蛋白质的保水性明显降低。LIAN P等[14]研究发现,鳍鱼在-20 ℃条件下冻藏4周后,其肌原纤维蛋白的盐溶性下降。LEYGONIE C等[15]研究认为,冷冻引起的蛋白变性会导致冻结期间肌肉组织细胞内的水分发生迁移。李银等[16]采用低温高湿变温解冻工艺能够减弱牛肉解冻过程中肌原纤维蛋白的氧化程度。张春辉等[17]采用低温高湿变温解冻羊肉,结果发现羊肉解冻后其肌肉蛋白表面疏水性降低。
本研究将猪肉采用-18 ℃和-50 ℃冻结,然后分别以微波、空气以及4 ℃解冻方式对其进行解冻,测定不同冻结与解冻方式对猪肉肌原纤维蛋白溶解性、表面疏水性、乳化性、乳化稳定性、起泡性及起泡稳定性的影响,并探讨肌原纤维蛋白在-18 ℃和-50 ℃冻结,不同解冻方式条件下各理化特性指标之间的相关性,以期获得维持猪肉较好品质的冻结和解冻方式,为实际肉品的冻结和解冻提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
试验用材料为猪背最长肌,购自绥化市大润发超市,购买后快速运回实验室,剔除猪肉表面脂肪和结缔组织,切分为80 g 左右的肉块,进行冷冻处理;大豆色拉油:黑龙江九三油脂有限公司。
1.1.2 化学试剂
牛血清蛋白(bovine serum albumin,BSA):北京索莱宝科技有限公司;乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol tetraacetic acid,EGTA):北京华迈科生物技术有限责任公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS):上海迈瑞尔化学技术有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS):上海源叶生物有限公司;磷酸氢二钠、磷酸二氢钠、硫酸铜、氯化镁、氯化钠(均为分析纯):天津市恒兴化学试剂制造有限公司。
1.2 仪器与设备
TH-120-150-WA超低温冰箱:北京天地精仪科技有限公司;EG720KG4-NA美的微波炉:美的微波炉制造有限公司;GL-16G-Ⅱ高速冷冻离心机:上海安亭科学仪器厂;DS-1高速组织捣碎机:上海净信实业发展有限公司;HH-6数显恒温水浴锅:江苏省金坛市荣华仪器制造有限公司;752紫外-可见分光光度计:上海菁华科技仪器有限公司;T18 basic型匀浆机:德国IKA公司;F96S荧光分光光度计:上海棱光技术有限公司;TP3001探针式电子温度计:义乌市宏辉电子技术有限公司。
1.3 实验方法
1.3.1 冻结方法
切分好的肉块随机分成两组,每组3块,分别置于-18 ℃和-50 ℃的条件下冻结,冻藏3 d后进行解冻处理;新鲜肉样为对照组,不做冻结及解冻处理。
1.3.2 解冻方法
-18 ℃和-50 ℃的条件下冻结组分别采用微波解冻、空气解冻(室温20 ℃)和4 ℃解冻。
(1)微波解冻:将冻结肉样放入洁净的塑料托盘中,置于微波炉中,启动“质量解冻”按钮(微波功率400 W、频率2 450 MHz),解冻到肉块中心温度达到4 ℃即可。
(2)空气解冻:将冻结肉样放入洁净的塑料托盘中,以空气为介质进行自然解冻,采用探针式电子温度计测定肉块中心温度达到4 ℃即可。
(3)4 ℃解冻:将冻结肉样放入洁净的塑料托盘中,置于4 ℃冰箱进行解冻,肉块中心温度达到4 ℃即可。
1.3.3 肌原纤维蛋白的提取
参照XIA X F等[18]的方法从不同处理组中提取肌原纤维蛋白,以牛血清蛋白作标准曲线,采用双缩脲法测定蛋白浓度,得牛血清蛋白标准曲线回归方程为y=0.236 4 x+0.014 8,相关系数R2=0.996 9,按照标准曲线回归方程计算各处理组的肌原纤维蛋白含量[19]。
1.3.4 溶解性的测定
将不同处理的肌原纤维蛋白用50 mmol/L pH 6.2的磷酸盐缓冲液(含有0.6 mol/L NaCl)配制成10 mg/mL的溶液于离心管中,4 000 r/min离心40 min后,上清液用双缩脲法测定其吸光度值,依上述标准曲线回归方程计算蛋白含量,按下式计算溶解度:
1.3.5 表面疏水性的测定
蛋白质的表面疏水性反映蛋白质分子表面疏水性氨基酸的相对含量,进而可以衡量蛋白质的变性程度[20],通常表面疏水性与变性程度呈正相关。根据KATO A等[21]的方法,以ANS为荧光探针,利用荧光分光光度计测定不同处理肉样蛋白质的表面疏水性。蛋白质量浓度被稀释在5~500 μg/mL之间,激发波长和发射波长分别设置为365 nm和484 nm。以荧光强度(y)为纵坐标,蛋白质量浓度(x)为横坐标,所得曲线的斜率即为表面疏水性指数。
1.3.6 乳化性及乳化稳定性的测定
参照RAMIREZ-SUAREZ J C等[22]的方法略作改动,取8 mL 0.1%的不同处理的肌原纤维蛋白样品溶液分别加入2 mL大豆色拉油,高速分散器8 000 r/min搅打1 min后,立即于容器底部取样50 μL,加入到5 mL 0.1%的SDS溶液中,漩涡振荡混匀后在波长500 nm处测定吸光度值,以SDS溶液作为空白。室温放置10 min后再次取样测定。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)分别按下式计算:

式中:EAI为乳化活性指数,m2/g;ESI为乳化稳定性指数;F为稀释倍数;Φ为乳化液中油相的比例;C为蛋白质溶液质量浓度,g/mL;A0为初始乳状液的吸光度值;A10为10 min后乳状液的吸光度值。
1.3.7 起泡性和起泡稳定性的测定
将不同处理的肌原纤维蛋白配制成5 mg/mL的溶液,分别取10 mL溶液(V)均质2 min(10 000 r/min),迅速倒入50 mL的量筒中,读取泡沫体积(V0),静置30 min后,再次读取泡沫体积(V30)。起泡性和起泡稳定性计算公式如下:
1.3.8 数据处理
所有试验均重复3次,计算结果以均值±标准差表示,采用Excel 2010作图,差异显著性分析采用Statistix 8.0软件进行,相关性分析采用SPSS软件进行。
2 结果与分析
2.1 不同解冻方式对肉品中肌原纤维蛋白含量的影响
不同解冻方式对肉品中肌原纤维蛋白含量的影响结果见图1。

图1 不同解冻方式对肌原纤维蛋白含量的影响
Fig.1 Effect of different thawing methods on content of myofibril protein
由图1可知,经不同冻结和解冻处理的猪肉肌原纤维蛋白含量均较对照组降低,但不论是那种冻结方式,采用4 ℃解冻方式得到的肌原纤维蛋白含量与对照组差异不显著(P>0.05),而采用微波解冻,-18 ℃和-50 ℃冻结的肌原纤维蛋白含量分别较对照组显著降低30.3%和26.6%(P<0.05),这可能是由于微波解冻过程中,热量迅速传递致使蛋白质大量变性,同时在解冻过程中,较高的温度导致不饱和脂肪酸氧化生成自由基,进而与蛋白质相结合,引起蛋白含量降低[23-24]。从图1还可以看出,采用微波解冻、空气解冻和4 ℃解冻,-50 ℃冻结的肌原纤维蛋白含量(4.84%、5.25%、6.32%)分别高于-18 ℃冻结的肌原纤维蛋白含量(4.60%、5.16%和6.07%),这可能是在较低的冻结温度下形成的冰晶对细胞结构破坏小,蛋白在解冻时保留率高。
2.2 不同解冻方式对肉品中肌原纤维蛋白溶解度的影响
不同解冻方式对肉品蛋白质溶解度的影响结果见图2。
由图2可知,冻结与解冻过程会使蛋白质的溶解度降低,这可能是由于猪肉在冻结与解冻过程中肌纤维收缩,蛋白质的去折叠与变性程度提高,因而导致肌肉蛋白质的溶解性降低[25]。BADII F等[26]在-10 ℃和-30 ℃环境下贮藏大西洋鳕鱼和黑线鳕鱼,结果发现两种鱼的蛋白溶解性均随着贮藏时间的延长而降低,并且贮藏温度越高,溶解性损失越严重。本研究也发现,采用微波解冻、空气解冻和4 ℃解冻,-50 ℃冻结的猪肉肌原纤维蛋白溶解度(16%、19.6%和22.05%)均高于-18 ℃冻结的猪肉(14.75%、17.9%和19.65%),可能是较低的冻结温度形成的冰晶小,对肌纤维的伤害较小。采用-50 ℃冻结、4 ℃解冻方式能有效保持蛋白的溶解性,而微波解冻与空气解冻由于较高的温度可能导致蛋白变性,从而使其溶解度分别较4 ℃解冻降低27.4%和11.1%。
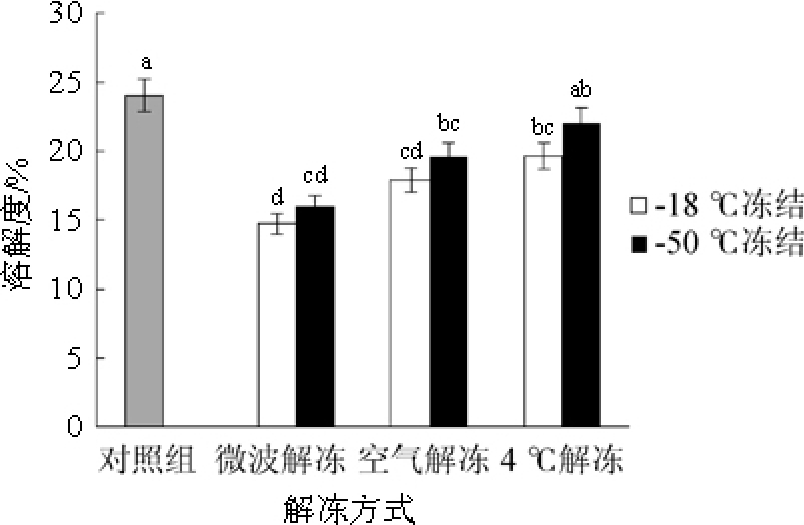
图2 不同解冻方式对肌原纤维蛋白溶解度的影响
Fig.2 Effect of different thawing methods on solubleness of protein
2.3 不同解冻方式对肉品中肌原纤维蛋白表面疏水性的影响
不同解冻方式对肉品蛋白质表面疏水性的影响结果见图3。

图3 不同解冻方式对肌原纤维蛋白表面疏水性的影响
Fig.3 Effect of different thawing methods on surface hydrophobicity of protein
由图3可知,猪肉肌原纤维蛋白经冷冻解冻处理后,除了采用-50 ℃冻结4 ℃解冻的处理组其疏水性指数(2 025)与未经处理的对照组(1 890)差异不显著(P>0.05)外,其余处理均显著增加(P<0.05),说明冻结与解冻处理使肌原纤维蛋白发生了变性。邓思杨等[27]研究发现,鲤鱼脊背肉经冷冻解冻处理1次后,肌原纤维蛋白表面疏水性增加,MALGORZATA K等[28]在研究冻融处理对太平洋鳕鱼天然肌动蛋白的理化性质的影响中发现,冻融循环后蛋白的表面疏水性也显著增加,认为可能是肌球蛋白头部的变化导致疏水性基团的暴露。本研究结果表明,不论采用哪种解冻方式,-50 ℃冻结的肌原纤维蛋白其疏水性均低于-18 ℃冻结的蛋白,但采用空气解冻,-50 ℃冻结蛋白的疏水性指数(2 115.5)和-18 ℃冻结蛋白的疏水性指数(2 321.5)差异不显著(P>0.05),同时采用4 ℃解冻,-50 ℃冻结(2 215.5)和-18 ℃冻结(2 101)差异也不显著(P>0.05),而采用微波解冻的蛋白,-50 ℃冻结(2 415)和-18 ℃冻结(2 720)差异显著(P<0.05)。可能是微波加热速率较快,破坏了蛋白质的结构,分子内部的基团被暴露,使表面疏水性增加。
2.4 不同解冻方式对肉品中肌原纤维蛋白乳化性和乳化稳定性的影响
不同解冻方式对肉品蛋白质乳化性和乳化稳定性的影响结果见图4。

图4 不同解冻方式对肌原纤维蛋白乳化活性和乳化稳定性的影响
Fig.4 Effect of different thawing methods on emulsion activity and emulsion stability of protein
由图4可知,猪肉经冷冻和解冻处理后,肌原纤维蛋白的乳化性与乳化稳定性均较对照组降低,这可能是由于肉在冷冻和解冻过程中蛋白质变性,不溶性蛋白质增多,乳化特性下降,但-18 ℃与-50 ℃冻结、4 ℃解冻处理组和-50 ℃冻结、空气解冻处理组,其乳化活性(7.63 m2/g、7.89 m2/g、7.51 m2/g)均与对照组(8.19 m2/g)差异不显著(P>0.05),-50 ℃冻结、4 ℃解冻处理组的乳化稳定性(32%)与对照组(37.1%)差异也不显著(P>0.05)。采用-18 ℃与-50 ℃冻结,微波解冻处理组的乳化性(6.84、7.16 m2/g)和乳化稳定性(23.9%、26.6%)分别与对照组相比,均显著下降(P<0.05),可能是微波解冻易加速蛋白质氧化,进而蛋白结构的稳定性被破坏,蛋白质的交联能力降低,从而造成蛋白质乳化活性和乳化稳定性下降。李学鹏等[29]报道冻藏会导致蛋白质发生氧化和变性,破坏蛋白结构的完整性,使其无法形成稳定的界面膜,进而使蛋白与脂肪的交联能力下降,蛋白的乳化性降低。
2.5 不同解冻方式对肉品中肌原纤维蛋白起泡性和起泡稳定性的影响
不同解冻方式对肉品蛋白质起泡性和泡沫稳定性的影响结果见图5。

图5 不同解冻方式对肌原纤维蛋白起泡性和起泡稳定性的影响
Fig.5 Effect of different thawing methods on foaming activity and stability of protein
由图5可知,与对照组相比较,冷冻与解冻处理均使肌原纤维蛋白的起泡性降低。其中-18 ℃冻结、微波解冻处理组起泡性(20.70%)与对照组(34.25%)相比,下降最为显著(P<0.05),起泡稳定性也表现出相同的趋势,这可能是微波解冻处理产生的较高热量增强了蛋白质的变性程度。丁一等[30]研究发现,随着冷冻时间的延长,肌原纤维蛋白变性程度加大,蛋白的起泡性降低。
2.6 不同解冻方式条件下各理化特性指标之间的相关性分析
肌原纤维蛋白在-18 ℃和-50 ℃冻结不同解冻方式条件下各理化特性指标之间的相关性分析,结果见表1和表2。
表1 -18 ℃冻结不同解冻方式条件下肌原纤维蛋白各指标相关性分析
Table 1 Correlation analysis of various parameters of myofibrillar protein obtained at -18 ℃frozen and different thawing methods
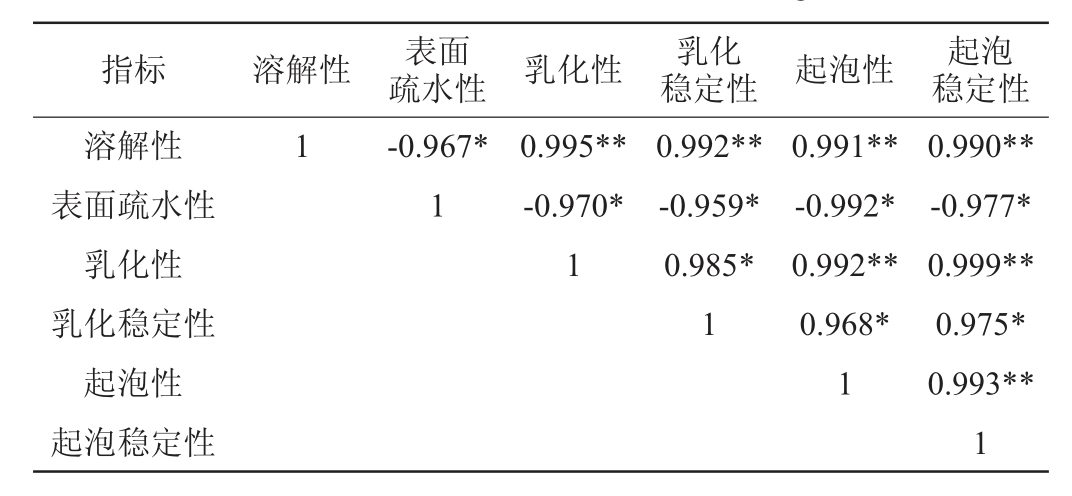
注:“*”表示显著相关(P<0.05);“**”表示极显著相关(P<0.01)。下同。
由表1和表2可知,-18 ℃和-50 ℃冻结的蛋白其乳化稳定性分别与乳化性、起泡性与起泡稳定性间有显著相关性(P<0.05),溶解性与乳化性与起泡性、起泡稳定性间呈极显著相关性(P<0.01),表面疏水性均与其他指标呈显著负相关(P<0.05),而其他指标之间呈正相关,这说明在不同的冷冻和解冻条件下,肌原纤维蛋白各指标之间的变化是相互关联。
表2 -50 ℃冻结不同解冻方式条件下肌原纤维蛋白各指标相关性分析
Table 2 Correlation analysis of various parameters of myofibrillar protein obtained at -50 ℃frozen and different thawing methods

3 结论
在不同冻结与解冻方式下肌原纤维蛋白的含量及理化特性均发生了变化,表现出溶解性、乳化活性和乳化稳定性、起泡性及起泡稳定性降低,表面疏水性增加,采用-18 ℃冻结,微波解冻的肌原纤维蛋白与未经处理的对照组相比,各理化指标下降最为明显,而采用-50 ℃冻结,4 ℃解冻的肌原纤维蛋白其含量与理化特性均保持较高,其机理有待进一步深入研究。
[1]胡新,姚亚明,王鹏,等.不同冻结和解冻方式对猪肉品质的影响[J].食品工业科技,2017,38(19):278-283.
[2]XIA X,KONG B,XIONG Y,et al.Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J].Meat Sci,2010,85(3):481-486.
[3]姜晴晴,刘文娟,鲁珺,等.冻结与解冻处理对肉类品质影响的研究进展[J].食品工业科技,2015,36(8):384-389.
[4]余力,贺稚非,ENKHMAA B,等.不同解冻方式对伊拉兔肉品质特性的影响[J].食品科学,2015,36(14):258-264.
[5]LI B,SUN D W.Novel methods for rapid freezing and thawing of foods-a review[J].J Food Eng,2002,54(3):175-182.
[6]郭恒,钱怡,李颖杰,等.解冻温度对冷冻鲐鱼品质、质构及超微结构的影响[J].中国食品学报,2014,14(12):49-56.
[7]李宝臻,李海宾,刘尔卓,等.影响速冻香肠质量的关键因素及控制措施[J].中国酿造,2013,32(8):134-137.
[8]高泽磊,张建.不同冻结方式对高白鲑肌原纤维蛋白理化特性和功能特性的影响[J].江苏农业科学,2017,45(11):129-134.
[9]TOLGA D,ASLI C,SUKRAN C,et al.Effects of different thawing methods on the freshness quality of fish[J].Ege J Fish Aquat Sci,2015,26(4):253-256.
[10]戴瑞彤,杨龙江.肉蛋白质的功能特性及其在肉品加工中的作用[J].肉类工业,2000(11):17-19.
[11]李芳菲,王博,石硕,等.低温胁迫肌原纤维蛋白结构和热稳定性的变化[J].中国食品学报,2019,19(3):232-241.
[12]夏秀芳,李芳菲,田佳艺,等.低温冻藏对肌原纤维蛋白凝胶特性的影响[J].中国食品学报,2019,19(1):163-170.
[13]THANONKAEW A,BENJAKULS,VISESSANGUANW,et al.The effect of metal ions on lipid oxidation,color and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiple freeze-thaw cycles[J].Food Chem,2006,95(4):591-599.
[14]LIAN P,LEE CM,HUFNAGEL L.Phisieoehemieal properties of frozen Red Hake mince as affected by cryoproteetive ingredients[J].J Food Sci,2000,65(7):1112-1117.
[15]LEYGONIE C,BRITZ T J,HOFFMAN L C.Impact of freezing and thawing on the quality of meat:Review[J].Meat Sci,2012,91(2):93-98.
[16]李银,孙红梅,张春晖,等.牛肉解冻过程中蛋白质氧化效应分析[J].中国农业科学,2013,46(7):1426-1433.
[17]张春晖,李侠,李银,等.低温高湿变温解冻提高羊肉的品质[J].农业工程学报,2013,29(6):267-273.
[18]XIA X F,KONG B H,LIU Q,et al.Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freezethaw cycles[J].Meat Sci,2009,83(2):239-245.
[19]GORNALL A G,BARDAWILL C J,DAVID M M.Determination of serum proteins by means of the biuret reaction[J]. J Biol Chem,1949,177(2):751-766.
[20]丁一,杨明,王松,等.骨蛋白水解物对冷藏鱼糜品质和蛋白结构特性的影响[J].食品工业科技,2013,34(12):145-148,152.
[21]KATO A,NAKAI S.Hydrophobicity determined by a fluorescence probe methods and its correlation with surface properties of proteins[J].Biochim Biophys Acta,1980,624(1):13-20.
[22]RAMIREZ-SUAREZ J C,XIONG Y L.Rheological properties of mixed muscle/nonmuscle protein emulsions treated with transglutaminase at two ionic strengths[J].Int J Food Sci Technol,2010,38(7):777-785.
[23]郭玲,刘爱国,胡志和,等.牛血清白蛋白的乳化和起泡特性[J].食品科学,2010,31(19):137-140.
[24]LEYGONIE C,BRITZ T J,HOFFMAN L C.Meat quality comparison between fresh and frozen/thawed ostrich M.iliofibularis[J]. Meat Sci,2012,91(3):364-368.
[25]李靖,马嫄,岳文婷,等.猪背最长肌蛋白质在冷冻贮藏过程中的变化[J].食品工业科技,2018,39(16):248-252.
[26]BADII F,HOWELL N K.Changes in the texture and structure of cod and haddock fillet during frozen storage[J].Food Hydrocolloid,2002,16(4):313-319.
[27]邓思杨,王博,李海静,等.冻融次数对镜鲤鱼肌原纤维蛋白功能和结构特性变化的影响[J/OL].食品科学:1-10[2019-04-29].http://kns.cnki.net/kcms/detail/11.2206.TS.20180918.1151.004.html.
[28]MALGORZATA K,CHEUNG I W Y,LICHAN E C Y.Effects of fish protein hydrolysate and freeze-thaw treatment on physicochemical and gel properties of natural actomyosin from Pacific cod[J].Food Chem,2013,138(2-3):1967-1975.
[29]李学鹏,周明言,周凯,等.大黄鱼冻藏过程中肌原纤维蛋白氧化及其功能性质的变化[J].中国食品学报,2018,18(7):171-179.
[30]丁一,黄莉,夏秀芳,等.冻藏对肌原纤维蛋白结构特性与功能特性的影响[J].包装与食品机械,2013,31(4):55-59.