海洋中蕴藏着丰富的生物资源,其中海藻种类丰富[1],并富含多种多糖类物质,如琼胶、褐藻胶等。琼胶及其水解产物琼胶寡糖因具有延缓衰老[2-4]、抗病抑菌[5]、增强免疫[6-8]、抗病毒[9-10]、抗淀粉老化[11]等多种生物活性而成为近年来的研究热点,在新药物、新功能性食品、高端化妆品的研发领域都展现出良好的应用前景[12]。
琼胶寡糖的制备方法主要有化学降解法和酶解法。化学降解法操作简单、生产成本较低,但能耗高、污染严重,因而未得到广泛应用。相比之下,酶解法具有特异性强、反应条件温和、反应过程易于控制、较为环保的特性,能够实现对琼胶的高效降解,因而成为制备琼胶寡糖较为常用的途径。琼胶酶被广泛应用于制备琼胶寡糖和琼胶低聚糖[13-14]、分子生物学研究[15]、海藻遗传工程的工具酶等方面[16-18]。但现有工业化生产的琼胶酶来源比较单一,且成本较高[19-20],导致琼胶酶的应用研究与开发受到限制。
据报道,琼胶酶菌株常见来源有海水、淡水、土壤、藻类等[21-22]。从海洋动物,如海兔属(Aplysia)、鲍属(Haliotis)、滨螺属(Littorina striata)、冠海詹属(Diadema antillarum)体内分离得到琼胶酶菌株的报道还较少[23]。本研究以鲍肠道内筛选得到的产琼胶酶弧菌(Vibrio)Y-AG3为研究对象,采用单因素试验、Plackett-Burman试验、最陡爬坡试验及Box-Behnken试验对其产琼胶酶发酵培养基组成进行优化,最终得到产琼胶酶较高的发酵培养基体系,为该菌株及其琼胶酶的后期研究、开发、应用提供实验依据和基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
弧菌(Vibrio)Y-AG3:国家海产贝类工程技术研究中心,分离自皱纹盘鲍。
1.1.2 试剂
琼脂粉、可溶性淀粉、氯化钠、七水合硫酸镁、葡萄糖、无水氯化钙(均为分析纯或生化试剂):上海国药集团化学试剂有限公司;酵母膏、酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;牛肉浸膏(生化试剂):北京双旋微生物培养基制品厂;D-半乳糖(纯度≥99.0%):北京索莱宝生物科技有限公司。
1.1.3 培养基
活化培养基[19]:琼脂粉20 g,NaCl 25 g,NaNO32 g,K2HPO41 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.02 g,CaCl20.2 g,蒸馏水1 000 mL,pH值7.5,121 ℃高压灭菌20 min。
种子培养基[24]:蛋白胨5 g,酵母粉1 g,磷酸铁0.01 g,陈海水1 L,pH值7.6,121 ℃高压灭菌20 min。
液体发酵培养基[19]:琼脂粉2 g,蛋白胨3 g,酵母膏8 g,NaCl 40 g,MgSO4·7H2O 6 g,CaCl22 g,蒸馏水1 L,pH值9.0,121 ℃高压灭菌20 min。
1.2 仪器与设备
AL104分析天平:梅特勒-托利多仪器有限公司;L535-1低速离心机:湖南湘仪实验室仪器开发有限公司;DK-S24型电热恒温水浴锅:上海森信实验仪器有限公司;GNP-9270隔水式恒温培养箱、DHZ-1102大容量恒温培养振荡箱:上海精宏实验设备有限公司;HFsafe1200生物安全柜:上海力申科学仪器有限公司;UV2800S紫外分光光度计:上海舜宇恒平科学仪器有限公司;STTIK高压灭菌锅:施都凯仪器设备(上海)有限公司。
1.3 方法
1.3.1 种子液制备
将保存的弧菌Y-AG3接种于活化培养基,30℃、180r/min条件培养24 h。从种子活化平板上挑取单菌落于100 mL种子培养基中,30 ℃、180 r/min条件下培养4~6 h,制得种子液。
1.3.2 发酵培养条件
按2%(V/V)的接种量将种子液接种于液体发酵培养基中,装液量为50 mL/250 mL,于30 ℃、180 r/min条件下培养7.5 h,4 000 r/min离心10 min,上清液即为粗酶液,用于测定琼胶酶活力。
1.3.3 琼胶酶活力测定[19]
D-半乳糖标准曲线的绘制:以D-半乳糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制D-半乳糖标准曲线。D-半乳糖标准曲线方程为y=1.792 1x+0.009 8,相关系数R2=0.999 4。
根据D-半乳糖标准曲线计算发酵液中还原糖的含量。琼胶酶活力定义:每分钟生成1 μg还原糖消耗的酶量定义为一个酶活力单位(U)。
1.3.4 弧菌Y-AG3产琼胶酶发酵培养基优化单因素试验
以液体发酵培养基为基础,通过单因素试验分别考察NaCl(1.0%、2.0%、3.0%、4.0%、5.0%)、MgSO4(0.2%、0.4%、0.6%、0.8%、1.0%)、酵母膏(0.4%、0.6%、0.8%、1.0%、1.2%)、琼脂(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%)、蛋白胨(0.10%、0.15%、0.20%、0.25%、0.30%)、CaCl2(0.05%、0.10%、0.20%、0.30%、0.40%、0.50%)等成分添加量对弧菌Y-AG3产琼胶酶的影响,确定该菌株的最佳发酵培养基组成。
1.3.5 弧菌Y-AG3产琼胶酶发酵培养基优化响应面试验
在单因素试验的基础上,确定各因素的最佳配比。然后对6个单因素继续进行Plackett-Burman试验设计,进而筛选出对菌株产琼胶酶影响显著的3个因素。再对3个因素进行最陡爬坡试验,确定最佳试验区域。最后通过Box-Behnken试验结果进行回归方程及响应面分析,得到最佳培养基组成。
2 结果与分析
2.1 弧菌Y-AG3产琼胶酶发酵培养基优化单因素试验
2.1.1 不同NaCl含量对弧菌Y-AG3产琼胶酶的影响
不同NaCl含量对弧菌Y-AG3产琼胶酶的影响见图1。由图1可知,当NaCl含量<2%之前,琼胶酶活力随着NaCl含量的增加逐渐升高;当NaCl含量为2%时,琼胶酶活力最高,为44.20 U/mL;当NaCl含量>2%之后,琼胶酶活力逐渐降低。因此,选定最佳NaCl含量为2%。
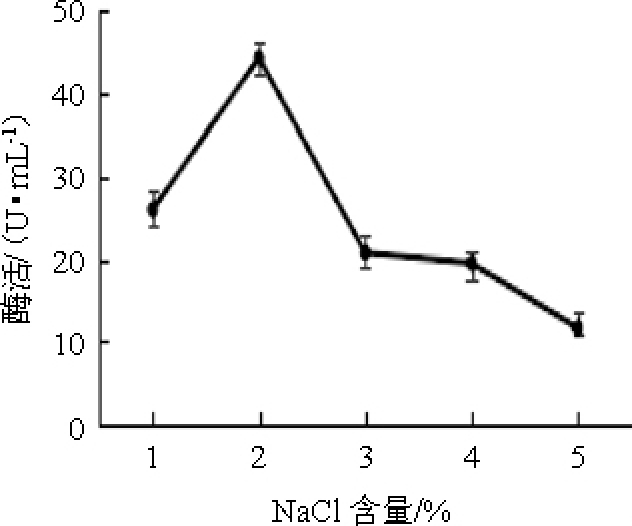
图1 不同NaCl含量对弧菌Y-AG3产琼胶酶的影响
Fig.1 Effect of different NaCl contents on agarase production by Vibrio Y-AG3
2.1.2 不同MgSO4含量对弧菌Y-AG3产琼胶酶的影响
一定浓度的金属Mg2+对琼胶酶的合成具有促进作用[19],但对不同菌株的作用浓度不同。不同MgSO4含量对弧菌Y-AG3产琼胶酶的影响见图2。由图2可知,当MgSO4含量<0.4%之前,琼胶酶活力随着MgSO4含量的增加逐渐升高;当MgSO4含量为0.4%时,琼胶酶活力最高,为42.00 U/mL;当MgSO4含量>0.4%之后,琼胶酶活力先降低,之后略有升高。因此,确定最佳MgSO4含量为0.4%。
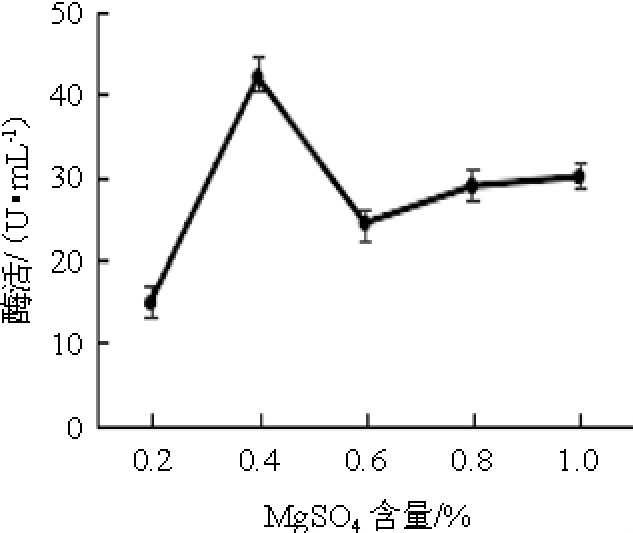
图2 不同MgSO4含量对弧菌Y-AG3产琼胶酶的影响
Fig.2 Effect of different MgSO4contents on agarase production by Vibrio Y-AG3
2.1.3 不同酵母膏含量对弧菌Y-AG3产琼胶酶的影响
不同酵母膏含量对弧菌Y-AG3产琼胶酶的影响见图3。由图3可知,当酵母膏含量<0.6%之前,琼胶酶活力随酵母膏含量的增加逐渐升高;当酵母膏含量为0.6%时,琼胶酶活力最高,为41.65 U/mL;当酵母膏含量>0.6%之后,琼胶酶活力逐渐降低。因此,确定最佳酵母膏含量为0.6%。
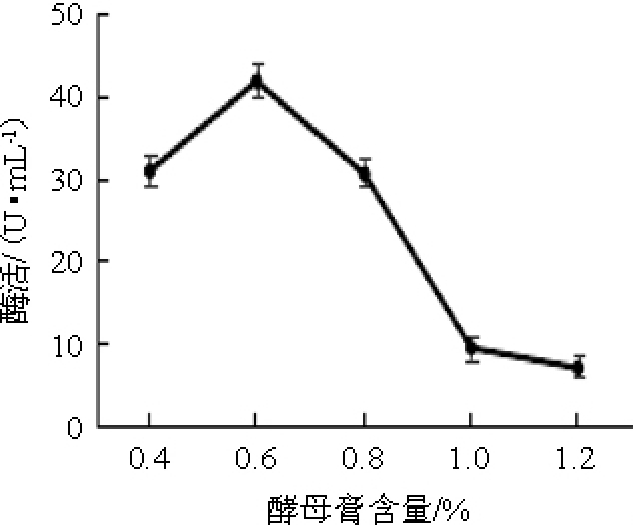
图3 不同酵母膏含量对弧菌Y-AG3产琼胶酶的影响
Fig.3 Effect of different yeast extract contents on agarase production by Vibrio Y-AG3
2.1.4 不同琼脂含量对弧菌Y-AG3产琼胶酶的影响
不同琼脂含量对弧菌Y-AG3产琼胶酶的影响见图4。由图4可知,当琼脂含量<0.5%之前,琼胶酶活力随着琼脂含量的增加逐渐升高;当琼脂含量为0.5%时,琼胶酶活力最高,为42.46 U/mL;当琼脂含量>0.5%之后,琼胶酶活力降低。因此,确定最佳琼脂含量为0.5%。

图4 不同琼脂含量对弧菌Y-AG3产琼胶酶的影响
Fig.4 Effect of different agar contents on agarase production by Vibrio Y-AG3
2.1.5 不同蛋白胨含量对弧菌Y-AG3产琼胶酶的影响
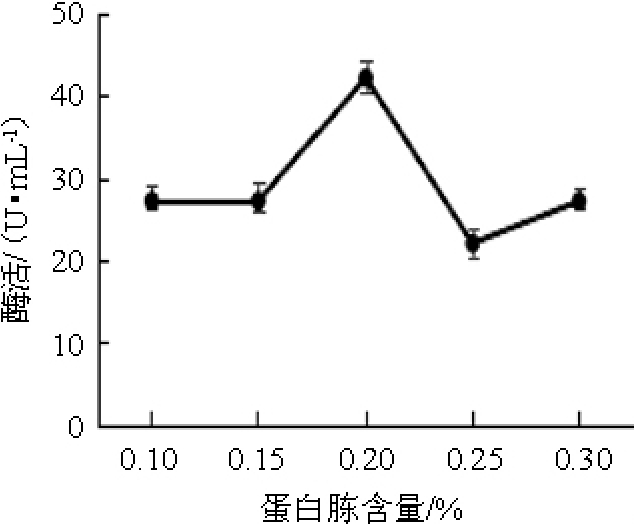
图5 不同蛋白胨含量对弧菌Y-AG3产琼胶酶的影响
Fig.5 Effect of different peptone contents on agarase production by Vibrio Y-AG3
不同蛋白胨含量对弧菌Y-AG3产琼胶酶的影响见图5。由图5可知,当蛋白胨含量<0.2%之前,琼胶酶活力随蛋白胨含量的增加逐渐升高;当蛋白胨含量达到0.2%时,琼胶酶活力最高,为42.24 U/mL;当蛋白胨含量>0.2%之后,琼胶酶活力逐渐降低。因此,确定最佳蛋白胨含量为0.2%。
2.1.6 不同CaCl2含量对弧菌Y-AG3产琼胶酶的影响
不同CaCl2含量对弧菌Y-AG3产琼胶酶的影响见图6。由图6可知,当CaCl2含量<0.1%之前,琼胶酶活力随CaCl2含量的增加逐渐升高;当CaCl2含量为0.1%时,琼胶酶活力达到最高,为42.24 U/mL;当CaCl2含量>0.1%之后,琼胶酶活力逐渐降低。因此,确定最佳CaCl2含量为0.1%。
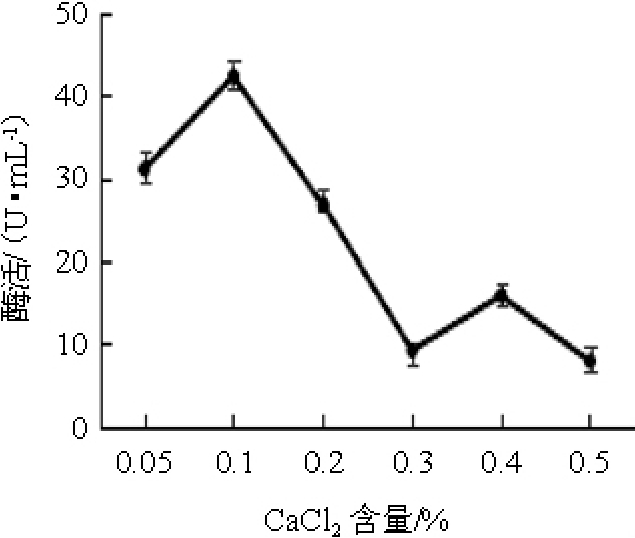
图6 不同CaCl2含量对弧菌Y-AG3产琼胶酶的影响
Fig.6 Effect of different CaCl2contents on agarase production by Vibrio Y-AG3
2.2 弧菌Y-AG3产琼胶酶培养基优化响应面试验
2.2.1 Plackett-Burman试验结果
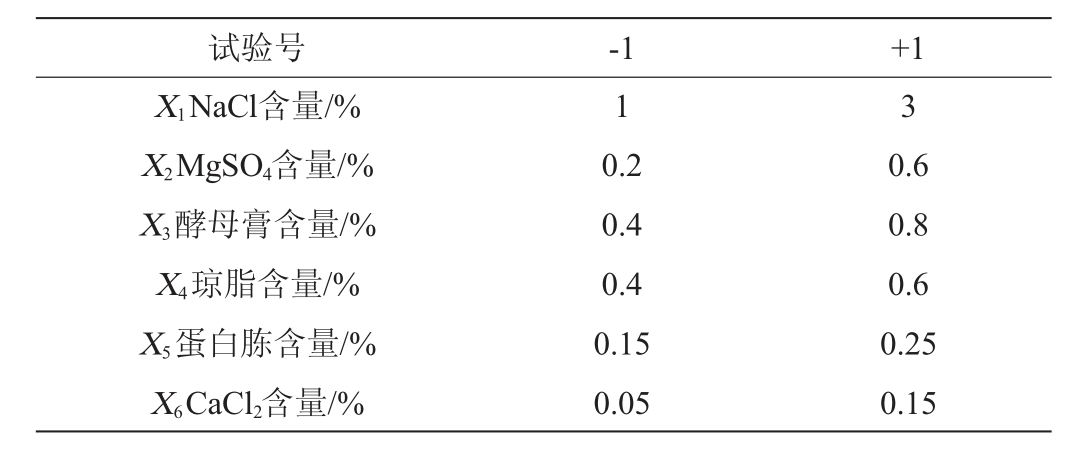
以琼胶酶活力(Y)为响应值,单因素试验的最佳值为基础进行Plackett-Burman试验,因素与水平见表1,设计与结果见表2。
表1 Plackett-Burman试验因素与水平
Table 1 Factors and levels of Plackett-Burman tests
利用Design-Expert 8.0.6软件将表2的数据进行回归分析,得到回归方程:Y=39.38+0.63X1+0.84X2+0.16X3+4.52X4-3.02X5+1.48X6,决定系数R2=0.970 3,校正决定系数R2adj=0.934 6,表明预测值与真实值具有较高相关性。变异系数(coefficientof variation,CV)值越低表明可靠性越高,本实验模型中CV值=3.94%,表明模型的可信度和精确度较好。对Plackett-Burman试验结果进行方差分析,结果见表3。
表2 Plackett-Burman试验设计与结果
Table 2 Design and results of Plackett-Burman tests
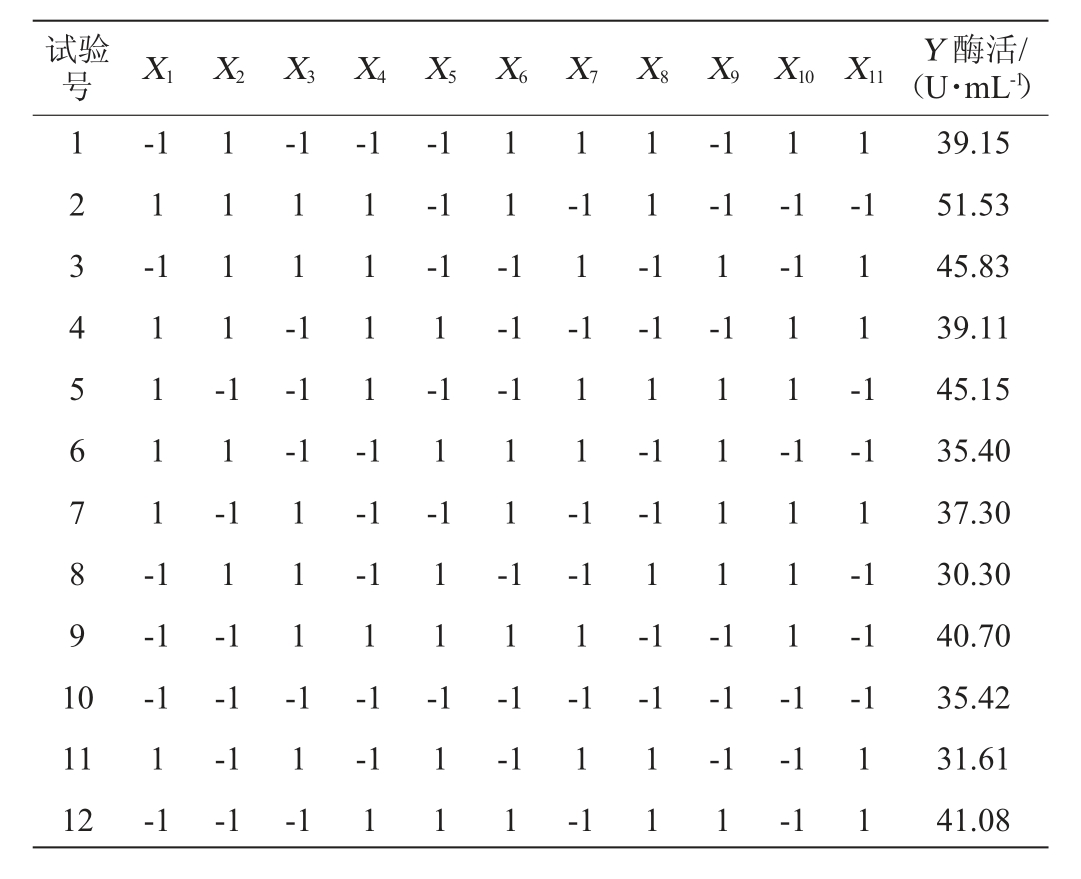
表3 Plackett-Burman试验结果方差分析
Table 3 Variance analysis of Plackett-Burman tests results
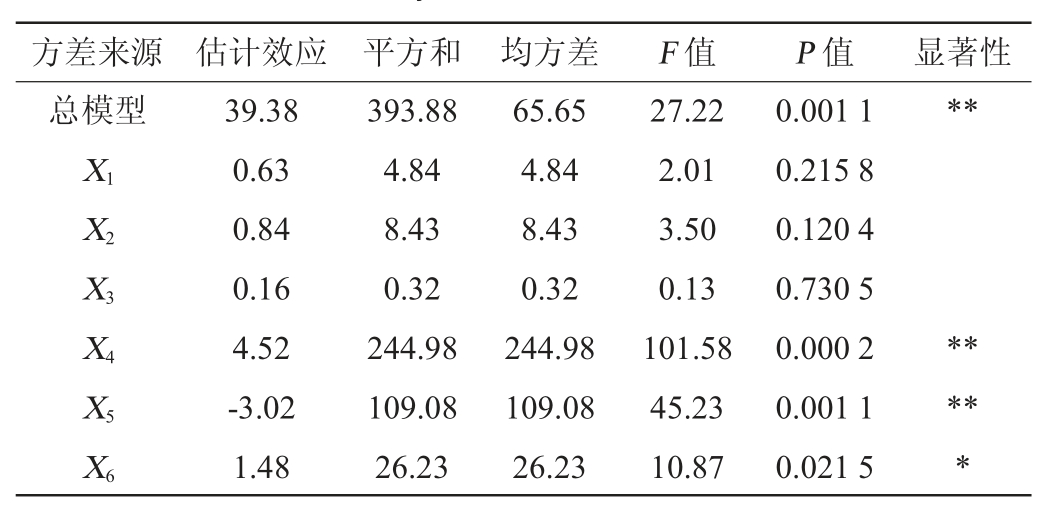
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
由表3可知,6个因素对响应值影响的主次顺序为琼脂>蛋白胨>CaCl2>MgSO4>NaCl>酵母膏。其中,琼脂和蛋白胨影响极显著(P<0.01),CaCl2影响显著(P<0.05),因此,选定CaCl2(A)、琼脂(B)、蛋白胨(C)3个因素进行最陡爬坡试验。
2.2.2 最陡爬坡试验结果
由Plackett-Burman试验得到的回归方程可以看出,CaCl2含量、琼脂含量两个因素对弧菌Y-AG3产琼胶酶的影响是正向效应,而蛋白胨含量是负向效应。根据三个影响因素对响应值的正负效应,设计变化方向及区间进行最陡爬坡试验,试验设计及结果见表4。
由表4可知,当CaCl2含量为0.10%、琼脂含量为0.50%、蛋白胨含量为0.20%时,琼胶酶活力达到最高值(51.31 U/mL)。因此,将第3组的因素含量作为Box-Behnken试验设计中心点进行进一步优化。
表4 最陡爬坡试验设计及结果
Table 4 Design and results of steepest ascent tests

2.2.3 Box-Behnken试验结果
Box-Behnken试验设计因素与水平见表5,结果与分析见表6。
表5 Box-Behnken试验因素与水平
Table 5 Factors and levels of Box-Behnken tests
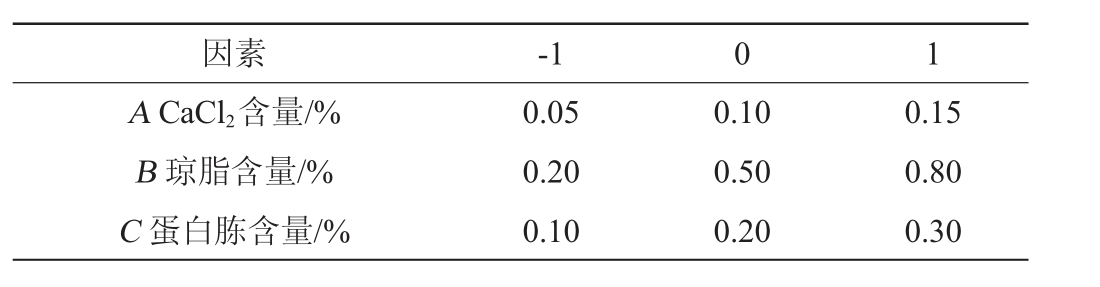
表6 Box-Behnken试验设计与结果
Table 6 Design and results of Box-behnken tests

采用Design Expert 8.0.6软件对表6中的数据进行多元回归拟合,得到二次回归方程为Y=49.92-0.27A+1.97B-0.48C+0.89AB+0.78AC+0.11BC-3.72A2-3.14B2-6.00C2。对回归模型进行方差分析,结果见表7。
由表7可知,回归模型的P值<0.01,极显著;失拟项的P值>0.05,不显著,说明模型可靠。决定系数R2=0.925 7,校正决定系数R2adj=0.830 1,表明回归方程拟合度较好。CV值=4.34%,表明试验结果可信。因此,该模型可以用于弧菌Y-AG3产琼胶酶发酵培养基的预测。此外,一次项B和二次项B2对结果影响显著(P<0.05);二次项A2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。为求得模型的极大值,根据回归方程求一阶偏导,得到Y极大值即最高酶活力值为50.24 U/mL,此时对应的培养基组分CaCl2、琼脂、蛋白胨含量分别为0.10%、0.59%、0.20%。
表7 回归模型的方差分析
Table 7 Variance analysis of regression model

2.3 最佳发酵培养基的验证
通过上述二次多项回归模型,利用软件Design-Expert 8.0.6优化培养基组成,获得最优发酵培养基:NaCl 2%,CaCl20.1%,琼脂0.59%,蛋白胨0.2%,MgSO40.4%,酵母膏0.6%。此优化条件下酶活力预测值为50.24 U/mL。采用上述条件进行验证试验,最终测得琼胶酶活力为51.60 U/mL,与预测值接近,说明优化后的回归方程对预测菌株的产酶活力具有可靠性。
3 结论
本研究采用响应面设计的方法对弧菌Y-AG3产琼胶酶的培养基组成进行优化,结果表明,最优培养基组成为NaCl 2%,CaCl20.1%,琼脂0.59%,蛋白胨0.2%,MgSO40.4%,酵母膏0.6%。在此优化条件下,琼胶酶活力为51.60 U/mL,比优化前(44.20 U/mL)提高了16.74%。该菌株可以作为一株具有潜在应用价值的高效产琼胶酶的新菌株进行培养,为实现琼胶寡糖的工业化生产提供新酶源微生物资源,为促进海洋资源的深加工利用发挥作用。
[1]李丹,朱璐璐,钱爽,等.海藻的开发现状和应用前景[J].广州化工,2016,44(21):13-16.
[2]李海新,梁家铭,李蓉,等.琼胶寡糖的抗氧化活性研究[J].广州化工,2018,46(20):66-68.
[3]刘方方,骆其君,陈海敏,等.琼胶寡糖对坛紫菜抗烂性的诱导效应[J].宁波大学学报(理工版),2014,27(4):12-15.
[4]赵蕊,倪辉,洪清林,等.海洋细菌JMUAZ5 琼胶酶的酶学性质及酶解产物的抗氧化活性[J].中国食品学报,2016,16(1):61-68.
[5]张红艳,林凯,阎春娟.国内外天然食品防腐剂的研究进展[J].粮食加工,2004(3):57-60.
[6]薛长湖,徐强,赵雪,等.琼胶低聚糖消除自由基的活性[J].水产学报,2003,27(3):283-288.
[7]张真庆,江晓路,管华诗.寡糖的生物活性及海洋性寡糖的潜在应用价值[J].中国海洋药物,2003,93(3):51-56.
[8]钱飞箭,陈海敏,严小军,等.藻类免疫防御的研究进展[J].海洋科学,2013,37(5):108-113.
[9]陈海敏,严小军,王峰,等.琼胶寡糖抑制血管形成作用的研究[J].营养学报,2007,29(4):405-407,410.
[10]刘刚.琼胶寡糖的制备及生物活性研究[D].上海:上海海洋大学,2010.
[11]欧阳茜茜,陈法锦,李思东,等.琼胶及琼胶寡糖的加工与应用研究进展[J].山东化工,2016,45(23):58-60,62.
[12]问莉莉,董静静,李思东.琼胶寡糖的制备及其研究应用进展[J].山东化工,2011,40(5):28-30.
[13]刘江涛,蔡俊鹏,吴冰.琼胶酶及其综合应用的研究概况[J].现代食品科技,2005,21(1):177-179.
[14]陈海敏,严小军,郑立,等.琼胶的降解及其产物的分析[J].郑州工程学院学报,2003,24(3):41-44.
[15]COLE K D,AKERMAN B.Enhanced capacity for electrophoretic capture of plasmid DNA by agarase treatment of agarose gels[J].Biomacromolecules,2001(4):771-781.
[16]杜宗军,王祥红,李筠,等.琼胶酶的研究进展[J].微生物学通报,2003,30(1):64-67.
[17]谢勇,洪晓昆,鄢仁祥,等.重组琼胶酶rAgaN3 基因的生物信息学分析[J].生物信息学,2017,15(1):16-26.
[18]李蓉,梁家铭,李海新,等.琼胶酶水解琼胶产生琼胶寡糖的正交试验研究[J].广东化工,2018,46(7):87-88.
[19]张建美,韩尧跃,王国增,等.海洋弧菌Ag-1 产琼胶酶条件研究[J].中国食品学报,2017,17(3):90-95.
[20]邵嫄,姚德恒,洪清林,等.海洋弧菌NTi 产琼胶酶的发酵条件优化[J].集美大学学报(自然科学版),2019,24(1):20-30.
[21]刘振华,周晨妍,王燕,等.一株产琼胶酶细菌的鉴定和发酵条件优化[J].基因组学与应用生物学,2016,35(4):892-900.
[22]唐啸龙.海洋杆菌G4 胞外琼胶酶分离鉴定及降解产物分析[D].天津:天津科技大学,2016.
[23]USOV A I,MARTYNOVA M D.Detection of agarase in mollusks of the genus Littorina[J].Dokl Akad Nauk SSSr,1970,194(2):455-457.
[24]杨迎风,杨文娟,杨琨,等.响应面法优化酵母菌产胞外多糖培养基的研究[J].中国酿造,2014,33(9):115-119.