酸奶作为最主要的发酵乳制品,因其具有特殊的风味和丰富的营养与保健价值,深受消费者的青睐[1]。近年来,我国酸奶的市场规模逐年上升,2017年销售额已达1 220亿元,首次超越牛奶,且每年仍以20%左右的速度快速增长,是最具发展潜力的乳制品之一[2]。然而,由于酸奶是经保加利亚乳杆菌(Lactobacillus bulgaricus)和嗜热链球菌(Strep tococcus thermophilus)共同发酵而制得的活菌型产品,在正常发酵结束后的贮藏、运输和消费过程中,酸奶的pH值会继续下降,出现后酸化现象,使产品酸味过重和感官质量下降,在一定程度上限制了酸奶产业的发展[3-4]。
目前,控制酸奶后酸化的主要方法有添加天然防腐剂、抑制剂等外源物,调整球杆菌比例,改善工艺水平,改变细胞膜的通透性,采用基因工程和人工诱变育种技术等[5-8]。其中,添加外源物、调整球杆菌比例、改善工艺水平等措施虽然能在一定程度上控制后酸化现象,但酸奶的特有风味和质量将大大降低[8-11]。彻底解决酸奶后酸化问题的关键是获得低温、低pH值条件下产酸弱的菌株,虽然基因工程技术在菌种的改良上具有显著效果,但由于合成乳酸的基因非常复杂,目前尚不是很清楚,因此,该方法很难实现[12-13]。而诱变育种尤其是离子注入诱变技术,因其具有育种速度快、操作简单及高效、高定向性、损伤轻、突变谱广等特点,因而在优良菌种的选育领域发挥着重要的作用[14-15],然而,关于N+注入诱变技术在弱后酸化酸奶发酵菌种选育中的应用鲜有报道。另外,由于德氏乳杆菌(Lactobacillus delbrueckii)保加利亚亚种是酸奶后期发酵的优势菌群,耐酸性较强,是导致后酸化的主要菌种[16-17],因此,选育弱后酸化的保加利亚乳杆菌(Lactobacillus bulgaricus),可有效解决酸奶的后酸化问题。
本研究以保加利亚乳杆菌(Lactobacillusbulgaricus)DL1为出发菌株,采用低能N+注入诱变技术,并用青霉素处理,选育低pH值条件下产酸弱的菌株,以求有效解决酸奶后酸化问题。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
保加利亚乳杆菌(Lactobacillus bulgaricus)DL1:本实验室筛选保藏;MRS液(固)培养基(pH值6.2):北京奥博星生物技术有限责任公司;脱脂乳培养基:12%还原脱脂乳(雀巢),95 ℃灭菌10 min。
1.1.2 生化试剂
青霉素(纯度99%):武汉易泰科技有限公司上海分公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Model-1型多功能等离子体浸没离子注入装置:哈尔滨工业大学材料科学与工程学院;2120UV型紫外可见分光光度计:韩国美卡希斯有限公司;S210-B型酸度计:梅特勒-托利多国际贸易(上海)有限公司;CL-32L型自动高压灭菌器:日本ALP公司;TGL-16型台式高速冷冻离心机:湘仪离心机仪器有限公司。
1.3 方法
1.3.1 保加利亚乳杆菌DL1生长曲线的绘制
菌种活化:将实验室保存的保加利亚乳杆菌DL1接种于MRS液体培养基中,37 ℃、140 r/min条件下培养,按照3%(V/V)的接种量每24 h传代一次,共传代三次。
生长曲线的绘制:将活化后的保加利亚乳杆菌DL1接种于MRS液体培养基中,37 ℃、140 r/min条件下培养14 h。按2%(V/V)的接种量转接到MRS液体培养基中,装液量为30 mL/250 mL,37 ℃、140 r/min条件下摇床振荡培养,每隔2 h取出5 mL发酵液,适当稀释后测定其在波长600 nm处的吸光度值,绘制保加利亚乳杆菌DL1的生长曲线。
1.3.2 低能N+注入诱变处理
菌膜的制备:将活化后的保加利亚乳杆菌DL1接种于于MRS液体培养基中,37 ℃、140 r/min条件培养10~12 h,制成细胞浓度约为1×108 CFU/mL的菌悬液。取0.2 mL菌悬液涂布于无菌小培养皿内,无菌室下自然风干,镜检,菌体无重叠后进行N+注入。
N+注入诱变处理[14]:将菌膜置于N+注入机中,在真空度为0.6 Pa,注入能量为25 keV,注入剂量为0~2.5×1015ions/cm2的条件下进行氮离子注入,同时以真空为对照。诱变后用1mL无菌生理盐水洗脱小培养皿中的菌体,得到诱变后的菌悬液。菌悬液经梯度稀释、涂布培养后按平板菌落计数法[17]进行菌落计数,并计算不同注入剂量菌株的致死率,绘制致死率曲线,从中选取最佳注入剂量。致死率计算公式如下:
1.3.3 青霉素处理
参照HOFHERR L A等[18]的方法。将N+注入处理后的菌株制备成菌悬液,接种于MRS液体培养基中,37℃、140 r/min条件下培养12 h后,25 ℃条件下10 000×g离心10 min,收集菌体,悬浮于pH 4.3、含有2.0 mg/mL青霉素的MRS液体培养基中,42 ℃条件下分别处理1 h、2 h、3 h、4 h、5 h。处理后,离心收集菌体,制备菌悬液,并采用平板菌落计数法进行菌落计数,以未经青霉素处理的为对照,计算致死率,其计算公式如下:
1.3.4 弱后酸化菌株的筛选
将青霉素处理后制备的菌悬液涂布于MRS固体培养基上,37 ℃培养48 h,挑选菌落分布均匀,且菌落数在100~300个之间的平板,通过平板印影法分别接种到pH值为4.3和4.8的MRS固体培养基中,用保鲜膜密封,37 ℃培养。选取在pH 4.8条件下生长,而在pH 4.3条件下不长或生长缓慢的菌落为目标菌株,并以出发菌株为对照,进行脱脂乳发酵及贮藏产酸实验,比较其在贮藏过程中pH值的变化。
1.3.5 菌株脱脂乳发酵产酸及后酸化验证
将初步筛选出的突变菌株传代2次,制作发酵剂。以出发菌株DL1为对照,接种于脱脂乳培养基中,在42 ℃条件下发酵8 h,每隔2 h测定pH值,观察其发酵产酸情况。待pH值至4.6时取出,于4 ℃冷藏12 h后置于25 ℃条件下保藏72 h,每隔12 h测定pH值,绘制72 h的pH值变化曲线,观察其贮藏过程中的酸度变化情况,筛选25 ℃保藏期间产酸慢的菌株。
1.3.6 遗传稳定性实验
将筛选出的突变菌株在MRS培养基中连续传8代,分别将第3代和第8代的菌株以2%(V/V)的接种量接种于脱脂乳培养基中,42 ℃条件下发酵,待pH值达4.6后,4 ℃冷却,25 ℃保藏72 h,每隔12 h测定pH值,以出发菌株DL1为对照,观察突变菌株遗传稳定性。
2 结果与分析
2.1 保加利亚乳杆菌DL1的生长曲线
诱变处理时,一般要求出发菌株应处于菌体生长状态同步、易于变异、重复性较好的对数生长期。考察保加利亚乳杆菌DL1的生长曲线,确定其对数生长期,结果见图1。
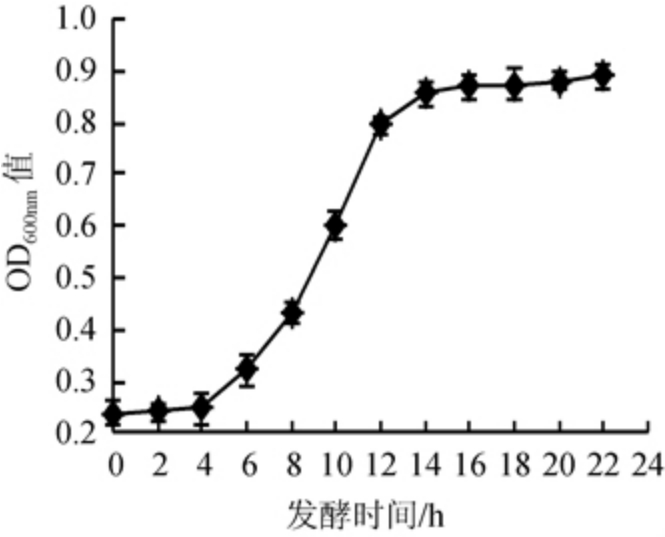
图1 保加利亚乳杆菌DL1的生长曲线
Fig.1 Growth curve of Lactobacillus bulgaricus DL1
由图1可知,保加利亚乳杆菌DL1在MRS培养基中启动较快,延迟期较短,4 h后进入快速生长的对数生长期,12 h后菌种生长趋于平稳,因此,确定保加利亚乳杆菌DL1的对数生长期为4~12 h。另外,为了增加可能变异的细胞数,需保证出发菌株具有一定的细胞浓度,因此,选择对数生长的中后期菌株进行诱变处理,即培养时间为10~12 h。
2.2 N+注入剂量对保加利亚乳杆菌DL1致死率的影响
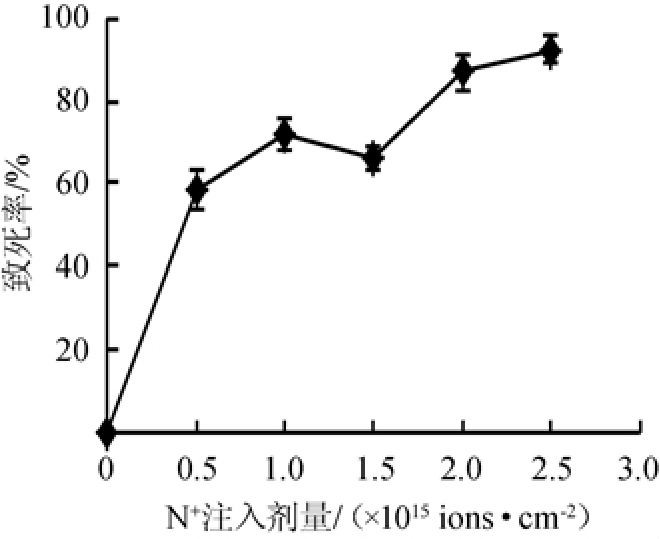
图2 不同氮离子注入剂量下保加利亚乳杆菌DL1的致死率曲线
Fig.2 Lethality rate curve of Lactobacillus bulgaricus DL1 under different nitrogen ion implantation dose
由图2可知,在注入能量为25 keV,N+注入剂量为0~1.0×1015 ions/cm2条件下,随着注入剂量的增大,保加利亚乳杆菌DL1的致死率迅速升高,而N+注入剂量在1.0~1.5×1015 ions/cm2之间时,致死率随N+注入剂量的升高出现小幅度的降低,而后随着N+注入剂量的进一步升高致死率显著上升,致死率曲线呈现典型的“马鞍型”[14]。这主要是由于N+注入剂量较低时仅会损伤细胞表面,而随着N+注入剂量的增加,细胞膜上沉积离子的能量和质量可能会对细胞骨架造成破坏,并间接诱导核仁的损伤,导致细胞死亡,致死率迅速上升,当N+注入剂量进一步上升达到一定数量后,细胞的自我修复功能被激活,致死率有所降低,当N+注入剂量增加到引起的细胞复杂损伤超过细胞修复能力时,菌株致死率再次升高[19]。由于最佳的N+注入剂量应该在致死率曲线波谷区域,故确定保加利亚乳杆菌DL1的最佳N+注入剂量为1.5×1015 ions/cm2。
2.3 青霉素处理条件的确定
N+注入诱变处理后的菌液,经37 ℃培养10 h后,在pH 4.3、42 ℃条件下,经2.0 mg/mL青霉素处理不同时间的致死率见图3。
由图3可知,采用2.0 mg/mL的青霉素处理能选择性地杀死在42 ℃、pH 4.3条下生长的保加利亚乳杆菌,从而达到浓缩低pH值条件下不生长菌株的目的[18]。另外,GORINI L等[20]研究表明,青霉素对细菌的致死率在50%左右时,对菌株的浓缩效果最好。因此,采用2.0 mg/mL青霉素对诱变后的菌株在42 ℃条件下处理2 h。

图3 青霉素处理时间对诱变菌株致死率的影响
Fig.3 Effect of penicillin treatment time on lethality rate of mutant strain
2.4 弱后酸化突变菌株的筛选
在“印影”平板上挑取在pH 4.8条件下生长,而在pH 4.3条件下不长或生长缓慢的菌落35个,分别接种于脱脂乳试管中,42 ℃条件下培养,观察脱脂乳凝乳情况,直接淘汰不凝乳或凝乳较差的突变菌株26株。取凝乳效果较好的9株突变菌,分别标记为DL1-1~DL1-9,传代2次,制作发酵剂,以出发菌株DL1为对照进行后酸化验证试验,比较贮藏过程中各管的pH值变化。最终筛选出在25 ℃下产酸缓慢的突变菌株DL1-3。
2.5 突变菌株DL1-3在脱脂乳中发酵产酸能力
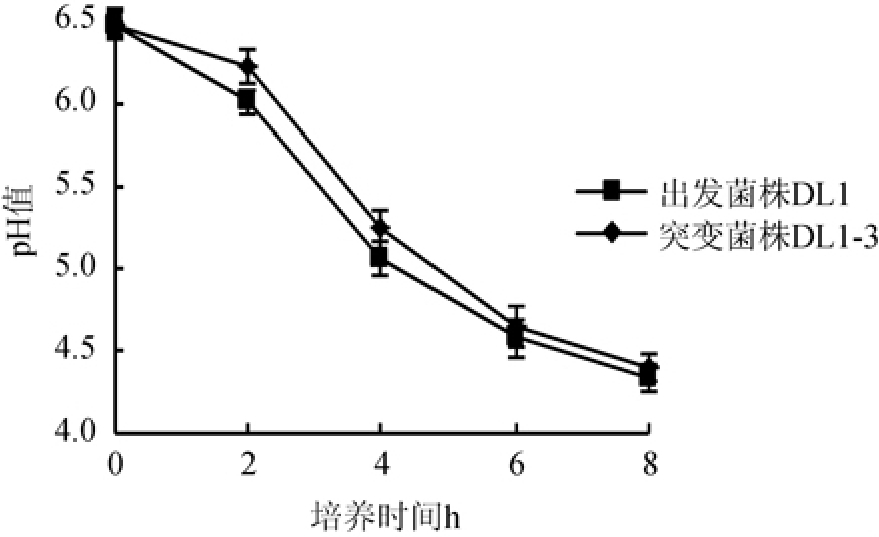
图4 42 ℃条件下菌株DL1及DL1-3在脱脂乳中的pH值变化
Fig.4 pH change of strain DL1 and DL1-3 in skimmed milk at 42 ℃
由图4可知,42 ℃条件下菌株DL1与DL1-3在脱脂乳培养基中发酵培养时,随着培养时间的增加pH值均逐渐下降,酸度增加。其中,突变菌株DL1-3的pH值下降速度较出发菌株DL1缓慢,尤其是在0~4 h,而4 h后突变菌株DL1-3的产酸量与出发菌株DL1逐渐接近,发酵培养6 h时,突变菌株DL1-3的pH值降至4.56,与出发菌株DL1的pH值没有显著差异(P>0.05)。因此得出,42 ℃发酵12%脱脂乳时,虽然突变菌株DL1-3在前4 h产酸速度较慢,但4 h后产酸速度有所加快,6 h时与出发菌株DL1的产酸量差异较小。
2.6 突变菌株DL1-3发酵脱脂乳的后酸化性能
由图5可知,菌株DL1-3与DL1发酵脱脂乳在25 ℃条件下贮藏时,随贮藏时间的增加pH值均逐渐下降,但突变菌株DL1-3与出发菌株DL1相比,后酸化的程度在贮藏12 h后显著降低(P<0.05)。其中,突变菌株DL1-3发酵脱脂乳在常温(25 ℃)条件下放置24 h,pH值仍能维持在4.1左右,贮藏72 h时pH值下降0.78,此时,pH值的降低(后酸化)程度比出发菌株DL1降低了18.8%。

图5 菌株DL1-3和DL1发酵脱脂乳在25 ℃条件下贮藏时的pH值变化
Fig.5 pH Change of skimmed milk fermented by strain DL1-3 and DL1 during storage at 25 ℃
2.7 突变菌株DL1-3的遗传稳定性
将突变菌株DL1-3在MRS培养基中连续传代8次,考察突变菌株DL1-3第3代与第8代发酵脱脂乳的后酸化性能,结果见图6。
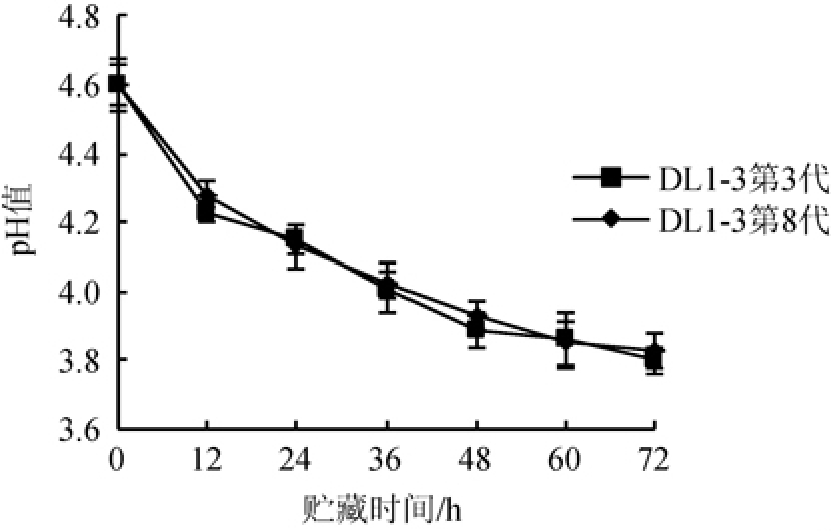
图6 突变菌株DL1-3第3代与第8代发酵脱脂乳在25 ℃条件下贮藏时pH值的变化
Fig.6 pH change of skimmed milk fermented by the third and eighth generations of mutant strain DL1-3 during storage at 25 ℃
由图6可知,突变菌株DL1-3第3代和第8代发酵脱脂乳在25 ℃条件下贮藏时,pH变化曲线没有显著差异(P>0.05)。结果表明,突变菌株DL1-3具有良好的稳定遗传性能。
3 结论
采用低能N+注入技术,以保加利亚乳杆菌DL1为出发菌株,在最佳注入剂量(1.5×1015 ions/cm2)的条件下进行诱变,并用2.0 mg/mL青霉素处理2 h,通过筛选获得一株后酸化能力较弱的突变菌株DL1-3,其后酸化程度比出发菌株DL1降低18.8%,且在42 ℃条件下发酵脱脂乳的产酸能力与出发菌株DL1差异较小,同时具有良好的遗传稳定性。
[1]胡锦涛,孔芳,邹木法,等.浆果果渣对酸奶品质和抗氧化性的影响[J].现代食品科技,2018,34(11):176-184.
[2]霍晓娜,曹志强.我国酸奶市场竞争格局与发展趋势[J].中国乳业,2018(3):8-10.
[3]李晨,张国文,赵云,等.酸奶后酸化中保加利亚乳杆菌关键基因表达分析[J].中国食品学报,2018,18(7):256-262.
[4]韩雪,张兰威,易华西,等.优良酸奶发酵剂组合的筛选[J].食品工业,2011,32(4):17-19.
[5]郭清泉,夏秀芳,张兰威.引起酸奶制品发生后酸化的主要发酵剂菌及性质[J].食品与机械,2002(1):14-15.
[6]LIU F,JIAO Y H,HUO G C.Optimization of co-culture condition for Lactobacillus delbrueckii subsp.bulgaricus with weak post-acidification ability and Streptococcus thermophiles[J].Adv Mater Res,2013,655-657:1982-1986.
[7]WANG X,REN H,LIU D,et al.H(+)-aTPase-defective variants of Lactobacillus delbrueckii subsp.bulgaricus contribute to inhibition of postacidification of yogurt during chilled storage[J].J Food Sci,2013,78(2):297-302.
[8]CRUZ A G,CASTRO W F,FARIA J A F,et al.Stability of probiotic yogurt added with glucose oxidase in plastic materials with different permeability oxygen rates during the refrigerated storage[J].Food Res Int,2013,51(2):723-728.
[9]RAJAPAKSHA D S W,KODITHUWAKKU K A H T.Evaluation of chitosan for its inhibitory activity on post-acidification of set yoghurt under cold storage for 20 days[J].J Chit Chitos Sci,2014,2(1):16-20.
[10]SETTACHAIMONGKON S,VAN VALENBERG H J,GAZI I,et al.Influence of Lactobacillus plantarum WCFS1 on post-acidification,metabolite formation and survival of starter bacteria in set-yoghurt[J].Food Microbiol,2016,59:14-22.
[11]胡毕斯哈拉图,王宏梅,孟和毕力格.延长酸奶保质期的研究进展[J].中国酿造,2015,34(4):8-12.
[12]SINGH S K,AHMED S U,PANDEY A.Metabolic engineering approaches for lactic acid production[J].Process Biochem,2006,41(5):991-1000.
[13]李晨,赵云,郭鑫,等.利用pGhost 系统筛选抗后酸化保加利亚乳杆菌[J].中国食品学报,2015,15(4):56-62.
[14]龚文静,娄兴焜,虞龙.低能N+离子注入阿维菌素B1a 生产菌的诱变选育[J].中国酿造,2016,35(8):133-136.
[15]XU T T,BAI Z Z,WANG L J,et al.Breeding of D(-)-lactic acid high producing strain by low-energy ion implantation and preliminary analysis of related metabolism[J].Appl Biochem Biotechnol,2010,160(2):314-321.
[16]李晨,李程,谷新晰,等.酸奶中保加利亚乳杆菌后酸化的评价[J].河北农业大学学报,2013,36(5):82-85.
[17]韩雪,张兰威,张爽,等.弱后酸化酸奶发酵菌株的紫外诱变选育[J].中国酿造,2011,30(1):127-130.
[18]HOFHERR L A,GLATZ B A,HAMMOND E G.Mutagenesis of strains of Propionibacterium to produce cold-sensitive mutants[J].J Dairy Sci,1983,66(12):2482-2487.
[19]虞龙,姚驰亚,吴晓菲,等.低能氮离子注入和紫外线复合诱变选育高产酿酒酵母[J].辐射研究与辐射工艺学报,2017,35(2):46-51.
[20]GORINI L,KAUFMAN H.Selecting bacterial mutants by the penicillin method[J].Science,1960,131(3400):604-605.