食用菌是具有高等子实体的一类大型真菌,其种类、数量繁多,富含多种活性成分,具有提高人体免疫力,抗肿瘤、降血脂等保健功效[1-4]。我国是食用菌生产大国,2017 年全国食用菌产量为3 712万t,其中香菇产量为986.51万t,产值为2 721.92亿元,约占世界食用菌总产量的70%以上[5]。香菇味道鲜美,营养丰富,是我国著名的食用和药用菌。目前,国内外都很重视香菇功能性成分的开发,如香菇呈味物质[6]、香菇多糖[7]、香菇挥发性风味物质[1,8]、香菇药理活性物质[9]以及香菇可溶性膳食纤维[10]等。由于香菇的采收季节性很强,采收后容易发生腐败,造成品质和营养价值的损失。目前,香菇的加工多是当地鲜销和制罐,其他类型的深加工产品很少[6,10],同时残次香菇及伞柄等加工中的下脚料,被完全浪费掉了,虽然目前香菇及伞柄等加工中的下脚料作为发酵原料制作酒精[11]、葡萄酒[12]、饮料[10]和调味品[6]等。但是,其利用率还不高,产品的种类还不丰富且附加值高的产品偏少。所以,香菇的综合利用迫在眉睫,其开发前景广阔。
黑曲霉(Aspergillus niger)是一种常见的曲霉属真菌,广泛分布在谷物、空气、土壤等,黑曲霉是公认安全的微生物[13],且黑曲霉生长较快[14],产酶周期短[15],用其生产的酶,种类丰富、安全可靠、不产生毒素[15-16],因此采用黑曲霉生产的纤维素酶特异性高,反应条件比较温和,能作用于香菇细胞壁,将蛋白质、功能性多糖等大分子物质释放出来[17]。
本试验以香菇残次品为主要原料,采用黑曲霉产纤维素酶液体发酵,对黑曲霉产纤维素酶的培养基组成进行了研究,探讨了不同培养基组成对所产纤维素酶活的影响,为香菇的综合利用提供了一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
黑曲霉(Aspergillus niger):由长江大学微生物实验室提供。
1.1.2 化学试剂
羧甲基纤维素钠(sodium carboxymethyl cellulose-Na,CMC-Na)、柠檬酸、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS),氢氧化钠,葡萄糖,柠檬酸三钠、盐酸、酒石酸钾钠、苯酚(重蒸)、无水亚硫酸钠:国药集团化学试剂有限公司。实验所用化学试剂均为分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:将马铃薯去皮、洗净、切成小块,称取200 g加入1 000 mL蒸馏水,煮沸20 min,用纱布过滤,滤液补足水至1 000 mL,再加入糖和琼脂,熔化后分装,pH 自然。121 ℃灭菌25 min。
纤维素培养基:CMC 5.0 g,Na2HPO46.0 g,K2HPO44.0 g,(NH4)SO42.0 g,琼脂15.0 g,矿物盐溶液500 mL,蒸馏水500 mL,pH 自然。121 ℃灭菌25 min。
1.2 仪器与设备
DL-5-C高速冷冻离心机:上海市离心机械研究所;ET-2010KA立式双门回旋摇床:金坛市亿通电子有限公司;UV-1800紫外分光光度计:日本岛津公司;HH-4恒温水浴锅、BS-IE振荡培养箱:国华电器有限公司;HFsafe-1200超净工作台:上海力申科学仪器有限公司;HVE-50立体式高压灭菌锅:上海三申医疗器械有限公司;YE4A349120移液枪:北京金花仪器有限公司;SPX-250B-Z生化培养箱:上海博迅实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 孢子悬液的制备
吸取20 mL无菌水加入到黑曲霉斜面试管上,用接种环将试管斜面上的孢子轻轻刮下,倒入带有四层擦镜纸的灭菌漏斗中过滤,然后将过滤的黑曲霉菌液倒入灭菌盛有小玻璃珠的50 mL三角瓶中,重复3次,30 ℃、150 r/min振荡培养15 min,将孢子充分打散,得到单孢子悬液。
1.3.2 培养方法
将香菇残次品切成丁,加入一定量的蒸馏水,用高速匀浆机打成浆,采用121 ℃高压汽灭菌30 min,冷却,接入2 mL的黑曲霉孢子悬液,在30 ℃发酵一定时间后取发酵液,10 000 r/min离心10 min,取上清液测定纤维素酶活。
1.3.3 葡萄糖标准曲线的制作[16]
在不同浓度的标准葡萄糖溶液中各加入DNS溶液1.5 mL,混合液于沸水浴中煮沸5 min,冷却后加蒸馏水定容至25 mL,摇匀,在波长540 nm处测定光密度(OD540nm)值,并以葡萄糖含量(mg/mL)为横坐标(x),OD540nm值为纵坐标(y)绘制葡萄糖标准曲线,得到葡萄糖标准曲线回归方程:y=0.464 7x-0.047 0(R2=0.983 4)。
1.3.4 纤维素酶酶活测定
纤维素酶活测定采用还原糖法即CMC-DNS法[16,18-19]。取发酵后的粗酶液1 mL,加到2 mL、1%的CMC溶液(pH 4.8的0.05 mol/L柠檬酸缓冲液配制),于50 ℃恒温水浴中反应0.5 h,取出加入3 mL DNS显色液,沸水浴10 min测定还原糖的含量。羧甲基纤维素酶活力(sodium carboxymethyl cellulose activity,CMCA)计算公式如下:
式中:X表示羧甲基纤维素酶活力,U/mL;m表示从标准曲线查得的葡萄糖含量,mg;N表示酶液稀释倍数,2表示时间单位换算。
羧甲基纤维素酶活力定义:1 g固体酶(或1 mL液体酶),在(50±0.1)℃、指定pH条件下(酸性纤维素酶pH 4.8,中性纤维素酶pH 6.0),1 h水解羧甲基纤维素钠底物,产生出相当于1 mg葡萄糖的还原糖量为1个酶活力单位(U/mL)。
1.3.5 黑曲霉产纤维素酶曲线
将2 mL黑曲霉单孢子悬液接入到50 mL香菇液体培养基中,在30 ℃下、150 r/min振荡培养。从第2天起,每隔24 h取样,测定发酵液的纤维素酶活,绘制黑曲霉产纤维素酶曲线,确定黑曲霉液态发酵时间。
1.3.6 培养基成分优化单因素试验
香菇与水料水比对产纤维素酶活的影响:分别按照香菇与水料水比为1∶6、1∶8、1∶10、1∶12、1∶14(g∶mL),接入2 mL的孢子悬液进行发酵培养,30 ℃、150 r/min振荡培养120 h后测定酶活。
麦芽糖添加量对产纤维素酶活的影响:在香菇液培养基中加入麦芽糖,使其质量浓度分别为0、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L,接入2 mL的孢子悬液进行发酵培养,30 ℃、150 r/min振荡培养120 h后测定酶活。
蛋白胨添加量对产纤维素酶活的影响:在香菇液培养基中加入蛋白胨,使其质量浓度分别为0.25 g/L、0.50 g/L、0.75 g/L、1.00 g/L、1.25 g/L,接入2 mL 的孢子悬液进行发酵培养,30 ℃、150 r/min振荡培养120 h后测定酶活。
酵母膏添加量对产纤维素酶活的影响:确定最佳麦芽糖和蛋白胨的添加量基础上,在香菇液培养基中加入酵母膏,使其质量浓度分别为0.25 g/L、0.50 g/L、0.75 g/L、1.00 g/L、1.25 g/L,接入2 mL 的孢子悬液进行发酵培养,30 ℃、150 r/min振荡培养120 h后测定酶活。
1.3.7 培养基成分优化响应面试验
选取香菇与水料水比(A)、麦芽糖添加量(B)、蛋白胨添加量(C)、酵母膏添加量(D)4个因素进行响应面(Box-Behnken)试验设计,以羧甲基纤维素酶酶活(Y)为响应值,其因素水平设置见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design

2 结果与分析
2.1 黑曲霉产纤维素酶曲线
发酵液的纤维素酶活随发酵时间的变化结果见图1。由图1可知,随着发酵时间在48~120 h范围内的延长,黑曲霉在香菇培养基中产纤维素酶活随之增加,并在发酵时间120 h时达到最高,为9.21 U/mL,发酵时间>120 h 之后呈平稳趋势。因此,黑曲霉产纤维素酶最佳发酵时间为120 h。
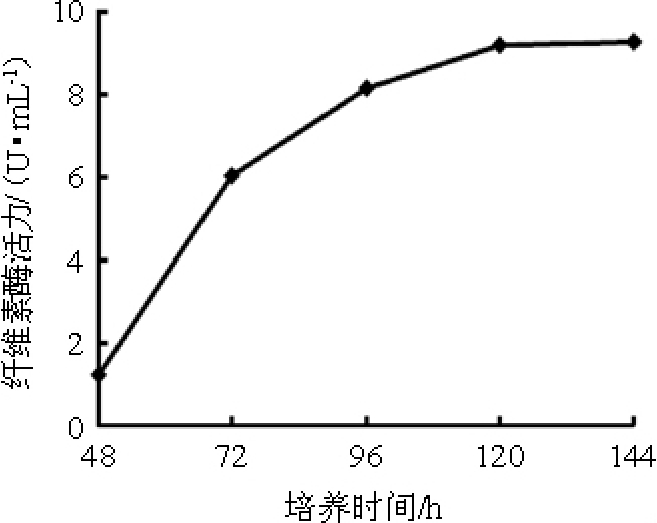
图1 黑曲霉产纤维素酶曲线
Fig.1 Curve of cellulase production by Aspergillus niger
2.2 培养基成分优化单因素试验
2.2.1 香菇与水比例对产纤维素酶活的影响
不同的香菇与水比例对纤维素酶活的影响结果见图2。由图2可知,香菇与水比例为1∶6~1∶10(g∶mL)范围时,纤维素酶活逐渐增加;香菇与水比例为1∶10(g∶mL)时,纤维素酶活最高,为9.37 U/mL;香菇与水比例在1∶10~1∶14(g∶mL)范围时,纤维素酶活逐渐降低。因此,香菇与水比例1∶10(g∶mL)为宜。
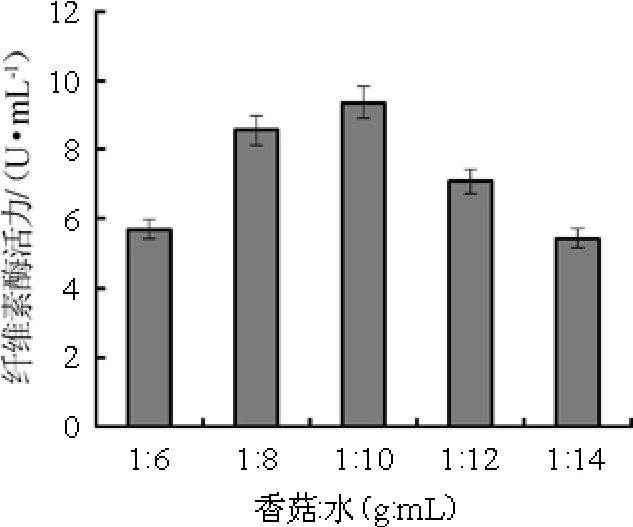
图2 香菇与水比例对黑曲霉产纤维素酶的影响
Fig.2 Effect of Lentinus edodes to water ratio on cellulase production by Aspergillus niger
2.2.2 麦芽糖添加量对产纤维素酶活的影响
前期预实验发现,在麦芽糖、葡萄糖、乳糖和蔗糖这4种碳源的情况下,黑曲霉产酶对麦芽糖作为碳源的利用效果最高。麦芽糖添加量对纤维素酶活的影响结果见图3。由图3可知,随着麦芽糖添加量的增加,纤维素酶活也在增加。达到1 g/L 时,纤维素酶活为9.48 U/mL,再增加其添加量对纤维素酶活影响并不显著。考虑到成本,因此,选择麦芽糖添加量1 g/L为最佳。
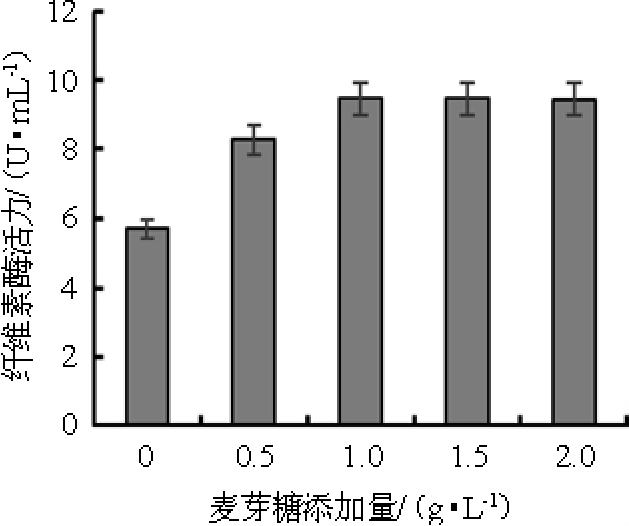
图3 麦芽糖添加量对产纤维素酶活的影响
Fig.3 Effect of maltose addition on cellulase production by Aspergillus niger
2.2.3 蛋白胨添加量对产纤维素酶活的影响
前期预实验发现,在蛋白胨、尿素、硫酸铵和硝酸钠这4种氮源的情况下,黑曲霉产酶对蛋白胨作为氮源的利用效果最高。蛋白胨添加量对纤维素酶活的影响结果见图4。由图4可知,随着蛋白胨添加量的增加,纤维素酶活也在增加。达到0.75 g/L 时,纤维素酶活为9.95 U/mL,再增加其添加量对纤维素酶活影响并不显著。考虑到成本,因此,选择蛋白胨添加量0.75 g/L为最佳。
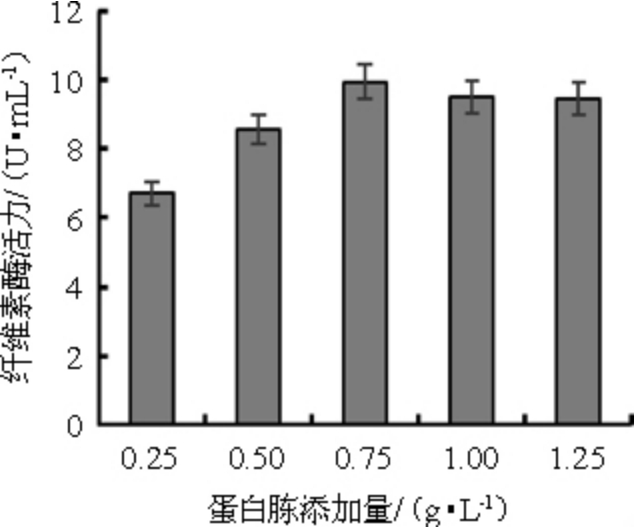
图4 蛋白胨添加量对产纤维素酶活的影响
Fig.4 Effect of peptone addition on cellulase production by Aspergillus niger
2.2.4 酵母膏添加量对产纤维素酶活的影响
酵母膏作为生长因子,其添加量对纤维素酶活的影响结果如图5所示。由图5可知,随着酵母膏添加量的增加,纤维素酶活也在增加。达到0.75 g/L时,纤维素酶活为10.19 U/mL,再增加其添加量对纤维素酶活影响并不显著。考虑到成本,因此,选择酵母膏添加量0.75 g/L为最佳。
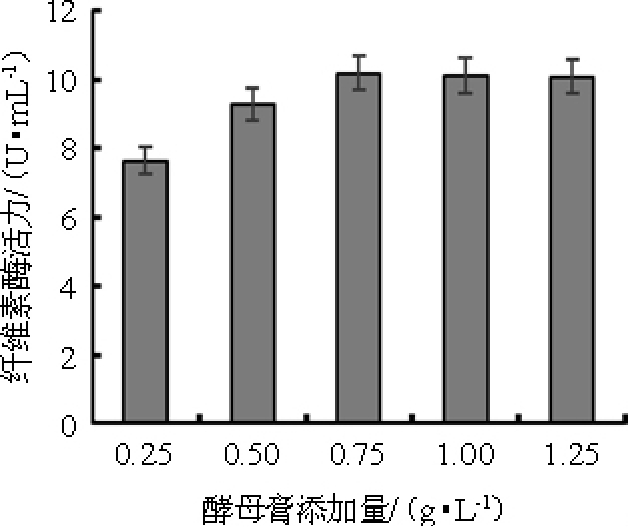
图5 酵母膏添加量对产纤维素酶活的影响
Fig.5 Effect of yeast extract addition on cellulase production by Aspergillus niger
2.3 响应面试验设计及分析
选取香菇与水料水比(A)、麦芽糖添加量(B)、蛋白胨添加量(C)、酵母膏添加量(D)4个因素进行响应面(Box-Behnken)试验设计,以羧甲基纤维素酶酶活(Y)为响应值,Box-Behnken试验方案及结果见表2,方差分析见表3。
表2 Box-behnken试验设计与结果
Table 2 Design and results of Box-behnken experiments

通过Design Expert 8.0软件对数据进行二次回归拟合,获得香菇与水料水比、麦芽糖、蛋白胨和酵母膏对纤维素酶活的二次回归方程:
表3 二次回归模型方差分析
Table 3 Variance analysis of quadratic regression model
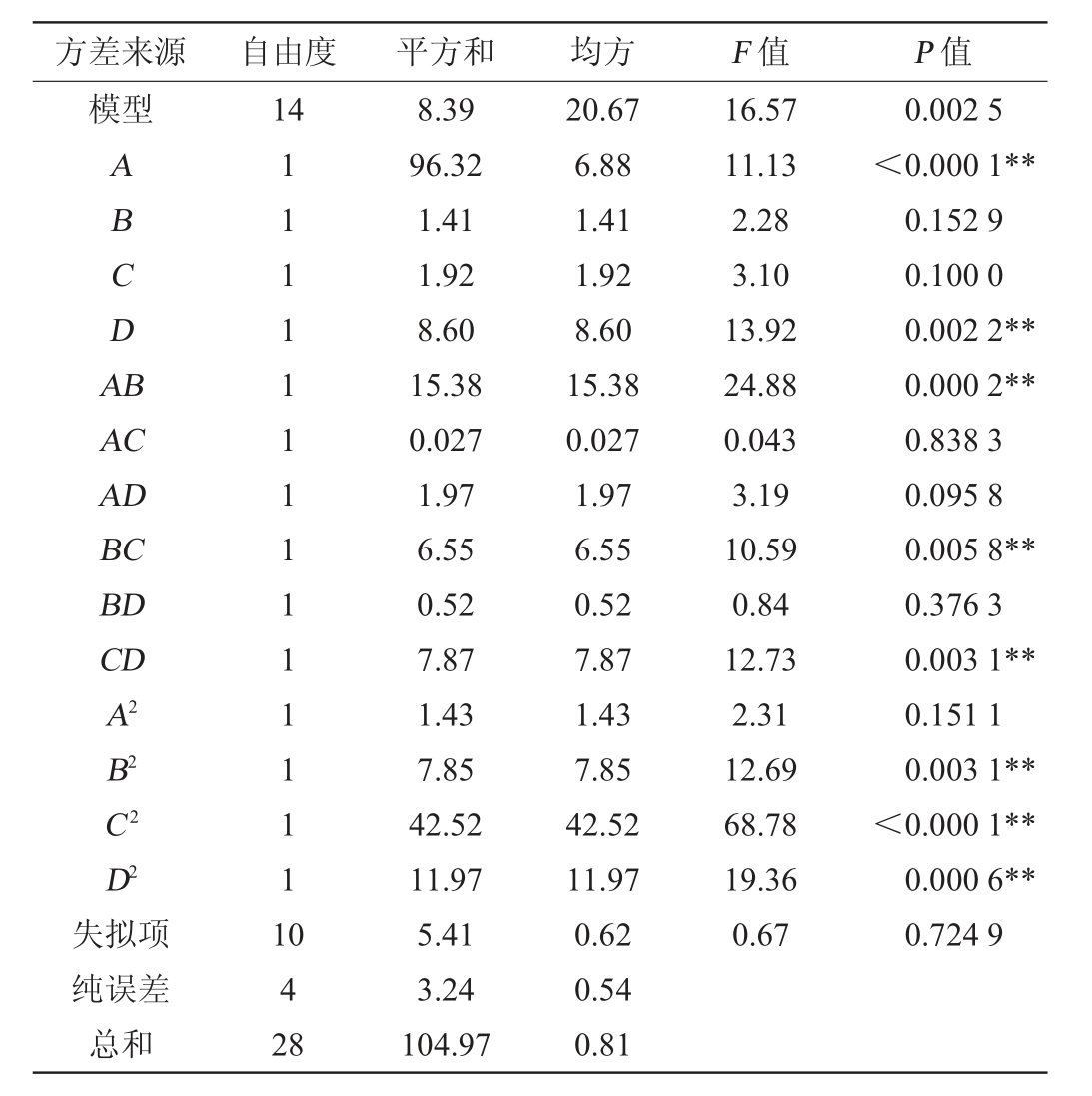
注:“**”表明对结果影响极显著(P<0.01)。
由表3可知,该模型P=0.002 5<0.01,失拟项P>0.05,表明该模型回归显著,失拟性不显著,因而无失拟因素存在。一次项A、D、交互项AB、BC、CD、二次项B2、C2、D2对结果影响极显著(P<0.01)。回归方程决定系数R2=0.917 5,调整决定系数R2adj=0.835 1,表明方程拟合较好。变异系数(coefficient of variation,CV)=8.23%,表示试验的精确度较高,试验操作可信。
Design Expert8.0软件得到三维响应面分析见图6。等高线的形状可以反映因素间交互作用的强弱大小,圆形表示交互作用不显著,椭圆形表示交互作用显著。由图6可知,麦芽糖与香菇与水料水比、麦芽糖与蛋白胨、酵母膏与麦芽糖的交互作用等高线均呈椭圆形,表明以上交互作用均对纤维素酶活影响显著。
为当麦芽糖量固定时,纤维素酶活随着香菇与水料水比呈先增大后减小的趋势;当香菇与水料水比固定时,纤维素酶活随麦芽糖量的增加也呈先增大后减小的趋势。
当麦芽糖量固定时,纤维素酶活随着蛋白胨量呈先增大后减小的趋势;当蛋白胨量固定时,纤维素酶活随麦芽糖量的增加也呈先增大后减小的趋势。
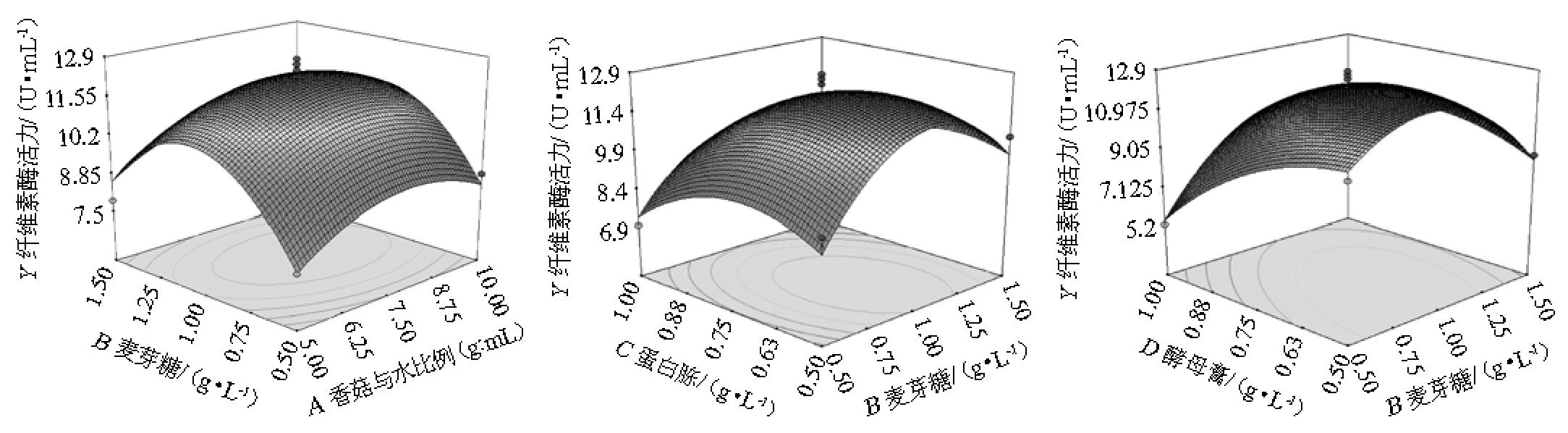
图6 各因素交互作用对黑曲霉产纤维素酶影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between each factors on cellulase production by Aspergillus niger
当酵母膏量固定时,纤维素酶活随着麦芽糖量呈先增大后减小的趋势;当麦芽糖量固定时,纤维素酶活随着酵母膏量也呈先增大后减小的趋势。
2.4 最佳培养条件的确定及其验证实验
对回归方程求解,得到最佳发酵培养基组成为:香菇与水比例为1∶9.09(g∶mL),麦芽糖添加量为0.91 g/L,蛋白胨添加量为0.66 g/L,酵母膏添加量为0.50 g/L。纤维素酶活预测值为12.95 U/mL。为方便实际操作,调整发酵培养基组成为:香菇与水比例为1∶9(g∶mL),麦芽糖添加量为0.9 g/L,蛋白胨添加量为0.7 g/L,酵母膏添加量为0.5 g/L进行发酵产纤维素酶3次验证实验,测得纤维素酶活平均值为13.15 U/mL,预测误差为1.52%。表明培养基优化模型是有效的。
3 结论
在纤维素酶的生产过程中,影响酶产量的因素很多,这些因素之间不是孤立的,而是相互联系的。本研究选取香菇与水料水比、麦芽糖添加量、蛋白胨添加量和酵母膏添加量4个因素,利用响应面法来优化黑曲霉产纤维素酶的发酵培养基组成。结果表明,在培养基组成为香菇与水比例为1∶9(g∶mL),麦芽糖添加量为0.9 g/L,蛋白胨添加量为0.7 g/L,酵母膏添加量为0.5 g/L的条件下,发酵得纤维素酶活为13.15 U/mL,比培养基未优化前提高了22.5%。表明用这种方法来优化黑曲霉产纤维素酶的发酵培养基,能够使酶活得到一定的提高,为香菇残次品的综合利用提供了一定的理论依据。
[1]殷朝敏,范秀芝,史德芳,等.HS-SPME-GC-MS 结合HPLC 分析5 种食用菌鲜品中的风味成分[J].食品工业科技,2019,40(3):260-266.
[2]刘晓,闫语婷.香菇的营养价值及综合利用现状与前景[J].食品工业,2017,38(3):207-210.
[3]张弘,王琦,姚骏,等.香菇柄营养成分及生物活性的研究[J].食品研究与开发,2019,40(7):203-206.
[4]张茜,李超,崔珏,等.香菇及香菇柄的研究进展[J].农产品加工,2018,467(21):59-62.
[5]中国食用菌协会.2017 年度全国食用菌统计调查结果分析[EB/OL].(2018-12-28)[2019-05-15].http://www.cefa.org.cn/2018/12/27/10457.html.
[6]曹世宁,陈相艳,崔文甲,等.食用菌中呈味物质的研究进展[J].食品工业,2016,37(3):231-232.
[7]郝俊尧.香菇多糖的提取工艺研究[J].湖北农业科学,2019,58(6):110-113.
[8]陈洪雨,鲍大鹏,康前进,等.香菇挥发性风味物质的研究进展[J].食用菌学报,2018,25(4):105-114.
[9]BISEN P S,BAGHEL R K,SANODIYA B S,et al. Lentinus edodes:a macrofungus with pharmacological activities[J].Curr Med Chem,2010,22(22):2419-2430.
[10]骆嘉原,常晨,孙瑶,等.香菇可溶性膳食纤维饮品的研制[J].中国酿造,2017,36(3):182-187.
[11]魏书信,刘丽娜,崔国梅,等.响应面法优化香菇柄酒精发酵工艺[J].中国酿造,2019,38(3):125-129.
[12]孙永林,王海燕.发酵型香菇葡萄酒酿造工艺研究[J].中国酿造,2015,34(11):167-170.
[13]张熙,韩双燕.黑曲霉发酵产酶研究进展[J].化学与生物工程,2016,33(1):13-14.
[14]刘宇,李阳,史同瑞,等.产纤维素酶黑曲霉菌的研究进展[J].畜牧与兽医,2015,47(6):157-159.
[15]张曈,刘晓燕,许家兴,等.黑曲霉产纤维素酶发酵条件的优化及酶学性质研究[J].资源节约与环保,2015(1):11-14.
[16]高星星,潘丽军,杨培周.里氏木霉与黑曲霉混合发酵产纤维素酶的条件优化[J].食品科学,2012,19(2):193-198.
[17]先天敏,陈介南,张林.黑曲霉改良株C112 产β-葡萄糖苷酶的诱导及条件优化[J].中南林业科技大学学报,2013,33(11):154-161.
[18]董基,刘钊.黑曲霉液体发酵桔粉产纤维素酶的研究[J].食品工程,2012,11(1):34-37.
[19]中华人民共和国国家发展和改革委员会.QB 2583—2003 纤维素酶制剂[S].北京:中国标准出版社,2003.
[20]ACHARYA P B,ACHARYA D K,MODI H A.Optimization for cellulase production by Aspergillus niger using saw dust as substrate[J].Afr J Biotechnol,2008,7(22):4147-4251.