γ-氨基丁酸(γ-aminobutyric acid,GABA)对人体有诸多生理功效,如降低血压[1-2]、缓解紧张焦虑[3]、防止肥胖[4]、改善睡眠[5]、促进身高增长[6]等,还可促进肾机能改善和保护作用。GABA广泛存在于微生物、植物、动物体内[7],在植物和微生物中,其在三羧酸循环中发挥着代谢功能[8];在哺乳动物中,其作为一种抑制性神经递质,主要作用于中枢神经系统,具有诱导胰岛素分泌[9]、调节脑内蛋白合成[10]等多种重要的生理功能,在保健食品、饮品[11]、动物饲料等方面展现了良好的前景。
GABA天然存在含量低,很难从一些天然动植物组织中大量提取分离,目前制备GABA主要利用微生物发酵法[12-13],这是一种既安全又低成本的方法[14]。乳酸菌是人体必不可少的且具有重要生理功能的有益菌[15]。国内外近年来也开展了许多微生物发酵产GABA的研究。DIANA M等[16]研究发现,从西班牙奶酪中分离的乳酸菌株可在未经优化的全麦面粉溶液中大量转化生成GABA,认为在发酵食品中添加此类菌株可为开发调节高血压的功能性食品提供可能性;黄敏欣等[17]通过对黄酒的发酵工艺优化后测得酒中的GABA含量达到309.09 mg/L,并证实其中有乳酸菌产生GABA;NORIKO K等[18]通过对发酵水产品中分离的副干酪乳杆菌(Lactobacillus paracasei)NFRI 7415发酵条件的探究,发现在底物浓度为500 mmol/L时,GABA产量为302 mmol/L;苏晓琴[19]从传统发酵米粉发酵液中筛选出产GABA的乳酸菌,利用该菌株研制出一种GABA含量可达25.02 mg/100 g的绿豆酸面团面包,其具有独特的风味且消费者的可接受度较高;韩昱姝等[20]从泡菜中筛选得到稳定产生GABA的乳杆菌,以牛奶为底物发酵GABA产量可达到1.68 mg/mL;田蕊[21]通过产GABA乳酸菌的紫外诱变及发酵条件优化,得到了GABA产量达到4.003 g/L的发酵菌株;SUNG H H等[22]利用从泡菜中分离出的短乳杆菌(Lactobacillus brevis)L-32进行生物转化产生GABA,通过小鼠实验证明了其可作为一种新型睡眠营养补充剂。
通过本课题组前期工作,分离筛选并鉴定得到菌株发酵乳杆菌(Lactobacillus fermentum)SD2112,本研究以菌株SD2112为对象,以谷氨酸为底物,发酵生成GABA,并利用单因素试验和响应面法优化其发酵条件,以提高GABA的产量,为后续应用于乳品及其他食品提供研究基础。通过对乳酸菌发酵生产GABA的研究,探索将乳酸菌产GABA应用于功能性食品开发的可能性,以期产生一定的社会效益及经济效益。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
发酵乳杆菌(Lactobacillus fermentum)SD2112:陕西科技大学食品与生物工程学院生物工程系419研究室。
1.1.2 化学试剂
95%乙醇、次氯酸钠(均为分析纯):天津市富宇精细化工有限公司;谷氨酸(分析纯):西安优博生物技术有限公司;苯酚(分析纯):国药集团化学试剂有限公司;硼酸、硼砂(均为分析纯):天津市登峰化学试剂厂;γ-氨基丁酸标准品(分析纯):西安优博生物技术有限公司。
1.1.3 培养基MRS肉汤培养基:北京陆桥技术股份有限公司。
1.2 仪器与设备
UV5300PC型紫外可见分光光度计:上海元析仪器有限公司;pHs-3c酸度计、FA2204B电子天平:上海精科仪器有限公司;DH5000AB电热恒温培养箱、WG-71电热鼓风干燥机:天津市泰斯特仪器有限公司;TG16A-WS台式高速离心机:湖南赛特湘仪离心机仪器有限公司。
1.3 实验方法
1.3.1 菌种活化
将-18 ℃冻藏保存的发酵乳杆菌(Lactobacillus fermentum)SD2112菌株以5%的接种量接种至MRS肉汤培养基中,于37 ℃条件下恒温培养24 h,活化两代后于4 ℃冰箱保存备用。
1.3.2 菌株培养
将已活化两代后保存于冰箱的发酵乳杆菌(Lactobacillus fermentum)SD2112按照5%的接种量,接种于含有50 mmol/L谷氨酸的MRS肉汤培养基中,在37 ℃条件下,培养60 h,从而获得含有GABA的发酵液。
1.3.3 分析检测
(1)菌液pH值测定
在室温条件下,使用pHs-3c酸度计直接测定,每个样品平行测定3次。
(2)γ-氨基丁酸含量测定
γ-氨基丁酸含量测定采用Berthelot比色法[23]。γ-氨基丁酸标准曲线的绘制:取质量浓度为0 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL的GABA标准溶液,加入1 mol/L的NaCO3溶液0.1 mL,pH值10.0,0.2 mol/L的硼酸盐缓冲液0.5 mL,6%苯酚1 mL,混匀后在室温下,在5 min内加入5.2%NaClO溶液1.0 mL,混匀,放置5~8 min。沸水浴10 min后立刻冰水浴20 min,待溶液出现蓝绿色后加入体积分数为60%的乙醇溶液2.0 mL,混匀后在冰水浴中放置20~40 min。以空白试剂为参比,在波长640 nm处测定吸光度值,并做3次平行样。以γ-氨基丁酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制γ-氨基丁酸标准曲线,按照γ-氨基丁酸标准曲线回归方程(y=1.2356x+0.0644,R2=0.9913)计算发酵液中γ-氨基丁酸含量。
1.3.4 发酵工艺优化单因素试验
依次选取发酵温度(28 ℃、31 ℃、34 ℃、37 ℃、40 ℃)、发酵时间(48 h、60 h、72 h、84 h、96 h)、初始pH值(4.0、4.5、5.0、5.5、6.0)、接种量(3%、4%、5%、6%、7%)、底物添加量(25mmol/L、50mmol/L、75mmol/L、100mmol/L、200mmol/L),考察其对GABA生成量的影响。
1.3.5 发酵工艺优化响应面试验
在单因素试验的基础上以及通过对各试验结果进行分析,采用Box-Behnken中心组合设计原理,以底物添加量、接种量、培养时间为考察因素,以GABA的产量(Y)为响应值,通过软件Design-Expert8.0.6进行试验设计,Box-Behnken试验设计因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design

1.3.6 数据处理及分析
以上试验均重复3次,结果取平均值。利用Origin8.6软件进行数据制图及统计分析,Design Expert8.0.6进行结果分析。
2 结果与分析
2.1 发酵工艺优化单因素试验
2.1.1 初始pH值对GABA产量的影响
在培养条件为接种量5%、培养温度37℃、培养时间72 h、底物添加量50 mmol/L时,考察培养基的初始pH值分别为4.0、4.5、5.0、5.5、6.0时的GABA产量,结果见图1。
由图1可知,菌株SD2112的GABA产量随着pH值在4.0~6.0范围内的增大呈先升高后降低趋势,说明在较酸性环境中随着pH值的上升,GABA的产量缓慢上升,在pH值达到5.0时产量达到最大值1.639 g/L,随后随着初始pH值的升高,GABA产量明显降低。由于pH值对微生物发酵是一重要因素[24],该结果可能由于该pH值是GABA的代谢途径中谷氨酸脱羧酶的适宜pH值,从而导致在pH值为5.0时GABA的产量最高,这与之前的研究结果相似[18,25]。因此最适初始pH值为5.0。

图2 初始pH值对γ-氨基丁酸产量的影响
Fig.2 Effect of initial pH on γ-aminobutyric acid production
2.1.2 接种量对γ-氨基丁酸产量的影响
控制初始pH值5.0,考察接种量分别为3%、4%、5%、6%、7%时的GABA产量,结果见图2。
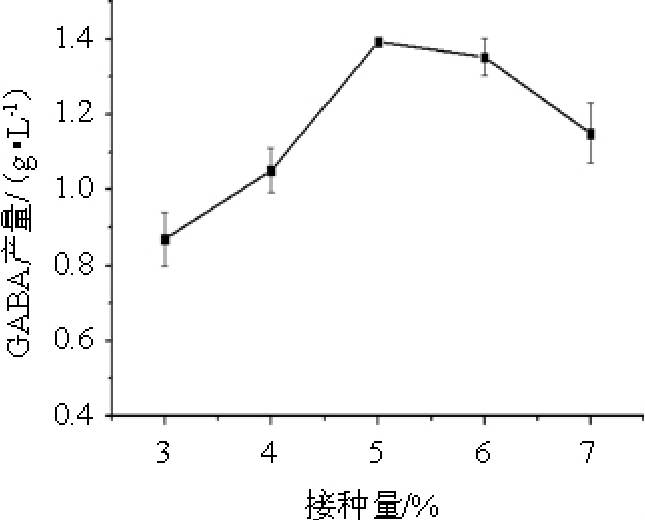
图2 接种量对γ-氨基丁酸产量的影响
Fig.2 Effect of inoculum on γ-aminobutyric acid production
由图2可知,随着接种量在3%~7%范围内的增加,菌株SD2112产GABA的量也随之呈现一定趋势,在接种量为4%~5%时,GABA的生成量急剧增加,而在接种量为6%和7%时,GABA生成量开始缓慢降低。因此,最佳接种量为5%。
2.1.3 底物添加量对γ-氨基丁酸产量的影响
控制接种量为5%,考察底物添加量分别为25 mmol/L、50mmol/L、75 mmol/L、100 mmol/L、200 mmol/L时的GABA产量,结果见图3。
由图3可知,随着底物添加量在25~200 mmol/L的增大,GABA的产量呈现先上升后下降的趋势,在添加量为50 mmol/L时,GABA产量最高为1.74 g/L,推测其原因可能为在GABA代谢途径中添加量为50 mmol/L时谷氨酸脱羧酶活性最高,转化谷氨酸生成GABA的量最大,在添加量为25 mmol/L时,底物含量过低,不足以支持GABA的大量转化,而随着添加量的升高,代谢过程受到了反馈抑制,导致谷氨酸脱羧酶活性降低[18],从而GABA产量降低。因此,最佳底物添加量为50 mmol/L。
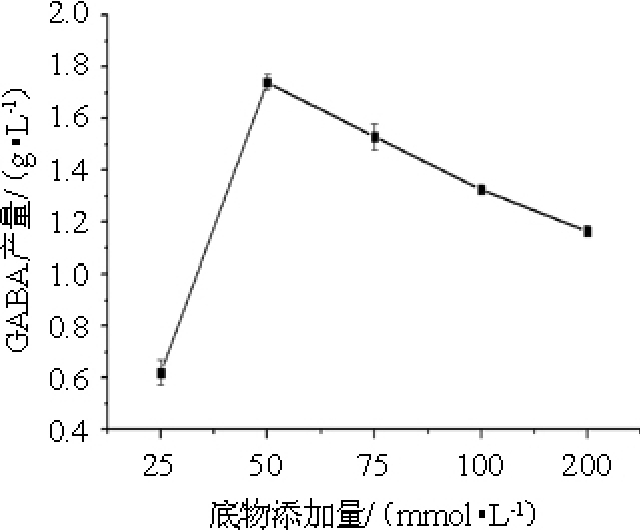
图3 底物添加量对γ-氨基丁酸产量的影响
Fig.3 Effect of substrate addition on γ-aminobutyric acid production
2.1.4 培养温度对γ-氨基丁酸产量的影响
控制底物添加量为50 mmol/L,考察培养温度分别为28 ℃、31 ℃、34 ℃、37 ℃、40 ℃时的GABA产量,结果见图4。
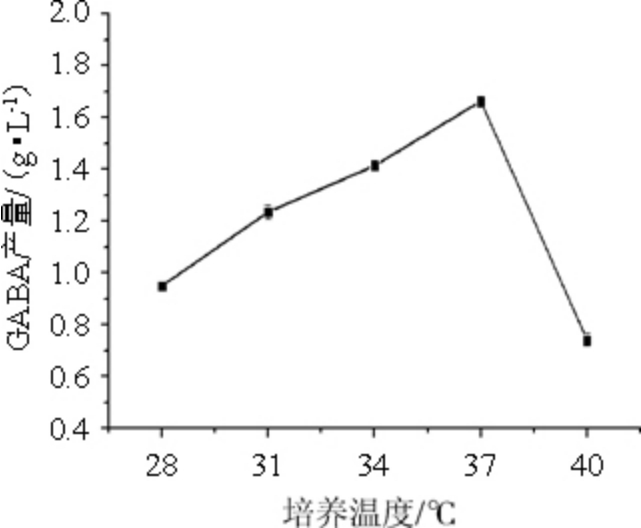
图4 培养温度对γ-氨基丁酸产量的影响
Fig.4 Effect of fermentation temperature on γ-aminobutyric acid production
温度也是影响细胞生长代谢的重要因素之一,可影响细胞内酶的产生以及生物合成等相关过程。由图4可知,随着培养温度在28~37 ℃区间上升,GABA的产量也随之上升,在37 ℃时达到最大值1.663 g/L,而培养温度>37 ℃之后,GABA产量显著降低,这与其他研究结果基本相似,如冯志彬等[26]探究短乳杆菌的最佳工艺条件发现最适温度为37 ℃。这可能是因为此温度为谷氨酸脱羧酶催化谷氨酸转化生成GABA的最适温度,温度过高则会破坏部分谷氨酸脱羧酶的活性,导致GABA的产量下降。因此,最佳培养温度为37 ℃。
2.1.5 培养时间对产γ-氨基丁酸的影响
控制培养温度为37 ℃,考察培养时间分别为48 h、60 h、72 h、84 h、96 h条件下,结果见图5。
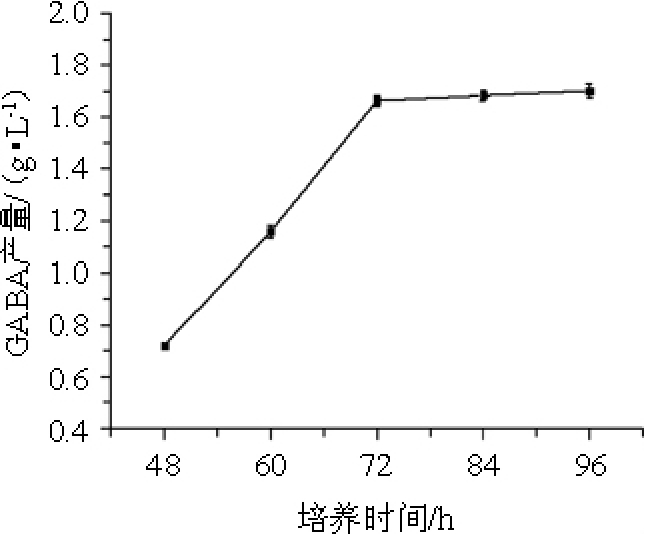
图5 培养时间对γ-氨基丁酸产量的影响
Fig.5 Effect of fermentation time on γ-aminobutyric acid production
由图5可知,在培养时间为48~72 h时,GABA产量随之增加,而在培养时间>72 h后,GABA产量趋于平缓,可能是由于发酵后期的菌体进入了稳定生长期,活菌数最多,代谢产物开始积累,菌体可以将培养基中的底物缓慢转化为GABA。因此,最佳培养时间为72 h。
2.2 发酵工艺优化响应面试验
菌株SD2112的最优单因素条件如下:底物添加量50 mmol/L、初始pH值5.0、接种量5%、37 ℃恒温培养72 h。在单因素试验基础上,依据Box-Behnken试验设计原理,以培养时间(A)、接种量(B)、底物添加量(C)这3个因素为自变量,以GABA产量(Y)为响应值,设计3因素3水平的试验,利用Design-Expert 8.0.6软件进行试验模型分析,考察各因素之间的交互作用,并对最佳发酵工艺条件进行预测。Box-Behnken试验设计及结果见表2,方差分析见表3。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
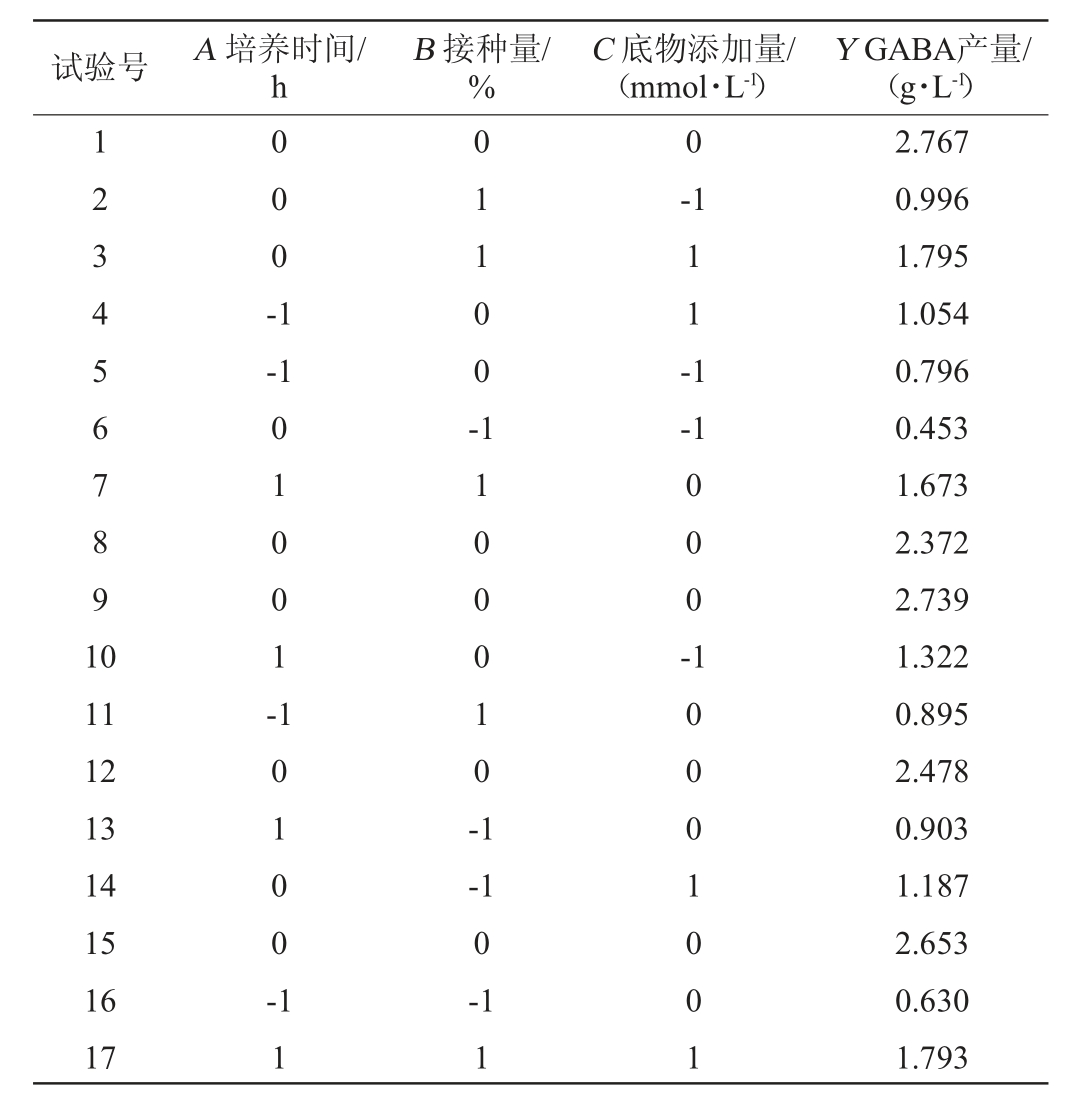
据表2的试验结果,通过Design-Expert 8.0.6软件对试验结果进行二次回归拟合,得到各个因素对样品GABA产量这一指标的二次回归方程如下:
表3 回归方程方差分析
Table 3 Variance analysis of regression equation

注:“*”表示差异显著(P<0.05);“**”表示差异较显著(P<0.01);“***”表示差异极显著(P<0.001)。
由表3可知,回归方程模型项P<0.000 1,失拟项P=0.476 8>0.05,由此可知建立二次的回归模型显著,失拟项不显著,表明建立的回归方程拟合良好。影响因子A、B、C的P值均<0.01,表明培养时间(A)、接种量(B)和底物添加量(C)对GABA的产量的影响较显著。二次型A2、B2、C2的P值<0.001,说明这三个因素对GABA产量的影响不仅仅是简单的线性关系。二次回归方程的决定系数R2为97.95%,说明97.95%的响应值变化可以用该模型解释。校正决定系数R2adj=95.30%,与R2相近,进一步说明了模型的显著性,因此可以用此回归方程来预测发酵乳杆菌SD2112的GABA产量。
统计软件Design-Expert.V8.0.6对回归方程进行分析,得响应面及等高线见图6。
通过对回归方程进行分析,得到最佳工艺条件为:底物添加量50 mmol/L、接种量5%、培养时间72 h。此条件下得出的GABA的产量理论值为2.578 g/L。通过使用所优化的条件,进行3组重复的验证试验,试验得到的GABA产量实际值为2.967 g/L,与预测值接近,证明利用响应面优化得到的发酵工艺条件合理可靠。

图7 培养时间、接种量及底物添加量对γ-氨基丁酸产量影响的响应面及等高线
Fig.7 Response surface plots and contour lines of effects of interaction between fermentation time,inoculum and substrate addition on γ-aminobutyric acid production
3 结论
本研究通过单因素及响应面法优化了发酵乳杆菌转化谷氨酸生成GABA的发酵条件。结果表明,发酵乳杆菌SD2112产GABA的最佳发酵条件为底物谷氨酸添加量50 mmol/L、初始pH 5.0、接种量5%、37 ℃恒温培养72 h,其GABA产量为2.967 g/L,是优化前的2.6倍,达到了优化的目的,并为后续研究奠定了基础。
[1]斯晗,史锋.谷氨酸棒杆菌S9114 摇瓶发酵产γ-氨基丁酸的研究[J].工业微生物,2017,47(1):31-36.
[2]杨胜远,陆兆新,吕凤霞,等.一株产谷氨酸脱羧酶乳酸菌的鉴定及其酶学性质[J].工业微生物,2007,37(6):25-30.
[3]SHIAH I S,YATHAM L N.GABA Function in mood disorder:an update and critical review[J].Life Sci,1998,63(15):1289-1303.
[4]张惠媛.富伽马氨基丁酸米糠抗肥胖效果分析[D].天津:天津科技大学,2017.
[5]黄远英,袁根良.酪蛋白水解物与GABA 复配制剂改善睡眠功能的研究[J].食品安全质量检测学报,2016,7(1):351-355.
[6]余绍淼,吴福同,王永新,等.关于运用复方GABA 来促进矮小少年儿童尽可能长高的研究[J].中国优生与遗传杂志,2010,18(8):112-115.
[7]LIAO W C,WANG C Y,SHYU Y T,et al.Influence of preprocessing methods and fermentation of adzuki beans on γ-aminobutyric acid(GABA)accumulation by lactic acid bacteria[J].J Funct Food,2013,5(3):1108-1115.
[8]窦海艳.副干酪乳杆菌产γ-氨基丁酸的研究[D].哈尔滨:黑龙江大学,2010.
[9]DAI X H.Development of Laozao enriched with GABA[J].Food science&Technology,2008,1:22-25.
[10]TUJIOKA K,OHSUMI M,HORIE K,et al.Dietary gamma-aminobutyric acid affect brain protein synthesis rate in ovariectomized female rats[J].J Nutr Sci Vitaminol,2009,55(1):75-80.
[11]吴慧,崔本来.柱前衍生-高效液相色谱法检测运动型饮料中γ-氨基丁酸的含量[J].中国酿造,2018,37(11):154-158.
[12]WANG J J,LEE C L,PAN T M.Improvement of monacolin K,γ-aminobutyric acid and citrinin production ratio as a function of environmental conditions of Monascus purpurcus NTU 601[J].J Ind Microb Biotechnol,2003,30(11):669-676.
[13]KONO I,HIMENO K.Changes in γ-aminobutyric acid content during beni-koji making[J].Biosci Biotech Bioch,2000,64(3):617-619.
[14]杨晶晶,曲媛,崔秀明.γ-氨基丁酸的制备方法与含量测定研究进展[J].食品工业科技,2014,35(3):351-356.
[15]范杰,孙君社,张晓杰,等.高产γ-氨基丁酸乳酸菌的筛选及鉴定[J].中国酿造,2011,30(4):39-41.
[16]DIANA M,TRES A,QUÍLEZ J,et al.Spanish cheese screening and selection of lactic acid bacteria with high gamma-aminobutyric acid production[J].Sci Technol,2014,56(2):351-355.
[17]黄敏欣,洪泽淳,赵文红,等.红曲对广东客家黄酒发酵及产γ-氨基丁酸的影响[J].中国酿造,2016,35(10):46-50.
[18]NORIKO K,JUN S,SHINICHI K,et al.Production of g-aminobutyric acid(GABA) by Lactobacillus paracasei isolated from traditional fermented foods[J].Food Microbiol,2005,22(6):497-504.
[19]苏晓琴.酸面团发酵富集γ-氨基丁酸面包的研究[D].无锡:江南大学,2016.
[20]韩昱姝,李永转,胡凤山,等.一株高产γ-氨基丁酸乳酸菌的筛选及应用[J].中国酿造,2017,36(12):72-75.
[21]田蕊.产γ-氨基丁酸乳酸菌的筛选鉴定、紫外诱变及发酵条件优化[D].呼和浩特:内蒙古农业大学,2018.
[22]SUNG H H,KI B H,HYUNG J S.Biotransformation of monosodium glutamate to gamma-aminobutyric acid by isolated strain Lactobacillus brevis L-32 for potentiation of pentobarbital-induced sleep in mice[J].Food Biotechnol,2017,31(2):80-93.
[23]杨胜远,陆兆新,吕凤霞,等.谷氨酸脱羧酶活力测定中GABA 比色定量方法研究[J].食品科学,2006,27(7):205-209.
[24]DHAKALR,BAJPA V K,BAEK K H.Production of gaba(γ-aminobuytric acid)by microorganisms:a review[J].Brazil J Microbiol,2012,43(4):1230-1241.
[25]LI H,QIU T,HUANG G,et al.Production of gamma-aminobutyric acid by Lactobacillus brevis NCL912 using fed-batch fermentation[J].Microb Cell Factor,2010,9(1):85-85.
[26]冯志彬,吴思颖,张玉香,等.短乳杆菌产γ-氨基丁酸发酵条件的优化[J].鲁东大学学报,2012,28(3):248-251.