黄酒是世界上最古老的酒类之一,起源于中国,其酿造和饮用历史已有5 000余年[1]。闻名于世的首推绍兴酒。黄酒是以稻米、黍米、玉米、小米、小麦等为主要原料,采用蒸煮、加酒曲、糖化、发酵、压榨等工艺而成的酿造酒[2]。黄酒含有多酚、类黑精、谷胱甘肽等生理活性成分,具有清除自由基,预防心血管病、抗衰老等生理功能[3]。黄酒在酿造过程中经菌群酶的作用产生丰富的功能性低聚糖,可促进肠道有益菌群的定殖,从而改善肠道功能、增强机体免疫力[4]。
高脂饮食中食物脂肪含量高,长期食用会使体内脂肪水平超出正常范围,当机体的能量摄入多于能量消耗时,肥胖就不可避免发生[5]。高脂肪饮食能够引起肠道组织氧化应急发生,改变肠道微生态[6],而肥胖又易造成心血管等一系列疾病,危害人体健康[7]。
目前国内对黄酒的功能作用研究比较深入,但对高脂肪饮食的动物研究相对较少。因此本研究通过对小鼠进行灌喂黄酒并饲喂高脂肪含量的饲料,研究黄酒对高脂饮食小鼠的肥胖指标及肠道菌群的影响。
1 材料与方法
1.1 材料与试剂
健康雄性C57BL/6J小鼠(无特定病原(specific pathogen free,SPF)级,体质量18~22 g):斯贝福(北京)生物技术有限公司。
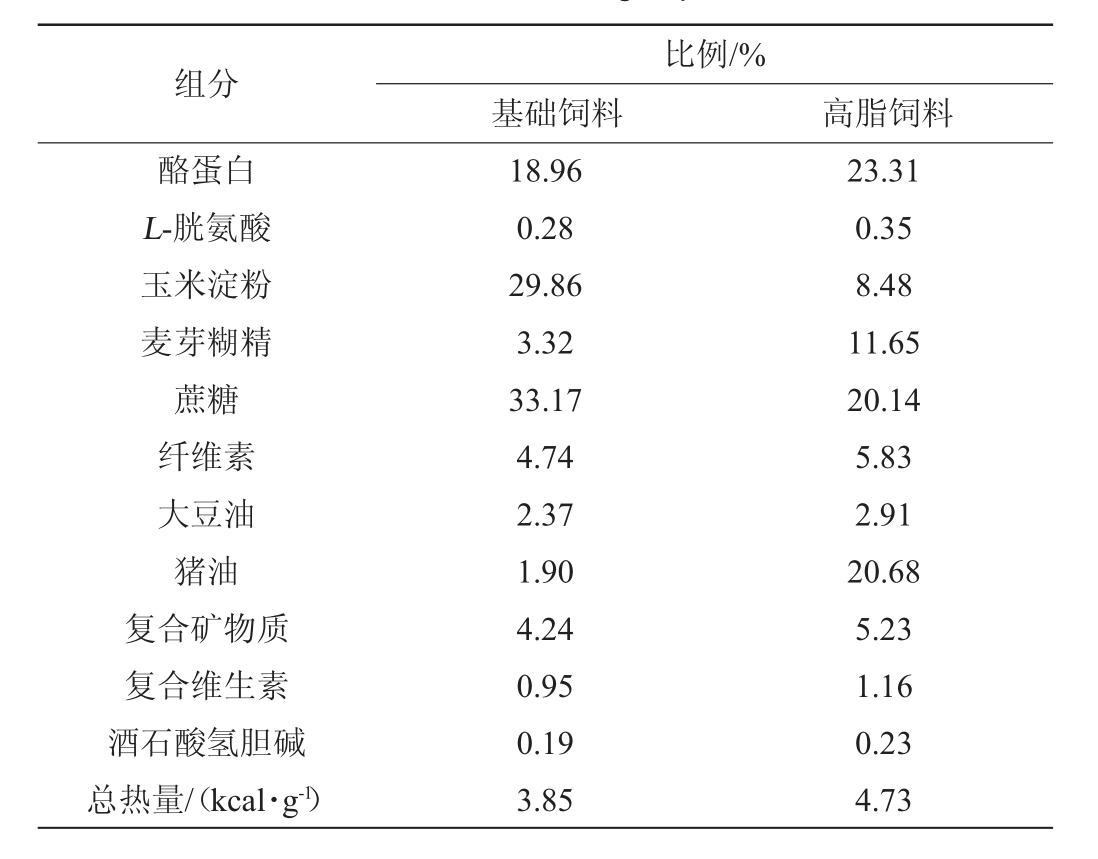
基础饲料和高脂饲料:北京科澳协力饲料有限公司,饲料配方见表1。动物饲养于中国疾病预防控制中心南纬路动物实验室,室温20~26 ℃,相对湿度40%~70%,12 h光照,12 h黑暗。绍兴黄酒(三年陈酿,原料:水、糯米、小麦,标示酒精度15%vol):市售。食用酒精(粮食酒精,普通级,酒精度95%vol):市售。粪便基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:德国QIAGEN QIAamp DNA Stool Mini Kit公司。
表1 两组饲料配方
Table 1 Formula of two groups of feed
1.2 仪器与设备
7600全自动生化分析仪:日本HITACHI公司;Illumina HiSe2500测序仪:美国Illumina公司;NANO DROP紫外分光光度计:美国Thermo公司;ME403E天平:瑞士梅特勒公司;AC2-4S1生物安全柜:新加坡ESCO公司;5427R高速冷冻离心机:德国EPPENDORF公司;RV10V-C旋转蒸发仪:德国IKA公司。
1.3 方法
1.3.1 动物实验
C57BL/6J小鼠共60只,适应性喂养3 d后按体质量随机分为5组,即空白对照组,饲喂基础饲料;高脂对照组、低剂量组、中剂量组和高剂量组,饲喂高脂饲料。每组12只,每6只一笼。以人体推荐量的5倍、10倍、30倍分别为低、中、高剂量组。按照《中国居民膳食指南》建议男性每日饮酒的酒精量≤25 g为参照,标准人体质量60 kg计算,人体每日饮酒量为100 mL,低剂量组=8.3 mL/kg体质量、中剂量组=16.6 mL/kg体质量、高剂量组=50 mL/kg体质量。将黄酒进行浓缩,用15%vol酒基按比例进行调配。高、中、低剂量组灌胃受试样品,空白对照组和高脂对照组给予蒸馏水,灌胃体积0.2 mL/10 g体质量,连续灌胃120 d。实验期间各组小鼠自由饮食饮水,每周称一次体质量并调整灌胃量,每周记录两次动物的给食量、剩食量及撒食量。实验结束时各组小鼠禁食12 h后称质量,摘眼球采血,离心收集血清待测;解剖取睾丸及肾周脂肪垫并称质量;无菌收集粪便-80 ℃冷冻保存待测。本研究动物实验已通过中国疾病预防控制中心营养与健康所伦理审查。
1.3.2 血清生化指标测定
小鼠血液经3 000 r/min离心15 min分离血清,测定血清中血糖(glucose,Glu)总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high desity lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low desity lipoprotein cholesterol,LDL-C)指标。
1.3.3 DNA提取和测序
参照QIAamp FAST DNA Stool Mini Kit说明书进行粪便细菌DNA提取,利用1%琼脂糖凝胶电泳检测DNA的纯度和浓度,使用通用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rDNA的V4区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。使用Agencourt AMPureXP 磁珠进行纯化并溶于Elution Buffer,完成文库构建,使用Agilent 2100 Bioanalyzer 检测文库的片断范围及浓度。应用Illumina HiSeq2500平台对PCR产物进行测序,测序类型为PE250。
1.3.4 生物信息学分析
下机数据滤除低质量的reads,获得clean data。序列拼接使用软件FLASH(fast length adjustment of short reads,v1.2.11),将双末端测序得到的reads拼接成Tags,利用软件USEARCH(v7.0.1090)将优化好的Tags在97%的相似度下聚类为操作分类单元(operational taxonomic units,OTU),通过RDP classifer(v2.2)软件将OTU代表序列与数据库比对进行物种注释,物种复杂度分析以及利用Mothur软件(version:1.31.2)对组间物种α-多样性进行分析。
1.3.5 统计学分析方法
采用Microsoft Excel 2010和SPSS 16.0进行数据的统计分析,结果用( )表示,组间差异比较应用成组t检验进行比较分析,P≥0.05无显著差异,0.01≤P<0.05为差异显著,P<0.01为差异极显著。
)表示,组间差异比较应用成组t检验进行比较分析,P≥0.05无显著差异,0.01≤P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
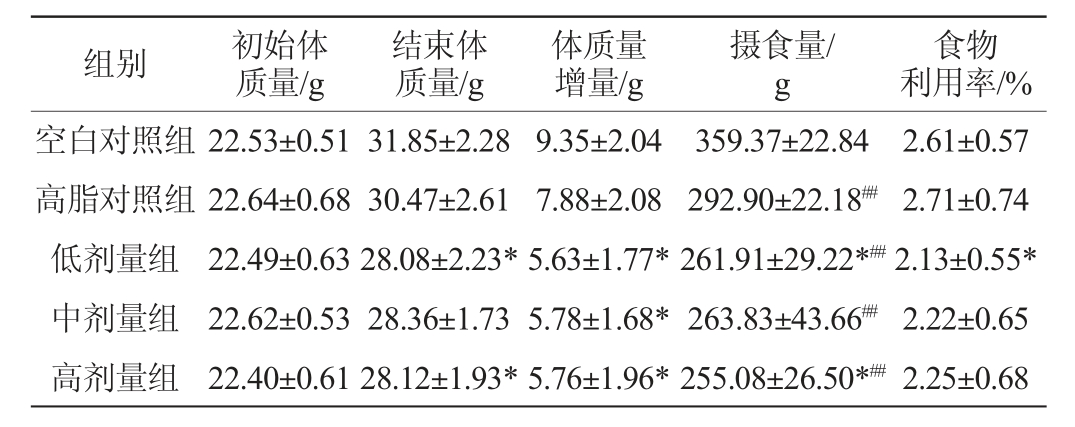
2.1 黄酒对小鼠体质量、摄食量和食物利用率的影响
由表2可知,与空白对照组相比,高脂对照组及各实验剂量组小鼠摄食量均明显减少,差异极显著(P<0.01),说明高脂饲料会抑制小鼠食欲,减少小鼠的摄食量;高脂对照组食物利用率有所提高,但差异不显著(P>0.05)。实验周期内,由于小鼠个体吸收代谢差异,高脂饮食组小鼠体质量与空白对照组相比并无显著差异(P>0.05),与相关报道不一致[8]。黄酒各剂量组小鼠食物利用率明显降低,体质量显著低于高脂对照组(P<0.05)。表明黄酒对小鼠食欲有一定调节作用,小鼠体质量增加受到抑制的现象是由于抑制了小鼠的食欲、减少食物的摄入而引起的,小鼠自身机体能量代谢达到平衡。
表2 各组小鼠体质量、摄食量和食物利用率的结果
Table 2 Results of body mass,food intake and food utilizing rate of mice in each group
注:“##”表示与空白对照组比较差异极显著(P<0.01);“*”表示与高脂对照组比较差异显著(P<0.05)。
2.2 黄酒对小鼠体内脂肪和肝脏指数的影响
体内脂肪质量和脂体比是反映动物肥胖程度的重要指标[9]。从表3实验结果看,与空白对照组比较,高脂饲喂的各组动物脂肪质量和脂体比均有明显增加,表明高脂饲料能促进脂肪在小鼠体内的堆积。与高脂对照组相比,黄酒各剂量组对小鼠体内脂肪的总质量减少表现出明显的效果,其总脂肪质量已接近于正常小鼠体内的脂肪质量,但差异不显著(P>0.05),表明黄酒对小鼠体内脂肪的累积有抑制的趋势。肝脏的质量和肝脏指数测定结果表明,高脂饲料并未促进小鼠肝脏的增大,结合表2可知,这与小鼠食物摄入量减少,机体能量达到相对平衡的状态,小鼠并未达到肥胖的状态有关。但黄酒各剂量组肝脏指数与高脂对照组相比有所升高,且中剂量组差异显著(P<0.05),说明长期饮酒能够导致肝脏的病变。
表3 各组小鼠脂肪质量、脂体比、肝脏质量和肝脏指数结果
Table 3 Results of fat weight,fat to body ratio,liver weight and coefficient of mice in each group

注:“*”表示与高脂对照组比较差异显著(P<0.05)。
2.3 黄酒对小鼠体内血清水平的影响
血脂指标与机体肥胖关系密切[10]。通过对小鼠血脂相关指标检测发现,高脂饲料能够引起小鼠TC、TG、HCL-C和LDL-C指标升高。与高脂对照组比较,黄酒未显著升高小鼠血清总胆固醇含量(P>0.05);高密度脂蛋白含量降低,低密度脂蛋白含量升高;黄酒低剂量组和高剂量组能够显著降低小鼠血清中甘油三酯含量(P<0.05),并且低于空白对照组。结果表明,适量饮用黄酒能改善高脂饮食小鼠血脂指标异常,这与黄酒组小鼠体质量增加缓慢,脂肪含量较低有关。但由于黄酒含糖量较高,能够引起小鼠血糖显著升高。
表4 各组小鼠血清指标结果
Table 4 Results of serum index of mice in each group mmol/L
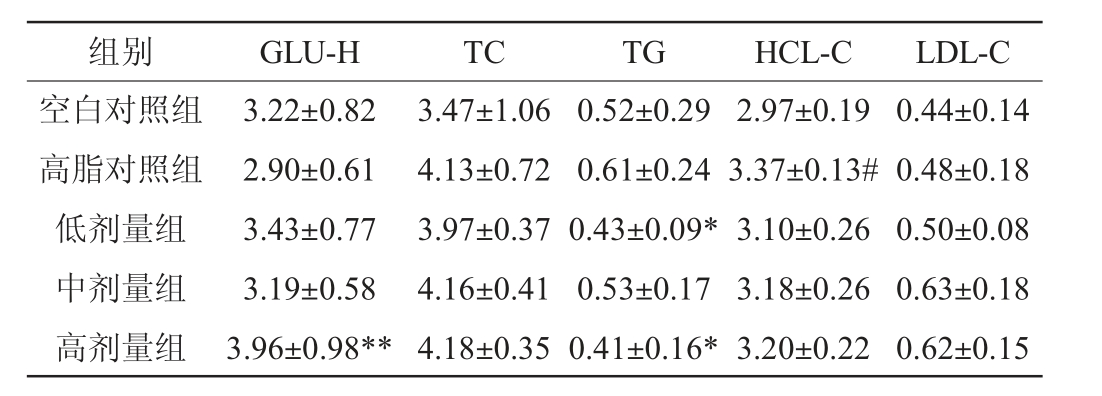
注:“#”表示与空白对照组比较差异显著(P<0.05);“*”表示与高脂对照组比较差异显著(P<0.05);“**”表示与高脂对照组比较差异极显著(P<0.01)。
2.4 黄酒对小鼠肠道菌群的影响
2.4.1 黄酒对小鼠肠道菌群多样性的影响
肠道菌群多样性是促进营养物质吸收、维持机体免疫和新陈代谢的基础,多样性降低极易对宿主免疫产生影响,进而影响健康[11]。Alpha多样性分析能反映特定区域或生态系统内的丰富度和均匀度,包括Observed-species指数、Chao指数、Ace指数、Shannon指数及Simpson指数,前面4个指数越大,最后一个指数越小,说明样品中的物种越丰富[12]。物种丰富度相同的情况下,群落中各物种均匀度越大,群落多样性越大[13]。由表5可知,与高脂对照组比较,黄酒各剂量组肠道菌群多样性有所提高,特别是中剂量组小鼠肠道菌群多样性显著提高,且逐渐接近空白对照组,由此推测黄酒能够改善因高脂饮食导致的肠道菌群多样性失衡,这可能与黄酒在发酵过程中产生大量菌群有关。结果表明,高脂饮食能降低肠道菌群的多样性。
表5 小鼠肠道菌群α-多样性统计分析
Table 5 Alpha diversity statistical analysis of gut microbiota in mice

注:“#”表示与空白对照组比较差异显著(P<0.05);“*”表示与模型对照组比较差异显著(P<0.05);“**”表示与高脂对照组比较差异极显著(P<0.01)。
2.4.2 黄酒对小鼠肠道菌群组成的影响
本研究使用偏最小二乘判别分析(partial least squaresdiscrimination analysis,PLS-DA)模型对各组小鼠肠道菌群组成差异进行分析。PLS-DA是一种用于判别分析的多变量统计分析方法,常用来判断研究对象如何分类。由图1A和图1B基于操作分类单元(OTU)的主坐标分析结果可知,基础饲料饲喂和高脂饲料饲喂的小鼠肠道菌群的数据点表现出各自聚集的情况,黄酒各剂量组与高脂模型组小鼠肠道菌群的数据点同样表现出各自聚集的情况。说明饮食干预影响了小鼠肠道菌群的组成,这可能与营养物质的吸收以及能量代谢水平差异有关。

图1 不同饮食组(a)、高脂饮食组(b)小鼠肠道菌群偏最小二乘判别分析
Fig.1 Principal coordinate analysis of gut microbiota in mice with different diet (a) and high-fat diet (b)
2.4.3 黄酒对小鼠肠道菌群门水平的影响
在门分类水平上,对小鼠肠道菌群组成的分析发现,各组小鼠优势菌由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和蓝藻菌门(Cyanobacteria)组成。如图3所示,与空白对照组相比,高脂饮食组小鼠拟杆菌门、厚壁菌门含量分别降低8%和14%,变形菌门和蓝藻菌门含量分别升高30%和20%,脱铁杆菌门(Deferribacteres)含量升高2倍,疣微菌门(Verrucomicrobia)含量高出近11倍。
厚壁菌门和拟杆菌门是肠道菌群中影响能量代谢平衡的两个主要群落,研究表明,厚壁菌门和拟杆菌门的含量和比例与宿主的身体质量指数(body mass index,BMI)有关[14-16]。本研究中,由于高脂饮食组动物日均摄食量显著降低,导致实验结束后动物体质量有所降低,高脂饮食组动物肠道菌群厚壁菌门和拟杆菌门的比例为28%,低于空白对照组的33%,与文献报道研究结果一致。
与高脂对照组比较,黄酒高剂量组厚壁菌门和拟杆菌门相对含量分别降低12%和11%,二者比例降低7%,疣微菌门和脱铁杆菌门含量显著上升,而黄酒中剂量组各优势菌群含量接近空白对照组,表明黄酒能够改善高脂饮食引起的肠道菌群门水平丰度。
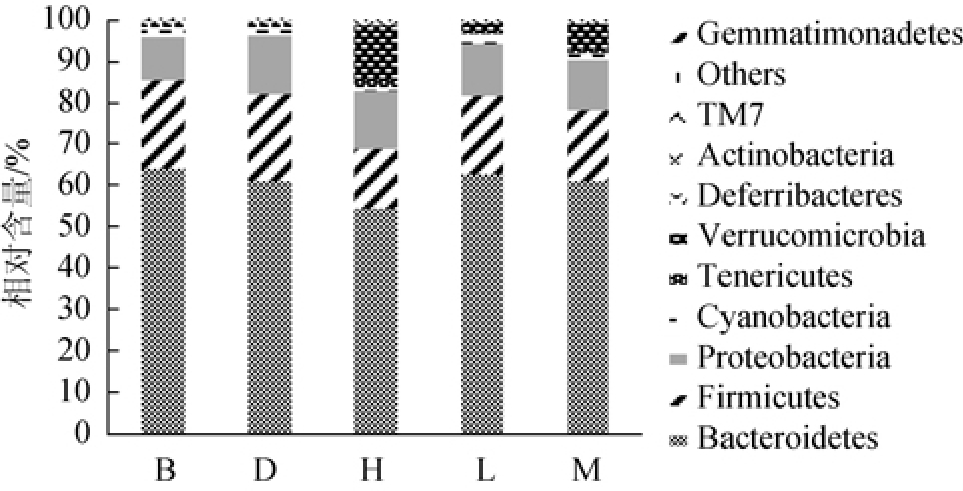
图2 各组小鼠肠道菌群在门水平上的注释结果
Fig.2 Annotation results of gut microbiota in each group of mice at phylum level
2.4.4 黄酒对小鼠肠道菌群种水平的影响
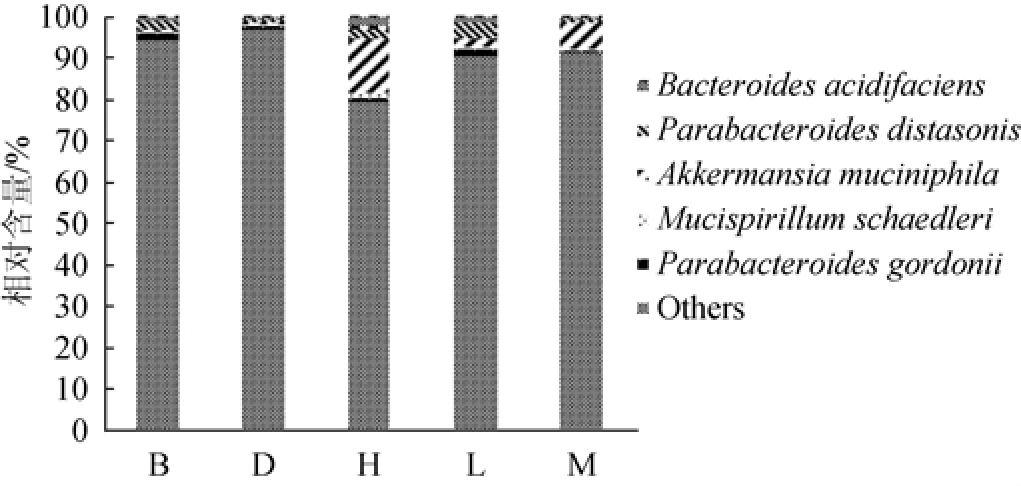
图3 各组小鼠肠道菌群在种水平上的注释结果
Fig.3 Annotation results of gut microbiota in each group of mice at species level
由图3可知,在种分类水平上各组小鼠肠道菌群能够注释到的物种主要包括Parabacteroides gordonii、Mucispirillum schaedleri、Akkermansia muciniphila、火氏副拟杆菌(Parabacteroides distasonis)、生酸拟杆菌(Bacteroides acidifaciens)等菌种。与空白对照组比较,高脂对照组Parabacteroides distasonis相对含量降低53%,而黄酒组该菌含量较高脂组平均升高126%,结合表2和表4结果推测,黄酒能够通过调节肠道菌群种水平丰度抑制因高脂饮食引起的脂肪含量堆积,进而改善血脂异常。有研究表明,Parabacteroides distasonis是人体核心菌群之一,其含量与肥胖、非酒精性脂肪肝、糖尿病等疾病状态呈显著负相关[17-19],WANG K等[20]研究发现,该菌可以显著改善高脂饮食诱导肥胖模型小鼠的肥胖、胰岛素抵抗、脂代谢紊乱。Parabacteroides distasonis通过产生琥珀酸、次级胆酸激活不同信号通路,发挥多靶点整体调节作用,是一种潜在、新型抗代谢综合症益生菌。
3 结论
黄酒能够通过抑制小鼠的食欲减少小鼠的摄食量,进而降低因高脂饮食引起的脂肪含量堆积,减缓体质量的增长。适量饮用黄酒能够改善因高脂饮食引起的相关血脂指标异常,但长期饮酒,可能会引起血糖升高和肝脏病变。黄酒能够改善高脂饮食小鼠肠道菌群的多样性,在种水平丰度上,黄酒能提高因高脂饮食导致的Parabacteroides distasonis含量降低,对高脂饮食小鼠肠道菌群结构有促进作用。
[1]沈振昌.黄酒·国粹·中国魂[J].中国酒,2011(11):48-49.
[2]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 13662—2008 黄酒[S].北京:中国标准出版社,2009.
[3]傅祖康,杨国军.黄酒生产200 问[M].北京:化学工业出版社,2010:31-40.
[4]刘月,祁国栋,张炳文.黄酒功能成分的研究进展[J].中国酿造,2015,34(11):27-30.
[5]彭买娇,惠华英,肖嫩群,等.芦笋对高脂饮食小鼠肠道内容物细菌多样性的影响[J].核农学报,2019,33(11):2229-2236.
[6]杨凤啸,卢敏惠.高脂饮食诱发小鼠肥胖及其对肠道菌群结构影响的研究[J].现代医院,2017,17(6):863-866.
[7]王勤,杨亦彬.肠道菌群失调对糖尿病及糖尿病肾病影响的研究进展[J].医学综述,2019,25(3):530-534.
[8]田滋润,王烨,韩雪,等.高脂诱导下胰岛素抵抗和非胰岛素抵抗小鼠糖脂代谢及肠道AKK 菌的变化[J].新疆医科大学学报,2019,42(8):984-987.
[9]GODWIN M.Obesity:Epidemiology,pathophysiology,and prevention[J].JAMA,2008,299(17):2092-2093.
[10]熊昌云.普洱茶降脂减肥功效及作用机理研究[D].杭州:浙江大学,2012.
[11]HILDEBRAND F,NGUYEN T L A,BRINKMAN B,et al.Inflammation-associated enterotypes,host geno-type,cage and inter-individual effects drive gut micro-biota variation in common laboratory mice[J].Genome Biol,2013,14:R4.
[12]SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mother:Open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
[13]高洁,孙静,黄建,等.开菲尔对高脂金黄地鼠肠道菌群的调节作用研究[J].中国酿造,2017,36(4):15-19.
[14]LEY R E,BACKHED F,TURNBAUGH P,et al.Obesity alters gut microbial ecology[J].P Natl Acad Sci USA,2005,102(31):11070-11075.
[15]TURNBAUGH P J,LEY R E,MAHOWALD M A,et al.The gut microbiome as a biomarker and therapeutic target for treating obesity or an obesity related disorder:US,EP2102350[P].2009-09-23.
[16]SERINO M,LUCHE E,GRES S,et al.Metabolic adaptation to a high-fat diet is associated with a change in the gut microbiota[J].Gut,2012,61(4):543-553.
[17]CEKANAVICJTE E,YOO B B,RUNIA T F,et al.Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models[J].P Natl Acad Sci USA,2017,114(40):10713-10718.
[18]DEL CHIERICO F,NOBILI V,VERNOCCHI P,et al.Gut microbiota profiling of pediatric nonalcoholic fatty liver disease and obese patients unveiled by an integrated meta-omics-based approach[J]. Hepatology,2017,65(2):451-464.
[19]VERDAM F J,FUENTES S,DE JONGE G,et al.Human intestinal microbiota composition is associated with local and systemic inflammation in obesity[J].Obesity,2013,21:E607-E615.
[20]WANG K,LIAO M F,LIU H W,et al.Parabacteroides distasonis alleviates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J].Cell Rep,2019,26(1):222-235.