酸浆豆腐是我国特色的传统食品,其制作的独特之处在于用酸浆代替传统的盐卤和石膏作为凝固剂。酸浆豆腐一直依靠工人多年经验进行生产的小作坊制作方式,先将酸浆老汤加入黄浆水,其中的乳酸菌在常温下将黄浆水自然发酵为酸浆[1],再使用酸浆作为酸性凝固剂,通过点浆使豆浆凝固制成酸浆豆腐。酸浆豆腐口感细腻,风味独特[1],在我国山东等地已经作为特色食品被列入“非物质文化遗产”。然而手工作坊式的生产方式具有酸浆质量无法保障,生产效率低,货架期不稳定等缺点[2]。为了实现酸浆豆腐的工业化生产,促进我国传统食品的“食文化”广泛传播,对酸浆中的乳酸菌进行分离筛选,发掘产酸能力强的菌株并探究其性质,为今后酸浆豆腐的工业化生产打下基础。
部分学者对豆腐酸浆中的微生物开展了初步探索,乔支红等[3]利用从豆腐酸浆老汤中筛选到的5株产酸菌发酵大豆黄浆水,以酸浆的pH值为考察指标,探讨了单菌发酵、双菌发酵、发酵温度、菌种接种量及菌种的混合比例对酸浆pH值的影响,结果表明,酸浆纯种发酵的最佳工艺参数为双菌混合发酵,混合比例1∶9(1号菌∶3号菌),接种量5%,发酵时间24 h,发酵温度42 ℃;贺云等[4]从云南牟定地区的10份自然发酵酸浆豆腐中分离筛选得到6种乳酸菌,并分别鉴定为类布氏乳杆菌(Lactobacillus parabuchneri)、发酵乳杆菌(Lactobacillus fermentum)、副干酪乳杆菌(Lactobacillus paracasei)、植物乳杆菌(Lactobacillus plantarum)、德式乳杆菌(Lactobacillus delbrueckii)和粘膜乳杆菌(Lactobacillus mucosa),其中植物乳杆菌产酸能力最强;刘倩等[5]从豆清发酵液中分离纯化出3株产酸菌,经生理生化和16S rRNA基因序列分析鉴定该菌株为产酸解淀粉乳杆菌(Lactobacillus amylolyticus)。但现有研究局限于单一产地,缺乏对全国酸浆菌种差异的整体研究。
本研究从云南建水、陕西榆林、山东邹平、河北涞源、云南石屏以及北京延庆6个国内具有代表性的酸浆豆腐产地中的7种豆腐酸浆老汤中筛选分离各样品中的高产酸乳酸菌,通过形态观察及分子生物学技术进行鉴定,并对其产酸能力、耐酸性、耐盐性等生长特性进行研究,旨在对全国主要酸浆豆腐产地中的产酸菌构成及特性进行探究,为酸浆中优质乳酸菌生物资源的筛选以及后续酸浆生产工业化奠定基础、提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
豆腐酸浆老汤:云南建水、陕西榆林、山东邹平、河北涞源、云南石屏以及北京延庆的酸浆豆腐加工作坊。
1.1.2 培养基
黄浆水培养基:为豆腐压滤成型后的黄色沥水,取自北京延庆豆腐厂。
MRS肉汤培养基、MRS固体培养基:北京奥博星生物技术有限责任公司。
以上培养基在121 ℃条件下高压蒸汽灭菌20 min。
1.1.3 化学试剂
葡萄糖、无水碳酸钙、邻苯二甲酸氢钾、氢氧化钠(均为分析纯):国药集团化学试剂有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)(色谱纯):北京博奥拓达公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、回收试剂盒、DL3000 DNA Marker、TransTaq-T DNA Polymerase(250 U)、10×TransTaq-T Buffer、2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)、6×DNA Loading Buffer:美国TransTaq公司。
1.2 仪器与设备
YP20001电子天平:上海雷韵实验仪器制造有限公司;PHS-3CpH计:上海精密科学仪器有限公司;DL-CJ-2ND型超净工作台:北京东联哈尔仪器制造有限公司;YQX-SG46-280S自动高压灭菌锅:上海博迅实业有限公司医疗设备厂;TENSUC恒温培养箱:上海天呈实验仪器制造有限公司;TU-1900紫外可见分光光度计:北京普析通用仪器有限责任公司;TGL-16aR高速冷冻离心机:上海安亭科学仪器厂;1260series高效液相色谱仪(high performance liquid chromatography,HPLC):美国Agilent科技有限公司;T1000聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司。
1.3 实验方法
1.3.1 酸浆增殖培养
酸浆的活化与增殖培养采用乔支红等[6]的方法。取5 mL酸浆接种于20 mL黄浆水培养基中,在37 ℃恒温培养箱中静置培养48 h。
1.3.2 产酸菌株的分离纯化
将增殖培养的酸浆经无菌生理盐水梯度稀释至10-4、10-5、10-6三个梯度,取100 μL梯度稀释液于空白培养皿中,倒入融化并冷却至45 ℃左右的含有2%CaCO3的MRS肉汤培养基[7],于37 ℃恒温培养箱中倒置培养48 h。挑取产生溶钙圈的菌落于MRS固体培养基反复划线分离直至出现单菌落,镜检后选取符合乳酸菌形态、无杂菌的菌落接种于MRS斜面培养基于4 ℃保存。
1.3.3 高产酸菌株的筛选
将每个样品中分离纯化得到的乳酸菌活化后接种于MRS肉汤培养基中,37 ℃恒温静置培养24 h,测定培养基pH值,选取每个样品中pH值最低的菌株为该样品中高产酸菌株。
1.3.4 菌株的分子生物学鉴定
采用细菌基因组DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板对菌株的16S rDNA进行PCR扩增。PCR扩增引物为16S rDNA通用引物1492R、27F[8];PCR扩增体系:10×buffer 5 μL,10×TransTaq-T 0.5 μL,引物27F 1 μL,引物1492R 1 μL,DNA模板1 μL,dNTPs 4 μL。PCR扩增程序:预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,29个循环;72 ℃再延伸10 min,4 ℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测,确认PCR扩增片段。将PCR扩增产物用回收试剂盒回收,使用测序仪对PCR扩增产物进行测序。
将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Genbank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,选取同源性较高的模式菌株的16S rDNA序列,采用MEGA-X 10.1软件中的邻接(neighbor joining,NJ)法构建系统发育树[9]。
1.3.5 产酸量测定
将活化后的菌种按2%(V/V)的接种量接种于MRS肉汤培养基中,37 ℃恒温静置培养。取样时间间隔为前12 h每隔2 h取样测定;12 h后每隔4 h取样测定;24 h后每隔12 h取样测定。发酵液经蒸馏水稀释10倍后,滴加5滴酚酞溶液,用0.1 mol/L氢氧化钠溶液滴定至粉红色出现,且30 s后不褪色即为滴定终点,记录NaOH消耗体积,三组平行[10]。以灭菌后的MRS肉汤培养基作为空白对照,计算产酸量,其计算公式如下:
X为样品产酸量(以乳酸计),g/100 mL;V1为样品消耗氢氧化钠溶液体积,mL;V2为空白培养基消耗氢氧化钠溶液体积,mL;CNaOH为标定的氢氧化钠浓度,g/L;0.09为乳酸的换算系数。
1.3.6 有机酸组成分析
将活化后的菌种接种于MRS肉汤培养基中,37 ℃恒温静置培养12 h。采用高效液相色谱(HPLC)进行有机酸组成分析[11]。液相色谱条件:色谱柱为Carbomix H-NP10:8%(10 μm,7.8×300 mm);流动相为20 mmol/L NaH2PO4;进样体积为10 μL;流速为1.0 mL/min;柱温为30 ℃;检测波长为210 nm。
1.3.7 耐酸性测定
以自然pH值的MRS肉汤培养基(pH 6.83)作为空白对照,将预先活化好的菌株按2%(V/V)的接种量分别接种于pH值为1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0的培养基中,37 ℃静置培养48 h,采用分光光度计在波长600 nm处测定其OD600nm值。
1.3.8 耐盐性测定
将预先活化好的菌株按2%(V/V)的接种量接种于盐浓度分别为0、1%、2%、3%、4%、5%的MRS肉汤培养基中,37 ℃静置培养48 h,测定其OD600nm值。
1.3.9 数据处理
利用Excel与SPSS18.0软件对数据进行分析处理,使用MEGA-X 10.1软件构建系统发育树。
2 结果与分析
2.1 样品采集情况
于云南建水、陕西榆林、山东邹平、河北涞源、云南石屏以及北京延庆等地的7个酸浆豆腐厂采集样品,涵盖我国主要酸浆豆腐产地。豆腐酸浆老汤样品采集情况见表1。
表1 豆腐酸浆老汤样品采集信息
Table 1 Collection information of fermented soy-whey samples
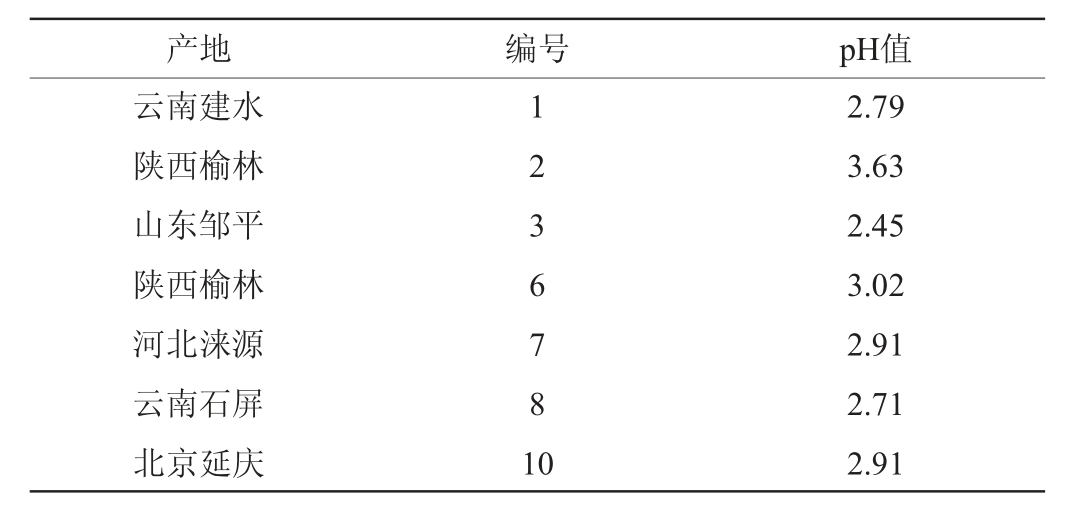
由表1可知,我国不同地区的豆腐酸浆老汤的pH值存在一定差异,其中取自陕西榆林的2号样品pH值最高,为3.63;取自山东邹平的3号样品pH值最低,为2.45。其余样品pH值均在2.71~3.02之间,呈酸性。结果表明,采集的豆腐酸浆老汤样品pH值范围与赵贵丽等[12]采用黄浆水发酵制成的酸浆老汤pH值基本一致。
2.2 高产酸菌株的分离筛选
通过含2%CaCO3MRS培养基从7种豆腐酸浆老汤样品中共分离筛选出31株溶钙圈较明显的产酸菌,通过菌落形态、显微镜镜检最终筛选出16株菌落形态差异较大的菌株。经过发酵产酸能力测定后,每种样品中选取发酵液pH最低的菌株视为该样品中的高产酸菌株,共7株,分别编号为L1-02、L2-03、L3-01、L6-07、L7-01、L8-03、L10-01。
2.3 高产酸菌株的鉴定
2.3.1 形态观察
7株高产酸菌株中,部分菌株在CaCO3-MRS培养基上的菌落形态及细胞形态分别见图1、图2。

图1 部分高产酸菌株的菌落形态
Fig.1 Colony morphology of some high yield acid-producing strains
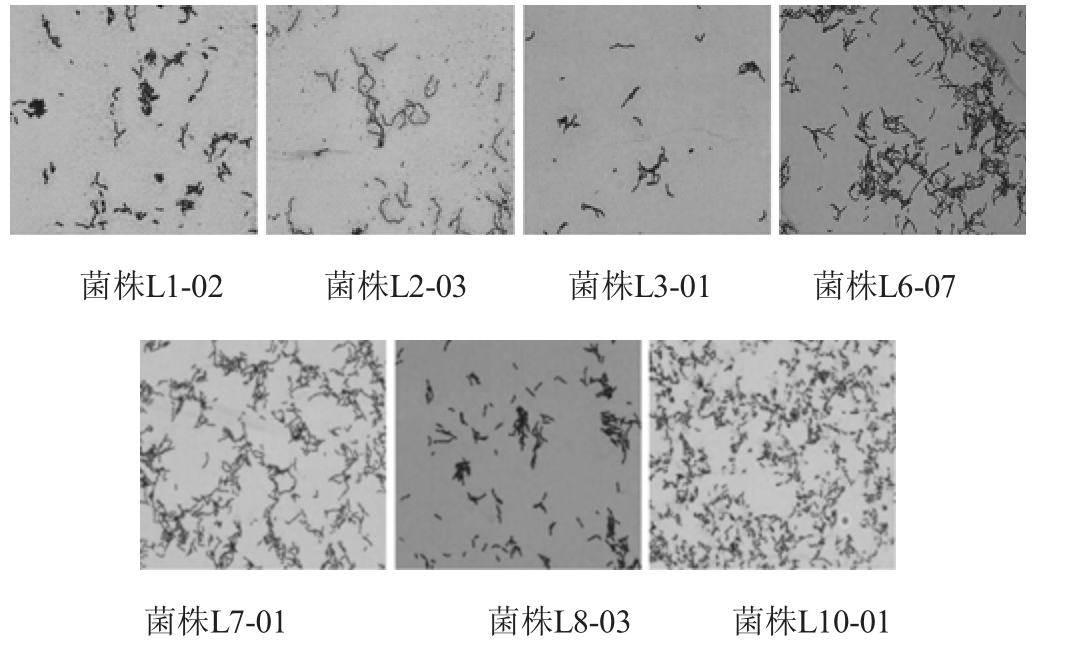
图2 7株高产酸菌株的细胞形态
Fig.2 Cell morphology of 7 high yield acid-producing strains
由图1可知,菌落均为乳白色,边缘较为整齐,单个菌落半径较小,呈圆形,半透明状态。由图2可知,经过革兰氏染色后,均为紫色革兰氏阳性菌,菌体呈杆状与短棒状,符合乳酸菌菌落形态与菌体特征[13]。
2.3.2 分子生物学鉴定
将7株高产酸菌株的DNA序列提交至NCBI的GenBank数据库中进行BLAST比对,并使用MEGA-X 10.1软件构建系统发育树,结果见图3。

图3 基于16S rDNA序列7株菌株的系统发育树
Fig.3 Phylogenetic tree of 7 strains based on 16S rDNA sequences
由图3可知,菌株L2-03、L3-01、L6-07、L7-01与玉米乳杆菌(Lactobacillus zeae)聚于一支,菌株L1-02、L8-03、L10-01与副干酪乳杆菌(Lactobacillus paracasei)聚于一支,亲缘关系最近。因此,综合形态学鉴定结果[14],将菌株L2-03、L3-01、L6-07、L7-01鉴定为玉米乳杆菌(Lactobacillus zeae),菌株L1-02、L8-03、L10-01鉴定为副干酪乳杆菌(Lactobacillus paracasei)[15]。
2.4 产酸能力分析
7株高产酸乳酸菌发酵过程中总酸产量及pH值的变化结果见图4。
由图4a可知,菌株L2-03、L3-01、L6-07、L7-01的产酸量在0~20 h内增速基本维持不变,增幅明显;菌株L1-02、L8-03、L10-01产酸量在14 h后增速逐渐放缓,曲线逐渐平稳。最终在生长36 h后产酸曲线基本到达终点。其中,菌株L6-07产酸速度最快,产酸量最高,达25.69 g/L,产酸性能明显高于其他菌株;菌株L3-01产酸量次之,达25.01g/L;菌株L1-02、L8-03产酸量较低,分别为17.51 g/L、17.15 g/L,产酸速率也较慢。其他研究者也从豆腐酸浆老汤中筛选出高产酸菌,如叶青等[16]从豆腐酸浆中筛选出高产酸的干酪乳杆菌(Lactobacillus casei),发酵48 h时,产酸量为27 g/L;王国良[17]分离出的高产酸菌发酵48 h后产酸量为24.9 g/L。本研究从陕西榆林豆腐酸浆老汤中筛选出的菌株L6-07发酵48 h后产酸量为25.69 g/L,相较于其他研究者所筛选出的产酸菌产酸量处于较高水平。

图4 发酵过程中7株高产酸乳酸菌的总酸产量(a)及pH值(b)变化
Fig.4 Changes of total acid production (a) and pH (b) of 7 high yield acid-producing lactic acid bacteria during fermentation
由图4b可知,在0~20 h内,7株菌的pH值下降明显;菌株L6-07的pH值下降最快,降至3.26,说明产酸能力最强;菌株L1-02的pH值下降最慢,降至4.01,说明产酸能力最弱;与图4a结论相符。发酵液pH值在24 h后基本维持不变,说明乳酸菌在24 h后基本不再生长。
2.5 有机酸组成分析
因乳酸菌发酵24 h后产酸量基本不再增加,故采用HPLC法测定24 h后发酵液中有机酸的组成及含量,结果见表2。
表2 7株高产酸乳酸菌发酵液中有机酸分析
Table 2 Analysis of organic acids in fermentation broth of 7 high yield acid-producing lactic acid bacteria g/L
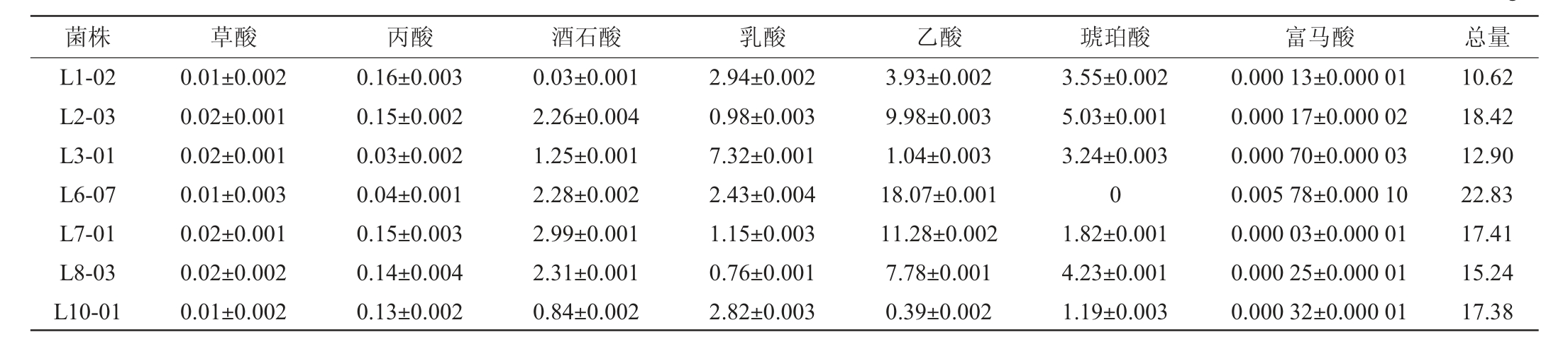
由表2可知,从7株高产酸乳酸菌的发酵液中共检测出7种有机酸,分别为丙酮酸、乳酸、乙酸、富马酸、琥珀酸、草酸、酒石酸,与胡欣欣[18]采用HPLC法测定黄浆水酸化过程中有机酸种类的结果基本一致。其中,乳酸与乙酸为菌株发酵产生的主要有机酸。7株菌株中,菌株L6-07的有机酸总量及乙酸生成量最高,分别为22.84 g/L、18.07 g/L;菌株L3-01的乳酸生成量最高,达7.32 g/L;除菌株L6-07发酵无法生成琥珀酸外,其余菌株在发酵过程中均能生成7种有机酸。
2.6 耐酸性能测定
因乳酸菌具有可以提高豆浆在人消化道生物可接受性等益生特性[19],所以乳酸菌能否适应胃肠道中的酸性环境十分重要。对7株高产酸乳酸菌的耐酸性进行测定,结果见图5。
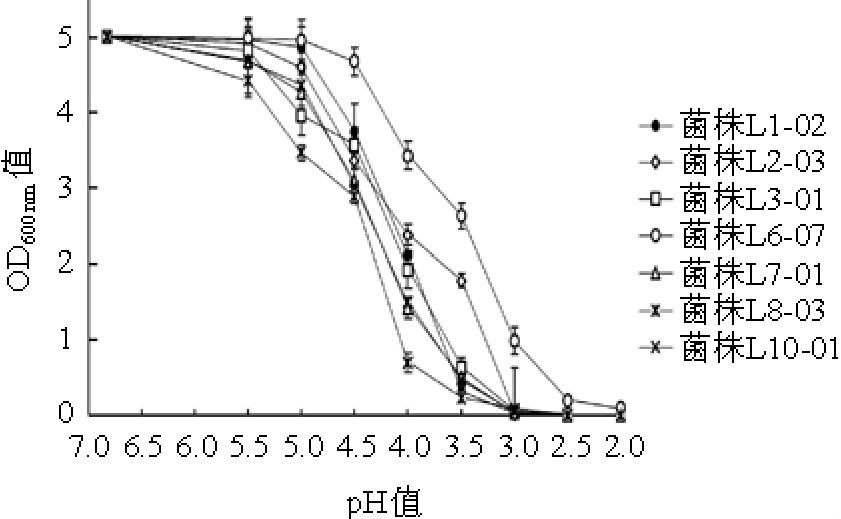
图5 7株高产酸乳酸菌的耐酸性
Fig.5 Acid tolerance of 7 high yield acid-producing lactic acid bacteria
由图5可知,随着培养基酸性增强,7株乳酸菌的生长均受到抑制。在pH值<2.5的酸性条件下,7株乳酸菌菌体浓度均接近于0,几乎停止生长。其中,菌株L6-07在pH 6.93(自然pH值)~4.5范围内OD600nm值下降比较缓慢,说明该菌株在pH值>4.5的酸性条件下可以良好生长;并且在相同酸性条件下菌体浓度始终高于其他6株乳酸菌,耐酸性最强。菌株L1-02、L2-03、L3-01、L7-01、L8-03、L10-01在pH值<5.5时菌体浓度大幅下降。当pH值为2.5时,除了菌株L6-07之外,其他菌株的OD600nm值均为0,说明绝大部分乳酸菌不能够在pH值为2.0与2.5的酸性条件下生长。培养基pH为4.0时,7株菌生长情况差异最为明显,能够体现7株菌的耐酸能力。经过统计学分析,培养基pH为4.0时菌株OD600nm值与菌株来源样品pH值间的Pearson相关系数R2为0.481,呈中等程度相关,说明从酸性强的酸浆样品中筛选出的乳酸菌耐酸能力相对更强。
2.7 耐盐性能测定
在酸浆的工业化生产过程中,发酵液离子强度可能会发生变化,并且工业化生产通常通过提升体系NaCl含量达到抑制杂菌生长的作用[20],所以乳酸菌具有一定程度的耐盐性是十分必要的。故对筛选出的7株高产酸菌株进行耐盐性测定,结果见图6。
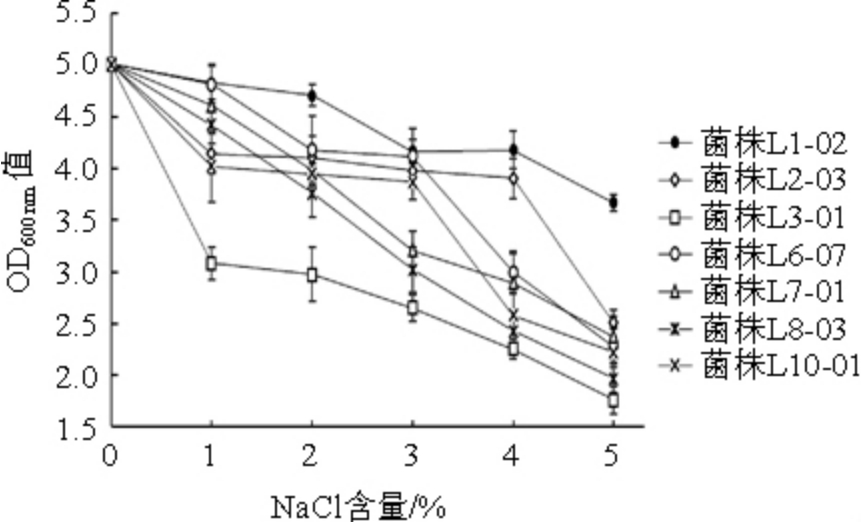
图6 7株高产酸乳酸菌的盐耐受性
Fig.6 Salt tolerance of 7 high yield acid-producing lactic acid bacteria
由图6可知,随着NaCl含量的升高,7株乳酸菌菌体浓度均呈下降趋势,说明渗透压会影响乳酸菌细胞内水分及正常生理活动[21]。当NaCl含量升高时,菌株L1-02菌体浓度下降最慢,并且在相同盐浓度条件下,菌体浓度始终高于其他6株菌,说明环境渗透压的提高对于该菌株的影响最小,甚至在NaCl含量为5%条件下该菌株的OD600nm值仍能维持在3.67,耐盐性最强;菌株L3-01菌体浓度下降最快,受NaCl含量提升影响最为明显,且在NaCl含量0~1%范围内该菌株菌体浓度下降显著,在NaCl含量为5%时,OD600nm值仅为1.76,几乎无法生长,耐盐性最差。综上所述,在相同渗透压条件下,菌株L1-02比其余6株乳酸菌表现出更强的盐耐受性,菌株L6-07次之,菌株L3-01耐盐性最差。
3 结论
本实验从采集于全国6大主要酸浆豆腐产地的7种豆腐酸浆老汤中共分离筛选得到7株高产酸乳酸菌,经形态观察及分子生物学技术鉴定菌株L2-03、L3-01、L6-07与L7-01为玉米乳杆菌(Lactobacillus zeae),菌株L1-02、L8-03与L10-01为干酪乳杆菌(Lactobacillus casei)。除菌株L6-07外,6株高产酸乳酸菌均能产草酸、酒石酸、丙酮酸、乳酸、乙酸、富马酸及琥珀酸共7种有机酸,乙酸与乳酸为主要有机酸。其中,菌株L3-01乳酸含量最高,达7.32 g/L,菌株L6-07乙酸含量最高,为18.07 g/L。产酸能力方面,菌株L6-07发酵液pH下降速率最快,产酸量最高,达25.69 g/L,产酸能力最强;耐酸性方面,L6-07在pH 2.5的酸性条件下仍能保持生长,耐酸性最强;耐盐性方面,菌株L1-02在5%NaCl条件下表现出较强的耐受性,耐盐性最强,菌株L6-07次之。本研究结果在菌株特性方面为酸浆豆腐的工业化生产提供了重要的基础数据及优质菌种资源。
[1]田亚,李丹,胡萍,等.不同凝固剂形成豆腐凝胶特性研究[J].大豆科学,2018,37(4):606-613.
[2]FILIPPIS F D,PARENTE E,D ERCOLINI.Metagenomics insights into food fermentations[J].Microb Biotechnol,2017,10(1):91-102.
[3]乔支红,闫佳,陈虹,等.酸浆标准化生产工艺的研究[J].食品工业科技,2015,36(12):162-164,169.
[4]贺云.豆腐酸浆中乳酸菌的分离鉴定及其在酸浆豆腐中的应用[D].无锡:江南大学,2018.
[5]刘倩,尹乐斌,赵良忠.高产酸乳酸菌的分离鉴定及生物学特性研究[J].山东化工,2015,44(22):57-60.
[6]乔支红,李艳芳,许荣华,等.豆腐酸浆老汤中产酸菌的分离筛选与鉴定[J].食品工业科技,2015,36(3):182-185,189.
[7]刘琳琳,王嘉琪,曾剑华,等.云南建水豆腐酸浆中乳酸菌的分离与鉴定[J/OL].中国食品学报,http://kns.cnki.net/kcms/detail/11.4528.TS.20191022.1013.010.html.
[8]佟梓沂,孙秀宇,王冰,等.自然发酵酸浆中一株高产酸菌的分离与鉴定[J].食品工业科技,2019,40(9):105-108,114.
[9]PARK E,CHUN J,CHA C,et al.Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing[J].Food Microbiol,2012,30(1):197-204.
[10]王嘉琪,吕铭守,凃婧,等.云南建水酸浆豆腐中乳酸菌生长特性研究[J].食品工业科技,2018,39(8):90-94.
[11]胡欣欣,蒋立文,刘嘉,等.黄浆水酸化过程中有机酸的变化研究[J].农产品加工,2011(3):74-75,77
[12]赵贵丽,罗爱平,廖娅凡,等.酸浆最适自然发酵条件优化[J].食品科学,2013,34(17):201-204.
[13]乌素,杨晓艳,班瑞,等.三株乳酸菌形态特征的研究[J].农产品加工,2019(12):19-21.
[14]DOBSON C M,CHABAN B,DENEER H,et al. Lactobacillus casei,Lactobacillus rhamnosus,and Lactobacillus zeae isolates identified by sequence signature and immunoblot phenotype[J]. Can J Microbiol,2004,50(7):482-488.
[15]印伯星.副干酪乳杆菌的分离鉴定及肠道耐受性研究[J].中国乳品工业,2019,47(5):4-7.
[16]叶青,许云贺,张莉力.豆腐酸浆中干酪乳杆菌的分离、鉴定及作为豆腐凝固剂的应用[J].食品工业科技,2017,38(18):94-98,104.
[17]王国良.酸浆野生菌发酵黄浆水生产天然凝固剂的研究[D].济南:山东轻工业学院,2005.
[18]胡欣欣.豆腐酸浆中产酸菌的分离及应用研究[D].长沙:湖南农业大学,2011.
[19]RUI X,XING G L,ZHANG Q Q,et al.Protein bioaccessibility of soymilk and soymilk curd prepared with two Lactobacillus plantarum strains as assessed by in vitro gastrointestinal digestion[J]. Innovat Food Sci Emer Technol,2016,38:155-159.
[20]赵山山,杨晓艳,杜秋玲,等.江西酸芋荷中乳酸菌的分离鉴定及在泡菜发酵中的应用[J].中国酿造,2018,37(10):36-42.
[21]ZHU Q M,WU F F,MASAYOSHI S,et al.Effect of magnesium salt concentration in water-in-oil emulsions on the physical properties and microstructure of tofu[J].Food Chem,2016,201:197-204.