玫瑰花茶(rose tea)是玫瑰花(Rosa rugosa)采摘后,经适当折瓣、摊放,去除花蒂、花蕊及其他杂质,以净花瓣和茶叶窨而制成[1]。玫瑰花含有氨基酸、黄酮类、多酚类及色素类等多种生物活性成分[2],同时富含香茅醇、香叶醇及苄醇等多种挥发性香气成分[3],因此,玫瑰花茶具有通经络、活血补血、护肤美容、助消化、抗氧化等作用[4],又因其香气甜美,成为最受欢迎的花草茶之一。原花青素(procyanidins)是一类由不同数量的单体黄烷-3-醇缩合而成的聚多酚类物质,单体含有典型的C6-C3-C6黄酮结构,也属于黄酮类化合物[5-6],其代谢产物为儿茶素和表儿茶素,具有清除自由基的功能和较强的抗氧化作用[7],是一类多酚天然抗氧化剂[8],玫瑰花中含有丰富的原花青素。
目前,原花青素的检测方法主要有薄层层析(thin layer chromatography,TLC)法、高效液相色谱(high performance liquid chromatography,HPLC)法、高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)法及核磁共振法等[9-13],虽然这些方法对原花青素的分离效果好,检测结果准确性高,但在生产中成本投入大,操作不方便。紫外分光光度法因其简单易行、快速准确,已应用于蓝莓[14]、蓝靛果[15]等产品中原花青素含量的检测,而应用于玫瑰花茶尚未见报道。此外,均匀试验设计与正交试验设计联用的方法在产品加工工艺优化试验中已有广泛应用[16-17],但应用于检测方法的研究与开发的报道却较少。
本研究拟采用紫外分光光度法检测玫瑰花茶中的原花青素,以乙醇作为提取溶剂[18],硫酸铁铵催化比色[19-20],选取影响玫瑰花茶中原花青素检测的因素,采用均匀试验设计初步优化原花青素检测条件,在此基础上,采用正交试验进一步优化检测方法,为玫瑰花茶中原花青素的分析检测提供参考。
1 材料与方法
1.1 材料与试剂
玫瑰花茶:贵州省贞丰县;原花青素标准品:上海安谱实验科技股份有限公司;甲醇、丙酮:天津市科密欧化学试剂有限公司;无水乙醇:重庆川东化工(集团)有限公司;盐酸:国药集团化学试剂有限公司;正丁醇:成都市科隆化学品有限公司;十二水合硫酸铁(Ⅲ)胺:上海沃凯生物科技有限公司。所有试剂均为分析纯。
1.2 仪器与设备
UV1901PC型紫外可见分光光度计:上海棱光技术有限公司;SK250HP型超声波清洗机:上海科导超声仪器有限公司;HH-S型恒温水浴锅:金坛市恒丰仪器制造有限公司;BSM220.4型电子天平:上海卓精电子科技有限公司。
1.3 方法
1.3.1 原花青素检测波长的选择
准确称取5.0 mg原花青素标准品,用甲醇溶解并定容至10 mL容量瓶中,得到质量浓度为0.5 mg/mL的标准储备液,避光保存[21]。准确移取1.0 mL原花青素标准储备液于10 mL容量瓶中,用无水乙醇定容,采用紫外可见分光光度计在波长200~800 nm范围内对其进行扫描,确定原花青素的最大吸收波长。
1.3.2 原花青素标准曲线绘制
准确吸取0、0.5 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL原花青素标准储备液于10 mL容量瓶中,用乙醇-盐酸-水溶液(50∶0.1∶49.9,V/V)定容,配制质量浓度分别为0、0.025 mg/mL、0.050 mg/mL、0.100 mg/mL、0.150 mg/mL、0.200 mg/mL的原花青素标准溶液。取6支10 mL具塞试管,分别加入6 mL正丁醇-盐酸溶液[22],1 mL标准系列溶液及0.2 mL 0.04 mol/L硫酸铁胺溶液,摇匀,沸水浴10 min,冷却平衡10 min,在最大吸收波长处,用紫外可见分光光度计测定吸光度值。以原花青素质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制原花青素标准曲线。
1.3.3 玫瑰花茶中原花青素含量的检测
称取0.2 g(精确至0.001 g)经粉碎的玫瑰花茶样品,置于50 mL具塞试管中,加入乙醇-盐酸-水溶液30 mL,超声提取,室温冷却,转移至50 mL容量瓶中,用该乙醇-盐酸-水溶液定容,过滤,制成试样溶液。在10 mL具塞试管中加入6mL正丁醇-盐酸溶液,加入1mL试样溶液及0.2mL0.04mol/L硫酸铁胺溶液,摇匀,沸水浴,冷却平衡,在最大吸收波长处,用紫外可见分光光度计测定吸光度值,通过标准曲线计算出试样溶液中原花青素的质量浓度,从而计算出玫瑰花茶中原花青素的含量。
1.3.4 均匀试验初步优化原花青素含量的检测方法
以原花青素含量(Y)为评价指标,选择乙醇-盐酸-水溶液中乙醇体积分数(X1)、盐酸体积分数(X2)、超声提取时间(X3)、沸水浴时间(X4)、平衡时间(X5)为考察因素,采用U9(95)均匀试验初步优化原花青素含量的检测方法。
1.3.5 正交试验设计优化原花青素含量的检测方法
在均匀试验的基础上,以原花青素含量(Y)为评价指标,乙醇体积分数(A)、盐酸体积分数(B)、超声提取时间(C)为考察因素,采用L9(34)正交试验优化原花青素含量的检测方法。
1.3.6 加标回收率试验
根据最佳检测条件,制备3份玫瑰花茶试样溶液,分别加入15 mg/g、30 mg/g、45 mg/g原花青素进行加标回收率试验,将加标样原花青素含量与未加标样原花青素含量进行比较,计算回收率[23],其计算公式如下:
式中:p为回收率,%;c1为未加标样提取液的原花青素含量,mg/g;c2为加标样提取液的原花青素含量,mg/g;c3为加标量,mg/g。
1.3.7 玫瑰花茶样品分析及精密度试验
采用最佳条件下检测6个玫瑰花茶样品中原花青素的含量,计算原花青素含量及其相对标准偏差(relative standard deviation,RSD)。
2 结果与分析
2.1 原花青素检测波长的选择
紫外可见分光光度计在波长200~800 nm处对原花青素扫描的结果见图1。由图1可知,原花青素在波长550 nm处有最大吸光度值,因此,确定最佳测定波长为550 nm。
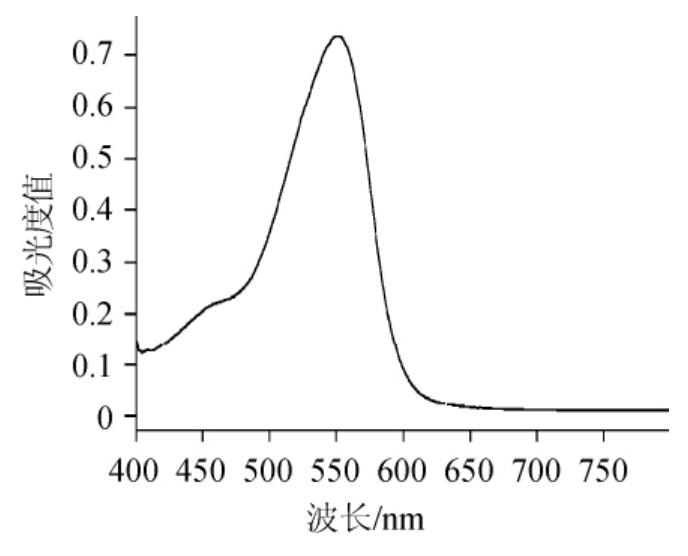
图1 原花青素紫外吸收波长的扫描结果
Fig.1 Scanning results of ultraviolet absorption wavelength of proanthocyanidins
2.2 原花青素标准曲线的绘制

图2 原花青素的标准曲线
Fig.2 Standard curve of proanthocyanidins
原花青素的标准曲线见图2。由图2可知,原花青素的标准曲线方程为y=4.972 4x-0.002 4,相关系数R2=0.999 9,表明原花青素在质量浓度0~0.200 mg/mL范围内,线性关系良好,可以用于原花青素含量的测定。
2.3 均匀试验优化结果
U9(95)均匀试验设计与结果见表1,方差分析见表2。
表1 均匀试验设计与结果
Table 1 Design and results of uniform tests
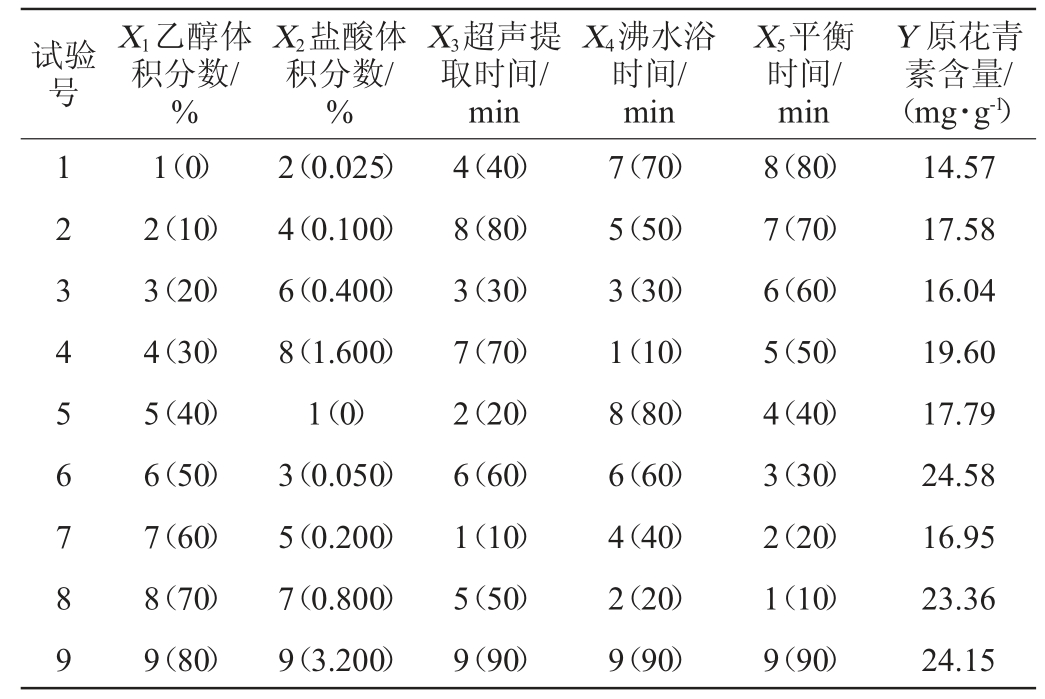
表2 均匀试验结果方差分析
Table 2 Variance analysis of uniform tests results

对表1的结果进行多元线性逐步回归分析,得到乙醇体积分数(X1)、盐酸体积分数(X2)、超声提取时间(X3)、沸水浴时间(X4)、平衡时间(X5)对原花青素含量的二次回归模型:Y=15.02-0.056 22X1X2+0.003 279X1X3。
由表2可知,回归模型的P值=8.516 3×10-7<0.01,极显著。由回归方程可知,X1与X2、X3存在交互作用,X4、X5对Y的影响非常小,对回归方程进行规划求解,得出玫瑰花茶中原花青素的检测条件为乙醇体积分数(X1)50%、盐酸体积分数(X2)0.1%、超声时间(X3)90 min、沸水浴时间(X4)为10 min、平衡时间(X5)为10 min。
2.4 正交试验优化结果
在均匀试验的基础上,选取乙醇体积分数(A)、盐酸体积分数(B)、超声提取时间(C)为考察因素,原花青素含量(Y)为评价指标进行L9(34)正交试验,正交试验设计与结果见表3,方差分析见表4。
由表3极差分析可知,各因素对玫瑰花茶中原花青素检测的影响主次顺序为乙醇体积分数(A)>盐酸体积分数(B)>超声提取时间(C),最佳检测条件为A2B2C3,即乙醇体积分数50%、盐酸体积分数0.10%、超声提取时间110 min。由表4可知,乙醇体积分数对原花青素检测结果影响显著(P<0.05),盐酸体积分数、超声提取时间影响不显著(P>0.05)。故玫瑰花茶中原花青素检测的最佳条件为乙醇体积分数50%,盐酸体积分数0.10%,超声提取时间110 min,沸水浴时间10 min、平衡时间10 min。
表3 正交试验设计及结果
Table 3 Design and results of orthogonal tests
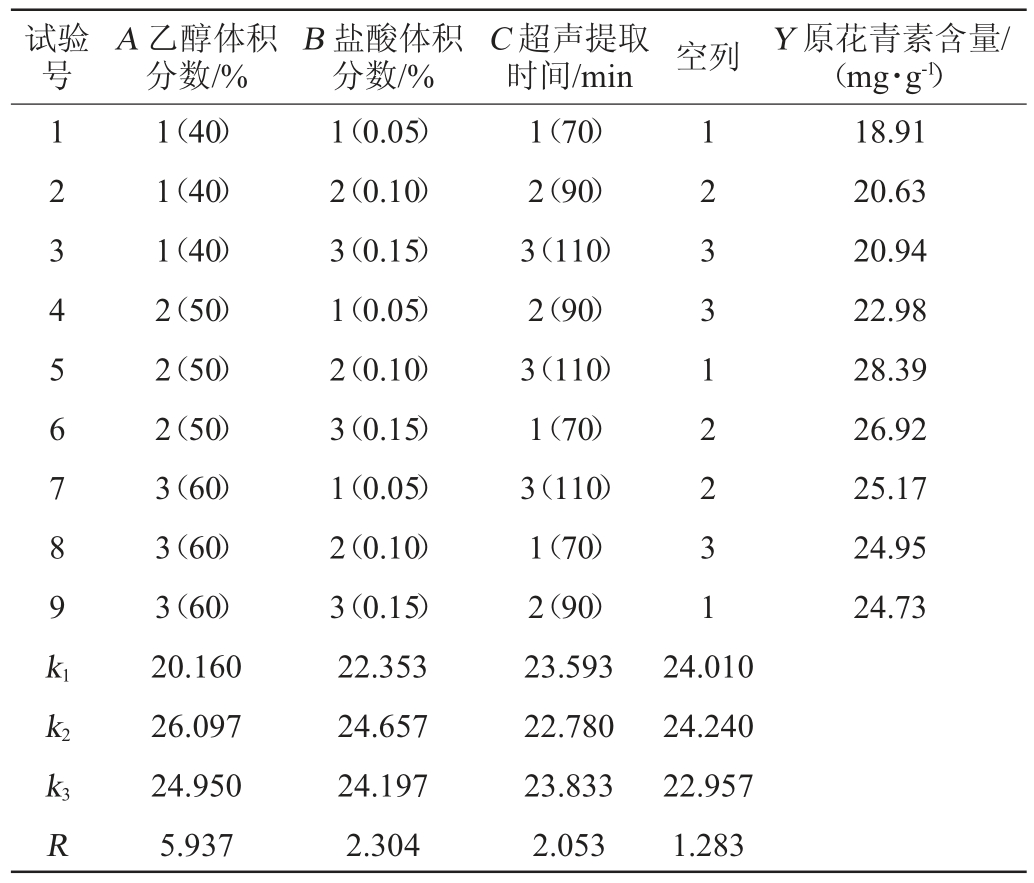
表4 正交试验结果方差分析
Table 4 Variance analysis of orthogonal tests results
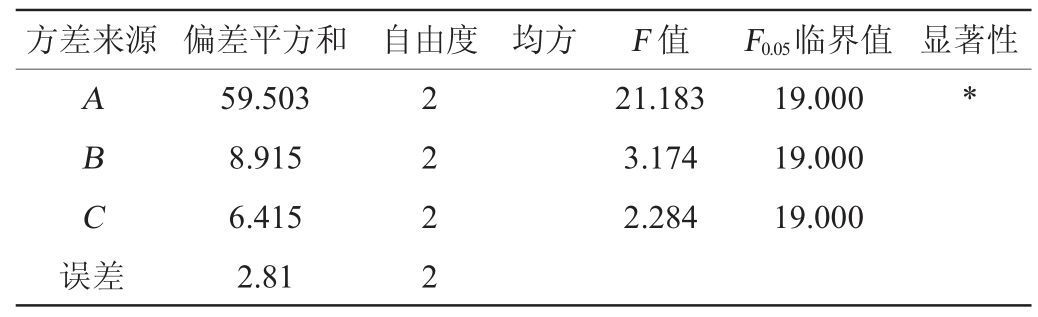
注:“*”表示对结果影响显著(P<0.05)。
2.5 加标回收率试验结果
加标回收率试验结果见表5。由表5可知,在最佳检测条件下,玫瑰花茶中原花青素的平均加标回收率为102.1%,RSD为3.64%,说明方法稳定可靠,准确度良好。
表5 原花青素的加标回收率试验结果
Table 5 Results of standard recovery rate tests of proanthocyanidins

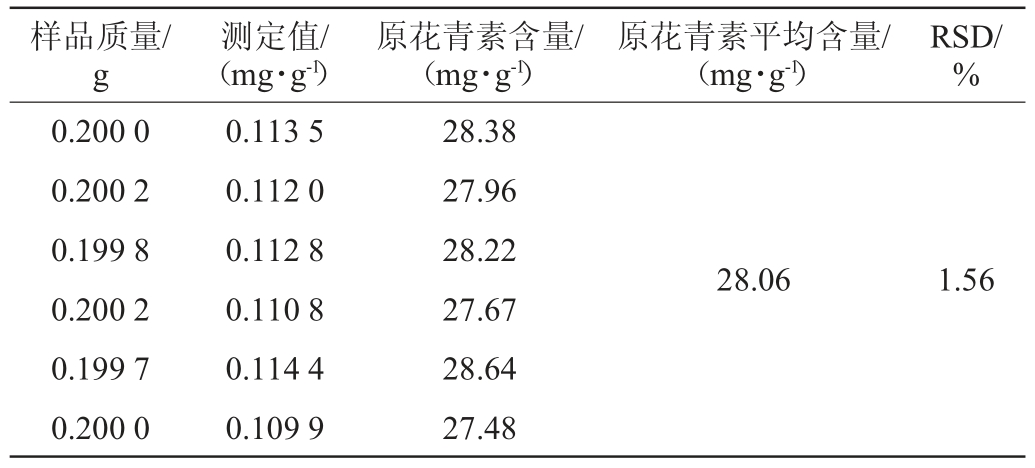
2.6 样品分析及精密度试验结果
在最佳检测条件下,6份相同玫瑰花茶的原花青素含量测定结果见表6。由表6可知,RSD为1.56%,表明该方法具有较高的精密度。经检测,玫瑰花茶中原花青素平均含量为28.06 mg/g。
表6 玫瑰花茶中原花青素含量的测定结果
Table 6 Determination results of proanthocyanidins content in rose tea
3 结论
运用均匀设计与正交设计联用法建立紫外分光光度法测定玫瑰花茶中原花青素含量的检测方法,最佳检测条件为乙醇体积分数50%,盐酸体积分数0.10%,超声提取时间110 min,沸水浴时间10 min,平衡时间10 min,该检测方法的加标回收率(102.1%)和精密度试验结果(1.56%)良好,灵敏稳定、操作简便。在此最佳条件下,测定玫瑰花茶中原花青素平均含量为28.06 mg/g。
[1]罗军.中国茶典全图解[M].北京:中国纺织出版社,2016:288-289.
[2]QIN H,DENG X Q,LI B C,et al.Volatiles,polysaccharides and total polyphenols in Chinese rose tea infusions and their antioxidant activities[J].J Food Process Pres,2018,42(1):e13323.
[3]陈文,张静,常平,等.玫瑰花茶对束缚应激小鼠尾悬挂实验与抗氧化能力的影响[J].食品工业科技,2012,33(1):376-378.
[4]DILAY K,ÖZLEM Ç.Determination of antioxidant properties of dry rose tea[J].Int J Second Metab,2017,4(3):384-390.
[5]姚育翠.玫瑰花中原花青素的分离分析及抗氧化活性研究[D].杭州:浙江大学,2008.
[6]ZHAO W,MENG Y C,YIN Z P,et al.Study on the isolation and purification of proanthocyanidins from Rhodiola rose by macroporous adsorbent resin[J].Adv Mater Res,2011,236-238:2053-2057.
[7]梁红敏,高德艳,胡文效.葡萄籽低聚原花青素体外抗氧化活性研究[J].2017,36(4):149-152.
[8]罗平.玫瑰类黄酮合成相关基因的克隆和功能解析[D].武汉:华中农业大学,2016.
[9]徐明璐,徐文远,刘文.原花青素研究进展[J].烟台果树,2017(1):7-8.
[10]格日勒,亓伟,刘淑娟.原花青素HPLC 测定方法研究进展[J].中国酿造,2014,33(6):6-9.
[11]吴寒,侯冬岩,回瑞华,等.高效液相色谱-电喷雾质谱法鉴定玫瑰花中低聚原花青素[J].鞍山师范学院学报,2014,16(2):47-51.
[12]彭慧敏,牟宗慧,刘红燕,等.HPLC 法测定玫瑰花中原花青素B2的含量[J].山东中医药大学学报,2011,35(2):180-181.
[13]姚育翠,李向荣.大孔吸附树脂分离纯化玫瑰花中原花青素的研究[J].中药材,2008,31(8):1239-1241.
[14]陈安平,黄勇军,汪胜峰.市售蓝莓类产品的原花青素含量测定[J].食品研究与开发,2016,37(1):170-173.
[15]侯妍,张昌浩,范忠义,等.紫外分光光度法测定蓝靛果中原花青素含量[J].延边大学医学学报,2018,41(2):103-105.
[16]蔡锦源,周小雷,熊建文.均匀设计与正交设计联用优选香菇多糖的微波辅助提取工艺研究[J].河南工业大学学报(自然科学版),2016,45(3):402-405.
[17]张洪,王明力,和岳.壳聚糖/纳米SiOx 复合膜对艳红桃的保鲜研究[J].食品科学,2012,33(22):319-323.
[18]刘贵忠.黑花生原花青素优化提取条件的研究[J].赤峰学院学报(自然科学版),2018,34(7):27-30.
[19]李华,肖付才,袁春龙,等.铁盐催化比色法测定葡萄籽超微粉中的原花青素[J].食品研究与开发,2007,28(9):114-117.
[20]杜利君,姚亚婷,王静慧,等.改进铁盐催化比色法测定保健食品中原花青素[J].检验检疫学刊,2013,23(5):50-52.
[21]智勇刚,张芹,唐辉,等.天山花楸中原花青素的可见分光光度法测定[J].食品科技,2009,34(6):252-254.
[22]乔洪翔,任红,陈君,等.银杏叶制剂中原花青素含量测定方法比较[J].海峡药学,2017,29(8):61-63.
[23]王凤娟,孙飞龙,叶文文.pH 示差法测定红菊苣中花青素条件的优化[J].包装与食品机械,2018,36(5):61-64.