嗜热脂肪土芽孢杆菌(Geobacillus stearothermophilus)属嗜热性需氧芽孢杆菌,但兼有厌氧的特性,为革兰氏阳性(G+)菌,芽胞孔雀绿着色。国标GB 18281.3—2015《医疗保健产品灭菌生物指示剂第3部分:湿热灭菌用生物指示剂》中将G.stearothermophilus作为湿热灭菌用生物指示剂。嗜热脂肪土芽孢杆菌之所以可以在严苛的条件下生长,与细胞膜的结构和流动性以及蛋白质的稳定性有关[1-2]。此外嗜热性也可能与菌体内存在着某种染色体外遗传因子有关,但还有待进一步地研究和证实。目前,对嗜热脂肪土芽孢杆菌的研究主要集中在某些特定的酶的研究[3-5]。但针对这些嗜高温特性是否与该菌产生热稳定性酶和胞膜的特殊性质有一定相关性,这种酶是什么样的酶,这种膜具有什么样的特殊构造等问题均需要作深入的研究。
热休克蛋白(heat shock protein,Hsp)33是氧化还原分子伴侣家族的主要成员,热休克反应导致各种热休克蛋白的迅速产生,从而保护细胞免受不利环境对细胞生长的影响[6-8]。Hsp33最初是从研究大肠杆菌(Escherichia coli)热休克蛋白时发现,后又在枯草芽孢杆菌(Bacillus subtilis)和酿酒酵母中发现,并在保护细胞免受胁迫过程中起着重要的作用[9]。Hsp33被广泛认为是细胞蛋白质构象和蛋白质转换的重要介质[10]。在细菌中,特定的感官分子能够感知温度波动并将这种波动转变成细胞间的信号进行传递。这种热传感器,包括核酸(脱氧核糖核酸(deoxyribonucleic acid,DNA)或核糖核酸(ribonucleic acid,RNA))和蛋白质。细菌一旦感知到应激信号,就会调用特定的分子机制来控制编码热休克蛋白的基因的转录[11]。CHUANG S E等[12-13]研究了大肠杆菌在热和氧胁迫条件下的热休克反应,结果表明,Hsp33在大肠杆菌处于热和氧化环境条件时,其表达量显著增加,而缺乏Hsp33基因的细菌,在遇到这些应激条件时,表现非常敏感。进一步研究发现,在大肠杆菌中Hsp33蛋白构象的变化影响其抗胁迫功能,Hsp33蛋白通过锌离子的释放,导致C端和连接区展开,并形成活性二聚体,从而阻止有害蛋白质聚集体的形成[14-15],有效的抵御外界胁迫。近来的研究主要集中在大肠杆菌的Hsp33的结构和作用机制[16-17]的研究,对嗜热脂肪土芽孢杆菌中Hsp33基因的研究尚鲜见报道。
本课题旨在对嗜热脂肪土芽孢杆菌(Geobacillus stearothermophilus)GL-1的Hsp33基因进行克隆,利用相关软件对其表达的蛋白结构进行分析。同时,考察热胁迫处理对嗜热脂肪土芽孢杆菌GL-1生长的影响,并利用反转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)研究菌株在热胁迫中Hsp33基因的表达情况,从而初步了解Hsp33基因在菌株的嗜热过程中的作用。为进一步了解该菌株的嗜热性提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
嗜热脂肪土芽孢杆菌(Geobacillus stearothermophilus)GL-1:分离自死海的海水中,保存于本实验室;DH5α感受态:北京索莱宝科技公司。
1.1.2 培养基
改良的LB培养基:胰蛋白胨10.0 g/L,酵母浸粉5.0 g/L,NaCl 50 g/L,琼脂18 g/L,pH值7.0。0.1 MPa、121 ℃高压蒸汽灭菌20 min。液体培养基中不加琼脂。
1.1.3 试剂
质粒pET28a、细菌基因组DNA提取试剂盒、2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、One Step RT-PCR Kit:索莱宝生物技术有限公司;限制性核酸内切酶EcoR I(10 U/μL),BamH I(10 U/μL):日本TaKaRa公司;信使核糖核酸(messenger ribonucleic acid,mRNA)提取试剂盒:上海泽叶生物技术有限公司。
1.2 仪器与设备
Nanodrop OneC微量DNA检测仪:美国thermofisher有限公司;T100 PCR仪:美国Bio-Rad公司;THZ-C-1恒温振荡培养箱:上海之信仪器有限公司;H2050R台式高速冷冻离心机:湖南湘仪离心机仪器有限公司;HH-4水浴锅:上海力辰仪器科技有限公司;DYCP-32A型琼脂糖水平电泳仪:北京六一生物科技有限公司;GelDo XR+凝胶成像系统:伯乐生命医学产品(上海)有限公司。
1.3 方法
1.3.1 菌株的活化
取100 μL保藏的嗜热脂肪土芽孢杆菌GL-1涂布于改良LB培养基,40 ℃条件下培养24 h。挑取单菌落划线于改良LB培养基,40 ℃条件下培养24 h。挑取单菌落接种于含有50 mL改良LB液体培养基的锥形瓶中,40 ℃、180 r/min条件下培养12 h。
1.3.2 菌株DNA的提取及PCR扩增
将培养12 h的发酵液在10 000 r/min条件下离心,收集菌体,按照细菌基因组DNA提取试剂盒的说明提取DNA,用微量DNA检测仪在波长260 nm处检测提取结果。根据已知菌株的Hsp33基因,设计相应引物,上游引物为5'-CGCGGATCCATGAGTGACTACTTAGTC-3'(下划线部分为EcoR I酶切位点),下游引物为5'-CCGGAATTCTTATATAGCTTCTTCTTTCAT-3'(下划线部分为BamH Ⅰ酶切位点)。以嗜热脂肪土芽孢杆菌GL-1的DNA为模板,进行PCR扩增。PCR扩增体系:DNA模板1 μL,上下游引物各1 μL,2×Taq PCR Master Mix 12.5 μL,双蒸水补充至25 μL。PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,共循环35次;72 ℃再延伸5 min。PCR扩增产物经回收柱纯化后用EcoRI、BamHI进行双酶切,纯化,与质粒pET-28a连接,通过电转化导入感受态细胞大肠杆菌DH5α中。挑取阳性克隆,提取质粒,送至生工生物工程(上海)股份有限公司测序。
1.3.3 Hsp33蛋白的结构分析
使用美国国立生物技术信息中心(national center for biotechnology information,NCBI)对Hsp33蛋白进行保守序列分析。采用在线软件ExPASy(http://www.expasy.org/tools/)中的Prot Param和Prot Scale程序对Hsp33蛋白的氨基酸组成、数目、相对分子质量及亲疏水性等进行分析。使用在线软件DNA MAN对Hsp33蛋白的氨基酸序列进行比对分析。运用COILS(http://www.ch.embnet.org/software/COILS_form.html)对Hsp33蛋白的卷曲螺旋位置进行分析。采用Signal P4.1对Hsp33蛋白的信号肽进行分析。采用在线软件SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa automat.pl?page=/NPSA/npsa_sopma.html)对Hsp33蛋白的α-螺旋、延伸链、β-转角结构以及无规则卷曲等进行分析预测。使用在线软件Pymol(https://pymol.org/)对Hsp33蛋白的三级结构进行分析。
1.3.4 菌株的热激处理
将嗜热脂肪土芽孢杆菌GL-1接种于改良LB液体培养基,30 ℃、180 r/min条件下培养,当OD600nm值达到0.5~0.6时,离心,收集菌体,进行热处理。菌株分别在40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃水浴30 min,考察温度对菌株存活率的影响;菌株分别在40 ℃、50 ℃、60 ℃、70 ℃水浴0 min、10 min、20 min、30 min、40 min、50 min、60 min、70 min,考察时间对菌株存活率的影响。将处理完的菌株,适当稀释,然后涂布于改良LB培养基平板,进行菌落计数[18],以未处理的菌株为对照,计算菌株存活率,其计算公式如下:
1.3.5 Hsp33基因表达的检测
取OD600nm值为0.5~0.6的发酵液5 mL,10 000 r/min离心10 min,收集菌体,无菌水水洗两次,用1 mL蒸馏水悬浮,然后取500 μL分别在40 ℃和50 ℃条件下热处理20 min和30 min。采用mRNA提取试剂盒提取RNA,用微量RNA测量仪在波长260 nm处测定RNA含量。采用One-Step RT-PCR kit进行RT-PCR,具体方法参考文献[19]。
2 结果与分析
2.1 Hsp33基因的克隆
以嗜热脂肪土芽孢杆菌GL-1的DNA为模板进行PCR扩增,PCR扩增产物经琼脂糖凝胶电泳检测,结果见图1。
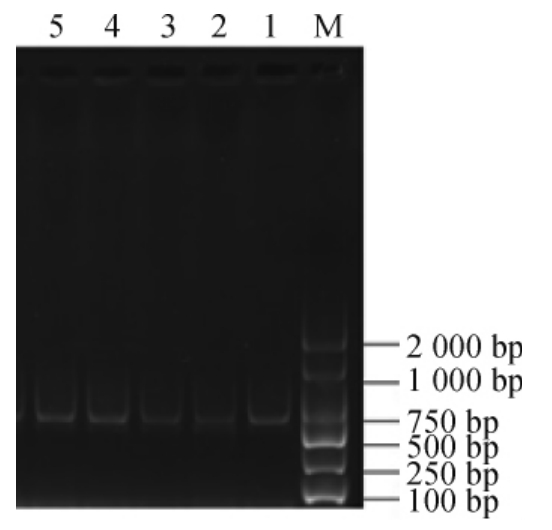
图1 Hsp33基因PCR扩增产物琼脂糖凝胶电泳结果
Fig.1 Results of agarose gel electrophoresis of PCR amplification products of Hsp33 gene
M为DL2000的DNA Marker;1、2、3、4、5均为PCR扩增产物。
由图1可知,克隆出一条碱基长度在700~100 bp的目的条带,将条带回收后寄上海生工生物技术有限公司进行测序,测序结果见图2。

图2 Hsp33基因的核苷酸序列
Fig.2 Nucleotide sequence of Hsp33 gene
由图2可知,Hsp33基因的碱基长度为876 bp,为一个完整的开放阅读框(open reading frame,ORF)。将测序结果在NCBI上进行BLAST比对,发现该基因与枯草芽孢杆菌(Bacillus subtilis)1vzy的Hsp33基因相似性达到99%,与阿氏芽孢杆菌(Bacillus aryabhattai)Hsp33的基因相似性达到99%。说明克隆的基因是Hsp33基因序列。将该基因序列提交至NCBI,通过BLAST比对,对Hsp33蛋白的保守序列进行分析,结果见图3。
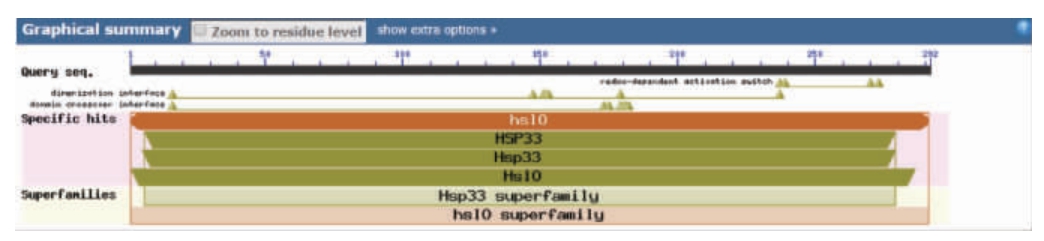
图3 Hsp33蛋白保守序列分析
Fig.3 Conserved sequence analysis of Hsp33 protein
由图3可知,嗜热脂肪土芽孢杆菌的Hsp33属于HslO超基因家族,在羧基端具有4个半胱氨酸残基构成的依赖氧化还原激活开关,此外具有7个氨基酸残基构成的二聚体表面结合位点和7个氨基酸残基构成的二聚体结构域结合位点。
2.2 Hsp33蛋白结构分析
通过Prot Param程序对嗜热脂肪土芽孢杆菌的Hsp33蛋白进行一级结构分析,结果显示,嗜热脂肪土芽孢杆菌的Hsp33蛋白由292个氨基酸组成,相对分子质量为31 706.20,蛋白质理论等电点为4.93,编码的蛋白质分子式为C1395H2238N374O438S14,蛋白质不稳定系数为33.02,蛋白质亲水性平均值为-0.157。其酸性氨基酸和亲水性氨基酸较多(经比较,嗜热脂肪土芽孢杆菌的Hsp33蛋白与Bacillussubtilis 1vzy的Hsp33蛋白亲水性基本相似,但亲水性都低于Escherichia coli str.K-12 substr.MG1655的Hsp33蛋白)。蛋白序列含有20种氨基酸,含量最多的是丙氨酸、谷氨酸、甘氨酸。含量较少的为组氨酸、色氨酸,其中碱性氨基酸32个、酸性氨基酸40个(经比较,嗜热脂肪土芽孢杆菌的Hsp33蛋白与Bacillus subtilis 1vzy的Hsp33蛋白电负性均低于Escherichia coli str.K-12 substr.MG1655的Hsp33蛋白)。使用在线软件DNA MAN对嗜热脂肪土芽孢杆菌GL-1、Bacillus subtilis 1vzy的Hsp33氨基酸序列进行比对,结果见图4。

图4 嗜热脂肪土芽孢杆菌GL-1与枯草杆菌1vzy的Hsp33氨基酸序列比对结果
Fig.4 Alignment results of amino acid sequences of Hsp33 from Geobacillus stearothermophilus GL-1 and Bacillus subtilis 1vzy
箭头所指部位为二聚体的中间,蓝色的地方为同源序列,淡蓝色为部分同源序列,白色为非同源序列。
由图4可知,两菌株的Hsp33氨基酸序列的一致性为73.3%,序列相似性为86.9%,同源性较高,亲缘关系较近。
对嗜热脂肪土芽孢杆菌的Hsp33蛋白的疏水性、卷曲螺旋位置及蛋白的信号肽进行分析,结果见图5。

图5 嗜热脂肪土芽孢杆菌GL-1的Hsp33蛋白的疏水性(A)、卷曲螺旋(B)、信号肽(C)分析结果
Fig.5 Analysis results of hydrophobicity (A),crimp helix (B) and signal peptide (C) of Hsp33 protein from Geobacillus stearothermophilus GL-1
由图5可知,Hsp33蛋白的疏水性氨基酸数量为126,无卷曲螺旋、信号肽。利用SOPMA软件分析嗜热脂肪土芽孢杆菌的Hsp33蛋白的二级结构,并且与Bacillus subtilis 1vzy和Escherichia coli str.K-12 substr.MG1655 Hsp33蛋白进行比较,结果发现,嗜热脂肪土芽孢杆菌的Hsp33蛋白的α-螺旋结构在二级结构中占比较大,为44.52%,而β-折叠和β-转角仅占很少一部分。有文献报道,较多的α-螺旋氨基酸残基的存在有利于蛋白质结构的稳定,提高蛋白质的热稳定性[20]。使用在线软件Pymol构建嗜热脂肪土芽孢杆菌GL-1、枯草杆菌1vzy的Hsp33蛋白的三级结构,结果见图6。

图6 嗜热脂肪土芽孢杆菌GL-1(A)与枯草芽孢杆菌1vzy(B)的Hsp33蛋白的三级结构
Fig.6 Tertiary structure of Hsp33 protein of Geobacillus stearothermophilus GL-1 (A) and Bacillus subtilis 1vzy (B)
箭头所指部位为C末端结构域。
由图6可知,嗜热脂肪土芽孢杆菌GL-1、枯草芽孢杆菌1vzy的Hsp33蛋白除C末端结构域有所差距外,其他部分基本相同,说明两者具有相似的核心结构域,这也更加证明了两者之间的同源性。对于两者结构的差异对蛋白质性质的影响有待于研究。
2.3 热胁迫对嗜热脂肪土芽孢杆菌GL-1生长的影响
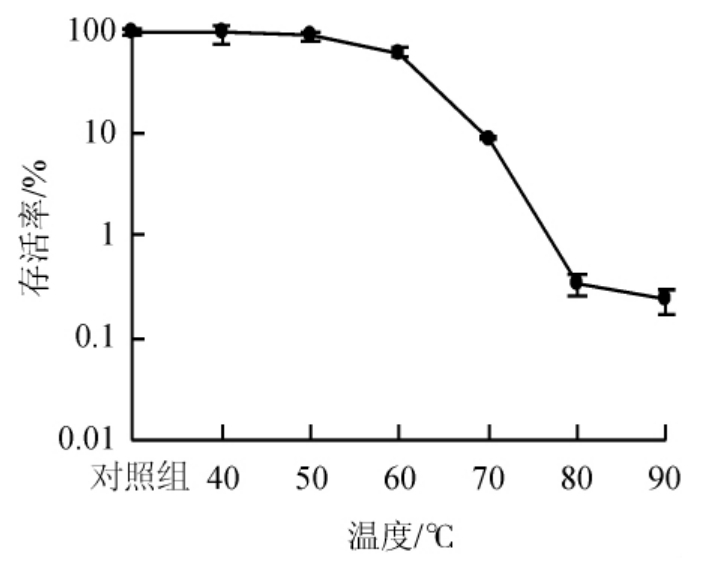
图7 热胁迫对嗜热脂肪土芽孢杆菌GL-1存活率的影响
Fig.7 Effect of heat stress on the survival rate of Geobacillus stearothermophilus GL-1
由图7可知,嗜热脂肪土芽孢杆菌GL-1在不同温度处理下存活率变化很大,在40 ℃、50 ℃处理30 min后,菌株存活率分别为95%、93%;在60 ℃处理30 min后,菌株存活率降至65%;处理温度>60 ℃之后,随着温度的升高存活率逐步下降,在90 ℃处理30 min后,菌株存活率0.5%。
由图8可知,40 ℃条件下处理嗜热脂肪土芽孢杆菌GL-1存活率保持恒定,基本维持在90%以上;50 ℃条件下处理时间>40 min之后,菌株的存活率陡然下降,70 min时接近1%;60 ℃条件下处理30 min,菌株的存活率下降到35%,70 min时存活率<1%;70 ℃条件下处理10 min,菌株的存活率降至65%,30 min时存活率<1%。结果表明,菌株可以耐受40 ℃高温。

图8 热胁迫时间对嗜热脂肪土芽孢杆菌GL-1存活率的影响
Fig.8 Effect of heat stress time on the survival rate of Geobacillus stearothermophilus GL-1
2.4 热胁迫条件下Hsp33基因的表达
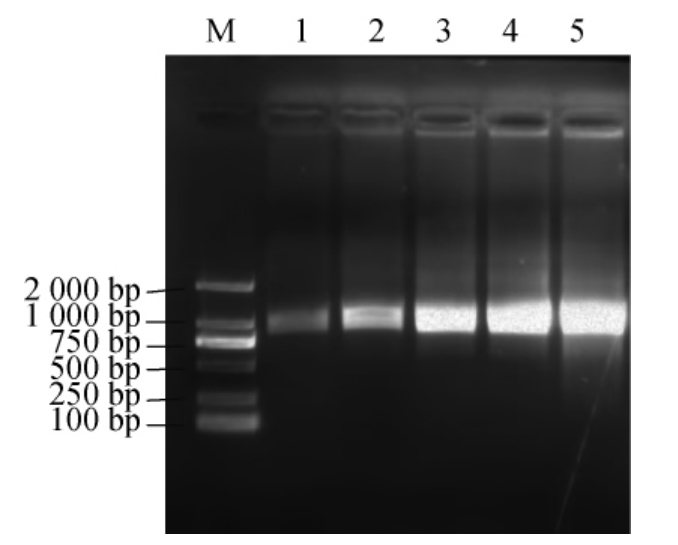
图9 RT-PCR扩增产物琼脂糖凝胶电泳结果
Fig.9 Results of agarose gel electrophoresis of RT-PCR amplification products
M为DL 2000 的DNA Marker,1为对照组即未处理菌株的Hsp33的表达量;2、3、4、5分别为40 ℃处理20 min、40 ℃处理30 min、50 ℃处理20 min、50 ℃处理30 min时Hsp33的表达量。
由图9可知,与对照组相比,嗜热脂肪土芽孢杆菌GL-1经热处理后Hsp33基因表达量增加。在40 ℃条件下热处理20 min,菌株Hsp33的基因表达量比处理30 min低。50 ℃条件下热处理20 min和30 min,菌株Hsp33基因的表达量基本相同,但均高于40 ℃热处理时菌株Hsp33基因的表达量。
3 结论
通过PCR扩增获得嗜热脂肪土芽孢杆菌(Geobacillus stearothermophilus)GL-1的Hsp33基因,该基因碱基长度为876 bp,与枯草芽孢杆菌(Bacillus subtilis)1vzy的Hsp33基因序列相似性达到99%,其表达的蛋白质结构与Bacillus subtilis 1vzy的Hsp33蛋白具有相似的核心结构域,二者除C-末端稍有不同外,具有相同的β-折叠和α-螺旋,无卷曲螺旋。热胁迫对嗜热脂肪土芽孢杆菌GL-1生长具有影响,当嗜热脂肪土芽孢杆菌GL-1菌株受到热胁迫时,Hsp33基因表达量增加,说明在受到胁迫时,Hsp33蛋白作出了应激反应,可以抵御环境胁迫给细胞带来的伤害。在嗜热脂肪土芽孢杆菌GL-1中,Hsp33基因表达与外界胁迫的关系还需要进一步的研究和探讨。
[1]SHARMA M,KUMAR R,SINGH R,et al.Thirty-degree shift in optimum temperature of a thermophilie lipase by a single-point mutation:effect of serine to threonine mutation on structural flexibility[J].Mol Cell Biochem,2017,430(1-2):1-10.
[2]KATES M.Structural analysis of phospholipids and glycolipids in extremely halophilic archaebacteria[J].J Microbiol Meth,1996,25(2):113-128.
[3]李祝.嗜热脂肪芽孢杆菌α-淀粉酶的异源表达及热稳定性改造[D].无锡:江南大学,2018.
[4]李雨桐.嗜热脂肪芽孢杆菌麦芽糖淀粉酶在枯草芽孢杆菌中的重组表达及发酵优化[D].无锡:江南大学,2018.
[5]肖亚朋,沈微,李婷霖,等.嗜热脂肪土芽孢杆菌普鲁兰酶基因的异源表达及重组酶性质[J].食品与发酵工业,2017,43(5):30-36.
[6]BALCHIN D,HAYER-HARTL M,HARTL F U. In vivo aspects of protein folding and quality control[J].Science,2016,353(6294):43-54.
[7]BERSHTEIN S,MU W,SEROHIJOS A R,et al.Protein quality control acts on folding intermediates to shape the effect of mutations on organismal fitness[J].Mol Cell,2013,49(1):133-144.
[8]DAHL J U,GRAY M J,JAKOB U.Protein quality control under oxidative stress conditions[J].J Mol Biol,2015,427:1549-1563.
[9]LIU W,ZHOU Y Y,TENG M K,et al.Purification,crystallization and preliminary X-ray analysis of Hsp33 from Saccharomyces cerevisiae[J].Acta Crystallogr F,2007,63(Pt2):114-116.
[10]CRAI E A,WEISSMAN J S,HORWICH A L.Heat shock proteins and molecular chaperones:mediators of protein conformation and turnover in the cell[J].Cell,1994,78(3):365-372.
[11]RONCARATI D,SCARLATO V.Regulation of heat-shock genes in bacteria:from signal sensing to gene expression output[J].FEMS Microbiol Rev,2017,41(4):549-574.
[12]CHUANG S E,BLATTNER F R.Characterization of twenty-six new heat shock genes of Escherichia coli[J].J Bacteriol,1993,175:5242-5252.
[13]KANG H J,HEO D H,CHOI S W,et al.Functional characterization of Hsp33 protein from Bacillus psychrosaccharolyticus;additional function of Hsp33 on resistance to solvent stress[J].Biochem Bioph Res Co,2007,358(3):743-750.
[14]DOYLE S M,GENEST O,WICKNER S.Protein rescue from aggregates by powerful molecular chaperone[J].Nat Rev Mol Cell Biol,2013,146(10):617-629.
[15]WINTER J,ILBERT M,GRAF P C F,et al.Bleach activates a redox-regulated chaperone by oxidative protein unfolding[J].Cell,2008,135(4):691-701.
[16]FOIT L,GEORGE J S,BIN W,et al.Chaperone activation by unfolding[J].P Natl Acad Sci USA,2013,110:E1254-E1262.
[17]JO K S,KIM J H,RYU K S,et al.Unique unfoldase/aggregase activity of a molecular chaperone Hsp33 in its holding-inactive state[J].J Mol Biol,2019,431(7):1468-1480.
[18]杨革.微生物学实验教程(第三版)[M].北京:科学出版社,2018:42-44.
[19]杨丹,陈丽莉,张党权,等.半定量RT-PCR 方法检测FADX 基因在油桐种子发育过程中的表达[J].分子植物育种,2016,14(2):450-455.
[20]SCANDURRA R,CONSALVI V,CHIARALUCE R,et al.Protein thermostability in extremophiles[J].Biochimie,1998,80(11):933-941.