磷脂酶D(phospholipase D,PLD)是一类特殊的酯键水解酶,能催化水解磷脂分子中的磷酸和羟基化合物的羟基成酯的P-O键,水解产物为磷脂酸(phosphatidic acid,PA)和羟基化合物,如水解磷脂酰胆碱(phosphatidyl cholines,PC)生成PA和胆碱;在特定条件下,PLD还能催化PA转移至其他的含羟基化合物(如丝氨酸、果糖等)形成新的酯键,也称为转磷脂酰基反应[1-3]。PLD催化的转磷脂酰基反应有重要的应用价值,可以用于磷脂的定向改造、药物的合成以及单一磷脂、稀有磷脂的制备[4-8]。PLD广泛分布于细菌、真菌和动植物体中,相对于动植物来源的PLD,微生物来源的PLD具有更强的转磷脂酰基能力,底物特异性低,受到国内外学者广泛关注[9-13]。目前报道的产磷脂酶D的微生物主要有链霉菌属、大肠杆菌、芽孢杆菌、假单胞菌、沙门氏菌、抗辐射不动杆菌等[14-16],其中对产酶发酵条件进行深入研究的主要集中在链霉菌属的微生物[17-19],对细菌产PLD的研究主要集中在基因工程菌的构建,对从自然界中筛选的蜡样芽孢杆菌产PLD发酵条件进行优化鲜有报道。为此,本研究对实验室筛选到的蜡样芽孢杆菌产磷脂酶D的发酵条件进行优化,为PLD的工业化生产和应用奠定基础。
1 材料与方法
1.1 材料与试剂
蜡样芽孢杆菌(Bacillus cereus):实验室筛选获得。
卵黄LB固体培养基:在LB固体培养基中添加20g/L卵黄。
硼砂卵黄固体培养基:NaCl 6.6 g/L、硼酸10.9 g/L、硼砂1.9 g/L、琼脂粉20 g/L、卵黄20 g/L,pH7.2~7.4。
基础发酵培养基:葡萄糖10 g/L、蛋白胨10 g/L、牛肉粉1 g/L、NaCl 3 g/L、MgSO4·7H2O 0.5 g/L、CaCl21 g/L,pH值6.5~7.0,种子培养基同基础发酵培养基。
磷脂酶D活性分析试剂盒(比色法):美国Bio Vision公司;LB固体培养基、蛋白胨、牛肉粉、琼脂粉(均为生化试剂):青岛海博生物有限公司;十二烷硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(ethylenediaminetetraaceticacid,EDTA):国药集团化学试剂有限公司;卵黄取自新鲜鸡蛋,其他试剂均为国产分析纯。
1.2 仪器与设备
LHS-250SC电热恒温恒湿培养箱、THZ-100B恒温培养摇床:上海一恒科学仪器有限公司;Infinite 200 PRO多功能酶标仪:瑞士帝肯有限公司。
1.3 方法
1.3.1 发酵方法
取生长良好的斜面菌种1~2环,接种到种子培养基中,36 ℃、200 r/min摇瓶培养10 h得到种子液。取适量种子发酵液,按照一定的接种量接入发酵培养基中,在一定温度、200 r/min条件下培养一定时间后,取样测定发酵液中PLD的水解酶活力及菌体浓度。
1.3.2 粗酶液制备
将发酵液在4 000 r/min条件下离心20 min,取上清液即为粗酶液。
1.3.3 磷脂酶D活力测定
硼砂卵黄平板牛津杯法测酶活[20]:取100 μL稀释后的粗酶液置于等距放置在硼砂卵黄平板上的牛津杯中,36 ℃温育24 h,所产生的乳白色晕圈的大小即代表酶活力的高低。为使结果具有可比性,硼砂卵黄平板采用同一规格的平皿,加入等量同批次硼砂卵黄固体培养基。为消除不同pH及酶浓度过高对晕圈反应的影响,粗酶液用一定pH缓冲液稀释10倍作为晕圈反应测定液,每个样品平行测定3次,取平均值。PLD水解活力测定采用酶联比色法[21]:利用PLD水解磷脂酰胆碱产生胆碱,胆碱在胆碱氧化酶和过氧化物酶的作用下形成红色显色物质,在波长500 nm下有最大吸收峰。本研究使用市售的根据该原理制备的磷脂酶D活性分析试剂盒(比色法)测定粗酶液中PLD水解PC产生胆碱的水解酶活性,操作方法根据试剂盒使用说明书进行。酶活定义为在25 ℃、pH7.4条件下,以PC为底物,每分钟生成1 μmol胆碱所需要的酶量为一个酶活力单位(U/mL)。由于该测定方法中胆碱氧化酶和过氧化物酶价格昂贵,故本研究中酶活初步鉴定采用硼砂卵黄平板牛津杯法。
1.3.4 菌体浓度测定
取发酵液1 mL于100 mL容量瓶中,加蒸馏水定容至100 mL,于波长660 nm处测定吸光度值,试验过程中做3组平行试验。
1.3.5 单因素试验
在基础发酵培养基基础上,每次改变一个条件,研究不同碳源、氮源、表面活性剂、金属离子、培养时间、温度、初始pH及接种量对蜡样芽孢杆菌产PLD的影响,根据硼砂卵黄平板牛津杯法产生的乳白色晕圈直径大小鉴定酶活力的高低,每个因素做3个平行。
1.3.6 正交试验
在单因素试验基础上,选取对酶活影响较大的因素,即卵黄、蛋白胨、牛肉粉、镁离子质量浓度4个因素,采用4因素3水平设计正交试验,进一步优化产酶条件,因素与水平见表1。
表1 培养基配方优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for medium formula optimization

2 结果与分析
2.1 培养基成分对发酵产酶的影响
2.1.1 碳源种类及添加量对发酵产酶的影响
在基础发酵培养基的基础上,改变碳源种类,分别以10 g/L葡萄糖、乳糖、蔗糖、甘油、淀粉及卵黄为碳源,接种量2%,于36 ℃、200 r/min培养24 h,测定晕圈直径,结果见图1。由图1可知,以10 g/L卵黄作为碳源产酶活力较高。

图1 不同碳源种类对发酵产酶的影响
Fig.1 Effect of different carbon sources on enzyme production
以卵黄为碳源,改变卵黄添加量分别为10 g/L、20 g/L、25 g/L、30 g/L、40 g/L、50 g/L,培养基初始pH7.0,接种量为2%,于36 ℃、200 r/min培养24 h,测定晕圈直径,结果见图2。由图2可知,卵黄添加量为20 g/L 时,发酵液中酶活力较好,继续提高卵黄含量,酶活力下降,可能由于卵黄含量过高,培养基液体黏度过大,影响了微生物需氧。

图2 卵黄添加量对发酵产酶的影响
Fig.2 Effect of egg yolk addition on enzyme production
2.1.2 氮源种类及添加量对发酵产酶的影响
在基础发酵培养基的基础上,改变氮源种类,分别以10 g/L蛋白胨、10 g/L酵母膏、10 g/L牛肉粉、10 g/L硫酸铵及10 g/L蛋白胨与1 g/L酵母膏、10 g/L蛋白胨与1 g/L牛肉粉、10 g/L蛋白胨与1 g/L硫酸铵的复合为氮源进行试验,发酵条件同碳源确定试验,结果见图3。由图3可知,使用有机氮源效果比无机氮源好,有机氮源复合使用比单一使用效果好,其中,蛋白胨与牛肉粉复合使用效果较好。

图3 不同氮源种类对发酵产酶的影响
Fig.3 Effect of different nitrogen sources on enzyme production
1为10 g/L蛋白胨;2为10 g/L酵母膏;3为10 g/L牛肉粉;4为10 g/L硫酸铵;5为10 g/L蛋白胨+1 g/L牛肉粉,6为10 g/L蛋白胨+1 g/L酵母膏;7为10 g/L蛋白胨+1 g/L硫酸铵
为进一步确定蛋白胨和牛肉粉复合使用的最适含量,固定牛肉粉添加量为1 g/L,改变蛋白胨的添加量分别为5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L进行试验,结果如图4a所示,随着蛋白胨添加量增加,酶活性增加,添加量为15g/L时酶活性最高,继续增加蛋白胨浓度,酶活反而下降,因此确定蛋白胨添加量为15 g/L。固定蛋白胨添加量为15 g/L,改变牛肉粉添加量分别为1 g/L、2 g/L、3 g/L、4 g/L、10 g/L进行试验,结果如图4b所示,结果表明,牛肉粉添加量为2g/L效果较好,继续提高牛肉粉添加量至10 g/L,酶活增加不明显,因此,确定牛肉粉添加量为2g/L。
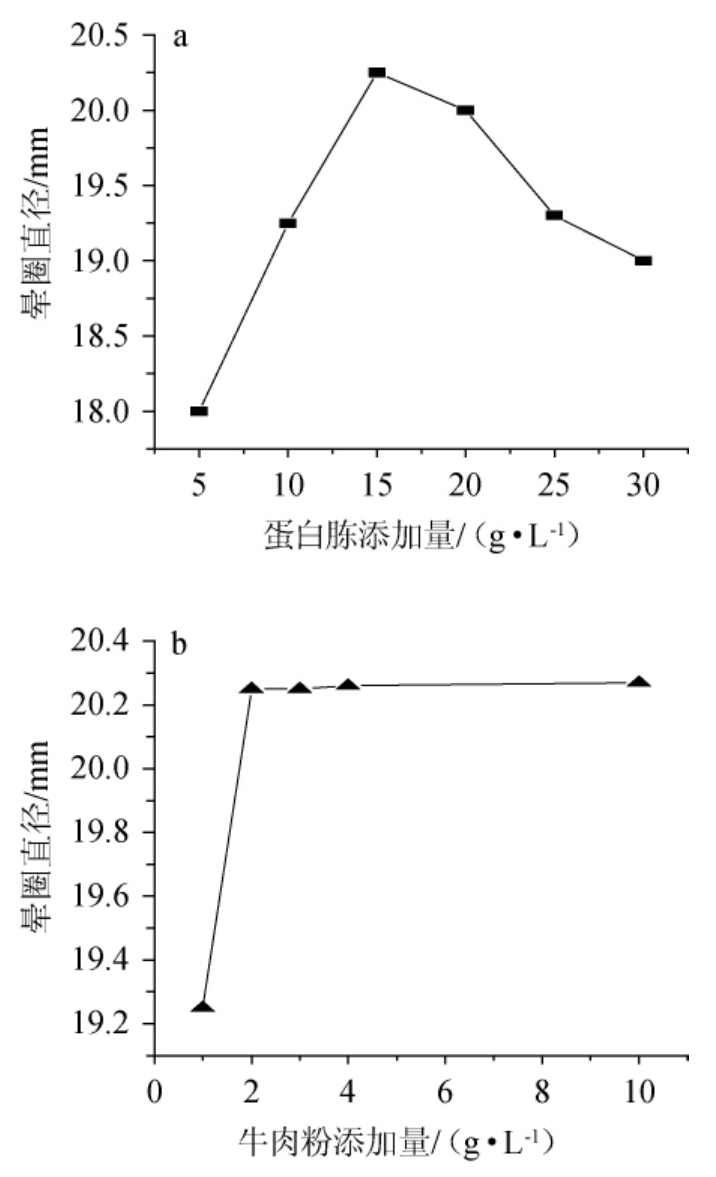
图4 氮源添加量对发酵产酶的影响
Fig.4 Effect of nitrogen source addition on enzyme production
2.1.3 无机盐种类及添加量对发酵产酶的影响
以20 g/L卵黄、15 g/L蛋白胨、2 g/L牛肉粉、3 g/L NaCl为基础培养基,改变无机盐的种类,设置其含量均为1.5 g/L,培养基初始pH7.0,接种量为2%,于36 ℃、200 r/min培养24 h,测定晕圈直径,结果见图5。由图5可知,添加1.5 g/L MgSO4·7H2O时发酵液中酶活力较好,而氯化钴对该菌产PLD有强烈抑制作用,添加1.5 g/L氯化钴时,发酵液中无酶活检出。
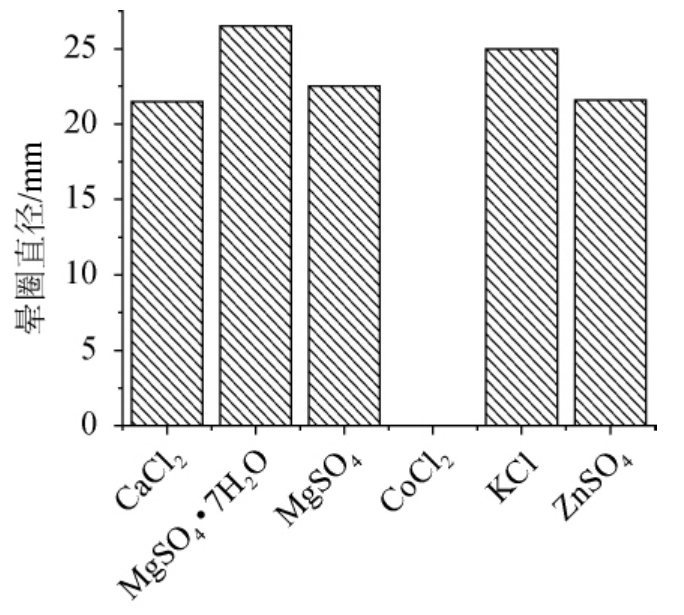
图5 不同无机盐种类对发酵产酶的影响
Fig.5 Effect of different inorganic salt on enzyme production
改变MgSO4·7H2O添加量分别为0、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L进行试验,结果见图6。由图6可知,MgSO4·7H2O添加量为2.0 g/L时,发酵液中酶活力较好。
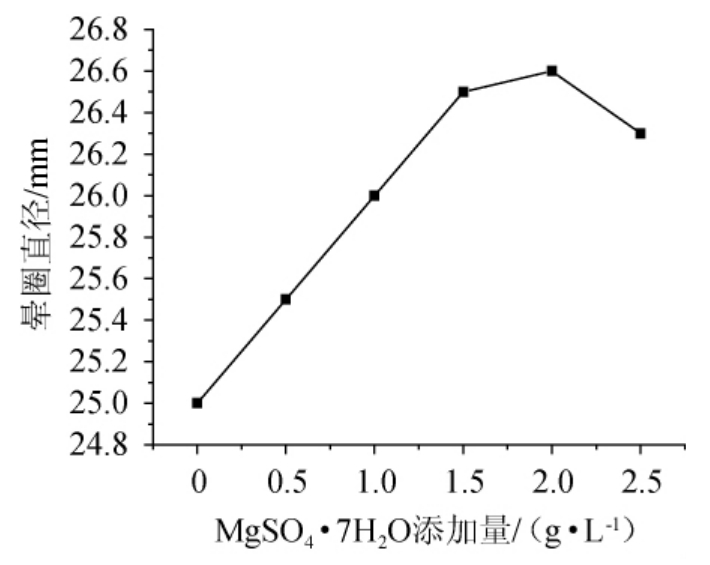
图6 无机盐添加量对发酵产酶的影响
Fig.6 Effect of MgSO4·7H2O concentration on enzyme production
2.1.4 表面活性剂及螯合剂对发酵产酶的影响
以20 g/L卵黄、15 g/L蛋白胨、2 g/L牛肉粉、3 g/L NaCl、2 g/L MgSO4·7H2O为基础培养基,按15 g/L的添加量加入不同的表面活性剂及螯合剂,培养基初始pH7.0,接种量为2%,于36 ℃,200 r/min培养24 h,测定酶活,结果见图7。由图7可知,表面活性剂对该菌产PLD有一定的抑制作用,加入金属螯合剂EDTA的摇瓶没有晕圈产生,说明EDTA对该菌产PLD有强烈的抑制作用,推测原因可能是PLD为金属酶,需要有金属离子参与才能合成。因此,培养基中不添加表面活性剂及螯合剂。

图7 表面活性剂及螯合剂对发酵产酶的影响
Fig.7 Effects of surfactant and chelating agents on enzyme production
2.1.5 培养基配方优化正交试验
在单因素试验的基础上,采用4因素3水平的正交表设计正交试验,进一步优化产酶条件,正交试验结果与极差分析及方差分析如表2和表3。
表2 培养基配方优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for medium formula optimization
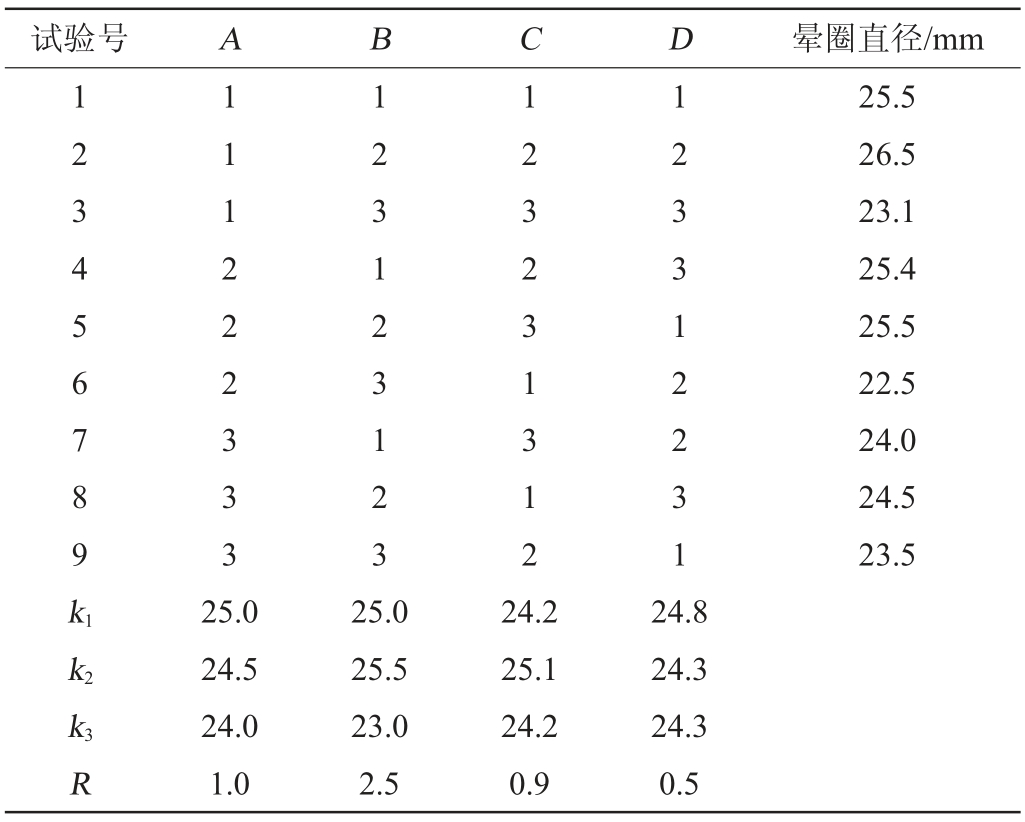
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
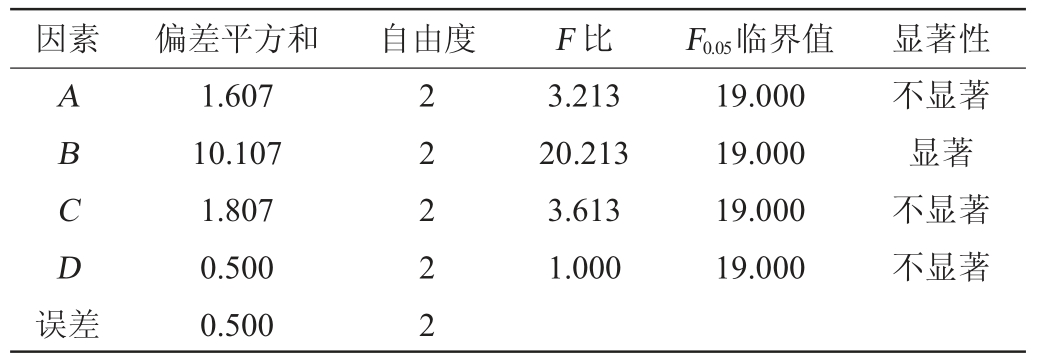
结果表明,蛋白胨含量对发酵产酶影响显著(P<0.05),其他因素影响不显著(P>0.05)。培养基优化最佳组合为A1B2C2D1,即培养基中卵黄添加量为10 g/L,蛋白胨添加量15 g/L,牛肉粉添加量2 g/L,MgSO4·7H2O添加量1 g/L。优化后的培养基组成为卵黄10 g/L、蛋白胨15 g/L、牛肉粉2 g/L、MgSO4·7H2O 1 g/L、氯化钠3 g/L。
2.2 培养条件对发酵产酶的影响
2.2.1 培养基初始pH对菌体生长及发酵产酶的影响
以优化后的培养基作为发酵培养基,培养基初始pH分别调至4.5、5.5、6.5、7.0、7.5、8.0、9.0、10.0,接种量2%,于36 ℃、200 r/min培养24 h,测定晕圈直径及菌体浓度,结果见图8。由图8可知,初始发酵pH5.5~6.5有利于菌体生长,但碱性范围有利于产酶,初始pH8.0时,产酶活力最高。
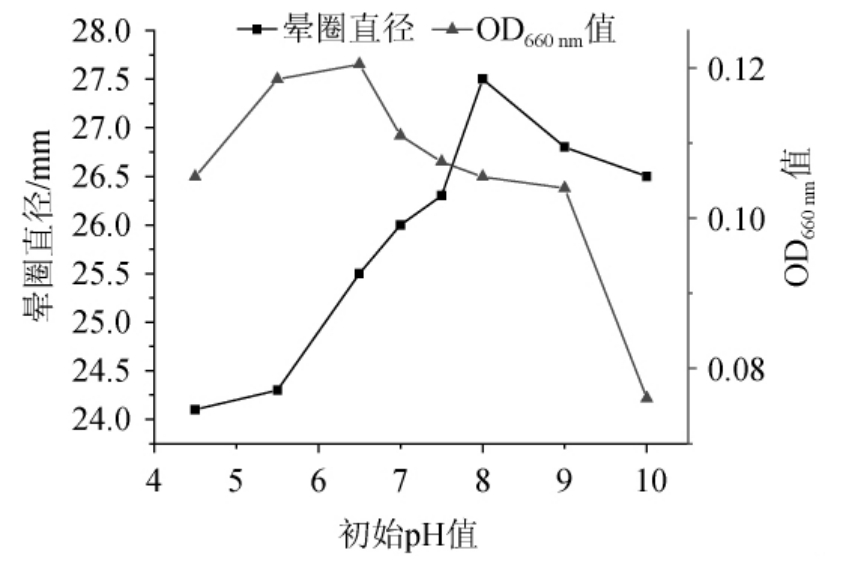
图8 初始pH值对菌体生长及发酵产酶的影响
Fig.8 Effect of pH on cell growth and enzyme production
2.2.2 培养时间对发酵产酶的影响
以优化后的培养基作为发酵培养基,初始pH8.0,接种量2%,于36 ℃、200 r/min分别培养不同的时间,测定发酵过程中不同时间条件下菌体浓度及晕圈直径,结果见图9。由图9可知,发酵初期(0~4 h)不产PLD,4 h以后开始产酶并于8 h达到最大,8 h后酶活力略有下降并趋于稳定。菌体浓度0~6 h增长较快,6~10 h增长缓慢,10~12 h增长较快,12 h后菌体浓度缓慢增长,22 h菌体浓度达到最大,之后开始下降。从菌体浓度变化曲线可以看出,PLD的产生对菌体生长不利,快速产酶期菌体浓度增长缓慢。以产酶量为目标,确定最佳培养时间为8 h。

图9 培养时间对菌体生长及发酵产酶的影响
Fig.9 Effect of incubation time on cell growth and enzyme production
2.2.3 培养温度对菌体生长及发酵产酶的影响
以优化后的培养基作为发酵培养基,培养基初始pH 8.0,接种量2%,分别置于28 ℃、32 ℃、36 ℃、42 ℃,200 r/min培养8 h,测定晕圈直径及菌体浓度,结果见图10。由图10可知,发酵温度低有利于菌体生长,温度为28 ℃时菌体生长良好,但温度升高有利于产酶,其中36 ℃时发酵产酶较好,42 ℃发酵产酶略有下降,所以选36 ℃作为培养温度。
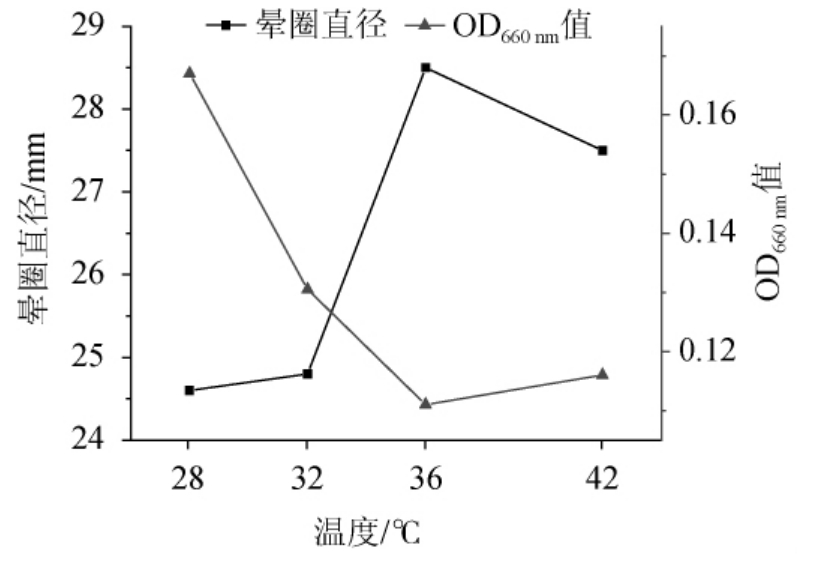
图10 培养温度对菌体生长及发酵产酶的影响
Fig.10 Effect of incubation temperature on cell growth and enzyme production
2.2.4 接种量对发酵产酶的影响
以优化后的培养基作为发酵培养基,培养基初始pH 8.0,接种量分别为0.5%、1.0%、2.0%、3.0%、4.0%,于36 ℃、200 r/min培养8 h,测定晕圈直径及菌体浓度,结果见图11。由图11可知,随着接种量的增加,酶活力刚开始是增加的,接种量为1.0%时酶活力达到最高,继续提高接种量,产酶活力迅速下降;菌体浓度随着接种量的增加,一开始也是增加的,接种量3.0%时菌体浓度最高,随后略有下降。以产酶量为目标,确定接种量为1.0%。
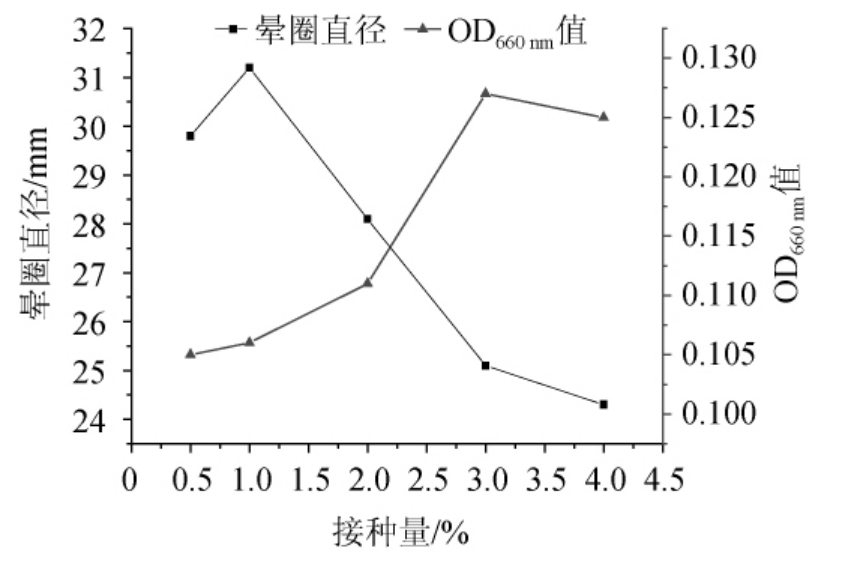
图11 接种量对发酵产酶的影响
Fig.11 Effect of inoculum on enzyme production
3 结论
该研究对蜡样芽孢杆菌产PLD发酵条件进行了优化,通过单因素和正交试验确定培养基最佳组成为卵黄10 g/L、蛋白胨15 g/L、牛肉粉2 g/L、MgSO4·7H2O 1 g/L、氯化钠3 g/L。最适培养条件为培养基初始pH8.0,接种量1.0%,于36 ℃、200 r/min培养8 h。在最适发酵条件下进行3批试验,采用酶联比色法测PLD活力,平均酶活达到4.21 U/mL,具有发酵周期短,产酶速度快的特点,为磷脂酶D工业化生产和应用奠定基础。
[1]WAITE M.The PLD super family:insights into catalysis[J].Biochim Biophys Acta,1999,1439:187-197.
[2]ULBRICH-HOFMANN1 R,LERCHNER A,OBLOZINSKY M,et al.Phospholipase D and its application in biocatalysis[J].Biotechnol Lett,2005,27(8):535-544.
[3]刘峻屹,刘炎峻,李兆杰,等.磷脂酰果糖的合成方法研究[J].中国油脂,2017,42(12):99-102.
[4]SONG S,CHEONGB L Z,KRISTENSEN K,et al.Phospholipase D(PLD)catalyzed synthesis of phosphatidyl-glucose in biphasic reaction system[J].Food Chem,2012,135(2):373-379.
[5]CHOOJIT S,BORNSCHEUER U T,UPAICHIT A,et al.Efficient phosphatidylserine synthesis by a phospholipase D from Streptomyces sp.SC734 isolated from soil-contaminated palm oil[J].Eur J Lipid Sci Technol,2016,118(5):803-813.
[6]张芹.酶法合成富含n-3 PUFA 的磷脂酰丝氨酸的研究[D].青岛:中国海洋大学,2015.
[7]钱娟,庞洋,王昕.磷脂酶D 的制备及催化磷脂酰胆碱合成磷脂酰丝氨酸[J].中国油脂,2017,42(9):66-71.
[8]杜阳吉.磷脂酶D 单一水相法催化合成磷脂酰丝氨酸工艺研究[J].中国食品添加剂,2015(2):113-117.
[9]张梁,吴斌.一种PLD 的生产方法:CN101182498A[P].2008-05-21.
[10]LIM S K,CHOI J W,CHUNG M H,et al.Production and characterization of extracellular phospholipase D from Streptomyces sp.YU100[J].J Microbiol Biotechn,2002,12(2):189-195.
[11]HATANAKA T,NEGISHI T,KUBOTA-AKIZAWA M,et al.Purification,characterization,cloning and sequencing of phospholipase D from Streptomyces septatus TH-2[J].Enzyme Microb Technol,2002,31(3):233-241.
[12]SHIMBO K,YANO H,MIYAMOTO Y.Purification and properties of phospholipase D from Streptomyces lydicus[J].Agr Biol Chem,2014,2(11):1946-1948.
[13]DAMNJANOVIC′ J,IWASAKI Y.Phospholipase D as a catalyst:Application in phospholipid synthesis,molecular structure and protein engineering[J].J Biosci Bioeng,2013,116(3):271-280.
[14]代书玲,张江,商军.PLD 高效产生菌的筛选及鉴定[J].江苏农业科学,2013,41(3):309-311.
[15]石创,张薇,王一丁.磷脂酶D 产生菌株的筛选及其转磷脂化反应特性[J].四川大学学报(自然科学版),2016,53(1):215-220.
[16]董丹,蒋丽,关统伟,等.豆瓣中产磷脂酶菌株的筛选及系统发育分析[J].中国酿造,2015,34(3):44-47.
[17]韩海霞,曹栋,史苏佳,等.链霉菌CA-1 产磷脂酶D 发酵条件的优化[J].食品工业科技,2014,35(13):176-180.
[18]郭浩.磷脂酶D 高产菌株的选育及发酵条件优化[D].西安:西北大学,2007.
[19]赵紫薇.色褐链霉菌产磷脂酶D 的发酵条件优化及诱变育种研究[D].郑州:河南工业大学,2010.
[20]刘菲菲,张梁,顾正华,等.蜡状芽孢杆菌磷脂酶C 基因在大肠杆菌中的异源表达[J].食品科学,2013,34(11):182-187.
[21]胡博新,顾鸽青,朱裕辉,等.链霉菌磷脂酶D 的分离纯化及部分酶学性质[J].中国医药工业杂志,2008,39(9):655-658.