蛹虫草(Cordyceps militaris)又称北冬虫夏草、北虫草、蚕蛹草、东北虫草等,属于子囊菌门(Ascomycota)、麦角菌目(Clavicipitales)、麦角菌科(Clavicinitaccac)、虫草属(Cordyceps)[1]。蛹虫草由子实体与菌核两部分构成,在自然条件下生长主要包括虫草菌丝体和子实体的生长,通过孢子对昆虫幼虫的感染,使孢子分裂产生菌丝体并且昆虫本身作为营养物质提供其生长所需营养,在昆虫的体外进行发育和分化菌丝形成子座[2]。蛹虫草作为一种名贵的中药材,含有丰富的生物活性物质,如虫草酸、虫草素、多糖、超氧化物歧化酶(superoxide dismutase,SOD)、蛋白质和氨基酸等[3-4]。其中虫草酸是蛹虫草主要活性成分之一,其能抑制各种病菌的成长,可预防与治疗脑血栓、脑出血、心肌梗塞、长期衰竭。虫草酸含量的高低是衡量蛹虫草质量的主要标准之一,一般认为虫草酸含量高的虫草的药用价值高[5]。
目前关于产虫草酸蛹虫草菌株的研究较少,万琴等[6]采用摇瓶培养的方法,通过单因素和正交试验,以生物量和虫草酸含量为评价指标,确定了蛹虫草液体培养的最佳培养基配方和培养条件;雷帮星等[7]采用静置培养实验方法培养虫草菌株,测定虫草多糖和虫草酸的产量,获得了培养基最优组合和最佳培养工艺参数;刁朝强等[8]采用大米米饭固体培养基培养出蛹虫草子实体并进行了培养工艺的优化,结果发现子实体中的虫草素含量明显高于培养基中虫草素的含量;马婕馨等[9]以4种蛹虫草菌株为研究对象,以生物量和SOD活性为指标,筛选出SOD高活性菌株,并对发酵条件进行了优化,使发酵液中的SOD活性得到显著提高。有研究表明,通过液态培养得到的蛹虫草菌丝体有效成分与蛹虫草子实体相同[10],且培养条件对发酵产物的形成产生有重要的影响,合理的培养工艺参数将大大提高培养液中生物活性物质的生成。
本试验采用组织分离育种法从蛹虫草中分离筛选高产虫草酸的菌株,通过分子生物学技术对其进行鉴定,并采用响应面试验优化其产虫草酸的条件,为蛹虫草液体深层发酵的工业化生产应用的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
蛹虫草子实体:四川绵阳市食用菌研究所。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[11]:土豆200g/L、葡萄糖20 g/L、蛋白胨20 g/L、K2HPO41 g/L、MgSO4·7H2O 1 g/L、维生素B1(vitamin B1,VB1)0.01 g/L、琼脂20 g/L,pH自然。121 ℃高压蒸汽灭菌20 min,冷却至80 ℃左右后加入质量浓度为50μg/mL的硫酸链霉素和青霉素钠。
种子和发酵培养基[12]:土豆200 g/L、葡萄糖20 g/L、蛋白胨10 g/L、K2HPO41 g/L、MgSO4·7H2O 1 g/L、VB10.01 g/L,初始pH6.0,121 ℃高压蒸汽灭菌20 min。
1.1.3 化学试剂
葡萄糖、蛋白胨、酵母浸出粉、琼脂粉(均为生化试剂):北京奥博生物技术有限责任公司;MgSO4·7H2O、KH2PO4(均为分析纯):天津市北晨方正试剂厂;硫酸链霉素、青霉素钠(均为分析纯):南京奥多福尼生物科技有限公司;醋酸铵、冰醋酸、乙酰丙酮、高碘酸钾、L-鼠李糖、浓盐酸、无水乙醇(均为分析纯):重庆川东化工(集团)有限公司;虫草酸(分析纯):上海士锋科技有限公司;真菌DNA提取试剂盒:美国Omega公司;聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒:杰瑞生物工程(上海)有限公司。
1.2 仪器与设备
ME204E电子天平:梅特勒-托利多仪器有限公司;Y60立式压力蒸汽灭菌锅:宁波久兴医疗器械有限公司;SW-CG-1F型超净工作台:苏州苏洁净化设备有限公司;DK-S28恒温培养箱、DHG-9015A电热鼓风干燥箱:上海一恒科学仪器有限公司;HH-4数显恒温水浴锅:江苏省金坛市环宇科学仪器厂;HZQ-2全温振荡器:江苏金怡仪器科技有限公司;T100型PCR仪:杭州博日科技有限公司;GelDoc 2000凝胶成像系统:美国Bio-rad公司;UV-3300(PC)紫外可见分光光度计:上海凌析仪器有限公司;TGL16M离心机:上海赫田科学仪器有限公司。
1.3 试验方法
1.3.1 菌株的分离、纯化
采用组织分离育种法[13]对蛹虫草中的菌株进行分离纯化。先用蒸馏水冲洗蛹虫草的菌核表面、子座头及子座柄,在超净工作台里用0.1%升汞浸泡1~2 min,再用无菌水冲洗蛹虫草表面以除掉多余的升汞并用滤纸吸干表面的水分。将蛹虫草子实体各个部分用无菌小刀分割成1 mm3的立方小块,用镊子把蛹虫草子实体的小块组织转移到PDA培养基上,于23~25 ℃条件下进行培养。用灭菌的接种环挑取萌发的菌丝体,在PDA培养基上进行划线培养至单菌落。挑取单菌落接种于PDA试管斜面培养基中,于23~25 ℃条件下培养,待菌丝体长满试管后存放于4 ℃冰箱。
1.3.2 菌株的筛选
用接种针从试管斜面培养基中挑取约1 cm2的菌块接种于种子培养基,于25 ℃、130 r/min条件下培养86 h作为种子液。将种子液以8%(V/V)的接种量接种于发酵液体培养基,于25 ℃、150 r/min条件下发酵72 h,采用分光光度法[14]测量菌液中虫草酸的含量,筛选出虫草酸高产菌株。
1.3.3 菌株的鉴定
参照文献[15-16]提取菌株的脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用ITS通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对菌株的ITS序列进行PCR扩增。PCR扩增体系:10×Buffer 2.5 μL,25 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)2 μL,MgCl22 μL,10 μmol/L正向引物0.5 μL,10 μmol/L反向引物0.5 μL,5 U/μL EX Taq酶0.5 μL,DNA模板0.3 μL,双蒸水(ddH2O)16.7 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性45 s,53 ℃退火50 s,72 ℃延伸90 s,共35个循环;72 ℃再延伸10 min。PCR扩增产物用1.2%琼脂糖凝胶进行检验,采用PCR扩增产物纯化试剂盒进行产物回收、纯化后送至上海生工有限公司进行测序。测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST同源性比对,选取同源性较高的模式菌株的ITS序列,采用MEGA 6.0中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 菌株产虫草酸培养条件优化单因素试验
挑取面积为1 cm2左右的菌苔接种于种子培养基,装液量为90 mL/250 mL,在25 ℃、150 r/min条件下发酵培养72 h。将种子液按10%的接种量接种到发酵培养基,装液量80 mL/250 mL,24 ℃、150 r/min条件下培养72 h。在此基础上,采用单因素轮换法依次考察接种量(6%、8%、10%、12%、14%、16%)、初始pH值(4.0、5.0、6.0、7.0、8.0、9.0)、培养温度(18 ℃、21 ℃、24 ℃、27 ℃、30 ℃、33 ℃)、转速(130 r/min、140 r/min、150 r/min、160 r/min、170 r/min、180 r/min)4个因素对菌株产虫草酸的影响。采用分光光度法[14]测定培养液中虫草酸的含量,平行试验3次,确定菌株产虫草酸的最佳培养条件。
1.3.5 菌株产虫草酸培养条件优化响应面试验
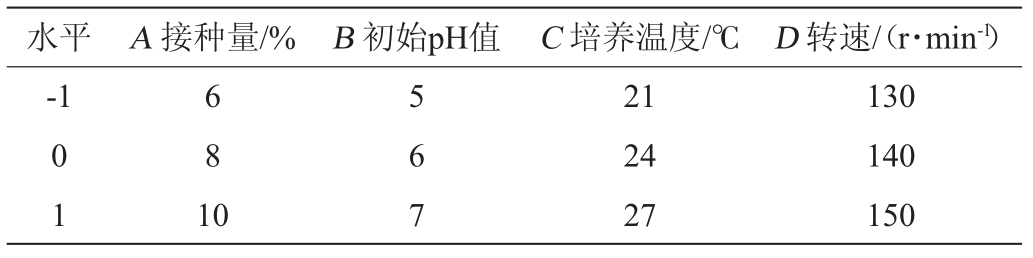
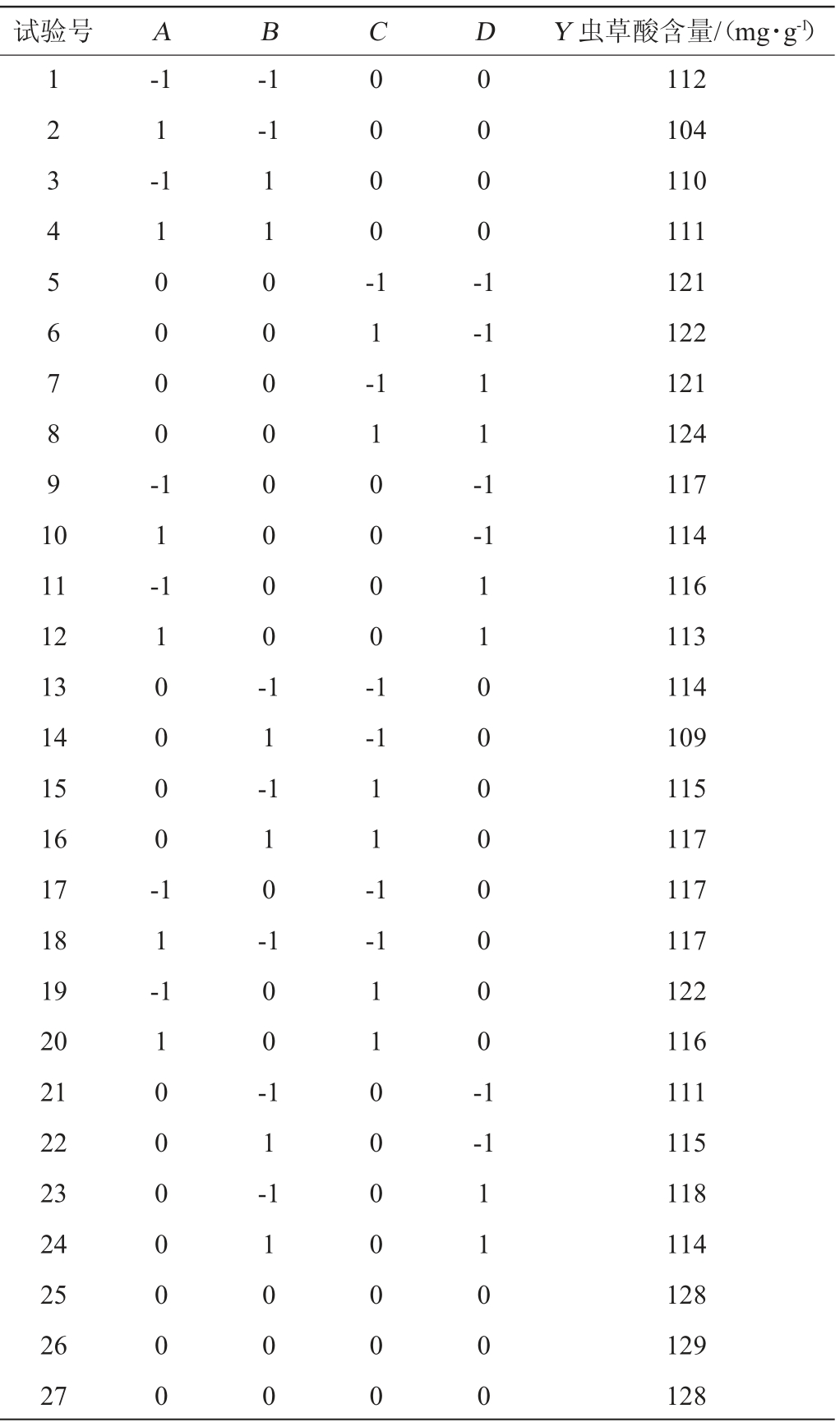
在单因素试验结果的基础上,以接种量(A)、初始pH值(B)、培养温度(C)和转速(D)为考察因素,虫草酸含量(Y)为评价指标,采用Box-Behnken响应面试验设计法[17-21]进行4因素3水平优化试验,其因素与水平见表1。
表1 菌株产虫草酸培养条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for culture conditions optimization of cordycepic acid-producing strain
1.3.6 数据统计与分析
运用Design-Expert(Version 8.0.6)软件对数据进行回归拟合,作出响应曲面图,并进行线性回归和方差分析。
2 结果与分析
2.1 菌株的分离筛选结果
通过组织分离育种法从蛹虫草子实体中分离得到6株菌株,根据6株真菌的虫草酸产量筛选得到一株产白色绒毛状菌丝的高产虫草酸蛹虫草菌株YCC-1,其培养液中虫草酸含量为101.83 mg/g。
2.2 菌株YCC-1的分子生物学鉴定结果
通过PCR扩增获得菌株YCC-1的ITS基因序列,其碱基长度为568 bp。将测序结果提交至NCBI,采用MEGA 6.0中的NJ法构建系统发育树,结果见图1。由图1可知,菌株YCC-1与蛹草拟青霉(Paecilomyces militaris)聚于同一分支,其序列同源性为98%。因此,将菌株YCC-1鉴定为蛹草拟青霉菌(Paecilomyces militaris)。

图1 基于ITS序列菌株YCC-1的系统发育树
Fig.1 Phylogenetic tree of strain YCC-1 based on ITS sequences
2.3 菌株YCC-1产虫草酸培养条件优化单因素试验
2.3.1 接种量对菌株YCC-1产虫草酸的影响
不同接种量对菌株YCC-1产虫草酸的影响结果见图2。
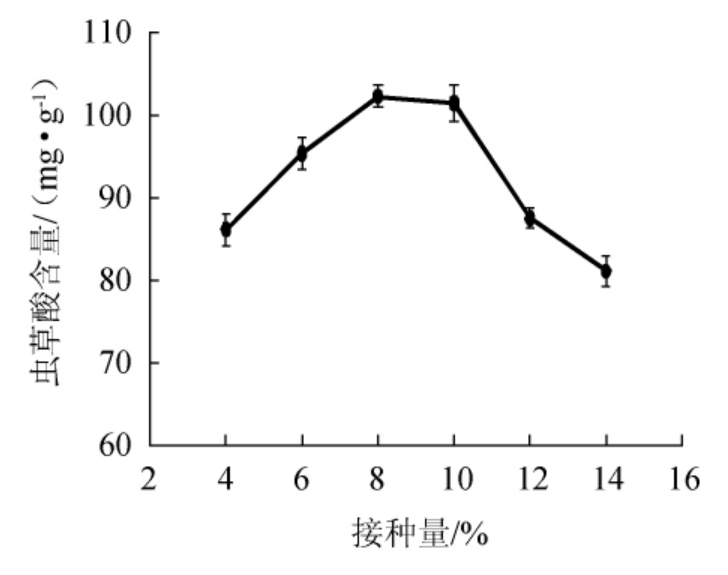
图2 不同接种量对菌株YCC-1产虫草酸的影响
Fig.2 Effect of different inoculum on cordycepic acid production by strain YCC-1
由图2可知,当接种量为4%~8%时,虫草酸含量随接种量的增加而增加;当接种量为8%时,虫草酸含量达到最大,为102.33 mg/g;当接种量>10%之后,随着接种量的增加,虫草酸含量大幅减少。分析原因可能是当接种量过小时,在发酵终点,培养基中所添加的营养物质没有被完全利用,降低了利用率;当接种量过大时,还未到发酵终点,培养基中的营养物质不能够支撑菌体代谢产物的生成。因此,确定最佳接种量为8%。
2.3.2 初始pH值对菌株YCC-1产虫草酸的影响
不同初始pH值对菌株YCC-1产虫草酸的影响结果见图3。
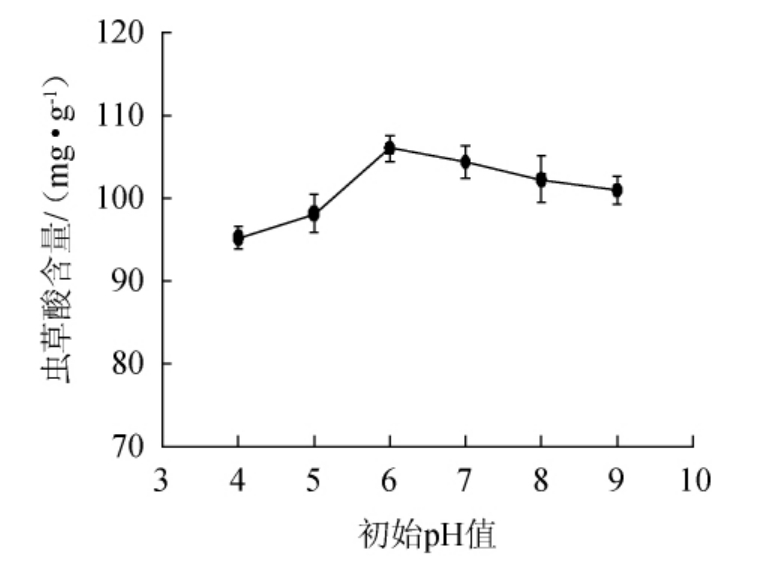
图3 不同初始pH值对菌株YCC-1产虫草酸的影响
Fig.3 Effect of different initial pH on cordycepic acid production by strain YCC-1
由图3可知,当初始pH值为4.0~6.0时,虫草酸含量随初始pH值的升高而升高;当初始pH值为6.0时,虫草酸含量达到最大,为106.15 mg/g;当初始pH值>6.0之后,虫草酸含量逐渐减少。分析原因可能是随着pH值过高或过低,都不利于蛹虫草菌丝体的生长和生物活性物质的生成,并影响虫草酸的含量。因此,确定最佳初始pH值为6.0。
2.3.3 发酵温度对菌株YCC-1产虫草酸的影响
蛹虫草属于中低温生长菌,菌丝体的萌发温度为20~23 ℃,较高的温度会影响蛹虫草的正常代谢活动,而较低的温度又不利于蛹虫草菌丝体的形成和生物活性物质的产生,因此,维持发酵过程中适宜菌体生长代谢的温度具有重要意义[17]。不同发酵温度对菌株YCC-1产虫草酸的影响结果见图4。

图4 不同发酵温度对菌株YCC-1产虫草酸的影响
Fig.4 Effect of different fermentation temperature on cordycepic acid production by strain YCC-1
由图4可知,在不同的发酵温度下,菌株YCC-1的生长情况差别很大。当发酵温度为18~24 ℃时,虫草酸含量随着发酵温度的升高而增大;当发酵温度为24 ℃时,虫草酸含量最高,为123.3 mg/g;当发酵温度>24 ℃之后,虫草酸含量逐渐降低,表明适当提高温度会加速菌丝体的生长,并有利于虫草酸分子转移到培养液中,但温度过高会抑制菌丝体的生长和影响虫草酸的含量。因此,确定菌株YCC-1的最佳发酵温度为24 ℃。
2.3.4 转速对菌株YCC-1产虫草酸的影响
转速对菌株YCC-1产虫草酸的影响结果见图5。
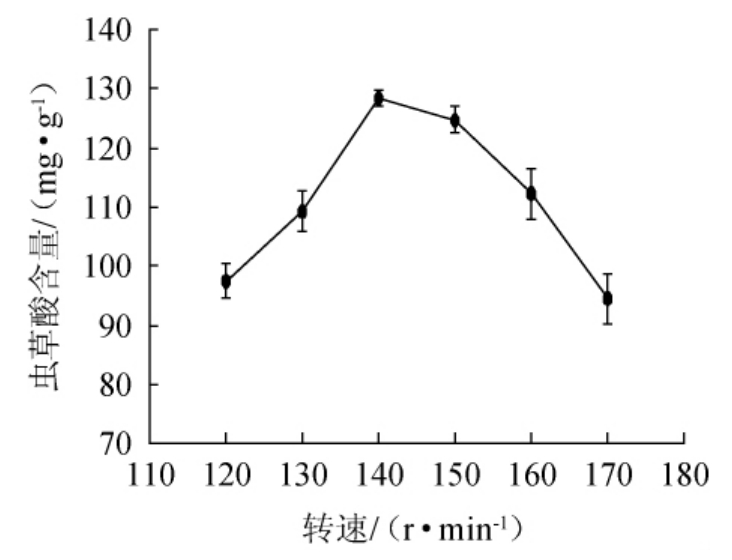
图5 转速对菌株YCC-1产虫草酸的影响
Fig.5 Effect of rotational speed on cordycepic acid production by strain YCC-1
蛹虫草的液体发酵属于好氧发酵,适当的摇床转速可以增加发酵液中的溶氧量,促进菌丝体的生长。由图5可知,当转速为140 r/min时,虫草酸含量达到最大,为127.4 mg/g;当转速<140 r/min之前,随着摇床转速的增大,虫草酸含量较快增加;当转速>140 r/min之后又较快下降,说明不同摇床转速对发酵液虫草酸生成影响较大。综合考虑,选择发酵摇床转速为140 r/min。
2.4 菌株YCC-1产虫草酸培养条件优化响应面试验
2.4.1 响应面试验设计及结果
在单因素试验的基础上,选取接种量(A)、初始pH值(B)、培养温度(C)、转速(D)为考察因素,以虫草酸含量(Y)为响应值,利用Minitab软件进行Box-Behnken试验设计,试验设计及结果见表2。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
2.4.2 回归方程的建立及显著性分析
利用Design-Expert 8.06软件对表2的试验结果进行多元回归拟合,得到二次多项回归方程:Y=129.33-1.58A+0.17B+1.42C+0.50D+2.25AB-1.50AC+1.75BC-2.00BD+0.050CD-8.96A2-11.33B2-3.21C2-4.33D2
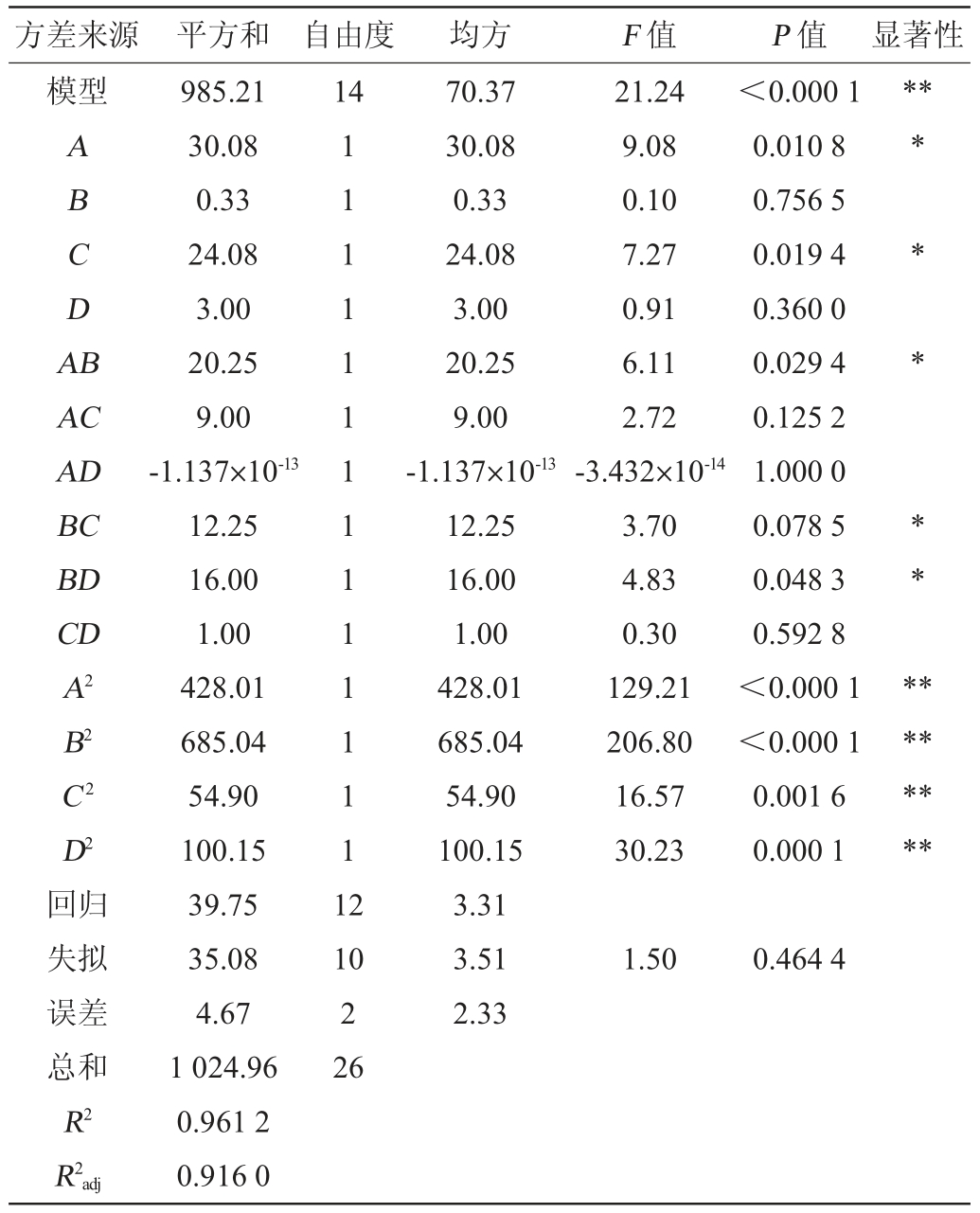
对该模型进行方差分析,结果见表3。
表3 回归模型的方差分析
Table 3 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由表3可知,回归模型P值为0.000 1<0.01,极显著;失拟项P值为0.464 4>0.05,不显著,表明该模型可靠。该模型的决定系数R2=0.961 2,说明该模型能解释96.12%响应值的变化,校正决定系数R2adj=0.916 0,说明该模型拟合程度较好[18],试验误差较小,因此,可用此模型对菌株YCC-1产虫草酸的培养条件进行分析和预测。
通过方差分析[19]可知,影响菌株YCC-1产虫草酸的因素的主次顺序为A>C>D>B,即接种量>培养温度>转速>初始pH值,与前面的单因素试验结果有一定的差异,可能是在响应面优化试验过程中,由于发酵工艺和单因素试验条件差异较大,使影响菌株产虫草酸的因素发生变化。模型的一次项A、C、交叉项AB、BC、BD对结果影响显著(P<0.05),二次项A2、B2、C2、D2对结果影响极显著(P<0.01),其他项对结果影响均不显著(P>0.05)。
2.4.3 响应面分析
各个因素间的交互作用对菌株YCC-1产虫草酸的影响的响应曲面及其等高线见图5。
等高线的形状反映出交互效应的强弱大小,圆形表示两因素间交互作用不显著,而椭圆形则与之相反[20]。由图5可知,接种量、初始pH值、培养温度和转速间的交互作用对菌株YCC-1产虫草酸的影响的响应面均呈抛物面型,说明所得到的响应面都存在一个极大值点,其中接种量、转速、培养温度分别与初始pH值的交互作用的等高线呈椭圆形,对结果影响显著(P<0.05),与方差结果分析一致。

图5 接种量、初始pH值、培养温度、转速对菌株YCC-1产虫草酸的影响的响应面和等高线
Fig.5 Response surface plots and contour lines of effects of inoculum,initial pH,culture temperature and rotational speed on cordycepic acid production by strain YCC-1
经过响应面优化,根据二次多项回归方程得到理论上菌株YCC-1产虫草酸的最佳培养条件:接种量7.78%、初始pH值6.01、培养温度24.76 ℃、转速140.7 r/min,在此最优条件下,虫草酸含量的理论值为129.62 mg/g。考虑到实际操作的可行性,将上述最优条件修订为接种量7.8%、初始pH值6.0、培养温度25 ℃、摇床转速140 r/min。
2.4.4 验证试验
为了验证该模型的有效性及实用性,在此最佳提取条件下对该模型做3次验证试验,结果测得虫草酸含量为132.65 mg/g,与预测结果基本一致,因此,该模型能较好地预测该菌株的实际培养状况。
3 结论
本研究以蛹虫草子实体为研究对象,采用组织分离法从中分离得到一株高产虫草酸的菌株YCC-1,通过分子生物学技术鉴定其为蛹草拟青霉(Paecilomyces militaris)。通过单因素及响应面试验优化得到菌株YCC-1产虫草酸的最佳培养条件为接种量7.8%、初始pH值6.0、培养温度25 ℃、摇床转速140 r/min。在此最优条件下,虫草酸含量可达到132.65 mg/g,较优化前提高了22.86%,为该菌株的深层发酵试验研究和工业化应用奠定了良好的基础。
[1]蒋永红,张晓峰,韩萍,等.杂粮蛹虫草菌丝共生体中虫草酸的优化提取及含量测定[J].河南工业大学学报(自然科学版),2017,38(6):88-93.
[2]STENSRUD Ø,HYWEL-JONES N L,SCHUMACHER T.Towards a phylogenetic classification of Cordyceps:ITS nrDNA sequence data confirm divergent lineages and paraphyly[J].Mycol Res,2005,109(1):41-56.
[3]陈俐彤,曹红峰,黄文芳.蛹虫草的化学成分、药效及应用[J].现代食品科技,2005,21(3):192-197.
[4]李楠,龚长虹,张宏.北冬虫夏草人工栽培技术研究及保健品研制[J].长春师范学院学报,2001,20(1):36-37.
[5]万琴,刘向阳,王松涛,等.蛹虫草液体发酵及其应用的研究进展[J].食品与发酵科技,2016,53(1):88-91.
[6]万琴,丁海龙,刘兴平,等.蛹虫草液体培养优化研究[J].食品与发酵科技,2016,52(3):46-50.
[7]雷帮星,康冀川,何劲,等.培养条件对粉被虫草菌株产虫草多糖及虫草酸的影响[J].西南农业学报,2017(9):1964-1968.
[8]刁朝强,文庭池,廖勇,等.蛹虫草固体培养产子实体条件的优化及其虫草素含量测定[J].山地农业生物学报,2017(6):86-89.
[9]马婕馨,蔡程山,高苏,等.蛹虫草SOD 高活性菌株筛选及液体培养条件优化[J].食品工业科技,2019(1):2-10.
[10]邵颖,李文,王陶,等.蛹拟青霉发酵菌丝体中虫草酸的提取与测定[J].食品工业科技,2012(1):262-264,267.
[11]李翠新,张国庆.野生蛹虫草的分离与高产菌株的筛选[J].中国食用菌,2007,26(2):20-21.
[12]柴建萍,白兴荣.不同蛹虫草菌株比较试验与筛选[J].云南农业科技,2003(1):27-28.
[13]郭俊霞,李青苗,王晓宇,等.北虫草子实体组织分离菌丝生长比较研究[J].时珍国医国药,2015(7):1759-1760.
[14]邵颖,李文,王陶.蛹拟青霉发酵菌丝体中虫草酸的提取与测定[J].食品工业科技,2012,33(1):262-265.
[15]LU L,LI J L,CANG Y H.PCR-based sensitive detection of medicinal fungi Hericium species from ribosomal internal transcribed spacer (ITS)sequences[J].Biol Pharm Bull,2002,25(8):975-980.
[16]张秀娟,季宇彬.真菌多糖的免疫药理作用的研究[J].哈尔滨商业大学学报,2002,18(1):63-65.
[17]杜双田,周锋利,陈德育.温度对蛹虫草生长的影响[J].西北农林科技大学学报(自然科学版),2007(5):46-50.
[18]钟宝,李凤林,张传军.软枣猕猴桃玫瑰醋发酵条件响应面法优化[J].中国酿造,2016,35(2):88-91.
[19]JIA J,YANG X,WU Z.Optimization of fermentation medium for extracellular lipase production from Aspergillus niger using response surface methodology[J].Biomed Res Int,2015,2015:497462.
[20]LU J,ZHOU C,RONG O,et al.Optimization of microwave-assisted extraction of flavonoids from Cryptotaenia japonica Hassk.using response surface methodology[J].Adv J Food Sci Technol,2013,5(3):310-317.