酯酶也称羧基酯酶,指能够水解羧酯键的酶类,功能与脂肪酶类似,在酶学上并无酯化酶这一术语,由于该酶具有合成与分解酯类的催化作用,因此在白酒行业内通常称之为酯化酶和酯分解酶[1-2]。
在自然界中能产生酯酶的微生物是非常丰富的,其中霉菌作为白酒中重要的产酯微生物[3-5],其分泌的酯化酶能催化乳酸菌代谢产生的乳酸和酵母酒精发酵产生的乙醇酯化合成乳酸乙酯。乳酸乙酯是白酒中重要的呈香成分[6],对白酒品质具有重要作用,乳酸乙酯含量高是我国白酒的显著特征之一[7],并且乳酸乙酯作为能与水和乙醇互溶的唯一的乙酯类,在水味重酒味淡薄的酒中,还能消除酒的水味,增加浓厚感[8]。当今研究发现在白酒生产中中乳酸乙酯的合成相较于酶催化,主要以化学合成为主[9-10],并其合成速度非常缓慢。而近年来随着清洁化生产的推进[11],出现了基酒中乳酸乙酯含量不足的问题,因此需要迫切寻找一种白酒专用高产乳酸乙酯酯化酶菌株应用于白酒生产中,提高白酒的质量,降低生产成本。目前国内对于产乳酸乙酯酯化酶菌株的研究较少,大多数还是通过一些常用的工业菌株红曲霉,根霉进行研究[12-14],相反对于己酸乙酯酯化酶的研究很多[15],并将其广泛应用于浓香型白酒的增香与调味酒中[16]。
常压室温等离子体(atmospheric pressure room temperature plasma,ARTP)作为一种操作简便,对人与环境均无害,突变率高的诱变技术[17],已广泛应用于细菌、霉菌、酵母、放线菌等微生物的诱变育种[18-20],均取得较好成果。有文献报道,ARTP诱变成功筛选出一株高产己酸乙酯酯化酶的枯草芽孢杆菌(Bacillus subtilis)[21],但国内外对于乳酸乙酯酯化酶菌株的筛选和诱变研究较少,并且酯化酶筛选存在对底物专一性不足的问题。因此,本研究通过对多株霉菌乳酸乙酯合成量的比较,通过常压室温等离子体诱变,并采用多级筛选体系,筛选出一株酶活明显提高的突变株,应用于白酒的生产,旨在提升白酒品质。
1 材料与方法
1.1 材料与试剂
1.1.1 化学试剂
乳酸、乙醇(均为分析纯):天津市永大化学试剂有限公司;三丁酸甘油酯(分析纯):天津市天力化学试剂有限公司。
1.1.2 菌种
紫色红曲霉(Monascus purpureus)M16、烟色红曲霉(Aspergillus fumigatus)M6、根霉(Rhizopus)Q303、华根霉(Rhizopus chinensis)R3、米曲霉(Aspergillus oryzae)A12、黑曲霉(Aspergillus niger)T103:由天津市工业微生物重点实验室保存。
1.1.3 培养基
一级平板筛选培养基采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)固体培养基:土豆200 g(去皮),葡萄糖20 g,琼脂25 g,蒸馏水1 000 mL;乳化液:将19 mL 3%的聚乙烯醇溶液与1 mL三丁酸甘油酯充分混合;将PDA固体培养基和乳化液按4∶1的体积比混合,pH自然。121 ℃灭菌20 min。
PDA液体培养基:土豆200 g(去皮),葡萄糖20 g,蒸馏水1 000 mL。121 ℃灭菌20 min。主要用于菌种活化和诱变前菌种萌发。
PDA固体斜面培养基:土豆200 g(去皮),葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL。121 ℃灭菌20 min。主要用于突变株的保藏。
麸曲固体培养基:
①试管培养(一级种):称取一定量的麸皮,加水65%左右,拌匀后分装试管,厚度为2.0 cm,121 ℃灭菌20 min。
②三角瓶培养(二级种):称取一定量的麸皮,加水80%,充分拌匀,装入500 mL三角瓶内,厚度为2.0 cm,121 ℃灭菌20 min。
1.2 仪器与设备
EL20实验室pH计:梅特勒仪器(上海)有限公司;DHP恒温培养箱:上海智诚分析仪器制造有限公司;BXW-360SD-G立式压力灭菌锅:上海博讯实业有限公司;TS-2402CL恒温摇床:上海捷呈实验仪器有限公司;Agilent 7890B气相色谱仪:美国安捷伦科技公司;ARTP-IIS常压室温等离子诱变仪:北京思清源生物科技有限公司。
1.3 实验方法
1.3.1 纯种麸曲的培养
将灭菌的一级麸曲试管接种烟色红曲霉M6、紫色红曲霉M16、Q303根霉、华根霉R3、米曲霉A12、黑曲霉T103孢子,置于30 ℃培养48 h,菌丝体遍布麸皮,置于37 ℃培养箱烘干,振荡打散即为一级种子。待冷却后将一级种子接入三角瓶麸皮培养基中,充分摇匀,30 ℃培养40 h,待菌丝体布满并将麸皮连成饼状时进行扣瓶,使麸皮脱离底部继续培养1 d,即可出瓶。出瓶后置于牛皮袋内,于37~40 ℃快速烘干(含水量<12%),充分打散并保存。
1.3.2 乳酸乙酯酯合成量的测定
吸取1 mL乳酸和20 mL无水乙醇于100 mL容量瓶中,用蒸馏水定容至刻度,混匀后转入250 mL玻璃瓶中,加5 g烘干曲粉,于30 ℃保温酯化7 d。然后加入50 mL 蒸馏水于1 000 mL 蒸馏烧瓶中加热蒸馏,并接收馏出液100 mL。取酯化馏出液进行气相色谱分析,其色谱检测条件如下:Agilent HP-INNOWAX色谱柱(30 m×320 μm×0.25 μm);载气为高纯氮气(N2)(纯度>99.999%);柱流速为0.8 mL/min;进样口温度200 ℃;检测器温度200 ℃;程序升温:起始温度50 ℃,保持8 min,以5 ℃/min升至150 ℃,保持15 min;进样体积为1 μL;分流进样,分流比为10∶1。
1.3.3 出发菌株的选择
(1)不同菌种麸曲催化合成乳酸乙酯含量的比较
按照1.3.1的方法,实验组将烟色红曲霉M6、紫色红曲霉M16、Q303根霉、华根霉R3、米曲霉A12、黑曲霉T103分别培养制成麸曲,并以不添加曲粉的反应体系为对照组,且将对照组的反应条件与实验组调成一致。每组实验做3次平行,按1.3.2的方法测定乳酸乙酯合成量,比较各菌株所产酯化酶对合成乳酸乙酯的能力,并初步挑选产乳酸乙酯酯化酶菌株以供后续实验。
(2)pH对酯化酶催化合成乳酸乙酯含量的影响
在pH值2.5~5.0的范围内,以pH值0.5为一个梯度,共设6个梯度,实验组分别在各pH值下测定酯化酶对乳酸乙酯合成量的大小,并以不添加曲粉的反应体系为对照组,保持酯化力测定中的温度和其他条件不变。每组实验做3次平行,按1.3.2的方法测定乳酸乙酯合成量。以此来确定酯化酶的最适酯化pH值。
(3)温度对酯化酶催化合成乳酸乙酯含量的影响
在温度值20~45 ℃的范围内,以温度值5 ℃为一个梯度,共设6个梯度,实验组分别在各温度下测定酯化酶对乳酸乙酯合成量的大小,并以不添加曲粉的反应体系作为对照组,每组实验做3次平行,按1.3.2的方法测定乳酸乙酯合成量。以此确定酯化酶的最适酯化温度。
1.3.4 筛选方法的建立
(1)一级筛选
利用菌株产生的酯酶分解三丁酸甘油酯产生脂肪酸和甘油,从而形成透明圈的原理。将经过常压室温等离子体(ARTP)诱变的孢子菌悬液稀释涂布于一级筛选培养基上,30 ℃培养5 d。挑选产透明圈大的单菌落接种于PDA斜面培养基,4 ℃保藏,以产生的透明圈的大小来衡量菌株产酯酶能力的高低。
(2)二级筛选
为了筛选的便捷并且更加准确地衡量产乳酸乙酯酯化酶的能力,将一级筛选得到的透明圈直径D与菌落直径d的比值较大的菌株接种于装有PDA液体培养基的三角瓶中,在100 mL水相体系中,以80 mL土豆液体培养基为基质,添加2%玉米粉为碳源,1%的豆粕为氮源,30 ℃、180 r/min摇床培养72 h制备酯化酶液[22],为节约筛选时间并能测定突变株的最佳酶活,调pH为3.5,静置酯化4 d,测定乳酸乙酯合成量。
(3)三级筛选
将二级筛选得到的产乳酸乙酯较高的菌株按1.3.1的方法制成麸曲,调pH为3.5,进行乳酸乙酯合成量测定。
1.3.5 ARTP菌种诱变
(1)孢子悬液的制备
将菌株接入PDA斜面培养基上培养72 h,然后用5 mL灭菌的生理盐水洗下孢子,置于装有玻璃珠的PDA液体培养基中,充分打散,并在30 ℃、180 r/min摇床振荡培养7 h使菌株孢子萌发[23],然后用无菌脱脂棉过滤即得孢子菌悬液。调整孢子悬液浓度为105~106个/mL。
(2)ARTP诱变过程
利用常压室温等离子体(ARTP)诱变仪对菌种进行诱变。诱变时的工作气体为氦气。按照处理功率100 W,氦气流量12 L/min,样品与等离子体发生器出口距离2 mm,操作温度在25~35 ℃,每个金属载片上均匀涂布10 μL的孢子菌悬液,分别按30、60、90、120、150、180、210、240、270 s不同的诱变照射时间来处理孢子悬浮液,诱变后将金属载片置于装有1 mL无菌生理盐水的EP管中,振荡悬浮,每个处理时间分别做10-1、10-2、10-3三个稀释度进行涂板,每个稀释度涂3个平板,30 ℃培养5 d后进行计数,通过菌落形成单位(colony-forming units,CFU)来计算致死率、正突变率,其计算公式如下:

式中:正突变菌落数为透明圈直径大于出发菌株透明圈直径的菌落数。
(3)最佳诱变时间的选择
通过CFU平板菌落计数法绘制菌株诱变后的致死率、正突变率曲线。对曲线数据进行分析,以正突变率最高的时间点作为最佳诱变时间点进行后续诱变处理。
(4)遗传稳定性分析
连续传代5代,按1.3.1的方法制成麸曲,对诱变筛选得到的突变株黑曲霉T206进行乳酸乙酯酯化能力的测定,考察诱变菌株的遗传稳定性。
2 结果与分析
2.1 出发菌株的选择
2.1.1 不同菌种麸曲乳酸乙酯合成量的比较
通过将实验室筛选保存的烟色红曲霉M6,紫色红曲霉M16,根霉Q303,华根霉R3,米曲霉SQ12,黑曲霉T103固体培养分别制成麸曲,30 ℃静置酯化7 d,蒸馏测定各霉菌麸曲催化合成乳酸乙酯的能力,结果见图1。
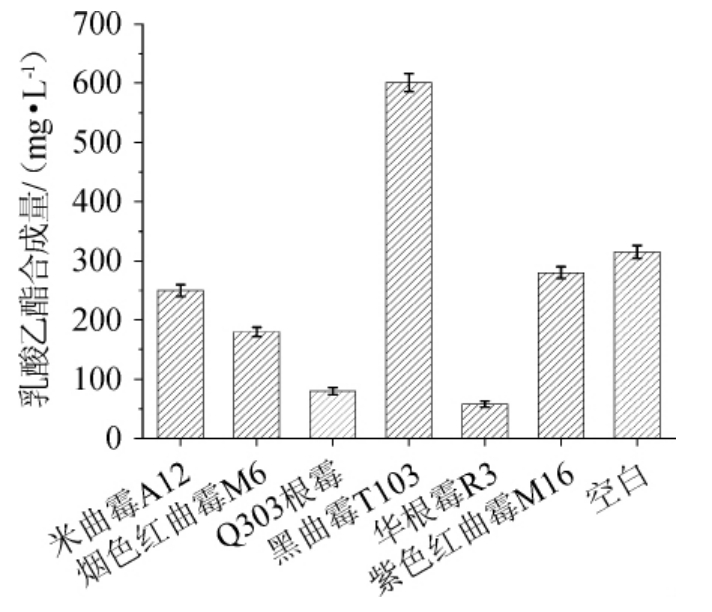
图1 不同菌株麸曲的乳酸乙酯酯化力比较
Fig.1 Comparison of ethyl lactate esterification power of different Fuqu
由图1可知,在催化合成乳酸乙酯的酯化能力上来看,米曲霉A12达到250.15 mg/L,烟色红曲霉M6达到180.35 mg/L,Q303根霉达到85.75 mg/L,华根霉R3达到58.75 mg/L,紫色红曲霉M16达到289.15 mg/L,均低于空白对照(化学合成)的315.28 mg/L,说明其对催化合成乳酸乙酯几乎没有作用,甚至起到了酯分解酶的作用,只有黑曲霉T103对乳酸乙酯的合成量最高,达到了601.75 mg/L。因此,初步选择黑曲霉T103为出发菌株,并进一步探究其所产酯化酶最适酯化pH和最适酯化温度。
2.1.2 pH对黑曲酯化酶合成乳酸乙酯的影响

图2 pH值对黑曲霉T103酯化酶合成乳酸乙酯的影响
Fig.2 Effect of pH on the synthesis of ethyl lactate by esterase from Aspergillus niger T103
酶作用酯合成量=综合作用酯合成量-化学作用酯合成量,其中不加曲为化学作用,加曲为综合作用。下同。
由图2可知,pH值对黑曲酯化酶酯化乳酸乙酯有很大影响,随着pH值的上升,化学作用合成乳酸乙酯的量逐渐减少,当pH值<3.5时,酶作用合成乳酸乙酯的量随着pH的升高而逐渐增加,当pH值达到3.5时,此时酶作用酯化乳酸乙酯的量最大,达到602.37 mg/L,当pH值大于3.5时,酶作用随着pH的升高而下降,因此黑曲酯化酶催化合成乳酸乙酯的最适pH值为3.5。
2.1.3 温度对黑曲酯化酶合成乳酸乙酯的影响
表1 温度对黑曲霉T103酯化酶合成乳酸乙酯的影响
Table 1 Effect of temperature on the synthesis of ethyl lactate by esterase from Aspergillus niger T103 mg/L
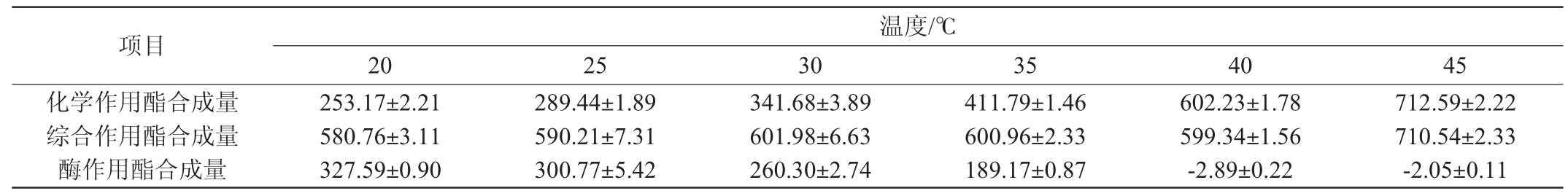
由表1可知,随着温度的上升,分子的热运动速率加快,乳酸乙酯的化学合成量是一直增加的,当温度在20~30 ℃时,黑曲霉作用酯合成量>化学作用酯合成量,说明黑曲酶作用合成乳酸乙酯占有主导作用,在温度20 ℃时,酶作用酯化能力最强,达到327.59 mg/L,随着温度的上升,酶酯化作用越来越弱,化学作用越来越强,当温度高于40 ℃时,高温使黑曲酯化酶变性失活,因而黑曲酯化酶对乳酸乙酯的酯化几乎没有作用。而当温度为30 ℃时,此时综合作用酯化乳酸乙酯的量最高,达到601.98 mg/L。因此,黑曲酯化酶催化合成乳酸乙酯的最适温度为30 ℃。
2.1.4 出发菌株的确定
通过对6株霉菌产酯化酶合成乳酸乙酯能力的比较,其中黑曲霉T103对乳酸乙酯具有合成作用,并进一步发现其最适酯化pH为3.5,最适酯化温度为30 ℃,符合白酒发酵的基础条件,因此确定黑曲霉T103为出发菌株以供后续实验。
2.2 诱变菌株的筛选
2.2.1 ARTP诱变致死率和正突变率曲线的测定
对黑曲霉的孢子进行前培养萌发后,进行ARTP诱变处理,对黑曲霉T103诱变的致死率和正突变率进行计算,并绘制致死率和正突变率曲线,结果见图3。
由图3可知,在60 s前致死率上升缓慢,但在90 s时致死率急剧上升至92%,随后在120 s下降至84%,210 s以后上升至96%左右,随着诱变时间的增加,270 s后致死率接近100%。为了尽可能多的选育出好的突变株,选择致死率为70%~80%诱变平板中诱变菌株,并在120 s时正突变率较高。因此,确定诱变时间为120 s,进行后续菌株选育。
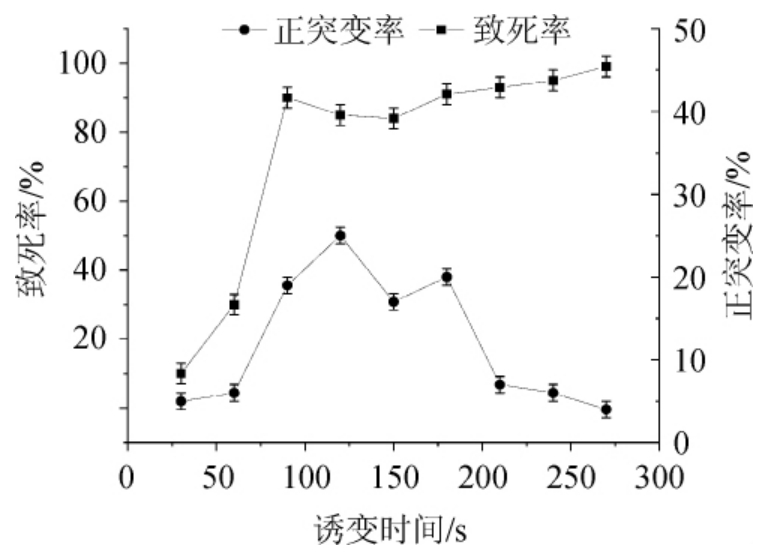
图3 诱变时间对黑曲霉T103致死率及正突变率的影响
Fig.3 Effect of mutagenesis time on lethality and positive mutation rate of Aspergillus niger T103
2.2.2 菌株初筛
采用添加三丁酸甘油酯产透明圈的方法,通过对各突变株透明圈大小的比较,总共挑选100个透明圈有明显的变化的菌株。
2.2.3 二级筛选
将初筛的100株菌进行液态培养产酯化酶,并按照二级筛选体系进行乳酸乙酯合成量的测定,结果见表2。
表2 诱变黑曲霉菌株二级筛选结果
Table 2 Secondary screening results of mutant Aspergillus niger
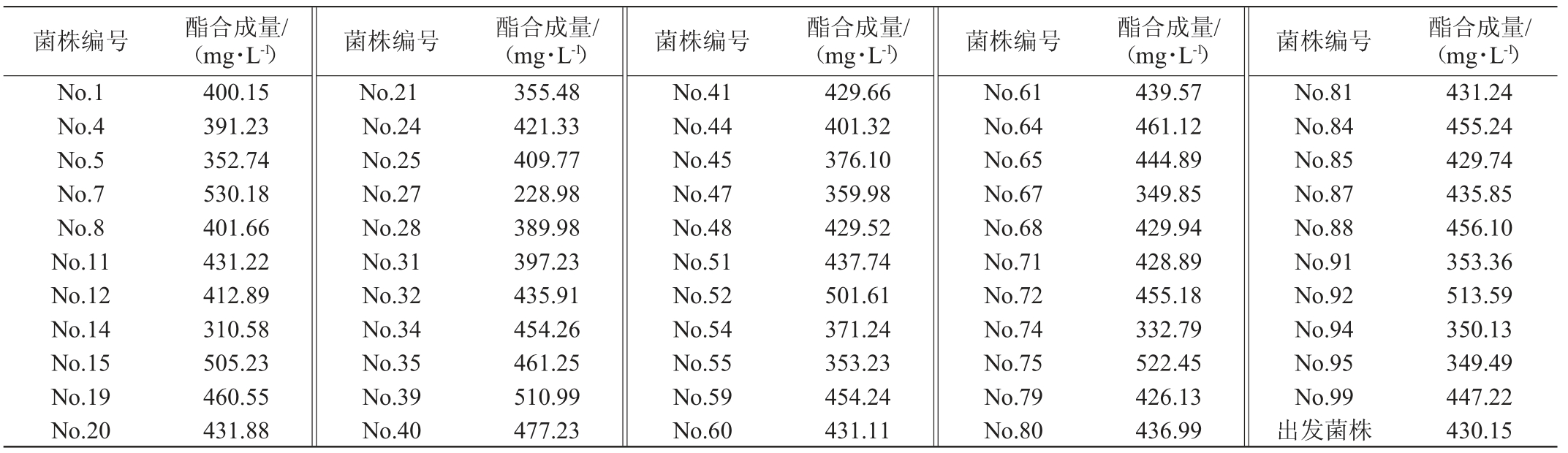
由表2可知,二级筛选体系中,出发菌株黑曲霉T103对乳酸乙酯合成量为430.15 mg/L,与出发菌株相比,发现有6株突变菌(No.7、No.15、No.39、No.52、No.75、No.92)对乳酸乙酯合成量在500 mg/L以上,其中菌株H7对乳酸乙酯的合成能力最高,达到530.18 mg/L。因此,选择这6株突变菌(No.7、No.15、No.39、No.52、No.75、No.92)进行三级筛选,确定其固态培养产酯化酶催化合成乳酸乙酯能力的大小。
2.2.4 三级筛选
将二级筛选出的产酶能力提高的诱变菌株进行麸曲固态培养,制成麸曲烘干并测定乳酸乙酯合成量,结果见图4。

图4 诱变黑曲霉菌株三级筛选结果
Fig.4 Tertiary screening results of mutant Aspergillus niger
由图4可知,6株突变菌(No.7、No.15、No.39、No.52、No.75、No.92)的乳酸乙酯合成量都有一定提高,其中菌株No.7(初步命名为黑曲霉T206)合成乳酸乙酯的量最高,达到892.15 mg/L,相较于出发菌株的727.88 mg/L提高了22.71%。
2.2.5 遗传稳定性研究
为了检测诱变菌株产酯化酶能力的稳定性,将其连续传代5代,按酯化力的测定方法,测定其对乳酸乙酯的酯化能力,结果表明乳酸乙酯的合成量稳定在880.58 mg/L左右,总体突变菌株黑曲霉T206具有较好的遗传稳定性。
3 结论
通过对6株霉菌(烟色红曲霉M6,紫色红曲霉M16,Q303根霉,华根霉R3,米曲霉A12,黑曲霉T103)进行乳酸乙酯酯化能力的测定,发现只有黑曲霉T103对乳酸乙酯的合成具有催化作用,并探究了黑曲霉T103酯化酶催化合成乳酸乙酯的最适pH值为3.5,最适温度为30 ℃,符合白酒发酵的基础条件,因此确定黑曲霉T103为出发菌株。进一步采用ARTP诱变技术对其进行诱变,结合透明圈法初筛、液体产酶的二级筛选及固态产酶的三级筛选,得到一株酶活较高的为突变株黑曲霉T206,其液态、固态产酶催化乳酸乙酯的合成量分别为530.18 mg/L、892.15 mg/L,相较于出发菌株黑曲霉T103分别提高了23.56%、22.71%。
[1]王耀,范文来,徐岩,等.浓香型大曲中酯化酶测定方法的研究[J].酿酒,2003,30(2):18-21.
[2]滕巍,李国莹,刘小波,等.大曲中产酯化酶菌株的分离鉴定及固体发酵工艺优化[J].食品与生物技术学报,2016,35(9):971-977.
[3]宫若楠.衡水老白干大曲中产酯化酶霉菌的筛选及其特性研究[D].石家庄:河北科技大学,2018.
[4]曾婷婷,张志刚.白酒酿造中酯化酶的研究现状[J].酿酒,2010,37(6):12-14.
[5]王涛,赵东,游玲,等.浓香型白酒酿造环节中产酯化酶的霉菌多样性[J].食品与发酵工业,2012,38(5):37-41.
[6]肖冬光,赵树欣,陈叶福,等.白酒生产技术[M].北京:化学工业出版社,2010:85-90.
[7]沈怡方.白酒的香型、风格与流派[J].酿酒,2003,30(1):1-2.
[8]李维青.浓香型白酒与乳酸菌、乳酸、乳酸乙酯[J].酿酒,2010,37(3):90-93.
[9]张浩,胡智慧,刑爽,等.酸浓度和pH 值对浓香型大曲酯化酶催化活力的影响[J].中国酿造,2017,36(5):41-45.
[10]邢爽,魏志阳,郭学武,等.不同香型大曲酯化酶的特性分析[J].现代食品科技,2018,34(5):87-92.
[11]杨萍,胡萍,樊敏,等.酱香型酒曲及窖内酒醅挥发性成分的分析[J].中国酿造,2018,37(11):166-171.
[12]王牛牛,雷振河,吕利华,等.以红曲霉酯化酶催化合成乳酸乙酯[J].食品与发酵工业,2011,37(1):73-77.
[13]CAO X Z,LVK B,LI S X,et al.Optimization of cultivation condition for the production of ethyl caproate esterifying enzyme by Rhizopus[J].Int J Modern Biol Med,2012,1:89-95.
[14]GU L Z.Study on application of Rhizopus sp.esterifying enzyme to soy sauce aroma enhancement[J].Food Sci,2009,30(11):175-179.
[15]罗小叶,胥思霞,邱树毅,等.高酯化大曲催化增香技术在浓香型白酒生产上的应用[J].中国酿造,2018,37(10):141-144.
[16]李河,张宿义,敖宗华,等.浓香型白酒酯化液的研究进展[J].中国酿造,2016,35(8):5-8.
[17]张雪,张晓菲,王立言,等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报,2014,65(7):2676-2684.
[18]薛刚,陈利娟,吴斌,等.ARTP 诱变选育高温蛋白酶高产菌株及其酶学性质研究[J].食品工业科技,2015,36(1):177-180,206.
[19]邱雯雯,任雅琳,陈存社,等.常压室温等离子体诱变筛选高乳糖酶活力酵母的研究[J].中国食品学报,2014,14(2):132-137.
[20]祁田甜,张婵,胡济美,等.常压室温等离子体诱变技术选育高产Monacolin K 紫色红曲霉突变株[J].食品科学,2015,36(9):66-70.
[21]薛正莲,刘阳,王洲,等.基因组改组选育产酯化酶地衣芽孢杆菌[J].中国生物工程杂志,2013,33(8):43-48.
[22]张谦,贾佳,林智,等.产脂肪酶黑曲霉摇瓶发酵条件优化研究[J].生物技术通报,2015,31(12):227-233.
[23]肖成建,陈楠,江慰,等.ARTP 诱变及高效筛选高产葡萄糖氧化酶菌株[J].食品与生物技术学报,2016,35(5):525-530.