L-丝氨酸(L-serine)化学结构为HO-CH2CH(NH3)-COOH,分子质量为105.10,化学名为α-氨基-β-羟基丙酸,是一种含羟基的中性氨基酸[1]。L-丝氨酸虽属人体非必需氨基酸,但却具有许多重要的生理功能,在医药、食品、化妆品等领域均有广泛应用,市场需求量日益增高[2]。目前,国内外生产L-丝氨酸的方法主要有发酵法[3]、酶转化法[4]、提取法[5]和化学合成法等[6]。其中,发酵法生产L-丝氨酸的方法是微生物利用培养基中的营养物质直接产生L-丝氨酸。发酵法生产L-丝氨酸的菌株几乎都是细菌,且产量不高,这是由于L-丝氨酸处于代谢的中间阶段,代谢速率非常快,不易积累。酶转化法是微生物培养到一定程度后,将产物的前体物质加入到培养基中,在微生物酶的作用下,生成L-丝氨酸。甘油酸、甘氨酸均可作为发酵前体物[7]。
目前,可以用来检测L-丝氨酸含量的方法有高效液相色谱法[8]、氨基酸自动分析仪[9]、纸层析-分光光度法[10]、变色酸-分光光度法[11-12]、茚三酮显色法[13-14]等。前两种方法对仪器设备要求高、衍生步骤繁琐,操作不方便,对于样品多,工作量大的丝氨酸的分离及丝氨酸生产菌的筛选并不适合。茚三酮显色法是利用丝氨酸和茚三酮在弱酸性条件下共热生成紫红色缩合物质,其缩合物的颜色随丝氨酸含量的变化而有所不同进行检测,但该方法显色的灵敏度比较差,不适合用常规的分光光度计进行检测,只能使用专门针对低含量样品设计的722E型可见分光光度计[15]。纸层析分光光度法和变色酸分光光度法操作简单,成本低,显色的灵敏度高,在常规的分光光度计上即可检测,适用范围较为广泛。
甲基营养菌(Methylobacterium sp.)指的能够利用甲基化合物(甲烷、甲醛、甲醇、甲酸、甲基胺类等)为其唯一的碳源和能源进行生长的一类微生物。据估计,每年大概有83~273百万吨甲醇,600百万吨甲烷释放到大气中,此外,甲基胺类也广泛存在于海洋和淡水环境中[16]。由于甲基营养型微生物能够将自然界取之不尽、用之不竭的一碳化合物变为碳源和能源,可以解决发酵过程中糖原料的限制并且拓石化原料的应用范围(我国年产甲醇5 000万t,主要以煤制甲醇为主,国内甲醇的需求量为2 000万t每年,产能过剩[17]),因此,对甲基营养型微生物的代谢研究具有重大意义。
丝氨酸是甲基营养型微生物的一种重要代谢产物。大部分能够利用甲醇的甲基营养型细菌具有L-丝氨酸代谢途径[18-19],它们可以通过丝氨酸羟甲基转移酶(serine hydroxymethyl transferase,SHMT)来同化单碳化合物与甘氨酸生产L-丝氨酸[20-21]。本实验室筛选了多株能够以甲醇为碳源的甲基营养型细菌,为了检测它们是否能产L-丝氨酸以及产L-丝氨酸的水平,亟需建立一种准确、简便的测定L-丝氨酸含量的方法。由于甲基营养菌主要通过转化发酵液中的底物甘氨酸来生成L-丝氨酸,还需要检测发酵液中甘氨酸的残留情况来确定菌株对甘氨酸的转化能力,而纸层析分光光度法能够同时检测出甘氨酸和L-丝氨酸的含量来反映菌株对底物的转化情况。由于转化体系与发酵液组分的差异,一些常用的氨基酸层析展开剂并不适合L-丝氨酸和甘氨酸的分离和含量测定。由此,本研究通过优化层展剂的种类、洗脱温度、洗脱时间等因素,建立一种L-丝氨酸检测方法,通过对该检测方法的精密度、准确性、稳定性等方法学考察,最终确定该方法的最佳实验条件,并用于检测和评价本实验室筛选的甲基营养型细菌产L-丝氨酸的能力。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
实验中所用的菌种均来自课题组保藏菌种,所用菌株为甲基营养型细菌(Methylobacterium sp.)5222。
1.1.2 化学试剂
甘氨酸(纯度>99.0%)、L-丝氨酸(纯度>99.0%):美国Amresco公司;茚三酮(分析纯):西陇化工股份有限公司;丙酮、正丁醇、二乙胺(均为分析纯):天津致远化学试剂有限公司;硫酸铜、乙醇(均为分析纯):天津科密欧化学试剂有限公司。
1.1.3 培养基
无机盐液体培养基:磷酸氢二钾7.5 g/L,磷酸二氢钾2 g/L,七水硫酸镁0.2 g/L,无水氯化钙0.015 g/L,氯化钠0.5g/L,硫酸铵2g/L,加蒸馏水1L。121℃高压蒸汽灭菌20min。
接菌前加入过滤除菌后的甲醇达到0.7%(V/V)为宜。
1.2 仪器与设备
PHS-25B型数字酸度计:上海大普仪器有限公司;752N紫外可见分光光度计:上海仪电分析仪器有限公司;SW-CJ-1F超净工作台:上海蓝豹实验仪器有限公司;HC-2064高速台式离心机:安徽中科中佳科学仪器有限公司;LDZM-60KCS-II立式压力蒸汽灭菌锅:上海申安医疗器械厂;FA2204B电子天平:上海天美天平仪器有限公司;LRH-150生化培养箱、THZ-300台式恒温摇床:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 种子液及发酵液的制备方法
甲基营养型细菌种子液的制备:从平板上挑取单菌落于0.7%甲醇(V/V)装液量为5 mL/25 mL无机盐液体培养基中,于34 ℃、150 r/min 条件下振荡培养48 h,终止发酵,即得种子培养液。
甲基营养型细菌发酵液的制备:将1%甲基营养型细菌种子液接种于含0.7%甲醇(V/V)装液量为50 mL/300 mL无机盐液体培养基中,于34 ℃、150 r/min 条件下振荡培养48 h,然后在无菌条件下加入过滤除菌的甘氨酸母液至终质量浓度为5 g/L,继续培养48 h,终止发酵即得发酵液。
1.3.2 纸层析-分光光度法测定氨基酸含量
(1)主要试剂和溶液的配制
展开剂:①正丁醇∶丁酮∶浓氨水∶水=4∶3∶2∶1(V/V)、②丙酮∶正丁醇∶二乙胺∶水=10∶10∶2∶5(V/V)、③正丁醇∶乙酸∶水=12∶3∶5(V/V)、④乙醇∶正丁醇∶二乙胺∶水=10∶15∶5∶8(V/V);显色剂:称取0.5 g茚三酮溶于100 mL丙酮中;洗脱液:0.1%硫酸铜∶体积分数为75%乙醇=2∶38(V/V)。现配现用。
10 g/L L-丝氨酸标准液的配制:称取1.0 g L-丝氨酸溶解于蒸馏水并定容至100 mL;10 g/L甘氨酸标准液的配制:称取1.0 g甘氨酸溶解于蒸馏水并定容至100 mL;100 g/L甘氨酸母液的配制:称取10.0 g甘氨酸溶解于蒸馏水并定容至100 mL。
(2)纸层析-分光光度法测定
点样:将滤纸裁成9 cm×28 cm大小,用铅笔在距滤纸底端2 cm的地方划一道基线,在线上每隔2 cm,画上一个小点作为点样原点。将待测氨基酸样品点样于滤纸上所标点的中心位置,点样量为0.2~2.0 μL(样品中氨基酸的含量为5~20 μg为宜)。
层析、显色:展开剂于层析缸中密封静置,待所点样液风干后,将滤纸放于层析杠中,并密封缸口。待层析液上行展开至距滤纸顶端1.0 cm左右时,取出层析纸后吹风机吹干,将显色剂用喷雾器均匀喷洒于层析纸上,置于烘箱中105 ℃显色5 min,取出。
比移值(retardation factor,Rf)为斑点中心距原点的距离与溶剂展开前沿距原点距离的比值,其计算公式如下:
Rf值=斑点中心移动距离/溶剂前沿移动距离
洗脱:待斑点完全显出后,剪下氨基酸斑点置于具塞玻璃管中,用5.0 mL洗脱液静置洗脱30 min后,得洗脱液。并在752N紫外可见分光光度计上测定其吸光度值。
(3)L-丝氨酸的标准曲线的绘制
将L-丝氨酸标准溶液点样于滤纸上所标点的中心位置,点样量依次为0.2 μL、0.4 μL、0.6 μL、0.8 μL、1.0 μL、1.2 μL,层析、显色并洗脱后于波长510 nm处测定其吸光度值,以吸光度值(y)为纵坐标,以L-丝氨酸质量(x)为横坐标绘制L-丝氨酸标准曲线。甘氨酸标准曲线制作同上。
(4)发酵液中氨基酸含量的测定
将发酵液在8 000 r/min转速下离心5 min,取出上清液,点样2.0 μL于层析滤纸上展开、显色。根据L-丝氨酸和甘氨酸标准样展开的Rf值定性判断发酵液中是否含有这两种氨基酸,若含有L-丝氨酸和甘氨酸,再剪下显色斑点洗脱,测定吸光度值,根据L-丝氨酸和甘氨酸的标准曲线方程算出发酵液中L-丝氨酸和甘氨酸含量。
1.3.3 纸层析-分光光度法精确性和准确性测试
通过对该方法进行精密度实验和回收率实验来确定方法的精确性和准确度。
2 结果与分析
2.1 展开剂的选择
为了使L-丝氨酸和甘氨酸两种氨基酸成功分离,各自单独获得,将L-丝氨酸、甘氨酸的标准液及L-丝氨酸和甘氨酸标准溶液的混合液采用1.3.2 中4种不同的展开剂液分别进行纸层析实验,以获取最佳的展开剂,纸层析结果见图1。

图1 发酵液在不同展开剂条件下的纸层析色谱图
Fig.1 Paper chromatogram of fermentation broth under different developing solvents
①②③④分别为不同种类的展开剂展开的效果图①正丁醇∶丁酮∶浓氨水∶水=4∶3∶2∶1(V/V);②丙酮∶正丁醇∶二乙胺∶水=10∶10∶2∶5(V/V);③正丁醇∶乙酸∶水=12∶3∶5(V/V);④乙醇∶正丁醇∶二乙胺∶水=10∶15∶5∶8(V/V);每张层析滤纸上的点样顺序从右到左分别为L-丝氨酸、甘氨酸、L-丝氨酸和甘氨酸的混合物。
由图1可知,采用③和④作为展开剂时,L-丝氨酸和甘氨酸斑点间的Rf值基本一致(用③作展开剂二者的Rf值均为0.295,用④作展开剂二者的Rf值分别为0.23和0.24),混合液中L-丝氨酸和甘氨酸未出现分离现象,因此不能作为本实验的展开剂。采用①作展开剂分离时,两种氨基酸的Rf值差距不明显(Rf值分别为0.175和0.12),仅仅能证明混合液中有两种氨基酸的存在,但分离效果不好。采用②作为展开剂时能够明显分离出混合液中的L-丝氨酸和甘氨酸,并且L-丝氨酸和甘氨酸斑点间Rf值差距较大(Rf值分别为0.445和0.295),效果最佳。因此,选择丙酮∶正丁醇∶二乙胺∶水=10∶10∶2∶5(V/V)作为最佳展开剂。
2.2 洗脱液最佳波长的测定
L-丝氨酸及甘氨酸的点样量为2.0 μL,展开、显色显出斑点后,剪下斑点在具塞玻璃管中用5 mL洗脱液洗脱30 min左右。以空白洗脱液为对照,用分光光度计在不同波长条件下测定洗脱液的吸光度值,确定洗脱液的最佳波长,结果见图2。
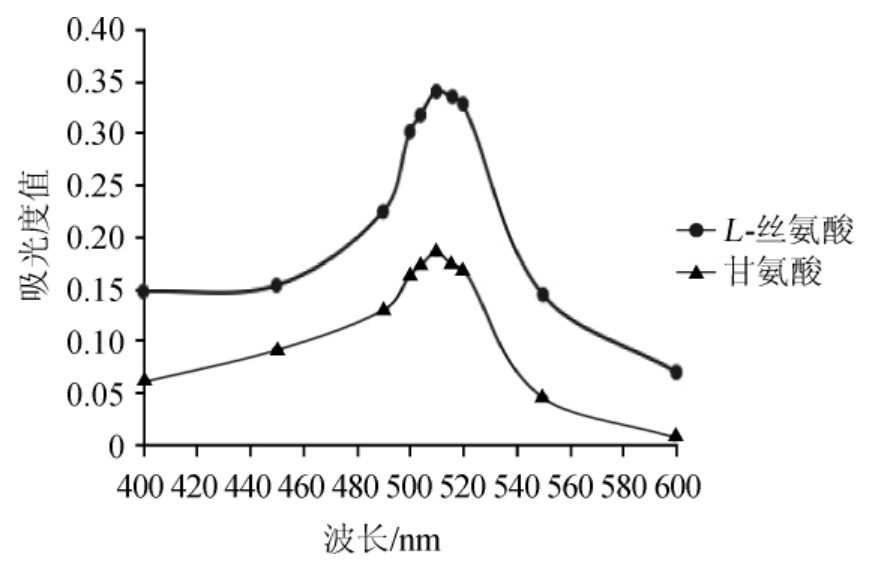
图2 洗脱液中L-丝氨酸和甘氨酸最适波长的测定
Fig.2 Determination of optimal wavelength of L-serine and glycine in eluants
由图2可知,L-丝氨酸的最大吸收波长为510 nm,甘氨酸的最大吸收波长也为510 nm。结果表明,当波长为510 nm时,两种氨基酸分析吸收峰均处于波峰位置,即两种洗脱液的吸光度值均达到最大值。因此,在测定L-丝氨酸和甘氨酸吸光度值时,均在510 nm波长条件下测定。
2.3 展开剂最佳pH值测定
按照最佳展开剂②比例配成展开剂的初始pH值为12.7,然后用2 mol/L的盐酸溶液将展开剂pH值依次调为10.5、8.0、6.0、4.0、2.0,用2.5 μL移液枪分别取0.5 μL L-丝氨酸、甘氨酸、L-丝氨酸和甘氨酸混合标准液点样,分别进行层析、显色,最终纸层析显色结果见图3。

图3 不同pH条件下标准液的纸层析色谱图
Fig.3 Paper chromatogram of standard liquid under different pH conditions
由图3可知,当展开剂pH值近似为8.0和2.0时基本不显出斑点;而当pH值为12.7时,能达到较好的层析效果,L-丝氨酸和甘氨酸混合液分离明显。因此,层析液按照各试剂比例配好后无需调pH值即能达到最佳的分离效果,可直接作为展开剂使用。
2.4 洗脱液最佳洗脱时间测定
L-丝氨酸的点样量为2.0 μL,展开、显色显出斑点后,在具塞玻璃管中用10 mL洗脱液洗脱不同时间。以空白洗脱液为对照,用分光光度计在波长510 nm处测定洗脱液的吸光度值,结果见图4。

图4 洗脱时间与吸光度值的关系
Fig.4 Relationship between elution time and absorbance value
由图4可知,在波长510 nm处洗脱液洗脱30 min时的吸光度值最大,因此测定L-丝氨酸和甘氨酸时,均选用30 min作为最佳洗脱时间。
2.5 洗脱液稳定性测定
L-丝氨酸的点样量为2.0 μL,展开、显色、显出斑点后,剪下显色斑点于具塞玻璃管中用10 mL洗脱液洗脱30 min后。放置不同时间后,以空白洗脱液为对照,用分光光度计在波长510 nm处测定洗脱液的吸光度值,结果见图5。
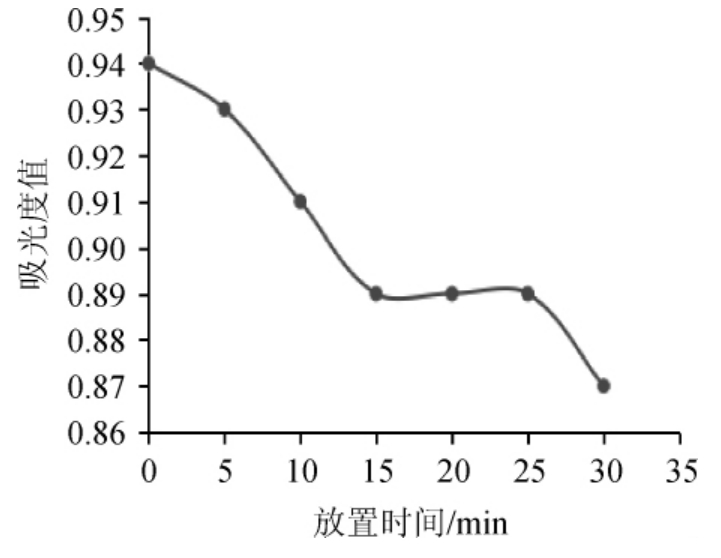
图5 洗脱后放置不同时间与吸光度值的关系
Fig.5 Relationship between eluent preserving time and absorbance value
由图5可知,随着洗脱后洗脱液放置时间的延长,洗脱液的吸光度值在不同程度上会有所降低。结果表明,在洗脱工作完成后要尽快测定洗脱液的吸光度值,不要间隔太长时间,尽量在10 min内完成所有测量工作,从而达到减小误差的目的。
2.6 L-丝氨酸及甘氨酸标准曲线的绘制
L-丝氨酸及甘氨酸的点样量分别依次为2.0 μg、4.0 μg、6.0 μg、8.0 μg、10.0 μg、12.0 μg,待L-丝氨酸加甘氨酸标准液点样、展开、显色后,剪下显色斑点置于具塞玻璃管中用5 mL洗脱液洗脱30 min,显色后图谱斑点进行洗脱。以空白洗脱液为对照,用分光光度计在波长510 nm处测定洗脱液的吸光度值,以吸光度值(y)为纵坐标,以L-丝氨酸及甘氨酸质量(x)为横坐标绘制L-丝氨酸及甘氨酸标准曲线,结果见图6。
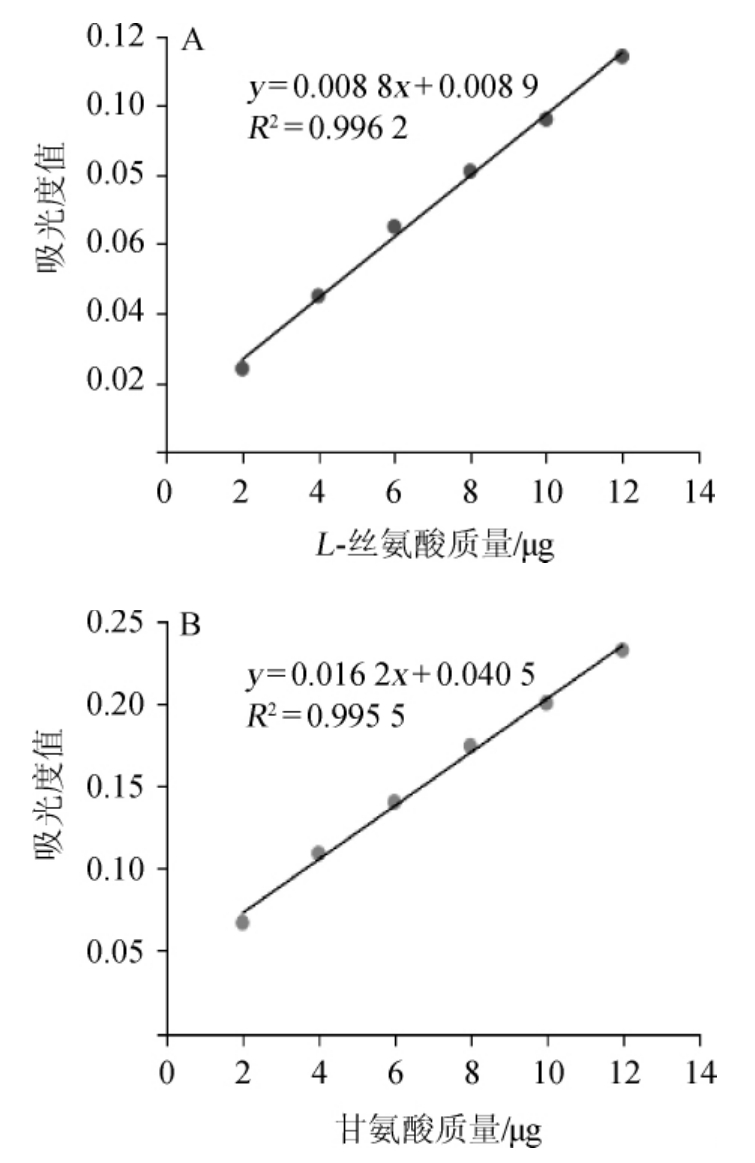
图6 L-丝氨酸(A)及甘氨酸(B)标准曲线
Fig.6 Standard curves of L-serine (A) and glycine (B)
由图6A可知,L-丝氨酸标准曲线回归方程为y=0.008 8x+0.008 9,相关系数R2=0.996 2。由图6B可知,甘氨酸回归方程为y=0.016 2x+0.040 5,相关系数R2=0.995 5。结果表明,L-丝氨酸和甘氨酸质量与吸光度值之间线性关系良好。
2.7 精密度实验
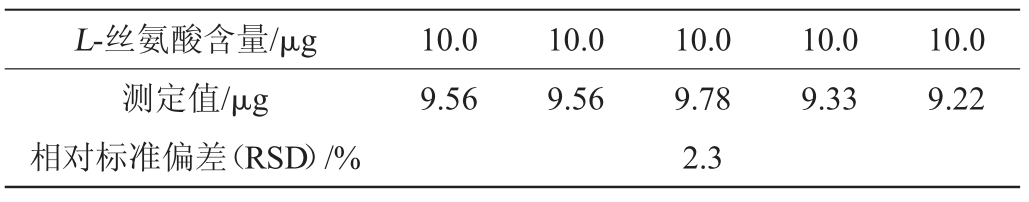
对10.0 μg L-丝氨酸分别进行5次平行实验。点样、展开、显色,洗脱后测量吸光度值,根据L-丝氨酸标准曲线方程算出L-丝氨酸含量,结果见表1。由表1可知,经计算得到L-丝氨酸的相对标准偏差(relative standard deviation,RSD)为2.3%。结果表明,该方法具有良好的精密度。
表1 精密度实验结果
Table 1 Results of precision tests
2.8 加标回收率实验
为了检验该方法在发酵液中的准确性,点样2 μL处理过的发酵液,同时加入0.5 μL L-丝氨酸标准溶液,并另外点2 μL发酵液来测定发酵液中的丝氨酸含量,进行加标回收率实验,结果见表2。
表2 加标回收率实验结果
Table 2 Results of standard recovery rate tests
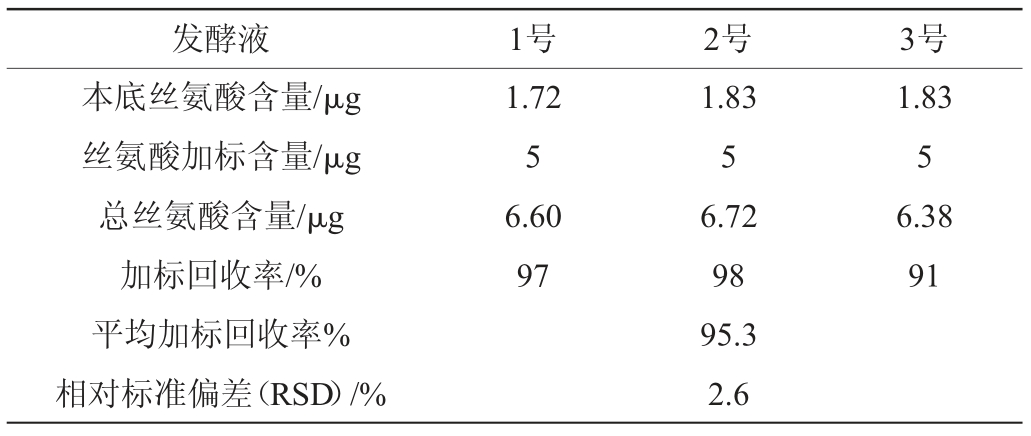
由表2可知,发酵液中L-丝氨酸的加标回收率在91%~98%之间,RSD为2.6%,说明该方法在发酵液中受到的干扰比较小。
2.9 甲基营养菌5222发酵液中L-丝氨酸含量的测定结果
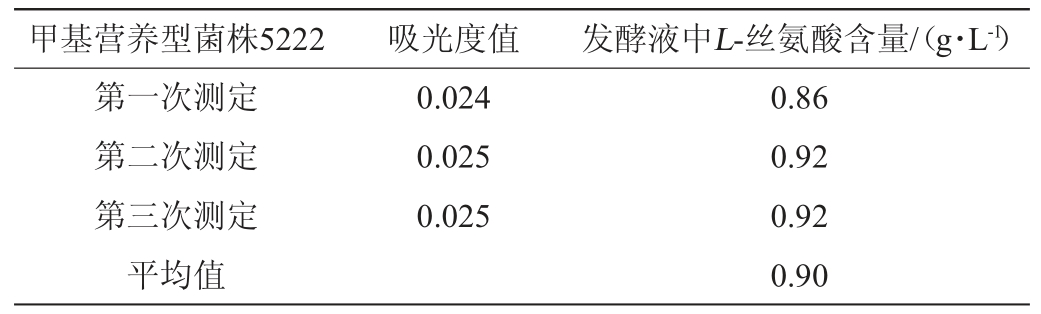
取培养96 h的发酵液上清2 μL,通过层展、显色、洗脱等步骤测定甲基营养菌5222发酵液中L-丝氨酸的含量,结果见表3。由表3可知,发酵液中L-丝氨酸的含量为0.90 g/L。
表3 发酵液中L-丝氨酸含量的测定结果
Table 3 Determination results of L-serine content in fermentation broth
3 结论
纸层析-分光光度法所用仪器设备比较简单,操作方便,重复性好。在发酵液中测定时,没有受到明显干扰,测定结果准确可靠,可以用于发酵培养基中L-丝氨酸含量的测定。本研究确立了纸层析-分光光度法的最适工作条件:展开剂为丙酮∶正丁醇∶二乙胺∶水=10∶10∶2∶5(V/V),展开剂pH值为12.7,波长为510 nm,洗脱时间为30 min。应用此方法,可以检测到甲基营养型细菌5222在发酵培养96 h以后,发酵液中L-丝氨酸的含量为0.90 g/L。
[1]郑桂花.酶促高效转化L-丝氨酸过程优化及其生命周期评价[D].武汉:华中科技大学,2016.
[2]刘岩,王慧,史吉平,等.微生物法生产L-丝氨酸代谢工程研究进展[J].生物技术通报,2015,31(8):44-49.
[3]ZHU G Y,ZHU X,WAN X L,et al.Hydrolysis technology and kinetics of poultry waste to produce amino acids in subcritical water[J].J Anal Appl Pyrol,2010,88(2):187-191.
[4]朱林江,李崎.L-丝氨酸的微生物法制备研究进展[J].食品与发酵工业,2015,41(1):181-185.
[5]张华芳.L-丝氨酸分离提取的研究进展.化工设计通讯,2018,44(9):196,250.
[6]贾慧慧.基于代谢工程改造大肠杆菌生产L-丝氨酸[D].天津:天津大学,2014.
[7]晁红军,宋修鹏,孙继华,等.甲基营养菌的研究进展[J].微生物学通报,2009,36(11):1727-1737.
[8]陈军,徐礼生,张兴桃,等.高效液相色谱法测定酶法制备L-色氨酸[J].食品与生物技术学报,2017,36(3):327-330.
[9]刘芳,张奶英,刘书亮,等.四川麸醋发酵过程中有机酸及游离氨基酸含量变化分析等[J].食品与机械,2017,33(7):11-15.
[10]冯志彬,陈国忠,张娟,等.分光光度法测定酶转化液中L-丝氨酸含量[J].中国酿造,2014,33(7):102-104.
[11]周圆圆,朱敏,王磊,等.变色酸-分光光度法测定丝氨酸含量[J].氨基酸和生物资源,2007,29(1):73-76.
[12]周圆圆.毛发水解液中L-丝氨酸的分离及相关分析检测方法的建立[D].武汉:华中科技大学,2007.
[13]张振华.α-氨基酸与茚三酮显色反应影响因素的探讨[J].邵阳高等专科学校学报,2000,13(1):42-44.
[14]洪亮,熊倩,余训民,等.茚三酮法定性定量检测丝氨酸[J].武汉工程大学学报,2012,34(11):40-43.
[15]李忠财,董会娜,张大伟,等.L-丝氨酸检测技术的研究进展[J].工业微生物,2016,46(5):61-65.
[16]杨靖,陈文静,张敏,等.甲基营养菌代谢网络途径和代谢工程改造的研究进展[J].生物加工过程,2017,15(6):9-16.
[17]陈垒,赵龙涛,李延勋,等.河南煤化工现状及问题探讨[J].河南化工,2015,32(5):7-14.
[18]HIROYA Y,NOBUO K,YASUYOSHI S.Genomic organization and biochemistry of the ribulose monophosphate pathway and its application in biotechnology[J].Appl Microbiol Biot,2010,88(2):187-191.
[19]赵军.基于xoxF 基因的不同生境下甲醇氧化菌群多样性研究初探[D].呼和浩特:内蒙古大学,2017.
[20]WHITAKER W B,JONES J A,BENNETT K,et al.Engineering the biological conversion of methanol to specialty chemicals in Escherichia coli[J].Metab Eng,2017,39:49-59.
[21]田丹丹.甲基营养型菌株WGP35 的筛选、鉴定及突变sdaA 基因对其产L-丝氨酸的影响[D].南宁:广西大学,2011.