牛乳及牛乳制品目前被认为是最适合人类食用的动物蛋白食品之一,而牛乳中占比最多的蛋白质是酪蛋白[1]。人体对蛋白质的消化过程中会产生许多种类的肽,牛乳酪蛋白不仅是优质的蛋白质,而且是生物活性肽的重要来源[2]。酪蛋白经不同酶解处理可产生不同的生物活性肽,如抑菌肽[3-4]、磷酸肽[5-6]、抗氧化肽[7]、血管紧张素转换酶(angiotensin conversion enzyme,ACE)抑制肽[8]。其中抗氧化肽是一类具有清除体内过多的自由基、抑制脂肪氧合酶活力、分解氧化物、增强人体抗衰老和抗疾病能力的活性多肽[9-10]。
20世纪90年代来,乳源抗氧化肽的分离鉴定及其活性的研究备受国内外学者关注,并随着质谱等技术的发展,已从多种动植物的蛋白水解产物中鉴定出大量的具有特定序列的抗氧化肽[2]。多肽的分离多采用树脂分离技术,不同树脂的分离机理不同,进而使其富集的多肽在分子质量、净电荷、氨基酸组成等方面具有差异,不同分离方式其分离出肽的富集片段也各不相同。宋晓光等[11]利用D201树脂分离了水蛭中活性肽成分,并优化了工艺参数。胡赞扬等[12]以酶凝干酪乳清为原料,通过硫酸铵沉淀、透析、超滤和D201树脂离子交换层析等工艺,实现了乳清中糖巨肽的有效分离。大量研究指出,多肽的自由基清除力、金属螯合力以及脂质过氧化抑制力与其氨基酸组成、氨基酸序列、分子质量和空间构象密切相关,如含有酪氨酸、色氨酸、组氨酸残基的多肽表现出较好的自由基清除能力,而疏水性氨基酸含量较高的多肽表现出极好的脂质过氧化抑制能力[15-16]。刘丽莎等[17]利用黄浆水为原料,通过比较酶种类及用量、酶解温度、酶解时间对黄浆水蛋白质水解度的影响,实现酶解工艺的优化,在此条件下水解度可达25.95%,血管紧张素转化酶体外抑制活性达92.0%。
关于乳源抗氧化肽的研究较多,但因多肽的分离纯化工艺复杂,成本高而难以实现产业化。本研究采用胰蛋白酶对牛乳酪蛋白进行水解,采用成本低廉的D201阴离子交换树脂对酶解物进行一次分离,获得酪蛋白多肽;系统分析酪蛋白多肽的抗氧化性,旨在为酪蛋白抗氧化肽的产业化开发提供参考依据。
1 材料与方法
1.1 材料与试剂
荷斯坦牛乳:甘肃农业大学牛奶厂;D201树脂:上海汇珠树脂有限公司;透析袋(0.1 kDa):上海源叶生物科技有限公司;胰蛋白酶(2 500 U/mg):上海源叶生物科技有限公司;赖氨酸:天津市光复精细化工研究所;大豆卵磷脂:郑州万博食品配料有限公司;盐酸、磷酸二氢钠、氢氧化钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS):天津医药化学有限公司;邻苯二甲醛(phthalaldehyde,OPA):天津市光复科技发展有限公司;四硼酸钠、β-巯基乙醇、1,1-二苯基-2-苦基苯基(1,1-diphenyl-2-bitter phenylyl,DPPH):天津市凯信化学工业有限公司;无水乙醇、氯化亚铁、三氯化铁、三氯乙酸、铁氰化钾、菲洛嗪、抗坏血酸、2-硫代巴比妥酸、2,6-二叔丁基-4-甲基苯酚、磷酸二氢钾、磷酸氢二钾、氯化钠:国药集团化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
3K-15高速冷冻离心机:德国Sigma公司;JJ224BC型电子天平:常熟市双杰测试仪器厂;PHS-3C pH计:上海三信仪器厂;DF-II恒温水浴磁力搅拌器:金坛市顺华仪器有限公司;TDL80-2B台式离心机:上海安亭科学仪器厂;TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;FD-IA-50冷冻干燥机:北京博医康实验仪器有限公司。
1.3 实验方法
1.3.1 酪蛋白的提取
将新鲜荷斯坦牛乳在高速冷冻离心机中4℃、6000 r/min离心15 min,弃去上层脂肪,取其下清液逐滴加入1 mol/L的HCl,并且缓慢搅拌使其沉降,静置4 h后用纱布过滤,用蒸馏水洗涤沉淀4次,即得盐酸沉淀酪蛋白;将其置于冷冻干燥机中干燥48 h。将干燥好的酪蛋白粉碎,冷藏备用。
1.3.2 酪蛋白的水解
准确称取10.0 g酪蛋白,加入300 mL蒸馏水溶解,45 ℃加热磁力搅拌,溶解过程中加1 mol/L NaOH调节pH值始终控制在7.0左右,直至酪蛋白溶解后用蒸馏水定容至500 mL。向酪蛋白溶液中加入400 μL质量浓度为0.1 g/mL的胰蛋白酶,在pH 7.0的条件下恒温水浴37 ℃磁力搅拌3 h,酶解结束后在沸水浴中5 min灭酶活,冷水中迅速冷却。
1.3.3 酪蛋白水解度的测定
赖氨酸标准曲线的绘制:准确称取40 mg OPA溶于1.00 mL体积分数95%的乙醇溶液中,移取pH 9.5的0.1 mol/L四硼酸钠缓冲溶25.00 mL、SDS溶液(20 mg/100 mL)2.50 mL、β-巯基乙醇100 μL混合均匀,用蒸馏水定容至50 mL。称取赖氨酸0.050 0 g,用蒸馏水定容至100 mL,配成质量浓度为500 μg/mL的溶液。分别移取适量赖氨酸溶液,稀释至400 μg/mL、300 μg/mL、200 μg/mL、100 μg/mL、50 μg/mL。取上述赖氨酸溶液400 μL,用磷酸盐缓冲液(pH 7.0)稀释至7.5 mL;取上述溶液200 μL,加入6.00 mL OPA试剂,混合均匀后室温条件下暗室放置5 min,以200 μL蒸馏水和6.00 mL OPA试剂混合液为参比,测定波长340 nm处的吸光度值;以赖氨酸质量浓度(x)作为横坐标,吸光度值(y)作为纵坐标,绘制标准曲线。
水解度的测定:取400 μL酪蛋白酶解液或未加酶的酪蛋白溶液,用磷酸盐缓冲液(pH 7.0)稀释至7.5 mL;取200 μL上述酶解液,加入6.00 mL OPA试剂,混合均匀后室温条件下暗室放置5 min,以200 μL蒸馏水和6.00 mL OPA试剂混合液为参比,测样品在波长340 nm处的吸光度值。酪蛋白水解度计算公式[18]如下:
式中:A0为未加酶样品的吸光度值;A为酶解后样品的吸光度值。
1.3.4 酪蛋白多肽的分离
离子交换树脂的预处理:称取200 g D201树脂置于烧杯中,倒入饱和食盐水,使饱和食盐水完全浸没树脂,并不断搅拌以除去气泡,使之充分混合,静置24 h。
将泡好的树脂装入分离柱中,用2倍柱体积的饱和食盐水缓慢冲洗树脂,然后用蒸馏水洗至无黄色液体流出。
用5倍柱体积4%的NaOH溶液浸泡,再用蒸馏水冲洗至中性;用5倍柱体积4%的HCl浸泡,再用蒸馏水冲洗至中性。
多肽的分离:在室温条件下,将水解后的酪蛋白溶液160 mL流过D201阴离子交换树脂层析柱,采用氯化钠梯度洗脱,氯化钠浓度为0~3%,洗脱液总体积为2 000 mL,分管收集分离出的液体,每管收集15 mL,洗脱液用紫外-可见分光光度计在波长280 nm处测定吸光度值。以洗脱液体积为横坐标,洗脱液吸光度值为纵坐标绘制洗脱曲线。
根据洗脱曲线,合并同一洗脱峰,置于透析袋(截留分子质量0.1 kDa)中透析24 h,采用冷冻干燥机冻干,即得酪蛋白多肽。
1.3.5 抗氧化性测定
还原力的测定:参考GU F等[19]的方法,准确称取适量酪蛋白肽,用蒸馏水配制成质量浓度为1.0 mg/mL的溶液,取多肽溶液1 mL,与1.0 mL浓度为0.2 mmol/L的磷酸盐缓冲液(pH 6.6)和1.0 mL 1%的铁氰化钾[K3Fe(CN)6]混合。将反应混合物在50 ℃水浴中温育20 min,冷却至室温后加入1.0 mL的10%三氯乙酸。使用离心机在25 ℃条件下将混合物4 000 r/min离心10 min。取离心后的上清液2.0 mL,加入2.0 mL蒸馏水和400 μL 0.1%FeCl3。使用紫外-可见分光光度计在波长700 nm处测量反应混合物的吸光度值。还原力表示为波长700 nm处的吸光度值,以2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)作为抗氧化剂参照物比较还原力。
DPPH自由基清除活力的测定:参考BENJAKUL S等[20]的方法,将2.0 mL质量浓度为1.0 mg/mL的多肽溶液加入4.0 mL DPPH浓度为0.1 mmol/L的乙醇溶液,将溶液剧烈混合,并在室温条件下于黑暗中静置20 min。将混合物4 000 r/min离心10 min。使用紫外-可见分光光度计在波长517 nm处测量上清液的吸光度值,记为A1;用等体积乙醇溶液替代DPPH溶液,吸光度值记为A2,等体积水代替样品溶液,吸光度值记为A0;等体积水和乙醇混合溶液调零。DPPH自由基清除力计算公式如下:
Fe2+螯合力的测定:将2.0 mL质量浓度为1.0 mg/mL的多肽溶液与3.7 mL蒸馏水和0.1 mL浓度为2.0 mmol/L的FeCl2混合,将混合物在室温条件下静置30 s;加入0.2 mL浓度为5 mmol/L菲洛嗪并混合,在室温条件下静置10 min,4 000 r/min离心5 min;用紫外-可见分光光度计测定波长562 nm处的吸光度值,记为A1。用水代替样品作为空白,以相同的方式进行测定,记为A2。Fe2+螯合力计算公式[21]如下:
脂质过氧化抑制力的测定:参考YI O S等[22]的方法,将卵磷脂悬浮于质量浓度为10.0 mg/mL的磷酸盐缓冲液(0.01 mmol/L,pH 7.4)中,溶液标记为LLS。将15 g三氯乙酸(trichloroacetic acid,TCA)、0.37 g硫代巴比妥酸(thiobarbituric acid,TBA)和2 mL浓HCl加入蒸馏水中,将体积调节至100 mL,标记为TCA-TBA-HCl。将1 mL LLS、1.0 mL 400 μmol/L FeCl3、1.0 mL 400 μmol/L抗坏血酸和1.0 mL样品溶液依次混合。将溶液在37 ℃黑暗的水浴中放置60 min,再加入2.0 mL TCA-TBA-HCl。混合液在90~100 ℃水浴加热15 min后用冰水冷却。将溶液以750 r/min离心10 min,采用紫外-可见分光光度计于波长532 nm处测定上清液的吸光度值,记为As。用1.0 mL蒸馏水替代样品,吸光度值记为Ac。脂质过氧化抑制力计算公式如下:
1.3.6 数据处理
各组数据均为3次实验的平均值±标准偏差,采用SPSS 18.0(SPSS Inc.,USA)进行显著性分析,采用Origin 8.5软件作图。
2 结果与分析
2.1 酪蛋白水解度
赖氨酸标准曲线如图1所示。
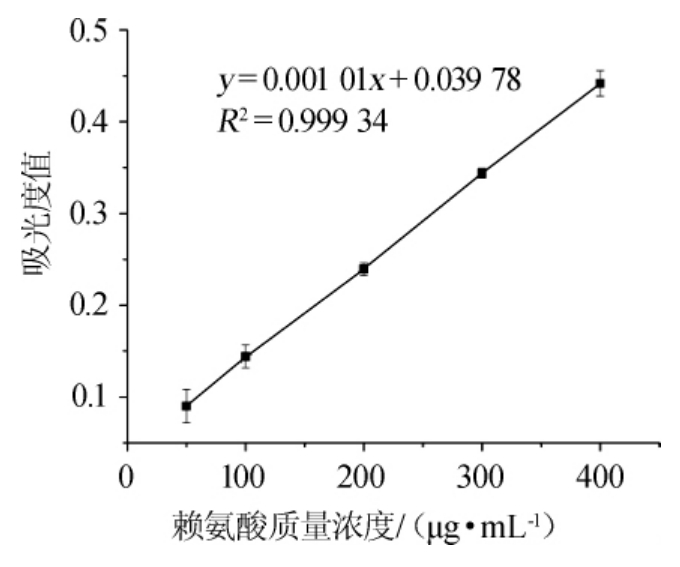
图1 赖氨酸标准曲线
Fig.1 Standard curve of lysine
由图1可知,经线性拟合,得到赖氨酸标准曲线方程为y=0.001 01x+0.039 78,方程相关系数R2为0.999 8,可以满足实验要求。经标准曲线方程计算得知,酪蛋白的水解程度为(83.33±3.26)%,由此可见,酪蛋白的水解程度较高。
2.2 酪蛋白多肽的分离
酪蛋白的胰蛋白酶水解液经过D201阴离子交换树脂分离的洗脱曲线见图2。
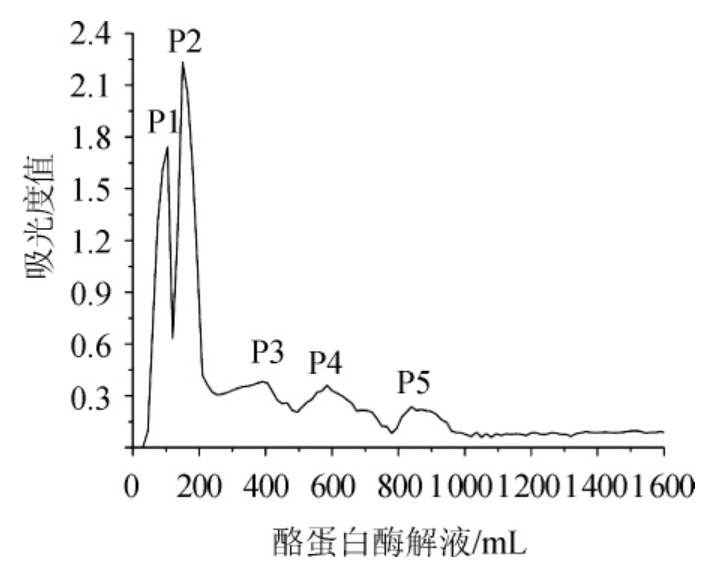
图2 酪蛋白酶解液洗脱曲线
Fig.2 Elution curve of casein enzymatic hydrolysate
由图2可知,采用D201阴离子交换树脂对酪蛋白酶解液分离后得到5个峰(分别标记为P1、P2、P3、P4、P5),实现了很好的分离。
2.3 酪蛋白多肽的抗氧化性
2.3.1 还原力
还原力是衡量多肽抗氧化性的重要指标之一,评价的是多肽的给电子能力。据报道,甲硫氨酸残基的硫原子可供电子,因而具有较强的还原力;甘氨酸的侧链有一个氢原子,使多肽具有很好的构象柔性,而脯氨酸的吡咯烷环可以阻止多肽的α-螺旋结构生成,这些氨基酸的存在有利于多肽中其他氨基酸残基抗氧化性的发挥[23-26]。对分离获得的5种酪蛋白多肽和未分离的酪蛋白酶解液进行还原力测定,结果见图3。

图3 酪蛋白酶解液及多肽的还原力
Fig.3 Reducing powers of casein enzymatic hydrolysate and polypeptide
不同小写字母表示差异显著(P<0.05)。下同。
由图3可以看出,酪蛋白酶解液的还原力最低,其吸光度值为0.026。酪蛋白多肽P2的还原力最大,其吸光度值为0.231。酪蛋白多肽的还原力顺序为P2>P1>P4>P5>P3,且多肽间还原力差异显著(P<0.05)。由此可见,经过分离后,还原力较高的肽段得以富集。
2.3.2 DPPH自由基清除力
对分离获得的5种酪蛋白多肽和未分离的酶解液进行DPPH自由基清除力测定,结果见图4。

图4 酪蛋白酶解液及多肽的DPPH自由基清除力
Fig.4 DPPH radical scavenging activities of casein enzymatic hydrolysate and polypeptide
由图4可以看出,与未分离的酶解液相比,分离所得的5个肽段DPPH自由基清除活力均高于酶解液。就多肽而言,多肽P4的DPPH自由基清除活性最强达到(23.8±0.18)%,P3的清除活性最差为(4.5±0.16)%;多肽P4与P2的DPPH自由基清除活性相当,均高于多肽P1。DPPH法测定多肽抗氧化性是基于单电子转移机理,可用于评价多肽提供电子的能力[15-16]。多肽P3的DPPH自由基清除活性是5个多肽中最差的,这一结果与还原力测定结果一致。虽然多肽P4、P5的还原力低于其他肽段,但其自由基清除活性并不低于其他肽段,这是因为多肽的自由基清除活性较还原力而言受到的影响因素更多、更为复杂,如pH、分子质量等[27-28]。
2.3.3 Fe2+螯合能力
对分离获得的5种酪蛋白多肽进行Fe2+螯合能力的测定,以未分离的酪蛋白酶解液为对照,结果见图5。
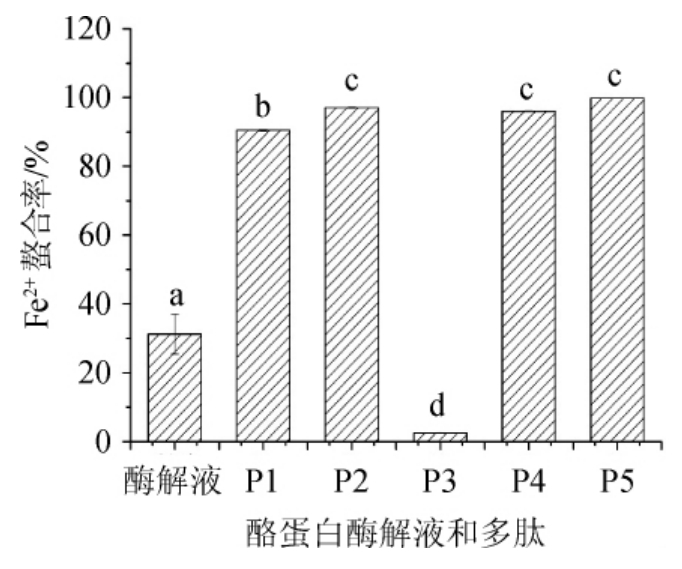
图5 酪蛋白酶解液及多肽的Fe2+螯合率
Fig.5 Fe2+chelating activities of casein enzymatic hydrolysate and polypeptide
由图5可以看出,未分离的酶解液Fe2+螯合率为(31.27±5.80)%。多肽P3的螯合率为(2.50±0.14)%,基本可忽略。其他4个肽段的Fe2+螯合率均>90%,其中多肽P5的Fe2+螯合率达(99.80±0.12)%,表现出极好的金属螯合能力。
据报道,组氨酸的咪唑基团可以螯合金属离子;酸性氨基酸(如谷氨酸、天门冬氨酸)带负电的侧链具有较好的金属螯合能力;碱性氨基酸赖氨酸也具有金属螯合能力[23-27]。采用阴离子交换树脂分离多肽的机理基于带负电荷的肽段被吸附于树脂上,在用盐洗脱的过程中,Cl-将多肽交换下来,从而实现了分离。由此可见,分离所得的肽段中性条件下带有负电荷,酸性氨基酸含量较高,从而表现出极高的金属螯合能力。肽段P3可能在金属螯合力测定条件下发生自组装,形成多聚体,或因其分子质量及构象影响,基本没有金属螯合能力,具体原因有待进一步研究。
2.3.4 脂质过氧化抑制力
对分离获得的5种酪蛋白多肽进行脂质过氧化抑制力的测定,以未分离的酪蛋白酶解液为对照,结果见图6。
由图6可以看出,酪蛋白酶解液表现出一定的脂质过氧化抑制力,抑制率为(14.82±0.12)%,而分离所得的肽段P1和P4抑制力较差,多肽P2和P3不具备脂质过氧化抑制能力;多肽P5的抑制力为(13.58±0.38)%。总而言之,多肽的脂质过氧化抑制力低于酶解液。
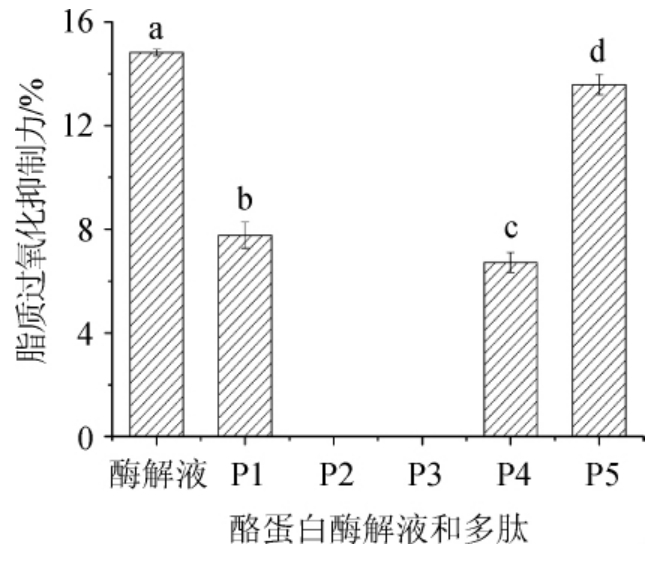
图6 酪蛋白酶解液及多肽的脂质过氧化抑制力
Fig.6 Lipid peroxidation inhibition of casein enzymatic hydrolysate and polypeptide
3 结论
利用牛乳酪蛋白为原料,经过胰蛋白酶充分水解后,再通过D201阴离子交换树脂梯度洗脱分离出5个较显著的肽片段,其分离效果较好。对酪蛋白酶解液与分离所得的5个肽段分别进行抗氧化性测定,对比还原力和DPPH自由基清除能力发现,分离出的肽段高于酶解液。P1、P2、P4、P5肽段的还原力、DPPH自由基清除活力、Fe2+螯合力均明显高于P3肽段,其中,P2肽段的还原力最高,为0.234,然后是P3肽段,为0.057;P4肽段的DPPH自由基清除活力最高,达到(23.8±0.18)%,然后是P3肽段,为(4.5±0.16)%;P5肽段的Fe2+螯合力最高,高达(99.80±0.12)%,P3肽段的Fe2+螯合力最低,为(2.50±0.14)%,而酶解液的Fe2+螯合率为(31.27±5.80)%。酶解液的脂质过氧化抑制力高于多肽;P5肽段的脂质过氧化抑制力为(13.58±0.38)%,略低于酶解液,酶解液的抑制力是(14.82±0.12)%,而P2、P3肽段不具备脂质过氧化抑制力。综上所述,酪蛋白多肽P1、P4、P5具有较好的抗氧化性。
[1]杨永新,王加启,卜登攀,等.牛乳重要营养品质特征的研究进展[J].食品科学,2013,34(1):328-332.
[2]SILVA S V,MALCATA F X.Caseins as source of bioactive peptides[J].Int Dairy J,2005,15(1):1-15.
[3]高维东,纪银莉,刘恭,等.牦牛乳酪蛋白抑菌肽制备工艺研究[J].食品工业,2013(11):160-162.
[4]付莉,王冰.中性蛋白酶制备酪蛋白抗菌肽的研究[J].中国农学通报,2012,28(27):283-289.
[5]刘剑虹,庞广昌,于金华,等.酪蛋白磷酸肽(CPPs)的纯化研究[J].食品科学,2001,22(4):31-35.
[6]TUNICK M H,REN D X,VAN HEKKEN D L,et al.Effect of heat and homogenization on in vitro digestion of milk[J].J Dairy Sci,2016,99(6):4124-4139.
[7]高婷,沈浥,卢蓉蓉.酪蛋白抗氧化肽制备工艺及酶解产物特性研究[J].食品工业科技,2010,31(6):192-195.
[8]FITZGERALD R J,MEISEL H.Milk protein-derived peptide inhibitors of angiotensin-I-converting enzyme[J].Brit J Nutr,2000,84(S1):33-37.
[9]吴丹,赵新淮.高活性酪蛋白抗氧化肽的制备方法研究[J].食品科学,2009,30(21):283-287.
[10]郁晓盼,赵肖蓉,牟光庆.酪蛋白抗氧化肽的制备及初步分离[J].食品科技,2011(5):29-31.
[11]宋晓光,李秉润,王少平,等.水蛭活性肽的纯化工艺[J].中国医院药学杂志,2017,37(23):2322-2325.
[12]胡赞扬,刘会平,董婷,等.干酪乳清中酪蛋白糖巨肽的分离纯化研究[J].现代食品科技,2010,26(3):222-224.
[13]JIANG X Y,PAN D D.Study on antifatigue effect of milk protein-derived peptide[J].Food Sci,2009,30(9):191-194.
[14]HERNANDEZ-LEDESMA B,DAVALOS A,BARTOLOME B,et al.Preparation of antioxidant enzymatic hydrolysates from alpha-lactalbumin and beta-lactoglobulin.Identification of active peptides by HPLC-MS/MS[J].J Agr Food Chem,2005,53(3):588-593.
[15]TSOPMO A,ROMANOWSKI A,BANDA L,et al.Novel anti-oxidative peptides from enzymatic digestion of human milk[J].Food Chem,2011,126(3):1138-1143.
[16]CHEN H,MURAMOTO K,YAMAUCHI F,et al.Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J].J Agr Food Chem,1996,44(9):2619-2623.
[17]刘丽莎,彭义交,任丽,等.分步酶解法制备黄浆水活性肽[J].中国酿造,2015,34(10):13-17.
[18]YANG M,CUI N,FANG Y,et al.Influence of succinylation on the conformation of yak casein micelles[J].Food Chem,2015,179:246-252.
[19]GU F,JIN M K,HAYAT K,et al.Characteristics and antioxidant activity of ultrafiltrated Millard reaction products from a casein-glucose model system[J].Food Chem,2009,117(1):48-54.
[20]BENJAKUL S,VISESSANGUAN W,PHONGKANPAI V,et al.Antioxidative activity of caramelisation products and their preventive effect on lipid oxidation in fish mince[J].Food Chem,2005,90(1-2):231-239.
[21]LI J,LIU Q,KONG B H,et al.Characteristics and antioxidant activity of Maillard reaction products from porcine plasma protein hydrolysategalactose model system[J].Adv Mat Res,2012,(554-556):1042-1048.
[22]YI O S,MEYER A S,FRANKEL E N.Antioxidant activity of grape extracts in a lecithin liposome system[J].J Am Oil Chem Soc,1997,74(10):1301-1307.
[23]SUETSUNA K.Antioxidant peptides from the protease digest of prawn(Penaeus japonicus)muscle[J].Mar Biotechnol,2000,2(1):5-10.
[24]ALEMAN A,GIMENEZ B,PEREZSANTIN E,et al.Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J].Food Chem,2011,125(2):334-341.
[25]MENDIS E,RAJAPAKSE N,KIM S K.Antioxidant properties of a radical-scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J].J Agr Food Chem,2005,53(3):581-587.
[26]NGO D H,QIAN Z J,RYU B M,et al. In vitro antioxidant activity of a peptide isolated from Nile tilapia(Oreochromis niloticus)scale gelatin in free radical-mediated oxidative systems[J].J Funct Foods,2010,2(2):107-117.
[27]HUANG G J,DENG J S,CHEN H J,et al.Defensin protein from sweet potato(Ipomoea batatas[L.]Lam'Tainong 57')storage roots exhibits antioxidant activities in vitro and ex vivo[J].Food Chem,2012,135(3):861-867.