纳豆是日本传统的发酵食品之一,起源于我国的豆豉[1]。唐朝时期,鉴真和尚东渡日本将豆豉带到了那里,逐渐演变成为纳豆[2-3]。在我国,李时珍的《本草纲目》中就已经有豆豉可以入药的记载[4];在日本民间,纳豆长期应用于治疗伤寒、痢疾等疾病[5-6]。20世纪日本研究者须见洋行首次从纳豆中分离出一株枯草芽孢杆菌(Bacillus subtilis),并发现其产生的纳豆激酶具有良好的溶解血栓的功能[7]。1905年,SAUMUR从纳豆中分离出一株γ-聚谷氨酸生产菌,命名为B.natto Sawamura[8],后来FUJI等学者又证明纳豆中含有γ-聚谷氨酸[9]。
γ-聚谷氨酸(γ-polyglutamate acid,γ-PGA)是一种由微生物发酵合成的氨基酸聚合物,通过谷氨酸的α-NH2和γ-COOH以酰胺键结合形成[10]。γ-PGA主链上存在大量肽键,在自然界或人体内可生物降解成短肽小分子和氨基酸单体,不产生毒副作用[11],分子链上具有大量的活性较高的游离侧链羧基(-COOH),易于和一些药物结合生成稳定的复合物[12],具有优良的生物兼容性和生物降解性,是理想的可生物吸收的医药用高分子材料[13]。本试验选取从纳豆中分离的纳豆芽孢杆菌(Bacillus natto)TK-2菌株,通过微生物发酵生产γ-聚谷氨酸,具有容易操作和控制,生产成本较低,产率较高的特点。γ-PGA对环境无污染,为绿色生物产品,被广泛应用于医药制造,食品加工,蔬菜、水果、海产品的防冻、保鲜及植物种子保护等许多领域,是一种具有极大开发价值和广阔应用前景的多功能新型生物制品[14]。本研究通过单因素以及正交试验对Bacillus natto TK-2产γ-PGA的发酵工艺进行优化,并对其发酵产物进行高效液相色谱(high performance liquid chromatogramphy,HPLC)分析,为γ-PGA的综合开发利用提供理论支撑依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
Bacillus natto TK-2菌种:学校食品工程实验室提供;蔗糖、果糖、麦芽糖、乳糖、味精等(均为食品级)、蛋白胨、牛肉膏、酵母膏、硫酸铵、尿素、乙醇、硝酸钠、氢氧化钠、柠檬酸、硝酸钾等(均为分析纯):北京百灵威科技有限公司。
1.1.2 培养基
肉汤培养基:牛肉膏0.5%,蛋白胨1%,NaCl 0.5%,琼脂2%,pH 7.2,121 ℃,0.1 MPa,灭菌15 min。种子液培养基:葡萄糖2%,蛋白胨1%,MgSO4·7H2O 0.05%,K2HPO4·3H2O 0.26%,pH 7.2,121 ℃,0.1MPa,灭菌20min。发酵培养基:碳源2.5%,味精2%,氮源3%,MgSO4·7H2O 0.05%,K2HPO4·3H2O 0.26%,pH 7.2,分装于250 mL的摇瓶中,每瓶装液50 mL,121 ℃,0.1 MPa,灭菌20 min。
1.2 仪器与设备
CX43光学显微镜:日本OLYMPUS公司;LRH250C生化培养箱:广东省医疗器材厂;冷冻干燥机:美国KENDRO公司;756型紫外/可见分光光度计:上海光谱仪器有限公司;PHSJ-4A型pH计:上海雷磁公司;AvantiJXN-30型高效离心机:BECKMAN COULTER公司;LC-100PHP型高效液相色谱仪:杭州俊升科学器材有限公司。
1.3 方法
1.3.1 菌种的培养
将菌株TK-2接种于肉汤培养基,37 ℃活化培养1 d,再接种于种子培养基中,37 ℃、170 r/min培养12 h,按一定接种量接种于发酵培养基,37 ℃、140 r/min条件下培养。
1.3.2 纳豆芽孢杆菌TK-2生长曲线的测定
利用分光光度法测定[15]。取29 mL空白液再加入1 mL发酵液,混合均匀,倒入比色皿中,在波长660 nm处测定OD660nm值,每隔2 h测定1次,直至菌种由生长期进入到衰退期。
1.3.3 γ-聚谷氨酸的纯化
(1)菌体的分离
将发酵液12 000 r/min、4 ℃条件下离心30 min,取上清液备用。
(2)乙醇沉淀
在上清液中缓慢加入3倍体积的体积分数95%乙醇提取,加入后出现蛋清状的物质,缓慢旋转摇瓶,使蛋清状物质慢慢成团聚集,最后用镊子夹出,用去离子水洗涤沉淀物[16]。
(3)丙酮沉淀
将乙醇沉淀后的粗样品溶解在0.015 mol/L、pH 7.0的K2HPO4-KH2PO4缓冲溶液中,加入4倍体积的丙酮,缓慢旋转摇瓶,使蛋清状物质慢慢成团聚集,最后用镊子夹出,用去离子水洗涤沉淀物[17]。
(4)透析除盐
把丙酮沉淀提取的沉淀物倒入截流分子质量8 000~12 000 Da的透析袋内,每隔2 h换1次水,4 ℃冰箱中保存,透析6 h,取出进行冷冻干燥称其质量[18]。
1.3.4 γ-聚谷氨酸产量的测定
将纯化后的γ-聚谷氨酸冷冻干燥后称质量,计算其产量。
式中:M为制备的γ-聚谷氨酸质量,g;V为发酵液的体积,L。
1.3.5 HPLC分析
称取谷氨酸标准样0.1 g,用蒸馏水定容至10 mL,取1 mL为待测谷氨酸标准样溶液。称取提纯的γ-聚谷氨酸0.1 g,用蒸馏水定容到10 mL,在封闭的磨口水解管中加入1 mL γ-聚谷氨酸溶液和10 mL的6 mol/L的盐酸,37 ℃,水解24 h,12 000 r/min离心30 min,取上清液1 mL为待测γ-聚谷氨酸水解液。
HPLC条件:荧光检测器;HydrosphereC18分析柱(4.6mm×25mm);流动相:体积比为6∶4的乙腈水溶液;流速:0.5mL/min;检测波长:发射波长350 nm,激发波长450 nm;用0.45 μm的滤膜将样品过滤除去杂质;进样量20 μL。
1.3.6 发酵培养基配方优化单因素试验
(1)碳源种类及添加量的选择
选取葡萄糖、蔗糖、乳糖、果糖、苹果酸、乙酸、麦芽糖、可溶性淀粉、柠檬酸、甘油等10种碳源,按2%水平分别加入到发酵培养基中,发酵培养,测定γ-PGA产量,确定最佳碳源。选取最佳碳源,按1%~8%的水平分别加入到发酵培养基中,发酵培养,测定γ-PGA产量,确定碳源最佳添加量。
(2)氮源种类及添加量的选择
选取酵母浸粉、玉米浆、蛋白胨、牛肉膏、NH4Cl、尿素、KNO3、NaNO3、(NH4)2SO4、NH4NO310种氮源,按2.5%水平分别加入发酵培养基中,发酵培养,测定γ-PGA产量,确定最佳氮源。选取最佳氮源,按0.5%~4.0%的水平分别加入发酵培养基中,发酵培养,测定γ-PGA产量,确定氮源最佳添加量。
(3)味精添加量的选择
味精按1%~7%的水平分别加入发酵培养基中,发酵培养,测定γ-PGA含量,确定最佳味精添加量。
(4)初始pH值的选择
选取发酵培养基初始pH值分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的发酵培养,测定γ-PGA产量,确定最佳初始pH值。
1.3.7 发酵培养基配方优化正交试验设计
在单因素试验的基础上,选取碳源、氮源、味精的添加量3个因素,以γ-PGA产量为评价指标,按表1进行正交试验[19]。
表1 发酵培养基配方优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for fermentation medium formula optimization

1.3.8 发酵工艺条件优化单因素试验
(1)装液量的选择
选取装液量分别为30 mL/250 mL、40 mL/250 mL、50mL/250mL、60mL/250mL、70mL/250mL、80mL/250mL、90 mL/250 mL,接种量2%,37 ℃、140 r/min振荡培养24 h,测定γ-PGA含量,确定最佳的装液量。
(2)接种量的选择
装液量为70mL/250 mL,接种量分别为1%、2%、3%、4%、5%、6%、7%,37 ℃、140 r/min振荡培养24 h,测定γ-PGA产量,确定最佳接种量。
(3)培养温度的选择
装液量为70 mL/250 mL,接种量2%,培养温度分别为28 ℃、32 ℃、37 ℃、40 ℃、42 ℃,140 r/min振荡培养24 h,测定γ-PGA产量,确定最佳培养温度。
(4)转速的选择
装液量为70 mL/250 mL,接种量2%,37 ℃,转速分别为80 r/min、110 r/min、140 r/min、170 r/min、200 r/min振荡培养24 h,测定γ-PGA产量,确定最佳的转速。
1.3.9 发酵动态曲线的绘制
在优化的最佳培养基和最佳发酵培养条件下进行摇瓶发酵实验,发酵培养30 h,每隔3 h从摇床上取下一瓶,测定发酵液的γ-PGA产量及其在波长660 nm处的OD660nm值,绘制Bacillus natto TK-2的发酵动态曲线[20]。
2 结果与分析
2.1 纳豆芽孢杆菌TK-2的生长曲线
每隔2 h测定波长660 nm处种子的OD660nm值,测定30 h菌种的生长状态,直至菌种由生长期进入到衰退期,生长曲线如图1。
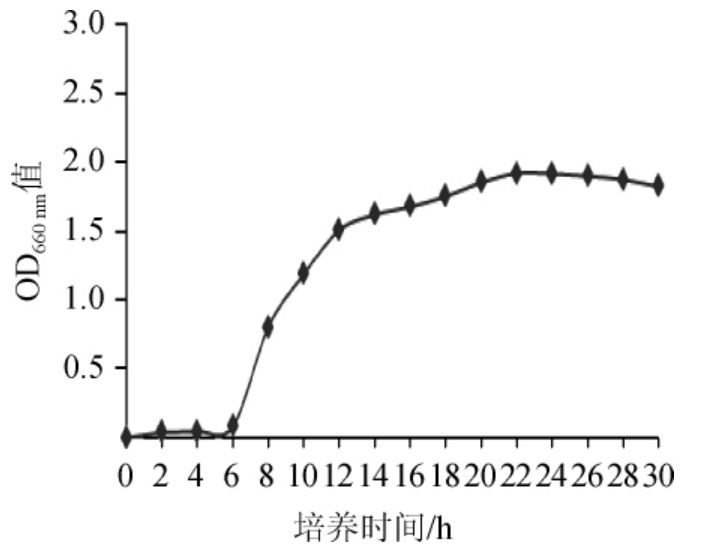
图1 纳豆芽孢杆菌TK-2生长曲线
Fig.1 Growth curve of Bacillus natto TK-2
由图1可以看出,纳豆菌生长6 h开始进入对数生长期,12 h进入对数生长的中期,在12 h时把种子液接种到发酵液中。
2.2 发酵培养基配方的优化
2.2.1 碳源种类及添加量的确定
装液量为70 mL/250 mL,接种量2%,37 ℃、140 r/min振荡培养24 h。不同的碳源对γ-PGA产量的影响如图2,碳源添加量对γ-PGA产量的影响结果见图3。

图2 不同碳源对γ-聚谷氨酸产量的影响
Fig.2 Effect of different carbon sources on γ-polyglutamic acid yield
由图2可以看出,葡萄糖和蔗糖做为碳源的γ-PGA的产量比麦芽糖等其他碳源相对较好,可能是葡萄糖和蔗糖作为培养基的碳源比较有利于菌体的发酵反应。结合经济条件考虑,选择葡萄糖为最佳碳源比较合适。
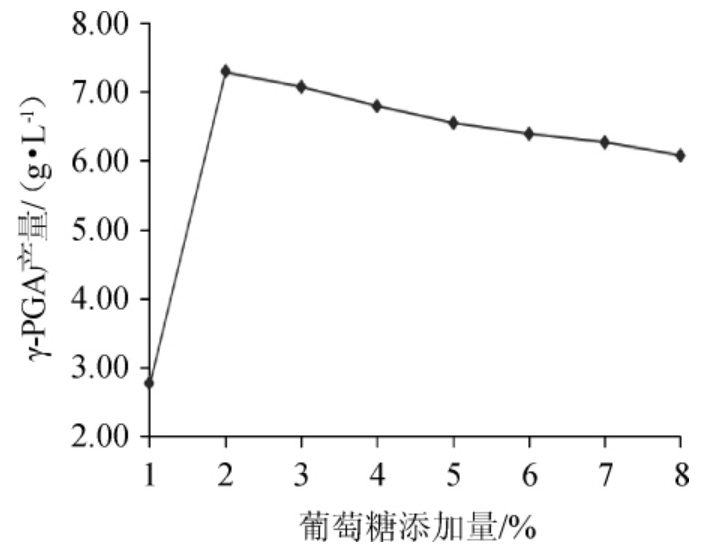
图3 葡萄糖添加量对γ-聚谷氨酸产量的影响
Fig.3 Effect of glucose addition on γ-polyglutamic acid yield
由图3可以看出,随着葡萄糖添加量的增加,发酵液中的γ-PGA产量逐渐增大,当葡萄糖添加量为2%时,γ-PGA产量最高。再增加葡萄糖添加量,γ-PGA产量逐渐降低。这是因为当葡萄糖添加量太低时,不够菌体生长所需;而当葡萄糖添加量过大时,对菌体的生长及γ-PGA的生成有抑制作用。综合分析,选择葡萄糖添加量为2%比较合适。
2.2.2 氮源种类及添加量的确定
装液量为70 mL/250 mL,接种量2%,37 ℃、140 r/min振荡培养24 h。不同的氮源对γ-PGA产量的影响如图4,氮源添加量对γ-PGA产量的影响结果见图5。

图4 不同氮源对γ-聚谷氨酸产量的影响
Fig.4 Effect of different nitrogen sources on γ-polyglutamic acid yield
由图4可以看出,蛋白胨、牛肉膏等有机氮源对发酵液中生成γ-PGA产量比氯化铵、硫酸铵等无机氮源高。而有机氮源中蛋白胨对发酵液的γ-PGA产量的效果要优于其他的有机氮源,可能是蛋白胨做为培养基中的有机氮源更有利于菌体的发酵反应。综合分析,选择蛋白胨为最优氮源。

图5 蛋白胨添加量对γ-聚谷氨酸产量的影响
Fig.5 Effect of peptone addition on γ-polyglutamic acid yield
由图5可以看出,随着蛋白胨添加量逐渐增大,发酵液中的γ-PGA产量逐渐增大,当蛋白胨添加量为2.5%时,发酵液中γ-PGA产量最高,而再增加蛋白胨添加量,γ-PGA产量逐渐降低。这是由于发酵反应初期,菌体的浓度比较大,随着蛋白胨添加量的加大,菌体与蛋白胨接触比较充分,发酵反应比较充分,随着反应的进行,菌体逐渐消耗,即使增大蛋白胨添加量,发酵反应程度也会降低。综合分析,选择蛋白胨添加量为2.5%比较合适。
2.2.3 味精添加量的确定
装液量为70 mL/250 mL,接种量2%,37 ℃、140r/min振荡培养24h。味精不同添加量对γ-PGA产量的影响结果见图6。
由图6可以看出,随着味精添加量的增加,发酵液中γ-PGA产量逐渐增大,当味精添加量为2%时,发酵液中γ-PGA产量最高。再增加味精添加量,γ-PGA产量逐渐降低。这是由于发酵反应初期,菌体的浓度比较大,随着味精添加量的加大,菌体与味精接触比较充分,发酵反应比较充分,随着反应的进行,菌体逐渐消耗,浓度降低,即使增大味精添加量,发酵反应程度也会降低。综合分析,选择味精添加量为2%比较合适。

图6 味精添加量对γ-聚谷氨酸产量的影响
Fig.6 Effect of monosodium glutamate addition on γ-polyglutamic acid yield
2.2.4 初始pH值的确定
装液量为70 mL/250 mL,接种量2%,37 ℃、140r/min振荡培养24 h。不同初始pH值对γ-PGA产量的影响结果见图7。

图7 初始pH值对γ-聚谷氨酸产量的影响
Fig.7 Effect of initial pH on γ-polyglutamic acid yield
由图7可以看出,随着初始pH值的增大,发酵液中的γ-PGA产量逐渐增大,当初始pH值为7.5时,发酵液中γ-PGA产量最大。再增大初始pH值,γ-PGA产量显著降低。这是因为发酵过程中,初始pH值是微生物在一定环境条件下代谢活动的综合指标,影响培养基中营养物质的离子化程度和微生物对营养物质的吸收,过酸性或过碱性环境都不利于菌种的发酵生长,初始pH值为7.5时比较有利于发酵反应的进行。综合分析,选择初始pH值为7.5比较合适。
2.3 发酵培养基配方优化正交试验结果
在单因素试验的基础上,选取葡萄糖添加量、蛋白胨添加量和味精添加量3个因素,设计正交试验,优化发酵培养基条件。正交试验结果见表2、方差分析结果见表3。
由表2和表3可以看出,最佳培养基配方为A3B2C2,即葡萄糖添加量2.5%,蛋白胨添加量2.5%,味精添加量2%。葡萄糖添加量、蛋白胨添加量和味精添加量对γ-PGA产量的影响因素大小为:A>C>B,即葡萄糖添加量>味精添加量>蛋白胨添加量,葡萄糖添加量具有显著性的影响(P<0.05),蛋白胨添加量和味精添加量均无显著性的影响(P>0.05)。
表2 发酵培养基配方优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for fermentation medium formula optimization
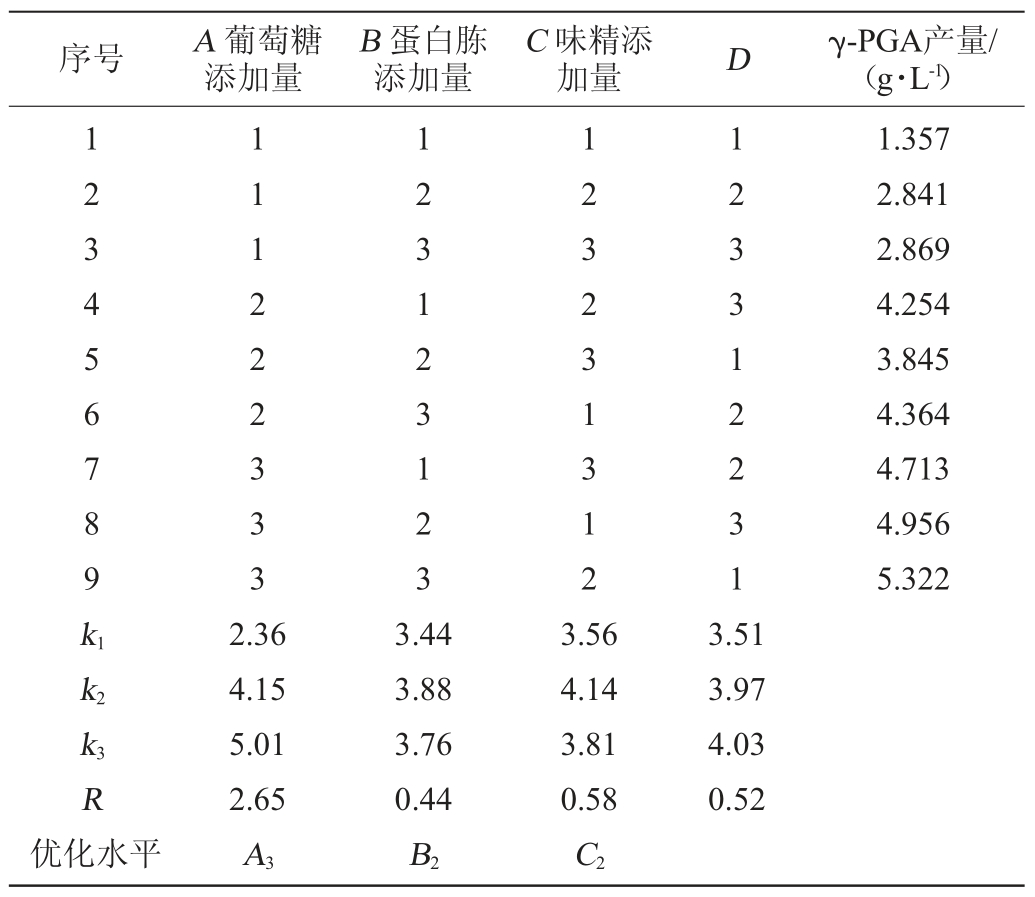
表3 方差分析结果
Table 3 Results of variance analysis
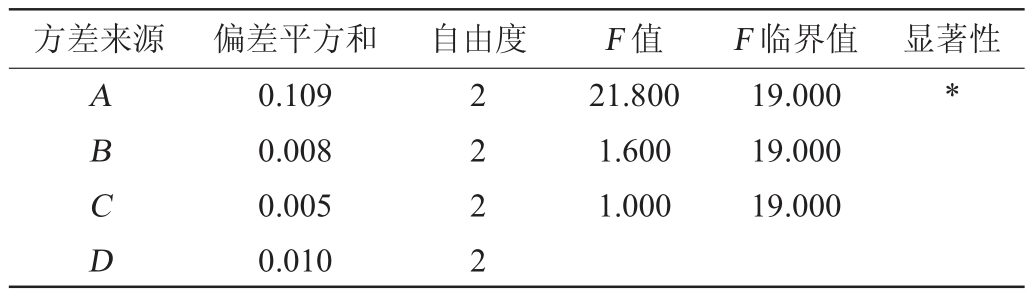
注:“*”表示对结果影响显著(P<0.05)。
综上所述,根据单因素试验及正交试验优化,发酵培养基最佳配方为:葡萄糖2.5%,蛋白胨2.5%,味精2%,pH 7.5。
2.4 发酵培养条件优化单因素试验
2.4.1 装液量的确定

图9 装液量对γ-聚谷氨酸产量的影响
Fig.9 Effect of loading volume on γ-polyglutamic acid yield
不同装液量对γ-PGA产量的影响如图8。由图8可以看出,随着装液量的增加,γ-PGA产量逐渐增大,当装液量达到70 mL/250 mL时,γ-PGA产量最高。再增大装液量,γ-PGA产量有较大幅度降低。综合分析,选择装液量为70mL/250mL比较合适。
2.4.2 接种量的确定
不同接种量对γ-PGA产量的影响如图9。由图9可以看出,随着接种量的增加,发酵液中的γ-PGA产量逐渐增大,当接种量为2%时,发酵液γ-PGA产量最大。再增加接种量,γ-PGA产量缓慢降低。这是因为发酵反应初期,菌体的浓度比较大,随着接种量的加大,菌体与种子接触比较充分,发酵反应比较充分,随着反应的进行,菌体逐渐消耗,浓度降低,即使增大接种量,发酵反应程度也会降低。综合分析,选择接种量为2%比较合适。
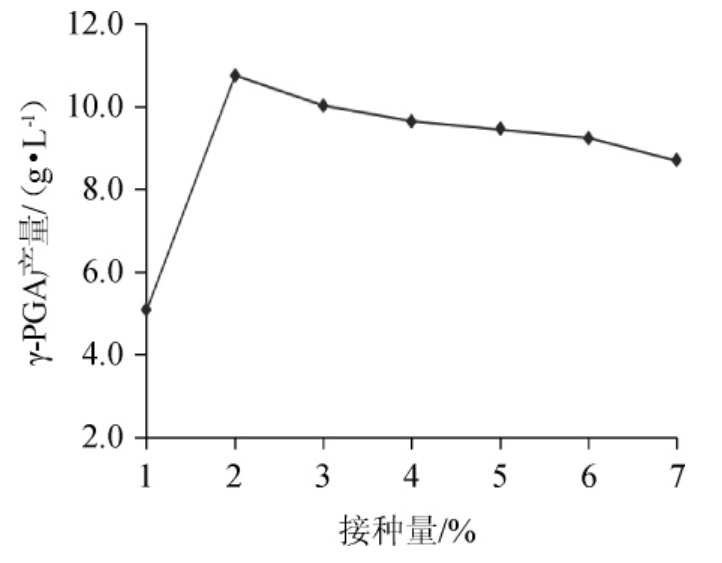
图9 接种量对γ-聚谷氨酸产量的影响
Fig.9 Effect of inoculum on γ-polyglutamic acid production
2.4.3 发酵温度的确定
不同温度对γ-PGA产量的影响如图10。由图10可以看出,随着培养温度的升高,发酵液中的γ-PGA产量逐渐增大,当培养温度达到37 ℃时,γ-PGA产量最大。再升高培养温度,γ-PGA产量显著降低。这是因为发酵反应初期,菌体的浓度比较大,升高温度可以加快发酵反应速度,随着反应的进行,菌体逐渐消耗,浓度降低,发酵反应程度也会降低。综合分析,选择培养温度为37 ℃比较合适。

图10 发酵温度对γ-聚谷氨酸产量的影响
Fig.10 Effect of fermentation temperature on γ-polyglutamic acid yield
2.4.4 转速的确定
不同转速对γ-PGA产量的影响如图11。由图11可以看出,随着转速的加大,发酵液中的γ-PGA产量逐渐增大,当转速达到140 r/min时,γ-PGA产量最大。再加大转速,γ-PGA产量开始降低。这是因为发酵反应初期,菌体的浓度比较大,加大转速可以加快发酵反应速度,随着反应的进行,菌体逐渐消耗,浓度降低,发酵反应程度也会降低。综合分析,选择转速为140 r/min比较合适。综上所述,最佳发酵培养条件:装液量70 mL/250 mL,接种量2%,培养温度37 ℃,转速140 r/min,振荡培养24 h,在此条件下进行验证试验,γ-PGA产量为11.48 g/L,产量提高了57.2%。
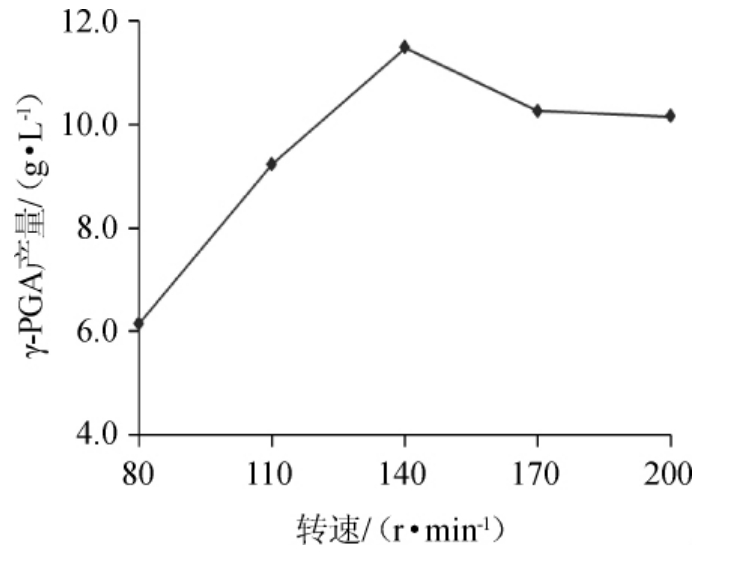
图11 转速对γ-聚谷氨酸产量的影响
Fig.11 Effect of shaking speed on γ-polyglutamic acid yield
2.5 发酵动态曲线
在优化的最佳培养基和最佳发酵培养条件下进行摇瓶发酵30 h,每隔3 h从摇床上取下一瓶,测定波长660 nm处的OD660nm值,绘制Bacillus natto TK-2的发酵动态曲线如图12,γ-PGA的产量动态曲线如图13。

图12 Bacillus natto TK-2的发酵动态曲线
Fig.12 Fermentation dynamic curve of Bacillus natto TK-2
由图12、图13可以看出,菌体在最佳发酵条件下能够快速的生长,经过3 h很快进入对数生长期,在21 h菌体进入平稳期。γ-聚谷氨酸的生成基本上与菌体的生长同步,从0~12 h生产γ-聚谷氨酸是缓慢的,在12~24 h能够较快速度地生成γ-PGA。之后随着发酵培养基营养物质的消耗,γ-PGA的产量趋于稳定并且有下降的趋势。
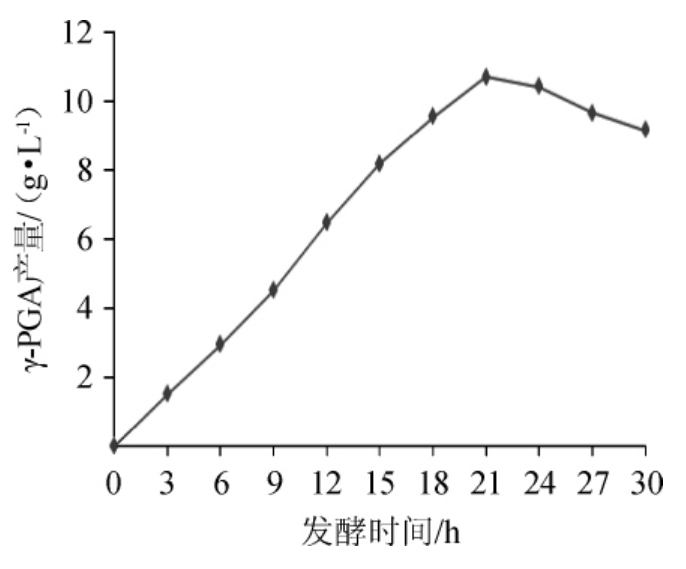
图13 γ-PGA的产量动态曲线
Fig.13 Dynamic curve of γ-PGA yield
2.6 HPLC分析
谷氨酸标准溶液和γ-PGA水解溶液的高效液相色谱图如图14所示。
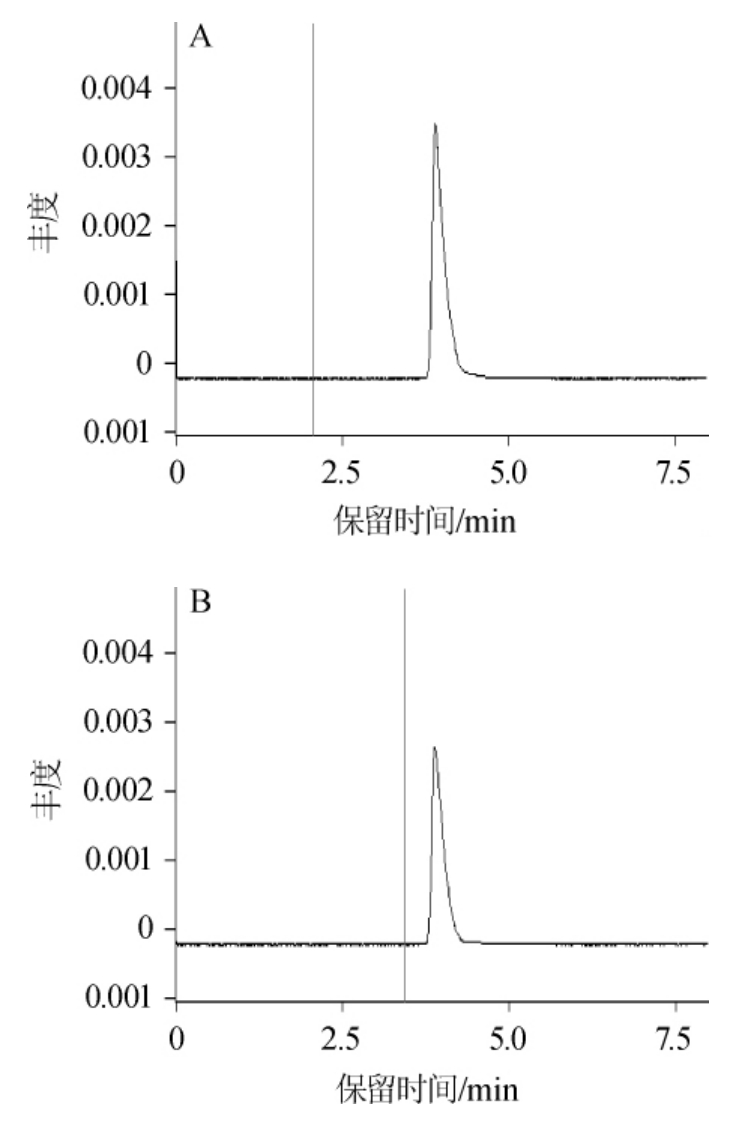
图14 谷氨酸标准溶液(A)以及γ-聚谷氨酸水解溶液(B)的高效液相色谱图
Fig.14 HPLC chromatogram of glutamate acid standard (A) and γ-polyglutamic acid hydrolytic solution (B)
由图14可以看出,γ-PGA水解产物只有一种氨基酸,并且与谷氨酸标准溶液的出峰时间基本相同,初步证明了γ-PGA为谷氨酸的一种聚合物,水解样与标准样比对基本一致。
3 结论
通过单因素试验及正交试验优化确定Bacillus natto TK-2发酵产γ-PGA的最佳培养基配方:葡萄糖2.5%,蛋白胨2.5%,味精2%,pH7.5;最佳发酵培养条件:装液量70mL/250mL,接种量2%,培养温度37 ℃,转速140 r/min;在此条件下进行验证试验,γ-PGA产量为11.48 g/L,产量提高了57.2%。
采用HPLC测定分析,γ-PGA是谷氨酸的一种聚合物,其水解产物只有一种氨基酸,并且与谷氨酸标准溶液的出峰时间基本相同。本研究成果为γ-PGA的综合开发利用提供理论支撑依据。
[1]高瑞萍,刘辉,刘嘉,等.纳豆的研究进展[J].食品与发酵科技,2011,47(1):23-26.
[2]孙婕,刘宁.纳豆的保健功效[J].中国调味品,2007,31(7):14-16,67.
[3]JOERG M B,ARGYRIOS M.Microbial biosynthesis of polyglutamic acid biopolymer and applications in the biopharmaceutical,biomedical and food industries[J].Crit Rev Biotech,2007,27(1):1-19.
[4]孙清荣.纳豆食品生产状况调研[J].食品工程,2010,38(4):16-18.
[5]付文静,王家林,张杰.中国纳豆生产工艺的研究现状及展望[J].食品工业,2018,39(3):230-233.
[6]齐凤元,李欢欢,杨利,等.响应面法优化花生纳豆的发酵工艺[J].中国粮油学报,2012,27(10):87-91,97.
[7]慕琦,向凌云,赵艳岭,等.纳豆红曲胶囊活性成分及其保健功能研究进展[J].河南科学,2018,36(10):1562-1568.
[8]ZHENG Z L,YE M Q,ZUO Z Y,et al.Probing the importance of hydrogen bonds in the active site of the subtilisin nattokinase by site-directed mutagenesis and molecular dynamics simulation[J].Biochem J,2006,395(5):509-515.
[9]王萌,许孝瑞. γ-聚谷氨酸在农业应用中的研究进展[J].黑龙江农业科学,2014,37(10):161-163.
[10]WU S,FENG C,ZHONG J,et al.Roles of S3 site residues of nattokinase on its activity and substrate specificity[J].J Biol Chem,2007,142(3):357-364.
[11]彭英云,张涛,缪铭,等. γ-聚谷氨酸的合成、性质和应用[J].食品与发酵工业,2012,38(6):133-138.
[12]曹名锋,金映虹,解慧,等.γ-聚谷氨酸的微生物合成相关基因及应用展望[J].微生物学通报,2011,38(3):388-395.
[13]吴高峰,黄占旺,刘宛玲,等.纳豆菌制剂及纳豆冻干粉成分比较分析[J].食品工业科技,2015,36(22):121-124.
[14]孙廷丽,施庆珊,欧阳友生,等.聚谷氨酸在医药领域的应用[J].生物技术进展,2012,02(1):34-38.
[15]张文,张树清,王学江. γ-聚谷氨酸的微生物合成及其在农业生产中的应用[J].中国农学通报,2014,30(6):40-45.
[16]徐虹,欧阳平凯.生物高分子:微生物合成的原理与实践[M].北京:化学工业出版社,2010:20-58.
[17]张艳丽,高华,于兹东,等.纳豆菌的分离及其发酵条件的优化[J].化学与生物工程,2008,25(10):68-72.
[18]李珣,周存宇,田春元,等.枯草芽孢杆菌中多聚-γ-谷氨酸的生物合成及其调控机制[J].应用与环境生物学报,2013,19(4):575-580.
[19]张文,张树清,马晓彤,等.纳豆芽孢杆菌(Bacillus natto)发酵生产γ-聚谷氨酸过程中培养基组分的优化[J].中国生物工程杂志,2013,33(11):44-50.
[20]朱丹,邹水洋,康建雄,等.纳豆芽孢杆菌液态发酵生产γ-聚谷氨酸[J].食品工业,2012,33(17):151-154.