刺楸(Kalopanax septemlobu)是五加科(Araliaceae)刺楸属(Kalopanax)落叶、阔叶乔木,分布广泛,主要生长在中国的东北、华北、华中、华南和西南地区,以及国外的朝鲜、苏联西伯利亚地区和日本[1]。刺楸具有很高的药用价值,其根茎皮和叶均可入药,用于治疗神经痛、风湿骨痛及跌打损伤等[2-3]。现代研究表明,刺楸中的皂苷成分具有明显的抗炎[4]、抗肿瘤[5]、抗类风湿[6]、抗氧化[7]、抗糖尿病[8]等药理活性。
皂苷分布在刺楸不同组织部位。BULGAKOV V P等[9]研究发现,刺楸不同组织中皂苷的含量从高到底依次为根、茎皮、绿叶、落叶和锯末,而程东岩等[10]研究吉林集安刺楸发现,叶中的总皂苷含量较树皮高,且有研究发现刺楸茎皮中分离出的化合物能抑制皮肤真菌[11]。
目前关于药用植物中提取皂苷的方法主要有酶法提取[7]、微波提取[12]、超声提取[13]、超临界流体萃取[14]等新型方法,但这些方法在一定程度上存在设备投资较大、生产成本较高、安全性、生产条件较高等问题[15],因此实际生产中仍是主要利用乙醇溶液进行渗漉、浸渍、回流等方法提取[16]。
鄂东大别山的野生刺楸资源十分丰富,当地居民经常将其茎皮熬成汁用于皮肤病防治。为了科学利用本地刺楸的茎皮资源,本实验拟以刺楸树皮为材料,采用单因素及响应面试验探讨其乙醇加热回流法的最佳提取工艺条件,并通过抑菌圈法评价刺楸树皮提取物的抑菌活性,从而为刺楸茎皮的利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
刺楸树皮:采自大别山国家森林公园;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、酵母菌:本实验室提供。
1.1.2 化学试剂
高氯酸(分析纯):天津市鑫源化工有限公司;香兰素、冰乙酸、葡萄糖、氯化钠(均为分析纯):国药集团化学试剂有限公司;无水乙醇、甲醇(均为分析纯):天津市凯通化学试剂有限公司;人参皂苷Re标准品(纯度>98%)(批号20161218):上海金穗生物科技有限公司。
1.1.3 培养基
LB液体培养基:牛肉膏3 g/L,蛋白胨6 g/L,NaCl 6 g/L,用2 mol/L的NaOH调pH值为7.2,蒸馏水定容至600 mL,于121 ℃灭菌20 min。LB固体培养基加入2%的琼脂。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:称取100 g去皮土豆,切碎,加水500 mL,放入锅中煮沸20 min,用4层纱布趁热在量杯上过滤,丢弃滤渣,滤液补充水分至500 mL,加入10 g葡萄糖,于115 ℃灭菌30 min。马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基为PDB培养基中加入2%的琼脂。
1.2 仪器与设备
Cary-100紫外可见分光光度计:美国Varian公司;FA2104电子分析天平:上海精细天平有限公司;DZKW-D-2电热恒温水浴锅:北京西城区医疗器械厂;HYG-B全温度摇瓶柜:大仓市实验设备厂;GPN型隔水式恒温培养箱:上海精宏实验设备有限公司。
1.3 方法
1.3.1 对照品溶液的制备
精密称取人参皂苷Re标准品0.002 3 g于10 mL容量瓶中,用甲醇将其定容至刻度,摇晃均匀,得到对照品溶液。
1.3.2 样品溶液的制备
称取5 g刺楸树皮粉末于500 mL圆底烧瓶中,按料液比1∶15(g∶mL)加入体积分数为70%的乙醇,在60 ℃水浴锅中加热回流提取1.5 h,得到样品溶液。
1.3.3 人参皂苷Re标准曲线的制作
根据参考文献[17],以人参皂苷Re的质量浓度(C)为横坐标,吸光度值(A)为纵坐标,拟合标准曲线回归方程为:A=5.012 1C+0.007 7,R2=0.999 1,表明人参皂苷Re取样质量浓度在0.023~0.207 mg/L范围内与吸光度值呈良好的线性关系。刺楸树皮中总皂苷得率计算公式如下:
式中:Y为总皂苷得率,%;C为样品中总皂苷质量,mg;N为稀释倍数;m为刺楸树皮粉末的质量,g。
1.3.4 总皂苷提取工艺优化单因素试验
分别称取5 g刺楸树皮粉末于500 mL圆底烧瓶中进行加热回流提取单因素试验,考察提取温度(50℃、60℃、70℃、80 ℃、90 ℃)、提取时间(1.0 h、1.5 h、2.0 h、2.5 h、3.0 h)、乙醇体积分数(50%、60%、70%、80%、90%)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25)(g∶mL)对刺楸中总皂苷的得率的影响。
1.3.5 总皂苷提取工艺优化响应面试验
基于单因素,找出对总皂苷得率影响最显著的三个因素提取温度(X1)、提取时间(X2)和乙醇体积分数(X3)为自变量,用-1、0、1编码每一个变量的低、中、高试验水平,以总皂苷得率(Y)为响应值,利用Box-Behnken方法设计响应面优化试验,因素与水平见表1。
表1 Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments

1.3.6 抑菌活性研究
以大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌及酵母菌4种菌为指示菌,将活化后的细菌菌种接种至LB液体培养基中,置于37 ℃的摇床中培养18 h,将活化后的酵母菌菌种接种至PDB培养基中后置于30 ℃的摇床中培养18 h。用移液枪分别移取200 μL浓度为10×106 CFU/mL的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌菌悬液于LB固体培养基中,移取200 μL浓度为10×106 CFU/mL的酵母菌菌液于PDA培养基中,涂布棒涂抹均匀后用打孔器打孔,再用移液枪吸取100 μL质量浓度为1.0 mg/mL总皂苷提取液于孔中,放恒温培养箱中培养24 h,测定抑菌圈直径[18]。
2 结果与分析
2.1 总皂苷提取工艺优化单因素试验
2.1.1 料液比对总皂苷得率的影响
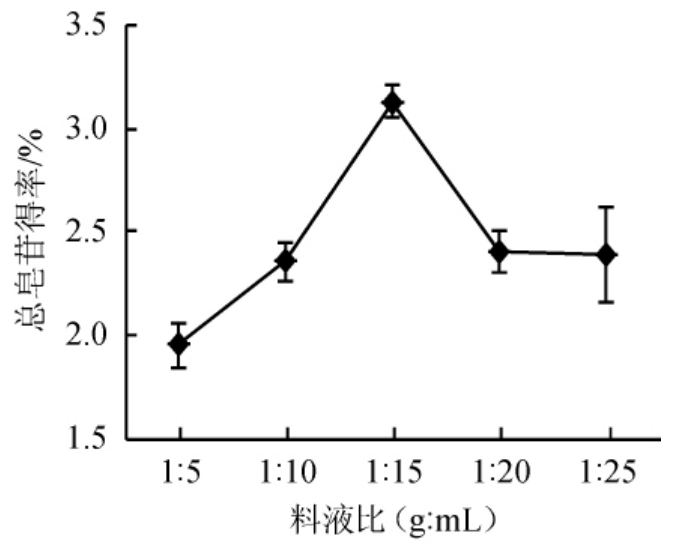
图1 料液比对总皂苷得率的影响
Fig.1 Effect of material to liquid ratio on the yield of total saponins
料液比对总皂苷得率的影响见图1。由图1可知,当料液比在1∶5~1∶15(g∶mL)范围内时,刺楸树皮中总皂苷的得率随之升高,当料液比为1∶15(g∶mL)时,此时总皂苷的得率达到最大,为3.12%,当料液比继续增加,总皂苷的得率则开始下降。可能的原因是随着料液比的减小提取溶剂与物料的接触更加充分,使得提取出的皂苷含量增加直到最大,继续降低料液比皂苷含量不发生改变,但由于提取出其他杂质类物质,影响了皂苷含量的测定,使之变小[19]。因此,最适料液比为1∶15(g∶mL)。
2.1.2 提取温度对总皂苷得率的影响
提取温度对总皂苷得率的影响结果见图2。由图2可知,当提取温度从50 ℃升至60 ℃时树皮总皂苷的得率呈下降趋势,但差异不显著(P>0.05)。当继续升高温度至70 ℃时,得率快速升高达到最大值为3.71%,继续升高温度时得率又开始下降。可能的原因是随着温度的不断升高刺楸树皮中皂苷苷键被高温破坏后分解,所以呈现逐渐下降趋势[20]。因此,最适提取温度为70 ℃。
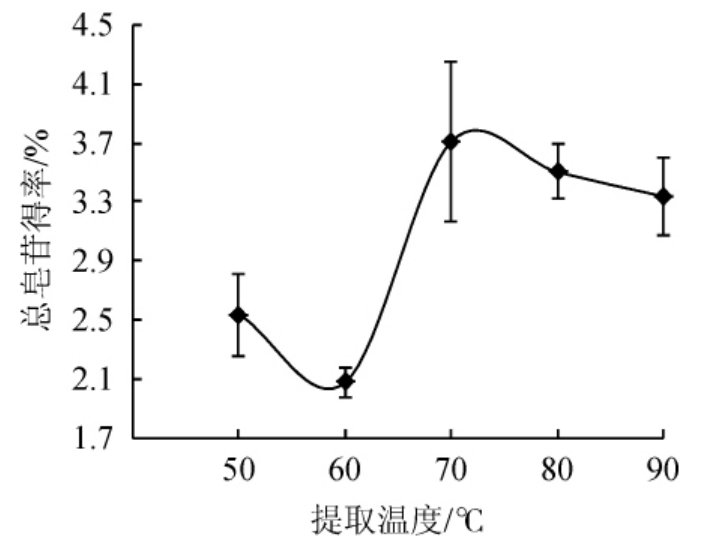
图2 提取温度对总皂苷得率的影响
Fig.2 Effect of extraction temperature on the yield total saponins
2.1.3 提取时间对总皂苷得率的影响
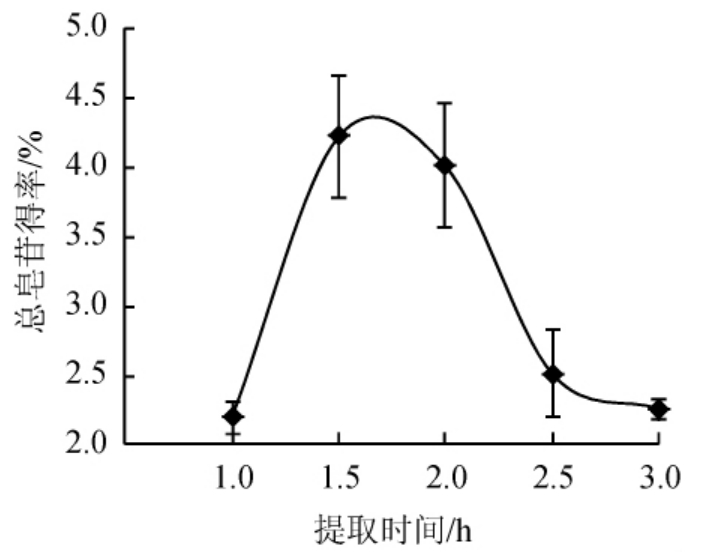
图3 提取时间对总皂苷得率的影响
Fig.3 Effect of extraction time on the yield of total saponins
提取时间对总皂苷得率的影响结果见图3。由图3可知,随着提取时间在1.0~3.0 h范围内的延长,总皂苷的得率呈先上升后下降的趋势,当提取时间逐渐延长时,刺楸中总皂苷的得率在逐渐升高,当提取时间为1.5 h时,得率达到最大值为4.22%,继续增加提取时间总皂苷得率反而逐渐降低,其原因可能是在提取液中,当植物材料细胞内外活性成分含量未达到平衡时,其得率随提取时间的延长而增加,当细胞内外浓度达到平衡后,活性成分不再溶出[21]。而加热时间过长会导致皂苷成分的降解,破坏了皂苷的活性,使总皂苷得率降低[22]。因此,最适提取时间为1.5 h。
2.1.4 乙醇体积分数对总皂苷得率的影响
乙醇体积分数对总皂苷得率的影响结果如图4所示。随着乙醇体积分数在50%~90%范围内逐渐升高,总皂苷的得率先升高然后下降,当乙醇体积分数在50%~70%时,总皂苷得率逐渐升高然后达到最大值为3.49%,当乙醇体积分数>70%时,总皂苷得率随着乙醇体积分数的升高又逐渐降低。可能是因为乙醇体积分数低时一些亲水性物质被提取出影响了皂苷的含量,乙醇体积分数太大时易形成较大渗透压[23-24],导致皂苷溶解性差,从而使刺楸树皮总皂苷的得率降低。因此,最适乙醇体积分数为70%。
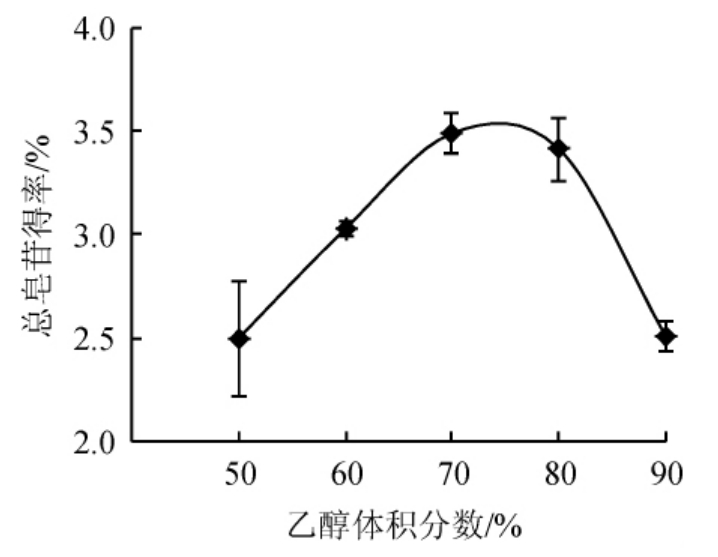
图4 乙醇体积分数对总皂苷得率的影响
Fig.4 Effect of ethanol volume fraction on the yield of total saponins
2.2 总皂苷提取工艺优化响应面试验
选取单因素试验中对刺楸树皮中总皂苷得率有显著影响的3个因素:提取温度(X1)、提取时间(X2)、乙醇体积分数(X3),固定料液比为1∶15(g∶mL),以总皂苷得率(Y)为响应值,利用Box-Behnken法响应面进行优化试验。响应面试验设计方案及结果见表2,回归模型方差分析见表3。
通过Design Expert 8.06软件对表2数据进回归方程拟合,得到各试验因子对响应值影响的多元二次回归方程为:Y=3.27-0.092X1-0.019X2-0.042X3-0.044X1X2-0.022X1X3-0.036X2X3-0.59X12-0.33X22-0.59X32
由表3可知,模型的P<0.000 1,说明回归模型效果极显著,而模型失拟项P=0.787 0>0.05,说明失拟项不显著,表明该模型的拟合度好,拟合方程显著。校正拟合度0.961 3与预测拟合度0.921 7基本一致,信噪比为17.868>4,表明该模型可用于预测。变异系数(coefficient of variation,CV)为3.83%,决定系数R2为98.31%,表明该模型的回归方程有很强的线性关系。因此,该回归方程可以很好地反映刺楸树皮总皂苷得率与提取因素之间的真实关系,即可通过该方程确定最优提取工艺条件。各因素对刺楸树皮中总皂苷得率的影响大小为:提取温度>乙醇体积分数>提取时间,一次项X1、二次项X22对总皂苷得率有显著影响(P<0.05),X12、X32对总皂苷得率有极其显著影响(P<0.01),其他项对结果影响不显著(P>0.05)。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
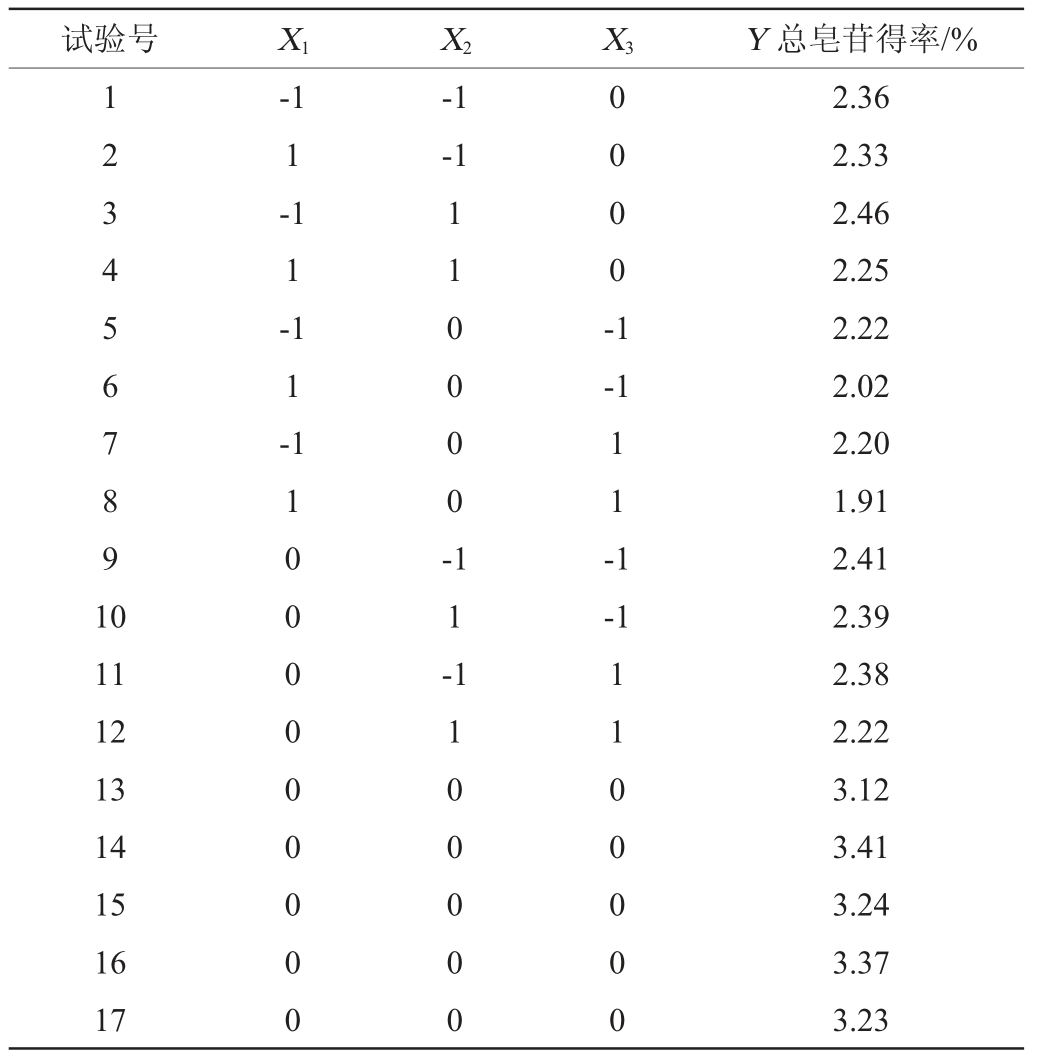
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
二元回归多项式的响应面结果见图5。由图5可知,提取时间与提取温度的等高线相交成圆形,表明提取温度与提取时间的交互作用不明显,乙醇体积分数与提取温度、提取时间等高线相交的中心区域图形据均程椭圆形,表明乙醇体积分数和提取温度、提取时间的交互作用明显。此外,提取时间、提取温度、乙醇体积分数这三个因素与总皂苷提取率的响应面均构成开口向下的凸面,表明在试验点连续区域内存在最大值。用Design Expert 8.0.6软件自动求解总皂苷最佳提取工艺为提取温度69.25 ℃、提取时间1.49 h、乙醇体积分数69.66%,总皂苷得率理论预测值为3.28%。
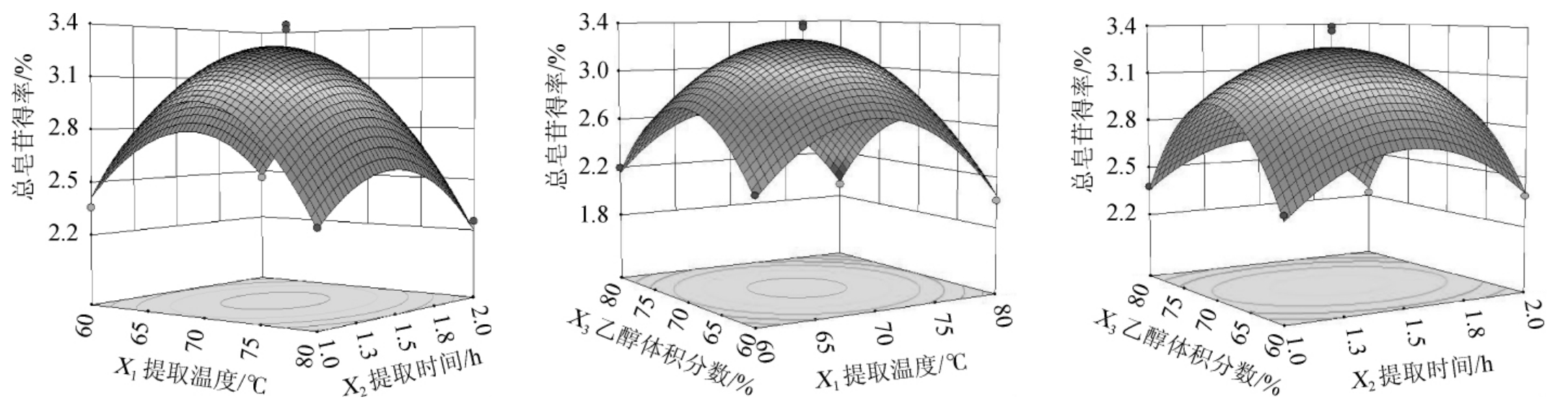
图5 提取时间、提取温度、乙醇体积分数交互作用对总皂苷得率影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between extraction time,temperature and ethanol volume fraction on total saponins yield
2.3 响应面验证试验
为方便实际操作,验证操作中修正最佳工艺条件预测值为提取温度70 ℃、提取时间1.5 h、乙醇体积分数70%,料液比1∶15(g∶mL)。在此优化条件下,进行3次重复验证,实测总皂苷平均得率为(3.33±0.04)%,与理论预测值3.28%基本吻合一致,表明拟合的二元多项式模型对刺楸树皮中总皂苷的乙醇加热回流提取工艺具有指导和预测作用。
2.4 抑菌活性结果
抑菌活性实验结果见表4。由表4可知,刺楸树皮总皂苷对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌、酵母菌的抑菌圈直径大小分别为3.00 cm、3.02 cm、2.30 cm、1.20 cm,表明1.0 mg/mL的刺楸树皮总皂苷对细菌及真菌均有一定的抑制作用,且相比革兰氏阴性菌,对革兰氏阳性菌的抑制作用更强。同时由表可知,1.0 mg/mL的刺楸树皮总皂苷提取物对细菌的抑制作用大于真菌。KIM D W等[11]发现,单糖链刺楸皂苷A和I(13)能有效抑制白色念珠菌(Candida albicans)KCTC 1940和新型隐球菌(Cryptococcus neoformans)KCTC 7224这两种真菌的生长,LEE M W等[25]也发现,刺楸皂苷对犬小孢菌(Microsporum canis)、球孢子菌属真菌(Coccidioidesimmitis)、须发癣菌(Trichophytonmentagrophytes)、新型隐球菌和白色念珠菌均具有抑制作用。因此,刺楸树皮总皂苷提取物对真菌具有一定的抑制作用,且在相同质量浓度下对细菌的抑制作用更强。
表4 刺楸树皮总皂苷的抑菌作用
Table 4 Antimicrobial effect of saponin from Kalopanax septemlobu bark
3 结论
选用乙醇回流法提取刺楸树皮中总皂苷,基于单因素试验并结合响应面分析软件对刺楸树皮中总皂苷的提取工艺进行优化,得出的最佳提取条件为提取温度70 ℃、提取时间1.5 h、乙醇体积分数70%,料液比1∶15(g∶mL)。在此优化提取条件下,总皂苷提率为3.33%。所得的乙醇提取液抑菌实验得出,刺楸树皮皂苷对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌、酵母菌的抑菌圈分别为3.00 cm、3.02 cm、2.30 cm、1.20 cm,表明刺楸树皮皂苷对以上四种菌均有抑制作用,且在此质量浓度时对细菌的抑制效果较明显,从而为刺楸茎皮的利用提供理论依据。
[1]朱鸿菊.山东省刺楸种质资源调查与评价[D].泰安:山东农业大学,2014.
[2]贾夏,朱玮,张檀,等.我国刺楸属植物资源与综合利用研究[J].西北林学院学报,2004,19(4):142-145.
[3]南京中医药大学.中药大辞典(第二版)[M].上海:上海科学技术出版社,2006:1848-1849.
[4]LEE K T,SOHN I C,PARK H J,et al.Essential moiety for antimutagenic and cytotoxic activity of hederagenin monodesmosides and bis-desmosides isolated from the stem bark of Kalopanax pictus[J].Planta Med,2000,66(4):329-332.
[5]KIM D H,BAE E A,PARK H J,et al.Metabolism of kalopanaxsaponin K by human intestinal bacteria and antirheumatoid arthritis activity of their metabolites[J].Biol Pharm Bull,2002,25(1):68-71.
[6]CHOI J,HUH K,KIM S H,et al.Kalopanaxsaponin A from Kalopanax pictus,a potent antioxidant in the rheumatoidal rat treated with Freund's complete adjuvant reagent[J].J Ethnopharmacol,2002,79(1):113-118.
[7]薛思慧,张枫源,向福,等.刺楸叶总皂苷的酶法提取及其抗氧化活性评价[J].中国酿造,2018,37(2):142-147.
[8]朱玮,贾夏,张鞍灵,等.刺楸属植物化学成分及生物活性研究进展[J].西北林学院学报,2004,19(3):119-124.
[9]BULGAKOV V P,BASHAROV A I,ALEKSEEV S G,et al.Identification and content of triterpene glycosides in the various organs of Kalopanax septemlobum(Thunb.)Koidz[J].Rastit Resur,1981,17(2):232-237.
[10]程东岩,王隶书,王海生,等.刺楸不同产地和不同药用部位中总皂苷的含量测定[J].时珍国医国药,2010,21(10):2494-2495.
[11]KIM D W,BANG K H,RHEE Y H,et al.Growth inhibitory activities of Kalopanax saponins A and I against human patnogenic fungi[J].Arch Pharm Res,1998,21(6):688-691.
[12]张卫军,颜清丽.微波辅助山银花中总皂苷提取工艺研究及含量测定[J].湖南科技学院学报,2018,39(10):34-36.
[13]罗亚兰,张吉仲,陶伟,等.响应面法优化超声提取黄花倒水莲总皂苷提取工艺[J].西南师范大学学报(自然科学版),2017,42(10):56-60.
[14]蒙英,赵旭壮,李明元.超临界CO2萃取黄芪皂苷的工艺研究[J].食品与发酵科技,2011,47(4):42-44.
[15]徐晓敏.藜麦皂苷的提取、分离纯化及生物活性研究[D].呼和浩特:内蒙古农业大学,2017.
[16]刘杨.中药有效成分分析的新方法新技术研究[D].上海:复旦大学,2012.
[17]杜月,陈新梅.比色法测定人参皂苷含量的方法探讨[J].化工时刊,2016,30(9):25-26.
[18]王彦杰,计红芳,孙俊良,等.老鹰茶总皂苷的超声提取及抑菌活性研究[J].食品科技,2012(9):226-229.
[19]欧阳凯,何先元,陈飞,等.四齿四棱草总皂苷提取工艺优化及抗氧化性研究[J].食品与机械,2016,32(7):141-145.
[20]李肇奖,吕晓玲,姚秀玲,等.油茶总皂苷提取工艺优化[J].中国食品添加剂,2004(5):1-4.
[21]陈武,伍晓春,邹盛勤,等.绞股蓝总皂苷提取工艺的研究[J].食品与机械,2008(1):75-77.
[22]钱蕾,陈阳.七叶一枝花有效成分的提取工艺优化[J].怀化学院学报,2019,38(5):11-16.
[23]陈瑶,吴龙月,向福,等.泥蒿叶总黄酮的酶法提取及其抗氧化活性评价[J].中国酿造,2017,36(6):142-146.
[24]吴祥庭,朱涛,郑巧敏,等.响应面法优化山药皮中皂苷提取的研究[J].中国粮油学报,2011,26(6):91-96.
[25]LEE M W,KIM S U,HAHN D R.Antifungal activity of modified hederagenin glycosides from the leaves of Kalopanax pictum var.Chinense[J].Biol Pharm Bull,2001,24(6):718-719.