豆酱是我国传统特色调味品,其作为发酵豆制品,不仅滋味鲜美、富含蛋白质,而且还含有异黄酮、多酚及类黑精等生理活性物质[1-2],广受消费者的喜爱。现代工业化生产豆酱主要依赖于米曲霉培养过程中产生的蛋白酶、淀粉酶等分解原料中的蛋白质、淀粉类成分,形成多肽、氨基酸和糖类等物质,从而获得豆酱独特的风味[3-4]。
目前,国内酿造酱企业,普遍采用米曲霉(Aspergillus oryzae)沪酿3.042作为发酵菌株,其具有蛋白酶活力高,生长快、安全等特点[5]。豆酱发酵环境的pH值一般在4.6~5.0之间,属于偏酸性环境,在此发酵条件下,中、碱性蛋白酶活力受到抑制,对原料蛋白质分解利用不彻底。因此,选育高产酸性蛋白酶菌株有利于豆酱的发酵[6-7]。鉴于豆酱发酵主要是由米曲霉分泌的水解酶起作用,因此,对于米曲霉胞外分泌蛋白的研究将有利于探究豆酱发酵的机理以及筛选优良菌种。ODA K等[8]首先运用双向凝胶电泳(twodimentional electrophoresis,2-DE)技术比较了米曲霉RIB40在固体和液体培养条件下胞外蛋白的分泌情况,共鉴定出29种蛋白,包括淀粉酶、糖化酶、蛋白酶、肽酶以及纤维素降解酶等;LIANG Y C等[9]利用单向电泳技术研究了A.oryzae 3.042在大豆制曲过程中胞外蛋白图谱,并结合基质辅助激光解吸电离-飞行时间/飞行时间-质谱(matrix-assisted laser desorption/ionization-time of flight/time of flight-mass spectrometry,MALDI-TOF/TOF-MS)技术鉴定出多种和大豆水解相关的蛋白酶;ZHANG B等[10]运用2-DE技术研究了绍兴米酒曲中米曲霉分泌的蛋白质组,共鉴定出41个蛋白,在2-DE图谱上,70%的蛋白质属于淀粉酶及其水解产物;ZHAO G Z等[5]运用2-DE技术对A.oryzae 3.042和突变株A100-8的胞内蛋白的蛋白质组学进行了比较研究,共鉴定出522个蛋白点,其中451个为差异蛋白点,且参与糖酵解、氨基酸合成代谢、次级代谢过程的蛋白与酿造酱油的风味相关,在蛋白组水平揭示了菌株A100-8发酵酱油风味比米曲霉3.042好。
本研究采用从种曲车间分离得到的中性蛋白酶、酸性蛋白酶、淀粉酶及糖化酶活力较高、产酶特性较好、不产生黄曲霉毒素的米曲霉ZJGS-LZ-12为研究对象,以米曲霉3.042为对照,采用2-DE技术研究米曲霉ZJGS-LZ-12与3.042的分泌蛋白组差异,确证米曲霉ZJGS-LZ-12的酶学轮廓及其在豆酱中的工业价值,为该菌株的后期应用及工业米曲霉菌种的发酵酶学研究提供重要指导意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
米曲霉(Aspergillus oryzae)3.042:实验室保存;米曲霉ZJGS-LZ-12:浙江五味和食品有限公司种曲车间分离,实验室保存。
1.1.2 试剂
硫脲、尿素、溴酚蓝(均为分析纯)、固相pH梯度(immobilized pH gradient,IPG)胶条(pH 4~7):美国Bio-Rad公司;非变性两性离子去垢剂、蛋白酶抑制剂:中国BIOSHARP公司;考马斯亮蓝G-250:德国Sigma公司;无水乙醇、甲醇(均为分析纯):杭州化学试剂有限公司;磷酸(分析纯):上海凌峰化学试剂有限公司;丙酮(分析纯):杭州双林化工试剂厂;乙酸(分析纯):江苏强盛功能化学股份有限公司;硫酸铵(分析纯):天津市永大化学试剂有限公司。
1.1.3 培养基
豆汁斜面培养基:豆汁1 000 mL,可溶性淀粉20 g,KH2PO41.0 g,MgSO40.5 g,(NH4)2SO40.5 g,琼脂20 g,自然pH,115 ℃灭菌30 min。豆汁:按豆粕质量加5~6倍水,煮沸1 h,过滤,每100 g豆粕制成5 Bé 豆汁100 mL。
麸皮固体培养基[11]:麸皮80 g,面粉20 g,蒸馏水80 mL,115 ℃灭菌30 min。
1.2 仪器与设备
Protean IEF cell等电聚焦电泳仪、PowerPac Universal垂直板电泳仪、Protean II xi电泳灌胶模具、GS-800高分辨专业扫描仪、PDQuest 8.0双向电泳图像分析软件、Mini-Protein cell II电泳系统:美国Bio-Rad公司;Biofuge stratos台式冷冻高速离心机、Forma 702超低温冰箱:美国Thermo Scientific公司;Milli-Q超纯水装置系统:美国Millipore公司;AF-10制冰机:美国Scotsman公司;Eppendorf移液枪:德国Eppendorf公司;DELTA 320标准型pH计:瑞士Mettler Toledo公司;4800 MALDI-TOF/TOF-MS仪:美国ABI公司。
1.3 方法
1.3.1 种曲的制备
米曲霉的活化:在无菌条件下,用接种环挑取米曲霉孢子接种到豆汁斜面培养基上,30 ℃条件下恒温培养3~5 d。
种曲的制备:在无菌条件下,用接种环挑取斜面菌种转接于麸皮固体培养基,摇匀,30 ℃条件下恒温培养18~20 h,摇匀,继续培养6 h,摇匀,继续培养至72 h,米曲霉生长成熟,即为豆酱种曲。
1.3.2 米曲霉胞外蛋白的提取与处理
胞外蛋白提取:称取25 g新鲜的种曲样品于500 mL三角瓶,加入50 mL胞外蛋白提取剂(含1‰蛋白酶抑制剂的0.05 mol/L乙酸缓冲液),轻轻摇晃,使曲料完全浸入提取液中,置于4 ℃冰箱中静置12 h。浸提完成后,首先用8层纱布过滤除去曲料中的麸皮、豆粕等物质,然后将得到的蛋白滤液在4 ℃、13 000 r/min条件下离心10 min,取上清液,同样条件下离心10 min,以除去滤液中不溶的杂质。离心后的上清液经0.45 μm的滤膜过滤,即为米曲霉胞外蛋白,于-80 ℃冰箱贮存备用。
胞外蛋白处理:参照文献[12]的方法,并稍加改动,对胞外蛋白进行处理。按照体积比1∶4向胞外蛋白样品中加入-20 ℃预冷的丙酮,混匀,于-20 ℃条件下静置2 h,混匀,于4 ℃、5 000 r/min条件下离心10 min,弃上清液,同样条件下离心1 min,弃丙酮液体。沉淀物用氮气吹干,加入适量的裂解液(尿素12 g,硫脲3.8 g,非变性两性离子去垢剂1 g,无菌水25 mL),间隔振荡至沉淀溶解,于4 ℃、15 000 r/min条件下离心1 min除去不溶物。
蛋白含量的测定:采用Bradford蛋白定量法[13]对样品蛋白浓度进行定量。
1.3.3 双向电泳
第一向是等电聚焦,选用pH 4~7的IPG胶条水化上样,考染,蛋白上样量400 μg、上样体积300 μL,在等点聚焦程序II(延长除盐时间(5 h)和聚焦时间(80 000 vhr))条件下进行2-DE实验。第一向完成后,取出胶条,转移到聚丙烯酰胺凝胶上进行第二向电泳。电泳完成后,采用PDQuest专业图像分析软件分析比对2-DE图谱,比较不同组间的蛋白点。如果某一蛋白点的表达量的相对比值≥1.5或≤0.5,且P<0.05,则将该点判定为差异表达蛋白点。当某个蛋白点的表达量的相对比值≥1.5时,为分泌表达量上调;当蛋白点的表达量的相对比值≤0.5时,为分泌表达量下调。
1.3.4 差异蛋白点的质谱鉴定
参照文献[8]的方法对差异蛋白进行鉴定。质谱条件:采用反射模式采集每个蛋白质的一级质谱(MS)信息,激光强度4 000,质量范围800~4 000 Da。一级质谱扫描完成后,选取7个信号强度最高的母离子进行二级质谱(MS/MS)分析,加速电压2000 V,采用诱导碰撞解离(collision-induced dissociation,CID)碰撞裂解母离子,获取每个母离子的离子碎片指纹谱。
定性分析:MS及MS/MS数据通过MASCOT软件中的applied biosystems对美国国立生物技术信息中心(national center for biotechnology information,NCBI)和Uniprot蛋白质数据库进行检索。检索参数为:米曲霉、胰蛋白酶酶解、最大漏切位点1个,固定修饰方式:半胱氨酸脲甲基化进行固定修饰、甲硫氨酸氧化进行可变修饰,肽段质量精确度±0.3 Da,置信度>95%具有统计学意义。
1.3.5 差异蛋白点的生物信息学分析
利用生物信息学手段对鉴定的米曲霉蛋白进行预测和分析。使用SignalP4.1(http://www.cbs.dtu.dk/services/SignalP)[14]预测信号肽、UniProt(http://www.uniprot.org/uniprot/)[15]和QuickGO(http://www.ebi.ac.uk/QuickGO/)数据库预测蛋白质的结构和功能。通过ExPASy的pI/MW工具(http://www.expasy.org/tools/pi_tool.html)[16]获得蛋白质的理论等电点和分子质量。通过WoLFPSORT program(http://wolfpsort.org/)[9]对蛋白质的亚细胞进行定位。
2 结果与分析
2.1 米曲霉ZJGS-LZ-12胞外蛋白质分泌量的检测
比较米曲霉3.042和ZJGS-LZ-12在种曲中胞外蛋白质的分泌量,结果见图1。
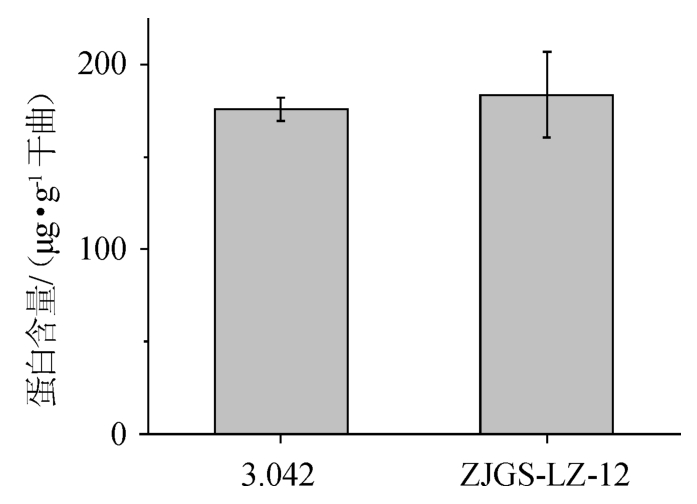
图1 米曲霉3.042和ZJGS-LZ-12胞外蛋白质的分泌量
Fig.1 Secretion volume of extracellular proteins by Aspergillus oryzae 3.042 and ZJGS-LZ-12
由图1可知,米曲霉3.042和ZJGS-LZ-12胞外蛋白质的分泌量分别为(175.78±6.07)μg/g干曲和(183.52±23.07)μg/g干曲。结果表明,两株米曲霉的胞外蛋白分泌能力相当。
2.2 米曲霉ZJGS-LZ-12分泌蛋白组的双向电泳图谱及差异蛋白质分析
米曲霉3.042和ZJGS-LZ-12的胞外蛋白双向电泳图谱见图2。

图2 米曲霉3.042(A)及ZJGS-LZ-12(B)分泌蛋白组的双向电泳图谱
Fig.2 Two dimentional electrophoresis pattern of secretome of Aspergillus oryzae 3.042 (A) and ZJGS-LZ-12 (B)
Mr为蛋白Marker,数字代表质谱鉴定成功的蛋白点。
由图2可知,经PD Quest软件进行定性、定量分析,在米曲霉3.042和ZJGS-LZ-21的2-DE图谱上分别检测到552±21和586±18个蛋白点,与米曲霉3.042相比,具有统计学意义的差异表达蛋白点共有169个(P<0.05),其中80个蛋白点分泌表达量下调,89个蛋白点分泌表达量上调。对169个差异表达蛋白点进行质谱鉴定及数据库检索,结果有105个蛋白点被鉴定成功,占总蛋白点数的62.1%。根据蛋白点的肽指纹图谱,共检索到27个差异蛋白质。结合NCBI和Uniprot数据库,对鉴定的蛋白质进行QuickGO蛋白功能聚类分析,结果见表1。其中3个蛋白(Q9HGY9、Q2ULB2及P80402)不属于分泌蛋白,不予以分析。
表1 米曲霉ZJGS-LZ-12和3.042胞外差异表达蛋白的鉴定
Table 1 Identification of extracellular differential proteins expressed by Aspergillus oryzae ZJGS-LZ-12 and 3.042

续表

2.3 米曲霉ZJGS-LZ-12差异蛋白质生物功能性分类及解析
A.oryzae 3.042和ZJGS-LZ-12胞外差异表达蛋白质的功能性分类见图3。由图3A可知,差异蛋白质主要参与糖类和蛋白质水解过程,分别占总蛋白质的65.22%和26.09%;4.35%的蛋白质参与氧化还原等过程。由图3B可知,差异蛋白质主要是水解淀粉、纤维素、半纤维素及蛋白质的酶。其中,66.6%淀粉水解酶和75%半纤维素酶分泌表达量上调,33.3%淀粉水解酶和25%半纤维素酶分泌表达量下调;33.3%蛋白酶和肽酶分泌表达量上调,其余分泌表达量下调;纤维素酶及氧化还原酶分泌表达量均下调。结果表明,大部分蛋白酶参与糖类和蛋白质的分解代谢,与制曲过程中胞外蛋白变化相一致[8]。分析原因可能是在固态发酵条件下,米曲霉必须分泌大量的水解酶降解麸皮等原料中的糖类和蛋白质,以获得生长所必须的营养物质。
大豆等制曲材料中的淀粉,只有先经制曲发酵,被米曲霉分泌的淀粉酶和糖化酶水解,才能在后期发酵中被酵母和细菌利用。由表1可知,蛋白点13、108和201是α-淀粉酶A,与米曲霉3.042相比,米曲霉ZJGS-LZ-12的蛋白点13和201分泌表达量上调3.24~5.05倍,而蛋白点108分泌表达量下调,说明不同α-淀粉酶A分泌表达量存在差异。LIANG Y C等[9]对绍兴米酒曲中米曲霉SU16的胞外蛋白质组学研究发现,α-淀粉酶和它的水解产物占凝胶上可视蛋白点的70%以上;ODA K等[8]研究发现,利用蒸煮后的麦麸进行制曲,米曲霉RIB40分泌的α-淀粉酶和它的水解产物占凝胶上可视蛋白点的50%以上。这些研究结果表明,在制曲过程中,米曲霉都具有较强的分泌淀粉酶的能力。本研究中经PD Quest分析显示,米曲霉ZJGS-LZ-12分泌的α-淀粉酶和它的水解产物占凝胶上可视点的60%以上,远高于米曲霉3.042(40%),预示着米曲霉ZJGS-LZ-12在豆酱发酵中的优良性能。α-淀粉酶通过水解淀粉的α-1,4-糖苷键生成麦芽糖、葡萄糖等还原糖,可与酱醅中的氨基酸发生美拉德反应,形成豆酱色素,生成的酯类还可增加豆酱的香气,与豆酱的色泽和香气的形成有重要的关系[5,12]。另外,葡萄糖也是酵母菌和细菌生长所必须的碳源,酵母菌发酵葡萄糖产生乙醇,细菌发酵葡萄糖产生乳酸、醋酸及琥珀酸,这些醇类和有机酸是豆酱香气的重要组成成分。
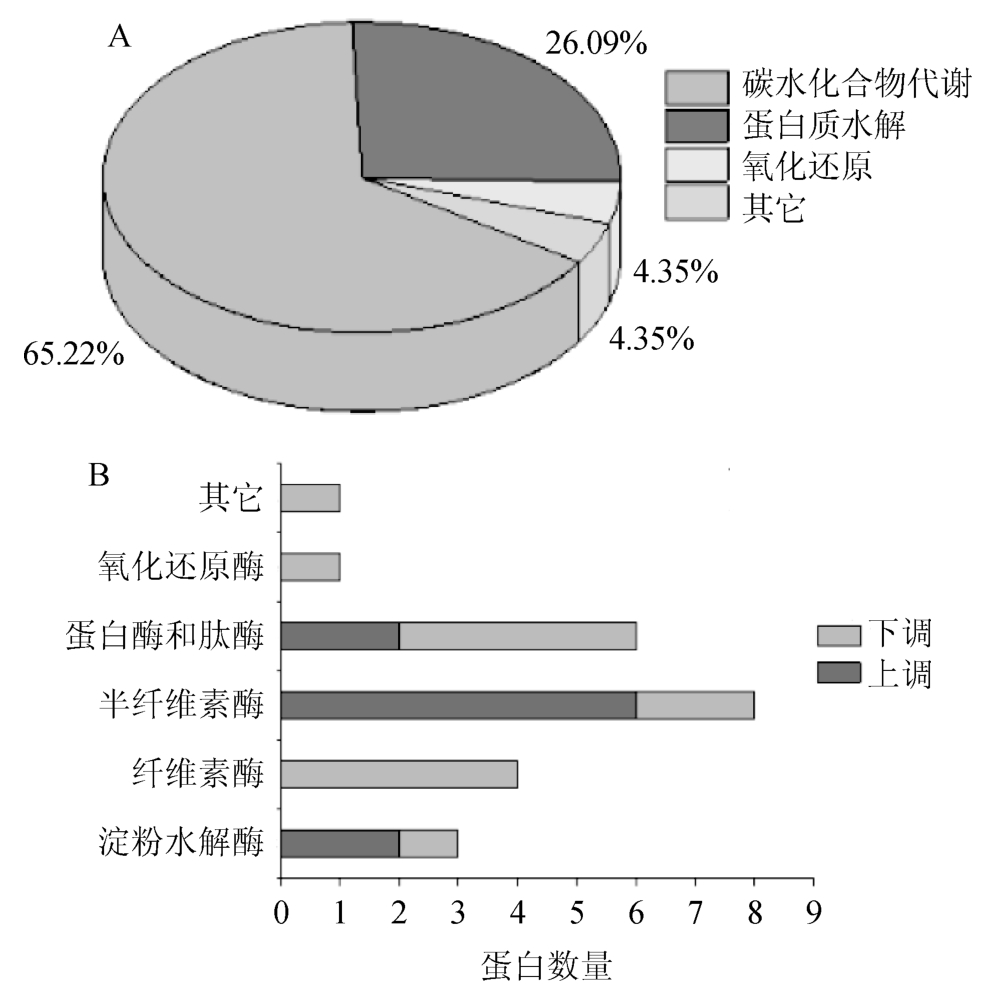
图3 米曲霉胞外差异表达蛋白质的功能分类
Fig.3 Functional classification for extracellular differential proteins expressed by Aspergillus oryzae
蛋白点73、187和124被鉴定为糖化酶。糖化酶又称为葡萄糖淀粉酶,由基因glaA编码,其能水解淀粉非还原性未端的α-1,4葡萄糖苷键产生葡萄糖,也能缓慢水解α-1,6葡萄糖苷键,转化为葡萄糖。米曲霉ZJGS-LZ-12的蛋白点73、187和124的分泌表达量下调0.10~0.36倍,说明米曲霉ZJGS-LZ-12分泌的糖化酶量比米曲霉3.042少。
蛋白点136、219、171和198被鉴定为纤维素酶,其中,蛋白点136为β-半乳糖苷酶A,米曲霉ZJGS-LZ-12分泌表达量上调1156倍,而另外3种分别为α/β葡萄糖苷酶agdC、β-1,4-D-葡聚纤维二糖水解酶A、β-1,4-内切葡聚糖酶B,分泌表达量均下调。其中,α/β-葡萄糖苷酶agdC具有α-葡糖苷酶和β-葡糖苷酶活性,参与细胞壁中纤维素的降解,生成D-葡萄糖。
蛋白点220、166、205、125、217、110、145、147和148被鉴定为半纤维素酶,其中米曲霉ZJGS-LZ-12的依赖烟酰胺腺嘌呤二核苷酸(磷酸)(nicotinamide adenine dinucleotide(phosphate),NAD(P)H)D-木糖氧化还原酶xyl1和乙酰木聚糖酯酶A分泌表达量下调,其余分泌表达量均上调。在分泌表达量上调的蛋白中,β-1,4-外切木聚糖酶bxlB参与木聚糖的水解,水解β-1,4-D-木聚糖,从非还原末端依次切掉D-木糖残基生成D-木糖,与豆酱香味及色泽形成有关。阿拉伯半乳聚糖-β-1,4-内切半乳聚糖酶A参与植物细胞壁多糖物质的降解,可水解I类阿拉伯半乳聚糖(arabogalactan,AGs),特异性作用于1,4-半乳糖苷链[17]。将AGs降解为低聚糖,供菌体生长利用。葡聚糖β-1,3-葡糖苷酶A参与β-葡聚糖的降解,从非还原末端切掉β-D-葡萄糖,释放α-葡萄糖,生成的木糖、葡萄糖等产物与豆酱发酵过程中风味和色泽的形成有直接的关系。β-1,4-内切木聚糖酶和乙酰木聚糖酯酶A参与木聚糖的降解,其中内切木聚糖酶水解木聚糖的主链生成低聚木糖及木糖;乙酰木聚糖酯酶A水解木聚糖上乙酰化的侧链,提高内切木聚糖酶降解木聚糖的速度[18]。
在差异胞外蛋白质中,也有很多蛋白质被鉴定为降解酶,分别是亮氨酸氨基肽酶A(leucine aminopeptidase A,Lap A)(蛋白点126、168、215)、亮氨酸氨基肽酶A2(leucine aminopeptidase A2,Lap A2)(蛋白点41)、二肽水解酶5(蛋白点174)、中性蛋白酶2(neutral protease 2,Ntp 2)(蛋白点200)、碱性蛋白酶1(alkaline protease 1,Alp 1)(蛋白点114和194)及天冬氨酸肽酶(aspartyl aminopeptidase)(蛋白点222)和天冬氨酸蛋白酶(aspartic protease pep1,Pep1)(蛋白点106)。
亮氨酸氨基肽酶(Laps)属于锌需要型金属蛋白酶类中的外肽酶,外肽酶在豆酱的工业生产中具有重要的作用,其能降解肽产生氨基酸,增加豆酱的鲜味[19]。米曲霉ZJGS-LZ-12的LapA(蛋白点215)分泌表达量上调2.33倍,而Lap2(蛋白点41)分泌表达量下调0.01倍。Lap2和LapA作用的最适pH值分别为9.5和8.5,偏碱性,在酸性条件下活性大大降低,而豆酱发酵的环境一般为4.6~5.0之间,属于偏酸性环境,不利于Laps酶促反应的进行。
蛋白质先经过内肽酶降解为大分子肽,再经过Laps和二肽酰多肽酶IV(dipeptidyl-peptidase IV,DppIV)(X-脯氨酰基降解酶)的协同作用进一步降解为氨基酸。因为当X-脯氨酰基序列存在时,Laps降解肽的反应被终止,通过互补的方式,DppIV可以移除X-脯氨酰基序列,从而使Laps继续水解氨基酸残基[20]。
Ntp 2主要在中性pH条件下水解蛋白质分子。米曲霉是产工业蛋白酶的重要真菌之一,米曲霉3.042是我国最常用的生产豆酱的菌株,高产中性蛋白酶,而米曲霉ZJGS-LZ-12的Ntp2(蛋白点200)的分泌表达量下调。
Alp1是一种丝氨酸蛋白酶,米曲霉ZJGS-LZ-12的Alp1(蛋白点114)分泌表达量上调约1 300倍,降解蛋白质分子,生成小分子量的肽,促进原料蛋白质的利用。
天冬氨酸蛋白酶是一种分泌型内肽酶,属于酸性蛋白酶,在米曲霉ZJGS-LZ-12中,其分泌表达量上调100多倍。研究表明,天冬氨酸蛋白酶可以在pH值3.5的条件下水解蛋白质(尤其是疏水性残基)的肽键[20],形成的各种多肽在肽酶作用下进一步被水解成游离氨基酸,大豆蛋白被水解生成的可溶性的䏡、胨、多肽及氨基酸,形成豆酱的营养物质氮素成分和鲜味。
3 结论
米曲霉ZJGS-LZ-12与我国传统经典米曲霉3.042胞外蛋白的分泌能力相当,分别为(175.78±6.07)μg/g干曲和(183.52±23.07)μg/g干曲,但胞外分泌蛋白组存在显著差异(P<0.05)。双向电泳结果表明,与米曲霉3.042相比,米曲霉ZJGS-LZ-12的差异表达蛋白点共169个,其中80个蛋白点分泌表达量下调,89个蛋白点分泌表达量上调。通过MALDI-TOF/TOF-MS法共鉴定出105个差异蛋白质点,通过和NCBI和Uniprot数据库比对分析共发现27个差异蛋白质。通过差异蛋白质生物功能性分析,结果表明,差异蛋白质主要参与糖类和蛋白质水解过程,主要是水解淀粉、纤维素、半纤维素及蛋白质的酶。其中,淀粉水解酶、半纤维素酶活性显著增强,β-1,4-内切木聚糖酶F3、β-半乳糖苷酶A和阿拉伯半乳聚糖-β-内切半乳聚糖酶A分泌表达量分别上调292、1 156和2 569倍;而蛋白酶Pep1和Alp1分泌表达量分别上调100和1 300倍。表明米曲霉ZJGS-LZ-12的分泌蛋白组具有较独特的组成及活性,有利于降解大豆蛋白并提高原料利用率及豆酱的风味和营养。因此,米曲霉ZJGS-LZ-12是一株比较优良的工业菌株,适合用于豆酱的发酵生产。
[1]雷宏杰,刘金霞,蒋立胜,等.豆酱生理功能性物质研究进展及其现存质量问题[J].中国酿造,2008,27(13):1-5.
[2]CHIOU R Y,CHENG S L.Isoflavone transformation during soybean koji preparation and subsequent miso fermentation supplemented with ethanol and NaCl[J].J Agr Food Chem,2001,49(8):3656-3660.
[3]龙鸣,田晓静,黄芳丽,等.黄豆酱关键工艺对其品质影响研究进展[J].中国酿造,2018,37(1):12-15.
[4]LEE E J,HYUN J,CHOI Y H,et al.Development of safe and flavor-rich doenjang (Korean fermented soybean paste) using autochthonous mixed starters at the pilot plant scale[J].J Food Sci,2018,83(6):1723-1732.
[5]ZHAO G Z,HOU L H,YAO Y P,et al.Comparative proteome analysis of Aspergillus oryzae 3.042 and A.oryzae 100-8 strains:Towards the production of different soy sauce flavors[J].J Proteom,2012,75(13):3914-3924.
[6]卢燕云,林建国,李明,等.复合诱变选育酸性蛋白酶高产菌株[J].中国酿造,2009,28(1):49-51.
[7]张秀江,胡虹,范国歌,等.酸性蛋白酶高产菌株选育及酶学性质的研究[J].河南科学,2012,30(3):327-332.
[8]ODA K,KAKIZONO D,YAMADA O,et al.Proteomic analysis of extracellular proteins from Aspergillus oryzae grown under submerged and solidstate culture conditions[J].Appl Environ Microbiol,2006,72(5):3448-3457.
[9]LIANG Y C,PAN L,LIN Y.Analysis of extracellular proteins of Aspergillus oryzae grown on soy sauce koji[J].Biosci Biotech Bioch,2009,73(1):192-195.
[10]ZHANG B,GUAN Z B,CAO Y,et al.Secretome of Aspergillus oryzae in Shaoxing rice wine koji[J].Int J Food Microbiol,2012,155(3):113-119.
[11]上海酿造科学研究所.发酵调味品生产技术[M].北京:中国轻工业出版社,1999:90.
[12]LIMA P M,NEVES R D C F,SANTOS F A D,et al.Analytical approach to the metallomic of Nile tilapia(Oreochromis niloticus)liver tissue by SRXRF and FAAS after 2D-PAGE separation:Preliminary results[J].Talanta,2010,82(3):1052-1056.
[13]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1-2):248-254.
[14]ANDRÉS G L,ANA M R P,FRANCISCO J R B,et al.Changes on the Caco-2 secretome through differentiation analyzed by 2-D differential ingel electrophoresis(DIGE)[J].Int J Mol Sci,2012,13(11):14401-14420.
[15]CHAVES D F S,SOUZA E M D,MONTEIRO R A,et al.A two-dimensional electrophoretic profile of the proteins secreted by Herbaspirillum seropedicae strain Z78[J].J Proteom,2009,73(1):50-56.
[16]VINCENT D,BALESDENT M H,GIBON J,et al.Hunting down fungal secretomes using liquid-phase IEF prior to high resolution 2-DE[J].Electrophoresis,2009,30(23):4118-4136.
[17]ZHAO G,DING L L,PAN Z H,et al.Proteinase and glycoside hydrolase production is enhanced in solid-state fermentation by manipulating the carbon and nitrogen fluxes in Aspergillus oryzae[J].Food Chem,2019,271(15):606-613.
[18]BARR C J,MERTENS J A,SCHALL C A.Critical cellulose and hemicellulose activities for hydrolysis of ionic liquid pretreated biomass[J].Bioresource Technol,2012,104:480-485.
[19]LIN S J,CHEN Y H,CHEN L L,et al.Large-scale production and application of leucine aminopeptidase produced by Aspergillus oryzae LL1 for hydrolysis of chicken breast meat[J].Eur Food Res Technol,2008,227(1):159-165.
[20]SRIRANGANADANE D,WARIDEL P,SALAMIN K,et al.Aspergillus protein degradation pathways with different secreted protease sets at neutral and acidic pH[J].J Proteome Res,2010,9(7):3511-3519.