白酒的主要风味成分可分为酸类、酯类、醇类、醛类及其他五大类,其中酯类物质所占比例最大,而“四大酯”(乙酸乙酯、乳酸乙酯、己酸乙酯和丁酸乙酯)约占白酒中总酯含量的90%以上[1]。其中,乳酸乙酯香弱、稍甜,含量较高时带涩味,是白酒的重要呈香物质[2],其含量高低直接影响酒的品质与风格特点[3]。通常认为,白酒中乳酸乙酯是由乳酸菌等产酸微生物代谢产生的乳酸与酒精在酯化酶的作用下形成[4],且以胞外酶的酯化合成为主,但也不排除胞内酶的补偿作用,如霉菌、某些酵母菌和细菌分泌的胞外酯化酶等[5-7]。
传统固态法的白酒酿造过程中,其开放式的发酵可使空气、生产车间、工具、发酵设备等环境中的微生物通过大量繁殖而进入酒醅内,其中以乳酸菌为主,进而为乳酸乙酯的合成提供大量前体物[8-9]。近年来,随着白酒机械化和清洁生产的推广,酿酒环境卫生、劳动生产环境的改善[10],使得酿酒环境中乳酸菌的种类和数量减少,尤其在冬季干燥的气候条件下,易造成发酵体系中乳酸菌的数量不足,致使成品酒中乳酸和乳酸乙酯含量下降,使得酒体香味失衡。因而迫切需要开发富含乳酸乙酯的调味酒用于基酒的勾调,以弥补基酒乳酸乙酯的不足,保证酒体风味协调,提高基酒的质量。
目前,国内对于生物酯化液的研究较多的是利用黄水等发酵副产物在酯化酶作用下催化生成己酸乙酯[11-14],并将其运用于浓香型白酒的增香与调味酒的生产[15]。而对于酯化生成乳酸乙酯的酯化技术研究较少[16-17],关于利用酯化酶在水相中催化合成乳酸乙酯酯化液并应用于白酒勾调的相关研究更是鲜有报道[18]。有文献报道[19],南极假丝酵母(Candida antarctic)脂肪酶B更适合在以非极性溶剂为催化介质的反应体系中催化酯化反应。因此,本研究利用自老白干酒醅中分离获得的一株高产乳酸干酪乳杆菌(Lactobacillus casei)发酵制得乳酸发酵液,通过南极假丝酵母(Candida antarctic)脂肪酶B催化乳酸发酵液与酒尾合成乳酸乙酯,并通过单因素试验和正交试验对其催化工艺进行优化,最后生产用于基酒勾调的乳酸乙酯调味酒,旨在弥补冬季生产时基酒中乳酸乙酯含量不足的问题,同时最大限度利用酒尾中的有益成分,提高资源综合利用率,实现清洁生产。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
干酪乳杆菌(Lactobacillus casei):自老白干酒醅中分离获得,并保藏于本研究室。
1.1.2 试剂
酒尾:老白干酒厂;大米、麦根:市售;南极假丝酵母脂肪酶B(作用pH值2.5~8.0,作用温度15~55 ℃):诺维信(中国)生物科技公司;葡萄糖、牛肉膏、蛋白胨、酵母膏(均为生化试剂):天津市北方天医化学试剂厂;其他化学试剂均为国产分析纯。
1.1.3 培养基
MRS培养基[20]:葡萄糖20.0 g、蛋白胨10.0 g、牛肉膏10.0 g、酵母膏5.0 g、柠檬酸二胺2.0 g、K2HPO42.0 g、乙酸钠8.0 g、MgSO4·7H2O 0.2 g、MnSO4·4H2O 0.05 g、Tween-80 1.0 mL,蒸馏水1 000 mL,自然pH,115 ℃高压灭菌20 min。
乳酸发酵培养基[20]:大米粉30.0 g,麦根粉3.0 g,蒸馏水175 mL,加液化酶5 U/g大米粉,90 ℃液化30 min,加热煮沸0.5 h,待温度降至60 ℃,添加糖化酶150 U/g大米粉,于60 ℃水浴锅中恒温糖化4 h,降温至40 ℃时,添加活化好的酸性蛋白酶5 U/g大米粉,过滤,调节糖度为16°Bx,自然pH,115 ℃高压灭菌20 min。
1.2 仪器与设备
Sever Easy型pH计:瑞士梅特勒托利多仪器有限公司;Agilent1260-紫外高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技公司;FA2204B电子天平:上海精密仪器有限公司;DHP恒温培养箱:上海智诚分析仪器制造有限公司。
1.3 试验方法
1.3.1 乳酸发酵液制备
干酪乳杆菌的活化:取一环保藏于斜面上的干酪乳杆菌接种于装有10 mL MRS液体培养基的试管中,30 ℃条件下静置培养24 h。
种子液的制备:将活化好的干酪乳杆菌培养液按10%(V/V)的接种量转接于装有100 mL MRS液体培养基的250 mL三角瓶中,30 ℃条件下静置培养24 h。
将干酪乳杆菌种子液按10%(V/V)的接种量转接于装有100 mL乳酸发酵培养基的250 mL三角瓶中,添加3.5%无菌碳酸钙,密封,于35 ℃条件下静置发酵15 d,乳酸含量达到80 g/L左右,待用。
1.3.2 乳酸乙酯酯化液制备
将酒精度为40%vol的酒尾与乳酸发酵液按体积比1∶1混匀(总体系100 mL),用1.0 mol/L NaOH及1.0 mol/L H2SO4溶液调节混合液的pH值为3.5,添加南极假丝酵母脂肪酶B 0.5 g,于30 ℃条件下静置反应14 d后测定乳酸乙酯含量。
1.3.3 脂肪酶催化合成乳酸乙酯条件优化单因素试验
依据脂肪酶的催化反应特性[21-22],采用单因素轮换法依次考察pH值(2.0、2.5、3.0、3.5、4.0、4.5、5.0)、反应温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、酶用量(0.2%、0.3%、0.4%、0.5%、0.6%)、反应时间(7 d、10 d、14 d、18 d、21 d、25 d、30 d)及酒尾与乳酸发酵液体积比(1.0∶4.0、1.0∶2.5、1.0∶1.5、1.0∶1.0、1.5∶1.0、2.5∶1.0)对脂肪酶催化合成乳酸乙酯的影响。
1.3.4 脂肪酶催化合成乳酸乙酯条件优化正交试验
根据单因素试验结果,考虑到混合液的自然pH值在3.0左右,且酯化液主要用于白酒调味酒的生产,确定正交试验pH值为3.0。选取反应温度(A)、反应时间(B)、酶用量(C)、酒尾与乳酸发酵液体积比(D)为考察因素,乳酸乙酯含量(Y)为评价指标,采用L9(34)正交表进行正交试验,以确定该脂肪酶催化合成乳酸乙酯最佳条件组合。正交试验因素与水平设计见表1。
表1 脂肪酶B催化合成乳酸乙酯条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for optimization of ethyl lactate synthesis conditions catalyzed by lipase B

1.3.5 高乳酸乙酯调味酒的制备
准确量取5份相同的高乳酸乙酯酯化液于蒸馏装置中分别蒸馏、浓缩,接取酒精度分别为35%vol、40%vol、45%vol、50%vol、60%vol的馏出液,通过比较不同酒精度下馏出液的乳酸乙酯含量及色泽和外观,确定最适的调味酒酒精度。
1.3.6 分析方法
参照文献[23]中高效液相色谱法测定乳酸及乳酸乙酯的含量。HPLC条件:Agilent1260-紫外高效液相色谱仪;色谱柱为C18(4.6 mm×250 mm,5 μm);流动相为乙腈与0.05 mol/L KH2PO4体积比8∶92;流速为1.0 mL/min;柱温为30 ℃;进样量为20 μL;检测波长为210 nm。
2 结果与分析
2.1 脂肪酶催化合成乳酸乙酯条件优化单因素试验结果与分析
2.1.1 pH值对乳酸乙酯合成的影响
pH值对乳酸乙酯合成的影响见图1。
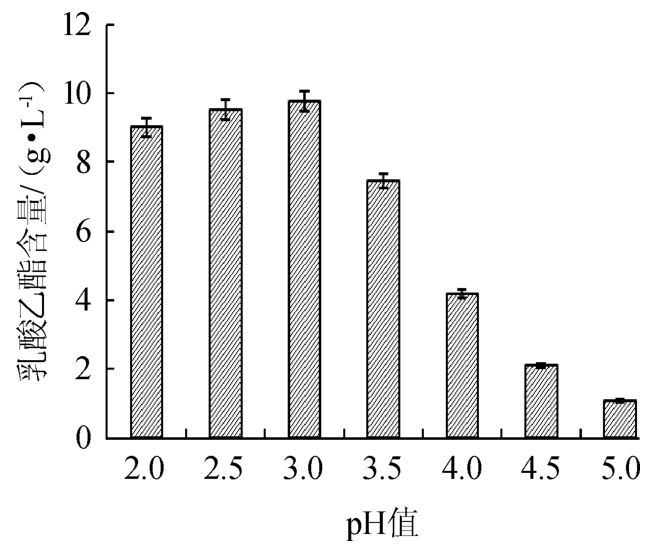
图1 pH值对乳酸乙酯合成的影响
Fig.1 Effect of pH on synthesis of ethyl lactate
由图1可知,随着反应液pH的增加,乳酸乙酯含量呈先增加后减少的趋势。当反应液pH值为3.0时,乳酸乙酯含量达到最大值,为9.47 g/L;当pH值<3.0之前,乳酸乙酯含量相对较高,说明酸性环境较有利于乳酸乙酯的合成;而当pH>3.0之后,随着pH值的增加,乳酸乙酯含量急剧下降,分析原因可能是由于随着pH值的升高,酯化酶的催化活性逐渐降低。因此,确定催化体系的最佳pH值为3.0。
2.1.2 反应温度对乳酸乙酯合成的影响
反应温度对乳酸乙酯合成的影响结果见图2。

图2 反应温度对乳酸乙酯合成的影响
Fig.2 Effect of reaction temperature on synthesis of ethyl lactate
由图2可知,随着反应温度的升高,乳酸乙酯含量呈先增加后减少的趋势。当反应温度为30 ℃时,乳酸乙酯含量达到最大值,为9.64 g/L。分析原因可能是由于在一定温度范围内,酶活力随反应温度的增加而逐渐升高;当达到酶的最适温度时,酶的活性达到最大,催化效率最高;当超过酶的最适温度时,酶活性则开始下降。因此,确定最适反应温度为30 ℃。
2.1.3 酶用量对乳酸乙酯合成的影响
酶用量对乳酸乙酯合成的影响结果见图3。
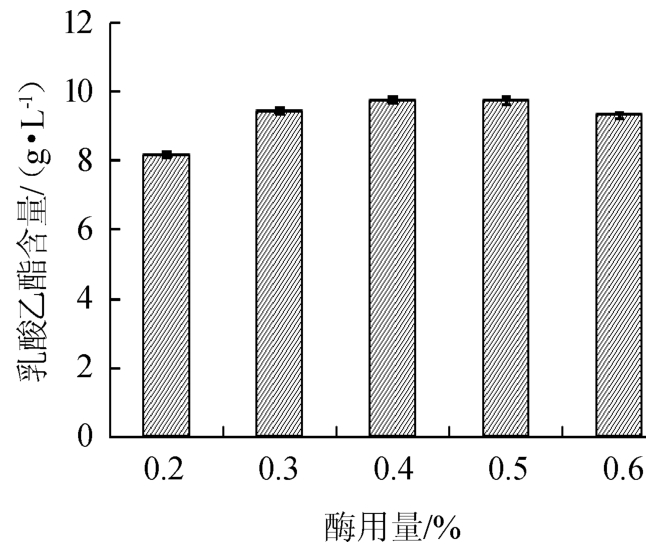
图3 酶用量对乳酸乙酯合成的影响
Fig.3 Effect of enzyme addition on synthesis of ethyl lactate
由图3可知,随着酶添加量的增加,乳酸乙酯含量呈先增加后减少的趋势。当酶添加量为0.4%时,乳酸乙酯含量达到最大值,为9.76 g/L;当酶添加量>0.4%之后,乳酸乙酯含量下降。分析原因可能是在一定的酶浓度范围内,酶浓度越大,酶与反应底物的接触几率越大,酶的催化反应效果越好,但当酶浓度相对于底物浓度接近饱和时,酶浓度对催化效果影响较小。因此,确定最佳的脂肪酶添加量为0.4%。
2.1.4 反应时间对乳酸乙酯合成的影响
反应时间对乳酸乙酯合成的影响结果见图4。

图4 反应时间对乳酸乙酯合成的影响
Fig.4 Effect of reaction time on synthesis of ethyl lactate
由图4可知,随着反应时间的延长,乳酸乙酯的含量呈先增加后减少的趋势。当反应21 d时,乳酸乙酯含量达到最大值,为10.08 g/L;当反应时间>21 d之后,乳酸乙酯含量下降,说明在第21天时底物的转化合成率达到最高,而继续增加反应时间,脂肪酶则主要表现出水解作用,使反应向着水解乳酸乙酯的方向进行。因此,确定该体系下合成乳酸乙酯的最佳反应时间为21 d。
2.1.5 酒尾与乳酸发酵液体积比对乳酸乙酯合成的影响
酒尾与乳酸发酵液体积比对乳酸乙酯合成的影响结果见图5。
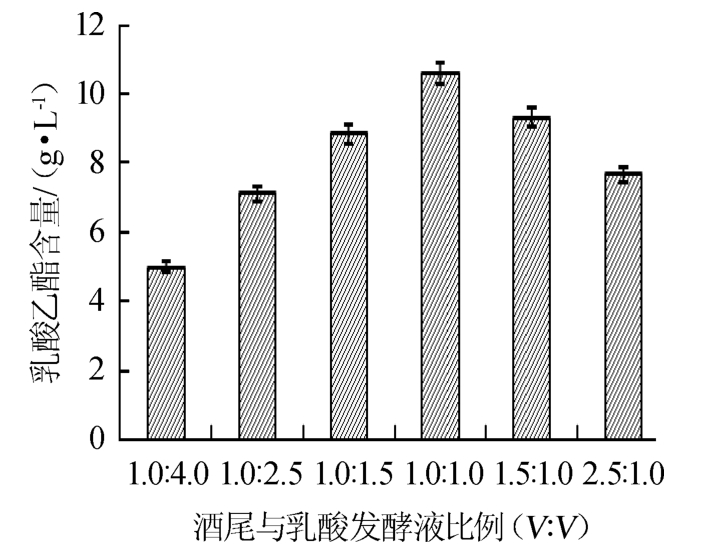
图5 酒尾与乳酸发酵液体积比对乳酸乙酯合成的影响
Fig.5 Effect of tailing liquor to lactic acid fermentation broth ratio on synthesis of ethyl lactate
由图5可知,随着酒尾与乳酸发酵液体积比的增加,即乙醇含量逐渐提高,乳酸含量逐渐降低,乳酸乙酯含量呈现先增加后减少的趋势。当酒尾与乳酸发酵液体积比为1.0∶1.0时,乳酸乙酯含量达到最大值,为10.59 g/L。分析原因可能是:酯化反应作为一种可逆反应,在一定范围内底物乳酸与乙醇含量的增加会促进酯化反应向合成乳酸乙酯的正方向进行,而当底物浓度过低时酯化酶则会催化反应向水解酯的逆方向进行;反应底物浓度太高会抑制脂肪酶的催化活性,甚至失去酶活性。因此,确定该体系下酒尾与乳酸发酵液的最佳体积比为1.0∶1.0。
2.2 脂肪酶催化合成乳酸乙酯条件优化正交试验结果与分析
2.2.1 正交试验结果与方差分析
根据单因素试验结果,以乳酸乙酯含量(Y)为评价指标,选取反应温度(A)、反应时间(B)、酶用量(C)、酒尾与乳酸发酵液体积比(D)4个因素进行4因素3水平正交试验,结果与分析见表2,方差分析见表3。
由表2极差分析可知,各因素对结果影响的主次顺序为D>A>B>C,即酒尾与乳酸发酵液体积比>反应温度>反应时间>酶添加量;该酯化酶催化合成乳酸乙酯的最佳条件组合为A2B2C3D2,即反应温度30 ℃,反应时间21 d,酯化酶添加量0.5%,酒精度40%vol的酒尾与乳酸发酵液体积比1.0∶1.0。由表3方差分析结果可知,反应温度和酒尾与乳酸发酵液体积比对乳酸乙酯催化合成有显著影响(P<0.05),而其他因素对结果影响不显著(P>0.05)。
表2 脂肪酶B催化合成乳酸乙酯条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for optimization of ethyl lactate synthesis condition catalyzed by lipase B
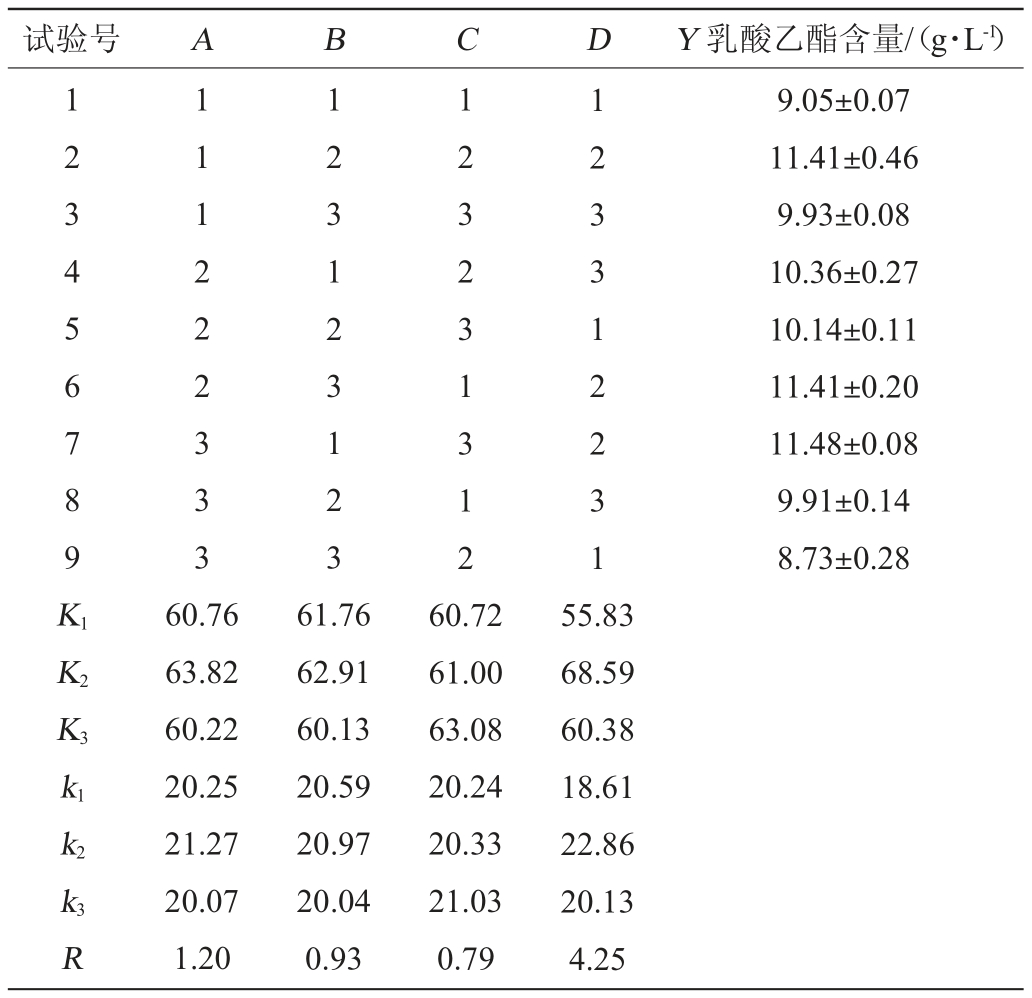
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal tests results

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
2.2.2 最优组合验证
按照上述正交试验得到的乳酸乙酯最佳合成条件组合进行了5次平行验证性试验,乳酸乙酯含量为(12.05±0.06)g/L。高于正交试验中的任何一组;且相对标准偏差(relative standard deviation,RSD)为0.51%,说明该乳酸乙酯酯化液合成制备工艺稳定、可行。
2.3 高乳酸乙酯调味酒的制备
不同酒精度下馏出液的乳酸乙酯含量及色泽见表4。
表4 调味酒酒精度对乳酸乙酯含量和酒体色泽的影响
Table 4 Effect of alcohol content of flavoring liquor on ethyl lactate content and liquor body color

由表4可知,随着调味酒酒精度的降低,乳酸乙酯的含量逐渐升高,当酒精度<45%vol之前,酒体逐渐出现浑浊现象。分析原因可能是由于酒尾中含有大量沸点较高的酯类、酸类,这些物质难溶于水,易溶于乙醇。因而最终确定最适调味酒酒精度为45%vol,此时酒体无色透明、无悬浮物、无沉淀,乳酸乙酯香味突出,乳酸乙酯含量达17.62 g/L,可用于乳酸乙酯含量偏低基酒的勾兑与调味。
3 结论
本研究通过单因素及正交试验确定南极假丝酵母脂肪酶B催化酒尾和干酪乳杆菌乳酸发酵液合成乳酸乙酯的最佳催化合成工艺为酒精度40%vol的酒尾与乳酸发酵液体积比1.0∶1.0,pH值3.0,脂肪酶添加量0.5%,反应温度30 ℃,反应时间21 d。在此最优催化合成条件下,酯化液中乳酸乙酯含量达12.05 g/L。酯化液经蒸馏、浓缩后,以酒精度为45%vol的馏出液作为调味酒,此时调味酒中乳酸乙酯含量最高,为17.62 g/L,酒体清澈透明,酯香突出,适用于勾调冬季或机械化生产中乳酸乙酯含量偏低的基酒,增加乳酯含量,稳定和改善固液结合白酒或液态发酵白酒的质量,提高经济效益。
[1]孙宝国,吴继红,黄明泉,等.白酒风味化学研究进展[J].中国食品学报,2015,26(9):1-7.
[2]肖冬光,赵树欣,陈叶福,等.白酒生产技术[M].北京:化学工业出版社,2011:132-140.
[3]辛磊.白酒微量成分与酒体风格特征关系的探讨[J].食品与机械,2004,20(2):49-50.
[4]沈怡方.白酒中四大乙酯在酿造发酵中形成的探讨[J].酿酒科技,2003(5):28-31.
[5]邢爽,魏志阳,郭学武,等.不同香型大曲酯化酶特性的研究[J].现代食品科技,2018(5):87-92.
[6]唐取来,李晶晶,郭学武,等.清香型大曲酯化酶活力的研究[J].中国酿造,2017,36(1):35-38.
[7]王小琴,练顺才,安明哲,等.大曲酯化力对固态酿酒的作用[J].酿酒科技,2016(1):63-64.
[8]刘彩霞,郭学武,李玲玲,等.高产酯酿酒酵母与乳酸菌共发酵过程中的相互作用研究[J].现代食品科技,2017(7):79-84.
[9]李维青.浓香型白酒与乳酸菌、乳酸、乳酸乙酯[J].酿酒,2010,37(3):90-93.
[10]汪春乾,陈俊伟,伍远超.清洁生产在白酒工业中的推广应用及研究[J].酿酒科技,2011(10):127-130.
[11]刘义刚,周治全,周超,等.全细胞酯化曲(酶)在生物酯化液中的应用[J].酿酒科技,2016(2):72-76.
[12]刘雪,杨爱华,张雪梅,等.华根霉生物酶法合成己酸乙酯条件的研究[J].酿酒科技,2017(2):57-60.
[13]潘志友,韩双艳,林影,等.南极假丝酵母脂肪酶B 的酿酒酵母表面展示及其催化己酸乙酯的合成[J].生物工程学报,2008,24(4):674-676.
[14]徐大刚,肖禄生,蔡扬,等.用脂肪酶非水相生物催化合成己酸乙酯的研究[J].精细化工,2004(4):279-281.
[15]王晓丹,胥思霞,班世栋,等.红曲酯化酶粗酶制剂在浓香型青酒大曲酒生产中的应用研究[J].酿酒科技,2014(7):43-48.
[16]赵天涛,高静,张丽杰,等.有机相中脂肪酶催化合成乳酸乙酯[J].催化学报,2006(6):537-540.
[17]赵江,胡松青.响应面法优化非水相酶催化合成乳酸乙酯[J].现代食品科技,2009,25(11):120-124.
[18]王牛牛,雷振河,李琦,等.以红曲霉酯化酶催化合成乳酸乙酯的研究[J].食品与发酵工业,2011,36(1):17-21.
[19]孙海龙,王有旭,朱文众.南极假丝酵母脂肪酶B 处理对白酒丢糟中有机酸酯化效果的影响[J].生物工程,2013(6):26-27.
[20]刘彩霞,郭学武,李玲玲,等.高产酯酿酒酵母与乳酸菌共发酵过程中的相互作用研究[J].现代食品科技,2017(7):79-84.
[21]任道群,唐玉明,姚万春,等.酯化酶动力学研究[J].酿酒科技,2006(6):28-29.
[22]魏志阳,李秋志,邢爽,等.HPLC 法同时测定清香类酒醅中主要酸和酯类物质[J].中国酿造,2018,37(8):167-171.
[23]JUHL P B,DODERER K,HOLLMANN F,et al.Engineering of Candida antarctica lipase B for hydrolysis of bulky carboxylic acid esters[J].J Biotechnol,2010,150(4):474-480.