酵母菌是人类文明史上利用得最早的微生物,属于兼性厌氧菌,其中酿酒酵母(Saccharomyces cerevisiae)利用最为普遍[1]。S.cerevisiae是一类用途广泛、研究透彻的单细胞真菌,作为重要的生产用微生物,在医药、食品和生物能源等方面受到人们的倍加重视[2]。S.cerevisiae在以葡萄糖为底物的发酵过程中,营养物质除用于菌株生长所必需的蛋白质和核酸等合成外,还会产生一些中间代谢产物和副产物[3]。研究表明,S.cerevisiae作为模式生物,易于培养、繁殖迅速、代谢产物少、碳源利用率高以及可存活于较低pH环境,这也就意味着在有限的营养供应和相对恶劣的条件下能完成大规模的产物积累[4-7]。作为公认安全(generally regarded as safe,GRAS)微生物,S.cerevisiae遗传操作技术成熟,蛋白质组学、转录组学和基因组学的有关理论研究较为清楚,而且自身具有完整的基因表达调控机制和对表达产物的加工后修饰能力,为S.cerevisiae的应用奠定了坚实的基础[8]。与细菌相比,S.cerevisiae对各种环境制约因子耐受性强,安全无致病性,为工业化生产提供了更高的可行性。
中国作为食品生产大国,尤其是发酵食品、酿酒业在世界范围内起到举足轻重的作用。长久以来,S.cerevisiae作为酿酒工业的主要微生物,对我国酒精饮料制品的发展起到重要的影响[9]。乙醇作为S.cerevisiae的主要代谢产物,可以提高酒精饮料的品质[10]。S.cerevisiae在代谢过程中还可以产生有机酸和氨基酸,将其作为发酵剂或出发菌株应用于食品饮品领域,能改善发酵制品的风味和口感[11]。随着生物技术的不断发展,研究者通过多种手段解析S.cerevisiae的代谢途径,从基因水平以及合成物学角度探究S.cerevisiae的产物合成机理,人为地改造菌株,获得工业化产品[12-14]。然而,新型S.cerevisiae的分离筛选以及高产量代谢产物菌株的获得仍是目前研究的工作重点[15]。
在先前的研究中,从东北葡萄果园中筛选出多株高产乙醇的菌株,并鉴定菌株的类别。本研究在此基础上,以S.cerevisiae QY-1为研究对象,采用高效液相色谱(high performance liquid chromatography,HPLC)仪和全自动氨基酸分析仪对其发酵过程中葡萄糖消耗量、乙醇生成量、有机酸及游离氨基酸(free amino acid,FAA)的种类及含量进行测定,研究菌株的发酵特性,为酵母的食品开发应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)QY-1:从东北葡萄果园中分离。
1.1.2 试剂
天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、组氨酸、赖氨酸、精氨酸、脯氨酸标准品(纯度均≥98%):赛卡姆(北京)科学仪器有限公司;葡萄糖、乙醇、无水柠檬酸、α-酮戊二酸、丙酮酸、苹果酸、琥珀酸、L-乳酸、甲酸、乙酸(纯度均≥98%):上海源叶生物科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)琼脂培养基、YPD培养基:青岛海博生物技术有限公司。
葡萄糖单碳源发酵培养基[16]:葡萄糖80 g,酵母提取物5 g,(NH4)2SO42.5 g,KH2PO42.5 g,MgSO4·7H2O 0.25 g,无水CaCl20.25 g,蒸馏水1 L,调pH值至5.0,108 ℃高压湿热灭菌20 min。
1.2 仪器与设备
Aminex HPX-87H有机酸和醇分析柱:美国Bio-Rad公司;S-433D全自动氨基酸分析仪:德国Sykam公司;Waters TMe2695型高效液相色谱(highperformanceliquidchromatography,HPLC)仪:美国Waters公司;22331Hamburg高速离心机:德国Eppendorf公司;FE28 pH计:梅特勒-托利多集团;V-5000可见分光光度计:上海元析仪器有限公司;BSP-400生化培养箱:上海博讯有限公司;SPH-110X12往复式恒温振荡水浴培养摇床:上海世平实验设备有限公司。
1.3 方法
1.3.1 酿酒酵母QY-1的发酵
活化:将甘油管保藏的S.cerevisiae QY-1接种于装液量为20 mL/50 mL的YPD培养基中,30 ℃、140 r/min振荡培养24 h,活化菌株。
种子液制备:将活化后的菌液分三区划线于YPD琼脂培养基平板上,30 ℃条件下静置培养48 h。连续传代培养3代后,分别挑取生长状况优良的单菌落接种于装液量为100 mL/250 mL的YPD培养基中,30 ℃、140 r/min振荡培养24 h制备种子液。
发酵液制备:将种子液以5%(V/V)的接种量接种于葡萄糖单碳源发酵培养基中,30 ℃、140 r/min培养60 h,每隔6 h取适量发酵液,利用紫外分光光度计测定吸光度值(OD600nm值),利用pH计测定发酵液的pH值。
1.3.2 测定方法
(1)葡萄糖、乙醇及有机酸[17]
采用高效液相色谱法测定发酵液中的葡萄糖、乙醇和有机酸含量。HPLC条件:Aminex HPX-87H有机酸和醇分析柱(300 mm×7.8 mm),流动相为0.005 mol/L H2SO4,流速0.6 mL/min,进样量20 μL,柱温35 ℃,检测波长210 nm。
标准曲线的绘制:配制不同质量浓度(0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.0 g/L、1.2 g/L)的葡萄糖、乙醇、无水柠檬酸、α-酮戊二酸、丙酮酸、苹果酸、琥珀酸、L-乳酸、甲酸、乙酸等标准溶液,取标准品1 mL,用0.22 μm滤膜过后,采用HPLC法测定。以有机酸质量浓度(x)为横坐标,峰面积(y)为纵坐标绘制标准曲线。
发酵液中葡萄糖、乙醇和有机酸含量的测定:取发酵液1 mL稀释100倍,13 000 r/min离心10 min,取上清液,0.22 μm滤膜过滤,采用HPLC法测定。
(2)游离氨基酸
参照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》进行测定。
1.3.3 数据处理
每个试验均设置3个重复,数据以均值±标准差形式表示。利用JMP(Version 9.0.2)软件进行方差分析及多重比较。采用Sigmaplot(Version 10.0)软件绘图。
2 结果与分析
2.1 酿酒酵母QY-1的生长及pH值变化分析

图1 酿酒酵母QY-1的生长状况及pH值变化
Fig.1 Growth situation and pH change of Saccharomyces cerevisiae QY-1
由图1可知,随着发酵时间的延长,OD600nm值呈先急速上升后保持稳定的趋势。在发酵0~24 h期间,酿酒酵母QY-1生长迅速;发酵24 h时,OD600nm值达到1.125±0.034;发酵24 h后,酿酒酵母QY-1生长进入稳定期。随着发酵时间的延长,pH值与OD600nm值负向耦合,呈先急速下降后保持稳定的趋势。在发酵0~24 h期间,pH值急速下降;发酵24 h时,pH值为3.87±0.08;发酵24 h后,pH值趋于稳定;发酵72 h时,pH值为3.81±0.04。因此得出,酿酒酵母QY-1在发酵过程中产生大量的有机酸,促使发酵体系的pH值降低。
2.2 葡萄糖和乙醇含量变化分析
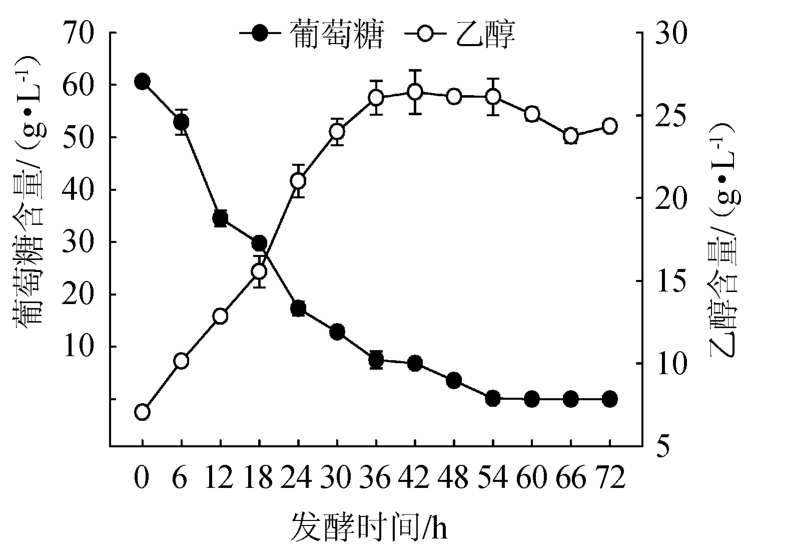
图2 酿酒酵母QY-1发酵过程中葡萄糖和乙醇含量的变化
Fig.2 Changes of glucose and ethanol content during Saccharomyces cerevisiae QY-1 fermentation
由图2可知,随着发酵的进行,葡萄糖被不断消耗,发酵54 h时,葡萄糖被消耗殆尽。而乙醇的生成量与葡萄糖消耗量负向耦合,呈先急速上升后略有下降最后保持平稳的趋势,在发酵36 h时,乙醇含量最高,为(26.87±2.76)g/L。分析原因可能是,酵母菌在发酵过程中将α-酮戊二酸、丙酮酸和乳酸逐渐转化为乙醇代谢中间产物,随着发酵时间的延长,乙醇产量迅速提高。在发酵后期,由于营养物质消耗殆尽,酵母菌生长代谢活性降低,导致乙醇含量逐渐稳定。袁文杰等[18]利用HPLC法研究克鲁维酵母(Kluyveromyces)菊芋发酵液中乙醇、糖和有机酸的变化情况发现,主要发酵产物为乙醇,主要副产物为乙酸、甘油和琥珀酸。
2.3 酿酒酵母QY-1发酵过程中有机酸及游离氨基酸变化分析
由图3可知,随着发酵的进行,有机酸含量呈现先升高后保持平稳的趋势,在发酵72 h时达到最高,为(3.242±0.213)g/L。而游离氨基酸含量则呈先升高后降低的趋势,在发酵24 h时达到最高,为(5.57±0.08)mg/L,此时有机酸含量为(2.364±0.101)g/L。在发酵72 h时,游离氨基酸含量为(3.68±0.11)mg/L,分析原因可能是发酵过程中菌体消耗了氨基酸[19]。酸类物质是酒精饮料中重要的风味物质,在酒精饮料中有增加浓厚感和减少甜味的作用,但是酸含量要适中,否则会影响酒精饮料的口感和风味[20]。游离氨基酸是酵母发酵过程中的主要可同化含氮物,对酵母菌的生长、碳源消耗和防止发酵停滞等均有重要影响[21]。在发酵食品以及酒精饮料中添加酵母菌,不仅可以有效地改善食品饮料的风味和口感,还可以提高食品饮料的营养价值。
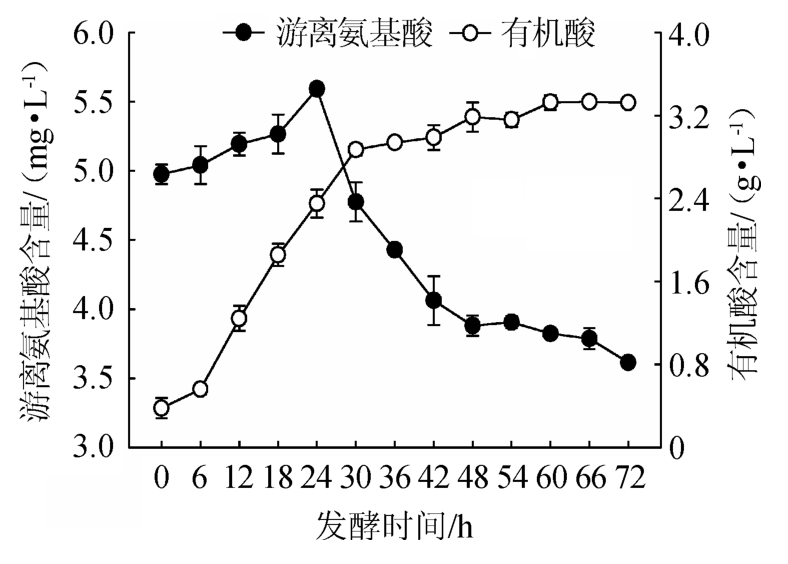
图3 酿酒酵母QY-1发酵过程中有机酸及游离氨基酸总量的变化
Fig.3 Changes of total organic acid and total free amino acid contents during Saccharomyces cerevisiae QY-1 fermentation
为进一步研究酿酒酵母QY-1的发酵动态变化,对菌株发酵过程中有机酸及游离氨基酸的种类及含量进行分析,结果见表1及表2。
表1 酿酒酵母QY-1发酵过程中有机酸种类及含量的变化
Table 1 Changes of types and contents of organic acid during Saccharomyces cerevisiae QY-1 fermentation g/L
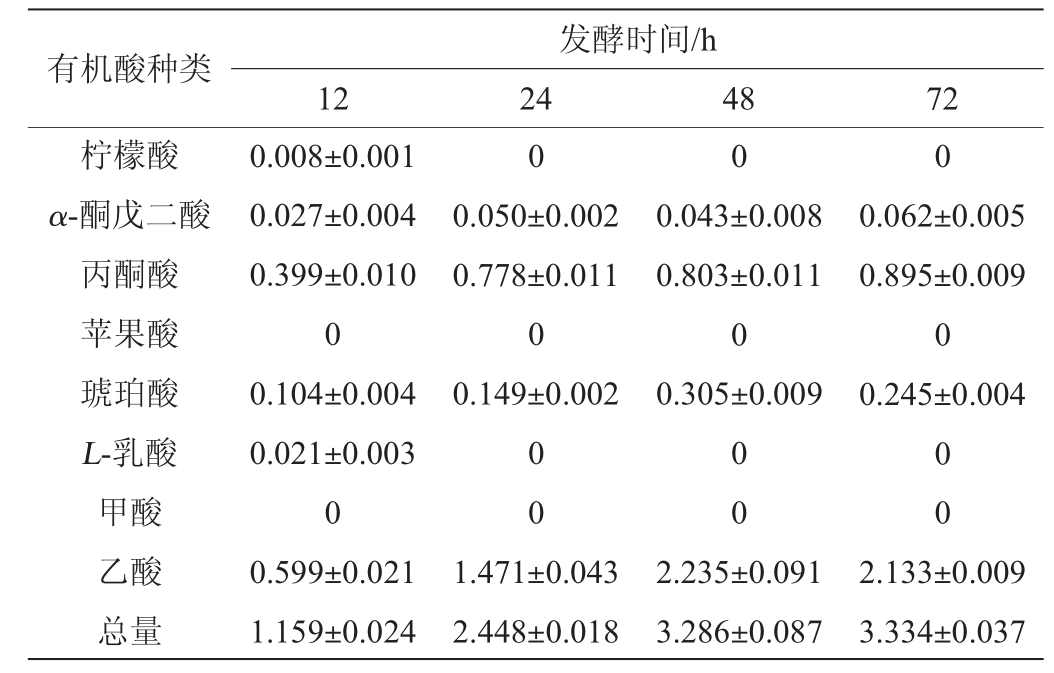
由表1可知,在酿酒酵母QY-1的整个发酵过程中,共检测到6种有机酸,包括柠檬酸、α-酮戊二酸、丙酮酸、琥珀酸、L-乳酸和乙酸,没有检测到苹果酸和甲酸。发酵12 h时,乙酸含量最高为(0.599±0.021)g/L,其次为丙酮酸(0.399±0.010)g/L;发酵24 h之后,柠檬酸和L-乳酸消失,各有机酸的含量从高到低依次为乙酸、丙酮酸、琥珀酸、α-酮戊二酸。柠檬酸是三羧酸循环中产生的少量中间代谢产物,很少甚至没有被分泌到胞外,甚至有少量的柠檬酸会被酵母菌利用[16],因此,在发酵24 h时消失。
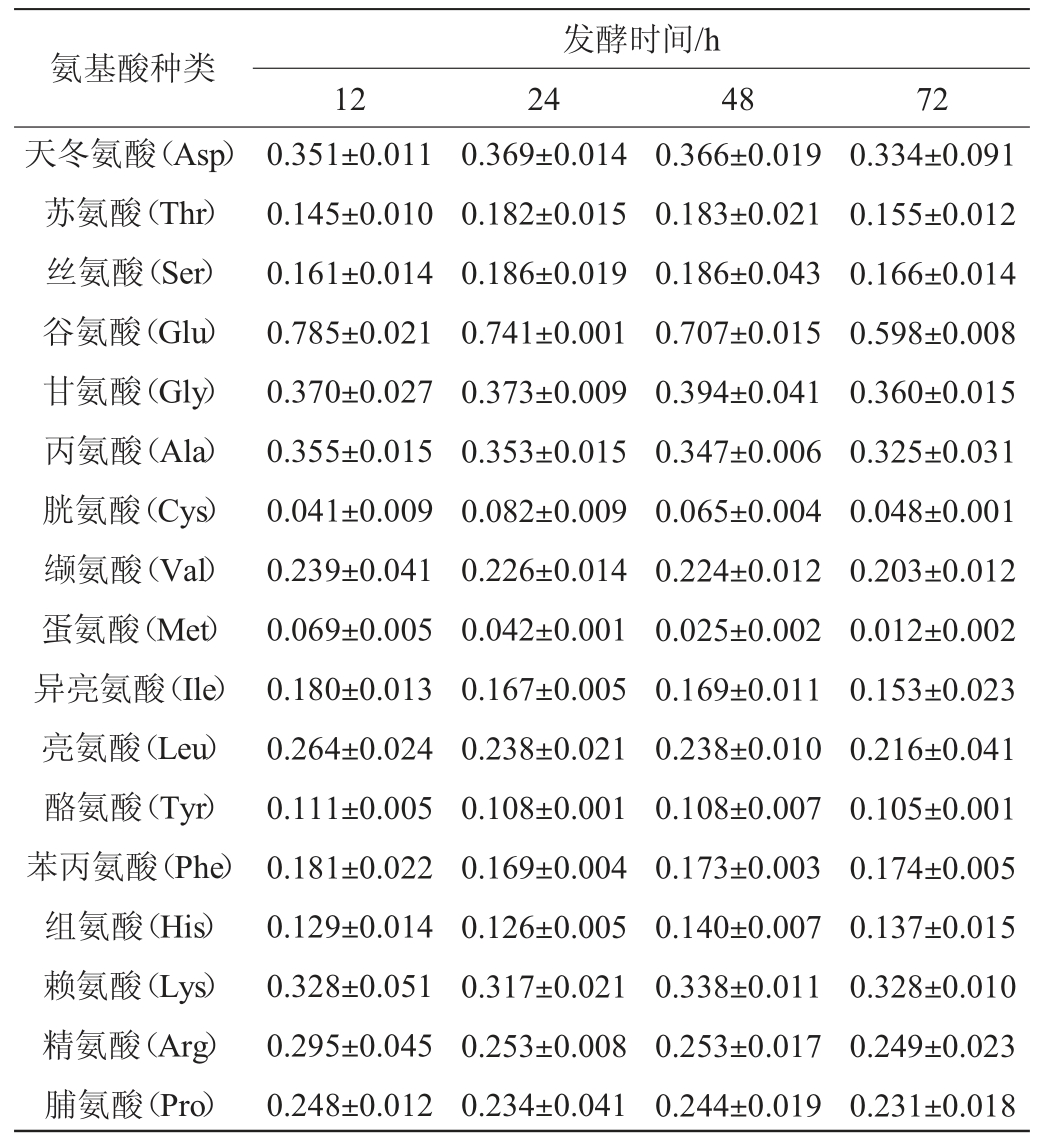
由表2可知,在酿酒酵母QY-1发酵过程中,共检测到17种游离氨基酸,谷氨酸含量最高,其次为甘氨酸,天冬氨酸、胱氨酸和蛋氨酸的含量较少。氨基酸作为营养价值评价指标,不仅可以促进人体机体正常生长、修复组织、调节血糖,而且可以提供能量,对人体的健康起着重要作用。酿酒酵母QY-1发酵过程中包含人体所需的8种必需氨基酸,因此可以得出,酿酒酵母QY-1所产生的氨基酸种类齐全、营养丰富,可以应用于多种食品和饮料中,提高营养价值。
表2 酿酒酵母QY-1发酵过程中游离氨基酸种类及含量的变化
Table 2 Changes of types and contents of free amino acid during Saccharomyces cerevisiae QY-1 fermentation mg/L
3 结论
本研究对酿酒酵母QY-1发酵过程中的OD600nm值、pH值、葡萄糖消耗量、乙醇生成量、有机酸及游离氨基酸种类及含量进行监控和分析。结果表明,随着发酵时间的延长,酿酒酵母QY-1的OD600nm值呈现先升高后保持稳定趋势,pH值呈现先急速下降后保持平稳的趋势,pH值与OD600nm值呈负向耦合;乙醇的生成量与葡萄糖消耗量负向耦合;有机酸含量呈现先升高后保持平稳的趋势,最高达(3.242±0.213)g/L,其中乙酸含量最高,其次为丙酮酸。游离氨基酸含量则呈现先升高后降低的趋势,最高达(3.68±0.11)mg/L,其中谷氨酸含量最高,蛋氨酸含量最低。本研究结果不仅为筛选用于食品工业和酿酒工业的优势菌株提供菌株来源,还为酿酒酵母的代谢过程研究提供理论支撑,同时为酿酒酵母功能性食品的开发和应用提供了基础数据。
[1]VASILEIOS E,MATTEO P,KALLIOPI R,et al.Saccharomyces cerevisiae-Starmerella bacillaris strains interaction modulates chemical and volatile profile in red wine mixed fermentations[J].Food Res Int,2019,122:392-401.
[2]赵小丽,甄玉国,王兰惠,等.酿酒酵母发酵条件的研究[J].中国酿造,2014,33(6):75-78.
[3]SUN L,LIU G Y,LI Y,et al.Metabolic engineering of Saccharomyces cerevisiae for efficient production of endocrocin and emodin[J].Metab Eng,2019,54:212-221.
[4]YU B,SUN J,BOMMAREDDY R R,et al.Novel(2R,3R)-2,3-butanediol dehydrogenase from potential industrial strain Paenibacillus polymyxa ATCC 12321[J].Appl Environ Microbiol,2011,77(12):4230-4233.
[5]秦加阳,肖梓军,张兆斌,等.一种简单的高产2,3-丁二醇发酵生产方法[J].生物加工过程,2005,3(4):71-73
[6]汪兆峰,石贵阳,张梁.酿酒酵母产D-乳酸重组菌的构建与发酵[J].生物加工过程,2015(6):6-12.
[7]李代昆,张德纯.酿酒酵母发酵糖类生产酒精的研究现状[J].中国微生态学杂志,2005,17(2):82-83.
[8]唐香山,张学文.酿酒酵母表达系统[J].生命科学研究,2004(S1):106-109.
[9]白梦洋,吴祖芳,李若云,等.果酒酵母菌多菌种混合培养的生长规律及挥发性风味物质的差异性分析[J].中国食品学报,2019,19(5):214-221.
[10]LAI H,CHIOU J G,ZHURIKHINA A,et al.Temporal regulation of morphogenetic events in Saccharomyces cerevisiae[J].Mol Biol Cell,2018,29(17):2069-2083.
[11]OGBUEWU I P,OKORO V M,MBAJIORGU E F,et al.Yeast(Saccharomyces cerevisiae) and its effect on production indices of livestock and poultry-a review[J].Comp Clin Pathol,2019,28(3):669-677.
[12]尹花,贺扬,侯晓平,等.Lager 啤酒酵母起源的历史足迹及基因组学研究[J].食品与发酵工业,2019,45(9):274-281.
[13]陈修来,王元彩,董晓翔,等.代谢工程改造酿酒酵母生产L-苹果酸[J].食品与生物技术学报,2019,38(2):72-80.
[14]黄耀庆,刘夺,贾斌,等.合成型酿酒酵母染色体重排技术及应用[J].生物产业技术,2019(1):62-66.
[15]杜仁鹏,赵丹,宋刚,等.高产乙醇酵母菌株的筛选及产醇发酵条件研究[J].黑龙江大学自然科学学报,2017,34(5):575-583.
[16]马建刚,刘娇,曾祥峰,等.大肠杆菌9 种有机酸代谢产物的高效液相检测条件优化[J].现代食品科技,2011,27(5):591-594.
[17]BAUTISTA K,UNPAPROM Y,RAMARAJ R.Bioethanol production from corn stalk juice using Saccharomyces cerevisiae TISTR 5020[J].Energ Source,2019,41(13):1615-1621.
[18]袁文杰,孔亮,孜力汗,等.高效液相色谱法测定克鲁维酵母菊芋发酵液中的乙醇,糖和有机酸类代谢成分[J].分析化学,2009,37(6):850-854.
[19]罗凤莲,夏延斌,文新昱.不同发酵条件对剁辣椒中有机酸种类及含量的影响[J].食品科技,2015,40(11):48-52.
[20]黄媛媛.酿酒酵母的筛选及发酵性能的比较[J].酿酒科技,2019(2):40-43,48.
[21]PROCOPIO S,KRAUSE D,HOFMANN T,et al.Significant amino acids in aroma compound profiling during yeast fermentation analyzed by PLS regression[J].LWT-Food Sci Technol,2013,51(2):423-432.