在我国常采用大曲、小曲和麸曲生产白酒,固态发酵生产白酒方法中,大曲既是一种粗制酶制剂,又是一种糖化发酵剂,同时也起生香作用[1]。由于大曲是自然培养而成的,所以含有霉菌、酵母、细菌等多种微生物种群及其产生的蛋白酶酶系、淀粉酶酶系及风味酶酶系等复合酶系,是一种多菌种的混合酶制剂,为形成复杂的香气成分起重要作用,由此可见,曲的优劣与酒的质量和酒体风格直接相关,名酒之所以为名酒,名在质量,贵在风格。微生物在白酒酿造中起着主要作用,因此了解微生物在酒曲培养以及白酒酿造过程中的习性和作用,不仅有利于提高白酒质量,而且可满足消费者对于曲酒类型的不同需求以及对曲酒品质的要求[2]。
传统的平板培养或聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)等技术只能对大曲中少数可以分离培养的菌种进行研究,具有很大的局限性,而高通量测序(high-throughput sequencing,HTS)技术具有高通量、高分辨率的优势,为准确揭示微生物菌群的多样性提供了强有力的手段,能够充分展示微生物菌群的多样性[3]。目前,Rocher 454、Illumina和Iontorrent是广泛应用的高通量测序平台,Miseq是Illumina开发的第二代高通量测序技术,具有成本低、准确率高、操作简便的优点,已被广泛且成功地应用于食品[4]、土壤[5-6]、水资源[7-8]等的微生物菌群分析,但目前应用高通量测序技术对白酒酿造大曲的真菌的研究报道还比较少。
本实验采用高通量测序技术,利用Illumina公司Miseq测序平台对浓香型白酒的中高温曲和芝麻香型白酒的高温曲中的真菌多样性进行研究,建立一套高通量测序技术分析白酒酒曲真菌的方法,同时通过数据分析,完整的解析两种酒曲中真菌的群落结构。为建立浓香型白酒酒曲和芝麻香型白酒酒曲的微生物信息数据库,优化酒曲的发酵工艺和提升品质提供了理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
浓香型白酒中高温曲(1月龄、2月龄、4月龄,分别命名为Z1、Z2、Z3)、芝麻香型白酒高温曲(命名为AA1):均取自河南省宋河酒业股份有限公司。样品采集后迅速粉碎密封,-20 ℃保存备用。
1.1.2 主要试剂
Taq脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(5 U/μL):美国Thermo公司;E.Z.N.A.Soil DNA提取试剂盒:美国OMEGA公司;SanPrep柱式DNA胶回收试剂盒:生工生物工程(上海)股份有限公司;Qubit2.0 DNA检测试剂盒:美国Life公司。
1.2 仪器与设备
Mastercycler PCR仪:德国Eppendorf公司;Pico-21台式离心机:美国Thermo Fisher公司;GL-88B漩涡混合器:其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:拓能达科技有限公司;DYY-6C型电泳仪:北京六一仪器厂;GelDoc-ItTS3凝胶成像系统:美国UVP公司;Miseq高通量测序仪:美国Illumina公司。
1.3 方法
1.3.1 DNA的提取
酒曲中微生物总DNA的提取按照DNA提取试剂盒说明书中的方法和步骤进行。
1.3.2 聚合酶链式反应及测序
以总DNA为模板,采用Miseq测序平台的通用引物ITS1(5'-CCCTACACGACGCTCTTCCGATCTN(barcode)CTTGGTCATTTAGAGGAAGTAA-3')和ITS2-Rev(5'-GTGACTGGAGTTCCTTGGCACCCGAGAATTCCAGCTGCGTTCTTCATCGATGC-3')对酒曲中真菌的ITS序列进行PCR扩增。
PCR扩增体系:10×PCR buffer 5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)0.1 mmol/L,DNA 10 ng,ITS1 0.5 μmol/L,ITS2-Rev 0.5 μmol/L,Plantium Taq 0.05 U,用双蒸水补充至50 μL。
PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,共计5个循环;然后94 ℃变性20 s,45 ℃退火20 s,65 ℃延伸30 s,共计20个循环;最后72 ℃延伸5 min。
PCR扩增结束后,PCR扩增产物进行琼脂糖电泳,利用SanPrep柱式DNA胶回收试剂盒回收PCR扩增产物。利用Qubit2.0 DNA检测试剂盒对回收的PCR扩增产物进行精确定量,依托生工生物工程(上海)股份有限公司进行Illumina MiSeq高通量测序。
1.3.3 数据分析
将测序获取的原始序列的双末端序列融合成一个方向的序列并进行质量控制(quality control,QC),方法如下:
(1)序列的融合,采用1.2.3 Flash软件融合双末端的序列,通过各个样品的barcode使数据回归样品,并对各个样品序列进行质量控制。
(2)QC分析:采用V0.20.4 Prinseq软件对序列阅读框的3'端进行质控,去掉碱基质量(Q)值<20的数据,提高后续序列的融合比率;通过Flash软件融合双末端序列,使其形成一条序列;采用Prinseq软件去除各个样品的引物序列、小于200 bp的序列、低质量序列和低复杂度序列;截掉非靶区域序列和嵌合体,首先采用1.30.1 Mothur软件的Pre.cluster模块校正测序错误,校正过程中允许的最大错配是1/150。然后,以Silva数据库中的序列作为模板,采用Uchime功能模块去掉嵌合体和非靶区域序列。
2 结果与分析
2.1 序列的拼接
采用Illumina Miseq测序平台得到Z1、Z2、Z3、AA1样本对应的原始序列分别为49 404条、51 278条、64 658条和98 202条,其平均长度分别为317.72 bp、304.71 bp、296.31 bp和254.15 bp,经拼接、过滤,分别得到有效序列49 389条、51 246条、64 587条和97 934条,其平均长度分别为273.91 bp、261.13 bp、252.28 bp和211.03 bp。
2.2 序列丰富度和多样性分析
香农(Shannon)指数、ACE指数、Chaol指数、辛普森(Simpson)指数和Coverage指数是常用于描述微生物群落物种多样性的Alpha多样性指数,这5个多样性指数可以对群落物种组成的丰富度及群落物种组成的均匀度进行综合性的评价,5个多样性指数中的Shannon指数对微生物群落物种多样性更为敏感。其中,Shannon指数越大,群落物种的多样性越高;Chaol指数或ACE指数越大表明群落物种丰富度越高;由Coverage指数可知本次实验的取样是否合理,若Coverage指数>97%,则证明本次取样是合理的;但Simpson指数值越大,说明群落多样性越低[9]。基于高通量测序技术对浓香型白酒中高温曲和芝麻香型白酒高温曲中真菌的序列数量、操作分类单元(operational taxonomic units,OTU)和Alpha多样性指数进行研究,结果见表1。
表1 不同酒曲中真菌的序列数量、操作分类单元和Alpha多样性指数分析结果
Table 1 Analysis results of sequence amounts,operational taxonomic units and alpha diversity indexes of fungi in different Jiuqu
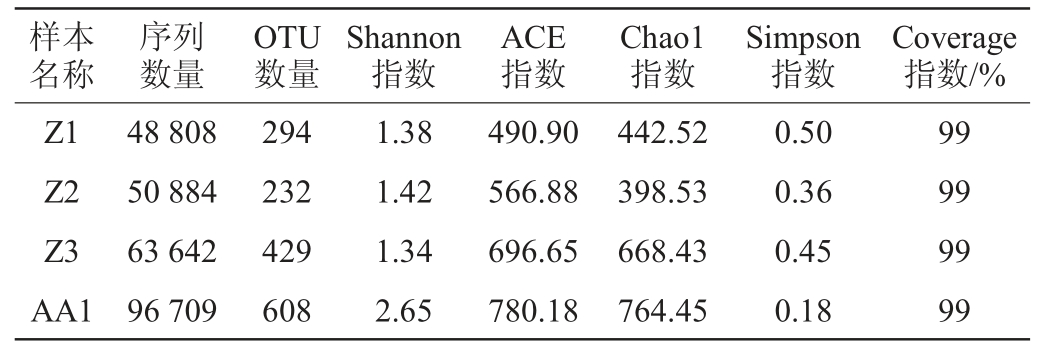
由表1可知,尽管Z1、Z2、Z3、AA1样品对应的Alpha指数在绝对数值上略有差异,但都可以看出测序数据量已足够大,可以反映样本中绝大多数的微生物信息。通过对4个样本对比分析可知,在浓香型白酒中高温曲中,样品Z3的Chao1指数值(668.43)最大,说明Z3样本的真菌群落物种丰富度最高;样品Z2的Shannon指数值(1.42)最大且Simpson指数值(0.36)最小,说明样品Z2的真菌群落多样性最高。芝麻香型白酒高温曲样本AA1的Chao1指数值(764.45)和Shannon指数值(2.65)都比浓香型白酒中高温曲的指数值大,因此,芝麻香型高温曲的真菌物种丰富度和真菌群落多样性都比浓香型白酒中高温曲的大。4个样品的Coverage指数都>97%,说明本次取样是合理的,测序结果能反映样本的真实情况。
2.3 香农指数曲线分析
香农指数曲线反映样品中微生物多样性,可以用于比较测序数据量不同的样本中物种的丰富度,也可以用于说明样本的测序数据量是否合理。当曲线趋向平坦时,说明测序数据量合理,更多的数据量只会产生少量新的OTU,反之则表明继续测序还可能产生较多新的OTU[10]。
基于高通量测序技术对浓香型白酒中高温曲和芝麻香型白酒高温曲中真菌的香农指数进行分析,香农指数曲线如图1所示。
由图1可以看出,随着测定序列数量的增加,稀释曲线趋向平坦,说明测序数据量渐进合理,取样情况能较好的说明样品中涵盖的所有菌群,样品Z1、Z2和Z3的稀疏性曲线几乎在同一曲线上,这是由于3个样本的Shannon指数值(分别为1.38、1.42和1.34)非常接近,所以微生物群落物种的多样性几乎是一样的,更多的数据量对发现新OTU的边际贡献很小。而样品AA1的稀疏性曲线则高于样品Z1、Z2和Z3,说明在芝麻香型白酒曲中真菌的物种多样性高于浓香型白酒中高温曲中真菌的物种多样性。

图1 不同酒曲的香农指数曲线
Fig.1 Shannon index curves of different Jiuqu
2.4 基于属水平各样本中真菌的种类和相对丰度分析
在属水平上,基于高通量测序技术对浓香型白酒中高温曲和芝麻香型白酒高温曲真菌的种类和相对丰度进行分析,根据相对丰度将样本中菌属分为优势菌属(相对丰度≥1.0%)和次要菌属(相对丰度<1.0%),且将次要菌属归类于其他(others),其结果见表2。
表2 不同酒曲中真菌菌属及相对丰度
Table 2 Genus and relative abundance of fungi in different Jiuqu

注:“-”代表相对丰度<1.0%。
由表2可知,假丝酵母属(Candida)是浓香型白酒中高温曲和芝麻香型白酒高温曲中的优势真菌群。随着浓香型白酒中高温曲贮存时间的延长,Candida的相对丰度逐渐增加。而曲霉属(Aspergillus)则正好相反,贮存时间越长菌属相对丰度越低。除此之外,根毛霉属(Rhizomucor)的相对丰度是先上升再下降,说明这类菌属在贮存4个月过程会出现峰值,然后开始下降;热子囊菌属(Thermoascus)则是先下降再上升。在浓香型白酒1月龄、2月龄和4月龄的中高温曲中未分类酵母的含量依次递减,到4月龄的酒曲中未分类酵母只占0.57%。芝麻香型白酒高温曲中真菌的物种多样性高于浓香型白酒曲中真菌的物种多样性,其主要优势菌属是假丝酵母(Candida)、曲霉属(Aspergillus)、威克汉姆酵母(Wickerhamomyces)、根毛菌属(Rhizomucor)等。
参考相关文献报道分析以上8种优势真菌菌属的功能作用如下:
假丝酵母(Candida)属于半知菌亚门(Deuteromycotina)、芽孢菌纲(Blastomycetes)、隐球酵母目(Cryptococcales)、隐球酵母科(Cryptacoccaceae),此属中有许多种具有酒精发酵的能力。施安辉等[11]研究发现,徐坊中高温大曲中耐热的Candida在酵母菌种中占优势;吕旭聪等[12]研究发现,福建红曲黄酒中含有10株光滑假丝酵母(Candida glabrata)。
曲霉属(Aspergillus)属半知菌亚门(Deuteromycotina)、丝孢纲(Hyphomycetes)、丝孢目(Hyphomycetes)、从梗孢科(Moniliaceae)[13],能够产生淀粉酶、蛋白酶、糖化酶、酯化酶、果胶酶、纤维素酶、单宁酶等,在白酒的酿造过程中主要作用于发酵的前期,是白酒发酵原料中淀粉等大分子物质分解的主要动力之一[14]。
根毛霉属(Rhizomucor)属于接合菌门(Zygomycota)、接合菌纲(Zygomycetes)、毛霉目(Mucorales)、毛霉科(Mucoraceae)。高亦豹[15]采用PCR-DGGE技术发现米黑根毛霉(Rhizomucor miehei)仅存在于今世缘中温曲、口子窖中温曲、汤沟大曲及剑南春大曲等中温大曲中。该菌具有很强的产脂肪酶能力,国内外很多学者对该菌所产脂肪酶进行了研究[16]。
嗜热子囊菌属(Thermoascus)属于真菌门(Eumycota)、子囊菌亚门(Ascomycotina)、嗜热子囊菌科(Thermoascaceae),可以产生过氧化氢酶[17]、内切葡聚糖酶[18]、木聚糖酶[19]、葡萄糖苷酶[20]、角质酶[21]和几丁质酶[22]等。徐占成等[8]利用高通量测序法对剑南春大曲真菌群落结构进行分析发现,Thermoascus在检测大曲样品中的相对丰度值介于1.711%~5.081%之间。
威克汉姆酵母(Wickerhamomyces)属于非酿酒酵母,虽然其发酵能力较低,但其可以合成多种酶,将原料中的前体物质转化成酯、酸、高级醇和醛等风味物质,对白酒风味的形成有重要的作用[23]。明红梅等[24]利用响应面法进一步优化异常威克汉姆酵母(Wickerhamomyces anomalus)发酵产苯乙醇的条件;陈玉香等[25]研究了发酵温度对W.anomalus产挥发性风味物质的影响。
脉孢菌属(Neurospora)属于子囊菌亚门(Ascomycotina)、粪壳菌纲(Sordariomycetes)、粪壳菌目(Sordariales),粪壳菌科(Sordariaceae),主要产生纤维素酶[26],其模式菌粗糙脉孢菌(Neurospora crassa)在纤维素降解以及糖转运蛋白方面取得了极其显著的成就[27-29]。
炭疽菌属(Colletotrichum)又称刺盘孢属,是半知菌亚门(Deuteromycotina)、腔孢纲(Coelomycetes)、黑盘孢目(Melanconiales)、黑盘孢科(Melanconiaceae)[30]。炭疽菌是一种植物病原真菌[31-32],也是一种植物内生真菌,普遍存在各种植物中,可以增强植物对病虫害的抵抗能力或者产生特有的次生代谢产物[33]。
镰刀菌属(Fusarium)是全球最重要的大型真菌属之一,主要侵染农业上重要的谷物[34],产生的镰刀菌属真菌毒素具有急性和慢性毒性作用[35],在酒曲的生产中要注意防治。
3 结论
本实验基于Illumina MiSeq高通量测序研究了宋河酒业浓香型白酒中高温酒曲和芝麻香型白酒高温酒曲中的真菌群落结构。在属的分类水平上分析,浓香型白酒中高温酒曲的优势真菌群(相对丰度≥1%)主要有假丝酵母(Candida)、嗜热子囊菌属(Thermoascus)、根毛霉属(Rhizomucor)等。芝麻香型白酒高温酒曲的优势真菌群主要有假丝酵母(Candida)、曲霉属(Aspergillus)、威克汉姆酵母(Wickerhamomyces)等。随着浓香型白酒中高温酒曲贮存时间的延长,假丝酵母(Candida)的相对丰度逐渐增加,其在两种酒曲中都是优势真菌,此属中有许多种具有酒精发酵的能力。采用高通量测序技术对酒曲中的菌落物种分类研究,操作简单、通量高、信息丰富,和传统方法比较具有一定的优越性。该研究成果为进一步研究优化制曲工艺、提高酒曲质量指明了方向,具有重要的理论和实践意义。
[1]龙婷,余志晟,汪强,等.我国传统白酒酿造与工业酒精发酵的比较分析[J].中国酿造,2018,37(12):7-11.
[2]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[3]MARGULIES M,EGHOLM M,ALTMAN W E,et al.Genome sequencing in microfabricated high-density picolitre reactors[J].Nature,2005,437:376-380.
[4]焦晶凯,莫蓓红.Illumina MiSeq 平台高覆盖率测定干酪中的细菌微生物多样性[J].中国酿造,2014,33(5):34-38.
[5]田地,马欣,李玉娥,等.利用高通量测序对封存CO2泄漏情景下土壤细菌的研究[J].环境科学,2013,34(10):4097-4104.
[6]SUN J,ZHANG Q,ZHOU J,et al.Illumina amplicon sequencing of 16S rRNA tag reveals bacterial community development in the rhizosphere of apple nurseries at a replant disease site and a new planting site[J].PLoS One,2014,9(10):e111744.
[7]KESHRI J,MANKAZANA B B J,MOMBA M N B.Profile of bacterial communities in South African mine-water samples using Illumina nextgeneration sequencing platform[J].Appl Microbiol Biot,2015,99(7):3233-3242.
[8]徐占成,唐清兰,刘孟华,等.剑南春酒曲细菌群落结构的分析[J].酿酒,2015(4):13-16.
[9]李慧星,杜风光,薛刚.高通量测序研究酒精废水治理中厌氧活性污泥的微生物菌群[J].环境科学学报,2016,36(11):4112-4119.
[10]幸晶晶,雷琼,邱祖明,等.应用高通量技术分析F446 饱水木漆器中微生物群落结构多样性[J].微生物学通报.2018,45(8):1685-1692.
[11]施安辉,关纪奎,张文璞,等.徐坊大曲的微生物区系及其优势菌的鉴定[J].酿酒科技,2001(6):26-28.
[12]吕旭聪,翁星,黄若兰,等.红曲黄酒酿造用曲及传统酿造过程中酵母菌的多样性研究[J].中国食品学报,2012,12(1):182-190.
[13]赵中开,龙可,马莹莹,等.米曲霉菌在酿酒工业中的研究进展[J].现代食品科技,2013,29(4):932-935.
[14]赵东,杨蓉.白酒酿造微生物培养技术研究[J].酿酒,2014(6):21-25.
[15]高亦豹.聚合酶链式反应-变性梯度电泳技术(PCR-DGGE)研究中国白酒大典中微生物群落结构[D].无锡:江南大学,2010.
[16]BOEL E,HUGEJENSEN B,CHRISTENSEN M,et al. Rhizomucor miehei triglyceride lipase is synthesized as a precursor[J].Lipids,1988,23(7):701-706.
[17]谢雪凤.嗜热子囊菌产过氧化氢酶的生产、固定化及应用研究[D].杭州:浙江工业大学,2009.
[18]王冬梅,张秀云,薛梅,等.嗜热子囊菌光孢变种(Thermoascus aurantiacus var.levisporus)固态发酵姜苗产内切β-葡聚糖酶条件优化[J].畜牧与兽医,2016,48(3):37-42.
[19]王美娟.嗜热子囊菌产耐热木聚糖酶的条件及酶学性质的研究[D].镇江:江苏大学,2017.
[20]陈卫红,李多川.嗜热子囊菌光孢变种β-葡萄糖苷酶的基因克隆、表达及酶学性质分析[J].应用与环境生物学报,2009,15(4):549-553.
[21]张瑶.嗜热子囊菌角质酶—纤维素结合域融合蛋白的构建、定性及其在纺织工业中的应用[D].无锡:江南大学,2011.
[22]张婕,谢晨,郭晓红,等.嗜热子囊菌原变种Thermoascus aurantiacus var.aurantiacus 热稳定几丁质酶的克隆表达及活性研究[J].菌物学报,2010,29(5):691-697.
[23]简晓平,简章容,余丽辰,等.1 株Wickerhamomyces 酵母菌对浓香型白酒发酵的影响[J].酿酒科技,2017(9):33-38.
[24]明红梅,周健,陈蒙恩,等.大曲中异常威克汉姆酵母发酵产苯乙醇的条件优化[J].湖北农业科学,2015,54(14):3492-3496.
[25]陈玉香,张雯,蔡琪琪,等.发酵温度对异常维克汉姆酵母产挥发性风味物质的影响[J].中国食品学报,2016,16(9):122-128.
[26]冉雪琴,叶静,王嘉福,等.罗汉松和珙桐内生真菌的分离及其多样性研究[J].中国农学通报,2014,30(25):12-19.
[27]郭清华,熊本涛,陈少林.粗糙脉孢菌产纤维素酶培养条件的优化[J].西北林学院学报,2018,33(2):151-155.
[28]TIAN C,BEESON W T,IAVARONE A T,et al.Systems analysis of plant cell wall degradation by the model filamentous fungus Neurospora crassa[J].P Natl Acad Sci USA,2009,106(52):22157-22162.
[29]ALLGAIER S,TAYLOR R D,BRUDNAYA Y,et al.Vaccine production in Neurospora crassa[J].Biologicals,2009,37(3):128-132.
[30]GALAZKA J M,TIAN C,BEESON W T,et al.Cellodextrin transport in yeast for improved biofuel production[J].Science,2010,330(6000):84-86.
[31]崔静秋.炭疽菌属与黑痣菌属分类及分子系统发育研究[D].杨凌:西北农林科技大学,2009.
[32]向梅梅,张云霞,刘霄.炭疽菌属真菌分类的研究进展[J].仲恺农业工程学院学报,2017,30(1):59-66.
[33]王剑文,夏仲豪,谭仁祥.内生真菌Colletotrichum sp.B501 的寡糖提取物对黄花蒿发根中青蒿素生物合成的诱导[J].植物学报,2002,44(10):1233-1238.
[34]张向民.镰刀菌属分类学研究历史与现状[J].菌物研究,2005,3(2):59-62.
[35]黄晓静,王少敏,毛丹,等.镰刀菌属真菌毒素的毒性研究进展[J].食品安全质量检测学报,2017(8):3117-3128.