小曲是以大米、米糠、麸皮等为原料,用于酿造生产甜米酒、黄酒、米香型、清香型和豉香型白酒的糖化发酵剂,根据形态不同可以分为块状小曲和散曲等[1-3]。小曲中微生物的群落组成和代谢决定了小曲酒的风味与品质,细菌在小曲中起着至关重要的作用,在发酵初期提供酿造所需的酸性环境,产生蛋白酶、脂肪酶、糖化酶等丰富多样的酶系,且具有酯化、促美拉德反应和产生吡嗪类物质等能力,从而促进酒中多种风味物质的形成[4-9]。探究小曲中细菌多样性,以此为基础,研究酿酒小曲功能细菌并应用于酿酒是目前提高酒质和生产效率的手段之一。
早期关于酒曲中细菌多样性的研究主要采用传统的分离纯化方法,该方法虽工作量大、分析速度慢[5-6],只能获得可培养微生物的部分信息,对于菌群结构的分析具有片面性,但获得可培养微生物的生物学形态特征及生理生化性能对于功能细菌的筛选具有重要意义。随着分子生物技术的发展,不依赖于培养的技术如聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)和高通量测序技术被应用于分析酒曲中微生物的群落结构。PCR-DGGE技术成本较低,但操作过程繁琐,对技术人员要求较高,且无法实现大量样本的同时检测[10]。高通量测序技术安全性和可靠性高,能更为全面的表现样品微生物丰度等优势[11]。因此,近几年,高通量测序技术开始应用于小曲中微生物群落结构的分析[6,12-15]。胡翠翠[14]利用高通量测序技术分析了黄酒曲中优势细菌菌群,结果表明,黄酒曲中主要细菌菌群包括片球菌属(Pediococcus)、水栖菌属(Enhydrobacter)、杆菌属(Geobacillus)、苍白杆菌属(Ochrobactrum)、链球菌属(Streptococcus)、醋杆菌属(Acetobacter)等20个属;WU H等[12]利用高通量测序技术分析了中国华西、湖北、四川酿酒小曲的微生物群落结构,结果表明,共鉴定出17种细菌,其中的优势细菌属为魏斯氏菌属(Weissella)、葡萄球菌属(Staphylococcus)和稳杆菌属(Empedobacter);WANG J等[13]利用高通量测序技术分析了中国华西、湖北、四川传统小曲中细菌的群落结构,结果表明,小曲中的细菌主要包括乳杆菌属(Lactobacillus)、Pediococcus、Weissella、芽孢杆菌属(Bacillus)、Acetobacter、不动杆菌属(Acinetobacter)和葡糖杆菌属(Gluconobacter)。
本研究首次采用高通量测序技术结合传统可培养分离方法对贵州5个地区(黔南州、遵义、盘州、威宁、兴仁)代表性传统酿酒小曲中细菌群落结构进行分析,并通过主成分分析(principal component analysis,PCA)对不同小曲样品细菌群落结构的相似性进行分析,挖掘具有地域特色的功能细菌资源,以期为进一步利用和开发小曲微生物资源提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
小曲A:贵州威宁县某酒厂生产块状酿酒小曲;小曲B:贵州盘州市某酒厂生产块状酿酒小曲;小曲C:贵州遵义市某酒厂生产块状酿酒小曲;小曲D:贵州黔南州某酒厂生产酿酒散曲;小曲E和F:贵州兴仁市生产块状酿酒小曲。采集时间为2017年9月份,取样后分别装入密封袋,置于冰盒运回实验室,分2份后分别保藏于4 ℃和-80 ℃。
1.1.2 试剂
营养琼脂(nutrient agar,NA)培养基:上海博微生物科技有限公司;丙三醇(分析纯)、无水乙醇(分析纯):天津市富宇精细化工有限公司;琼脂糖H(生化试剂):上海斯信生物科技有限公司;Loading Buffer:宝生物工程(大连)有限公司。
1.2 仪器与设备
CX31RBSFA显微镜:日本东京奥林巴斯株式会社;SPX-250生化培养箱:上海悦丰仪器仪表有限公司;BCD-640WAGM冷藏柜:青岛海尔股份有限公司;ZQPL-200立式全温振荡培养箱:天津市莱玻特瑞仪器设备有限公司;5424EQ766751离心机:德国Eppendorf公司;Block assembiy 96G PCR仪:德国Jena分析仪器设备股份有限公司;Bio-Bset140E 凝胶成像仪:美国西蒙国际公司。
1.3 方法
1.3.1 小曲中DNA提取、PCR扩增和测序
将保藏于-80 ℃的小曲样品送至北京百迈客生物科技有限公司进行脱氧核糖核酸(deoxyribonucleic acid,DNA)提取、PCR扩增及测序。具体操作:采用土壤微生物DNA强力提取试剂盒提取小曲样品中的DNA,以其为模板对细菌16S rRNA的V3与V4区进行PCR扩增。PCR扩增引物为F(5'-ACTCCTACGGGAGGCAGCA-3')和R(5'-GGACTACHVGGGTWTCTAAT-3')。PCR扩增体系为引物F、R各1.5μL,基因组DNA 5 μL,KOD FX Neo 1 μL,buffer 25 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)10 μL,双蒸水(ddH2O)补至总体系50 μL。PCR扩增条件为95 ℃预变性5 min;95 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min,共15个循环;72 ℃再延伸7 min。PCR扩增产物纯化后用1.8%的琼脂糖凝胶进行检测,优质DNA片段进一步在Illumina HiSeq 2500测序平台条件下进行高通量测序。
1.3.2 高通量测序数据处理与分析
高通量测序所得序列通过拼接、过滤、去除嵌合体,得到最终有效序列。利用定量洞察微生物生态学(quantitative insights into microbial ecology,QIIME)划分操作分类单元(operational taxonomic unit,OUT),将相似度>97%的序列定义为一个OTU,每个OTU对应于一种代表序列,并基于Silva分类学数据库进行16S rRNA基因序列比对,进行分类学注释。使用Mothur(version v.1.30)软件在97%相似度水平下对样品的Alpha多样性指数进行分析,Alpha多样性指数衡量指标包括超1(Chao1)、ACE、香农(Shannon)和辛普森(Simpson)指数[16]。采用R软件绘制相对丰度热图,并在属水平上进行热图聚类分析。采用PCA对不同小曲样品细菌群落结构的相似性进行分析。
1.3.3 传统小曲中细菌的分离纯化及形态学鉴定
分别称取10 g传统小曲于250 mL三角瓶中,加入无菌水至终体积100 mL,加入玻璃珠后用透气膜封口;室温条件下150 r/min振荡20 min;静置后,取1 mL上清液梯度稀释至10-1、10-2、10-3、10-4、10-5、10-6,将梯度稀释液分别涂布于NA培养基上,37 ℃恒温倒置培养1~2 d。待菌落长出后,计数,挑出单菌落在NA培养基上分离纯化3~4次,观察菌落形态,并在显微镜下观察细菌细胞形态。
2 结果与分析
2.1 小曲细菌多样性分析
6种小曲样品的16S rRNA V3和V4区高通量测序结果经过滤和双端拼接后,共得到369 734条优质序列,优质序列去除嵌合体后共得到365 169条有效序列,平均碱基长度为423 bp,得到2 181个OTU。为直观展现各小曲样品中的共有OTU和特有OTU,对所有小曲样品的OTU进行统计和比较[17],结果见图1。由图1可知,6种小曲样品中共有的OTU数为65个。使用Greengenes细菌分类学数据库对每个OTU的代表序列进行物种注释,共注释得到209个门、475个纲、750个目、1 269个科、2 049个属和1 458个种水平的细菌。

图1 6种小曲样品OTU的统计和比较
Fig.1 Statistics and comparison of OTU of 6 kinds of Xiaoqu samples
从6种小曲样本中随机抽取一定数量的序列,统计这些序列所代表的OTU数目,并以序列数与OTU数构建稀释性曲线,结果见图2。由图2可知,小曲样品A、B、C、D、E、F的稀释性曲线先急剧上升,随着测序序列数的增加后趋于平缓,说明在序列数增加前期细菌群落中有大量物种被发现;当序列数>20 000个后,物种不再随测序数量的增加而显著增多;结果表明,6种小曲样本测序量充分,测序结果能够真实反映小曲细菌的群落结构和多样性。
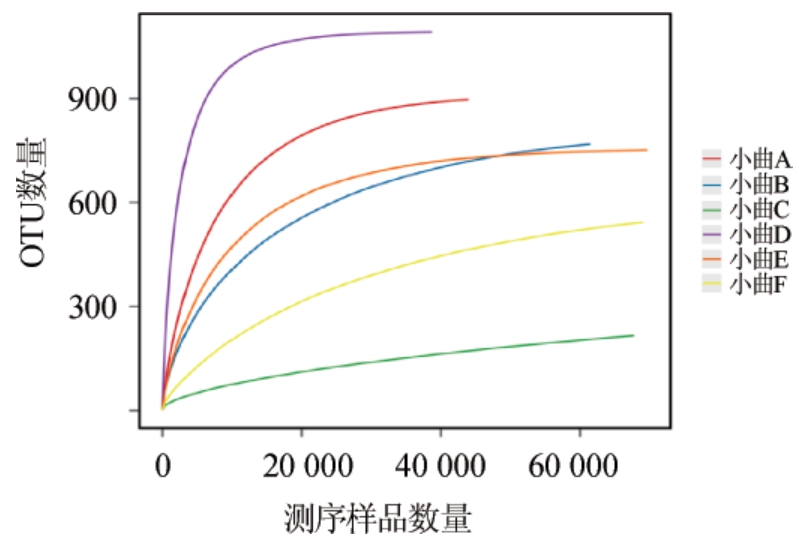
图2 6种小曲样品细菌OTU数稀释性曲线
Fig.2 Rarefaction curves of bacterial OTU numbers in 6 kinds of Xiaoqu samples
利用Mothur软件绘制Shannon指数曲线,结果见图3。由图3可知,所有小曲样品的Shannon指数曲线都随着测序序列数的增加趋于平滑,结果表明测序数据量充分,测序结果能够真实反映小曲细菌的物种信息。
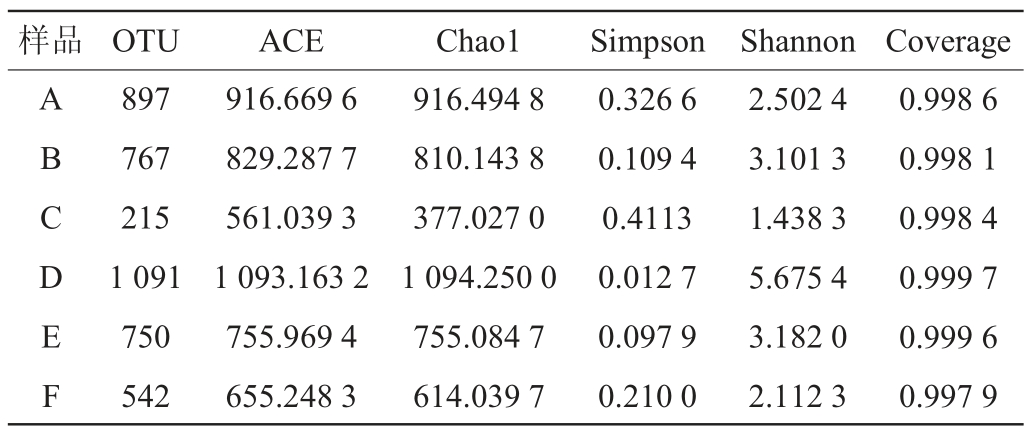
使用Mothur软件评估6种小曲样品细菌的Alpha多样性。在97%相似度水平下,各小曲样品Alpha多样性指数测定结果见表1。由表1可知,Coverage数值越大表示样本检出率越高,6种小曲样品的Coverage数值均>0.997,说明样本中物种被测出的概率较高,测序的结果能够真实的反映样品物种丰度及多样性[18-19]。小曲D的Simpson指数最低,Shannon指数、Chao1指数和ACE指数均高于块状小曲,说明散曲物种分布均匀性最佳,物种丰富度及多样性均高于块状小曲。5种块状小曲样品中物种多样性由高至低依次为小曲E>小曲B>小曲F>小曲A>小曲C,而块状小曲中物种丰富度由高至低依次为小曲A>小曲B>小曲E>小曲F>小曲C。
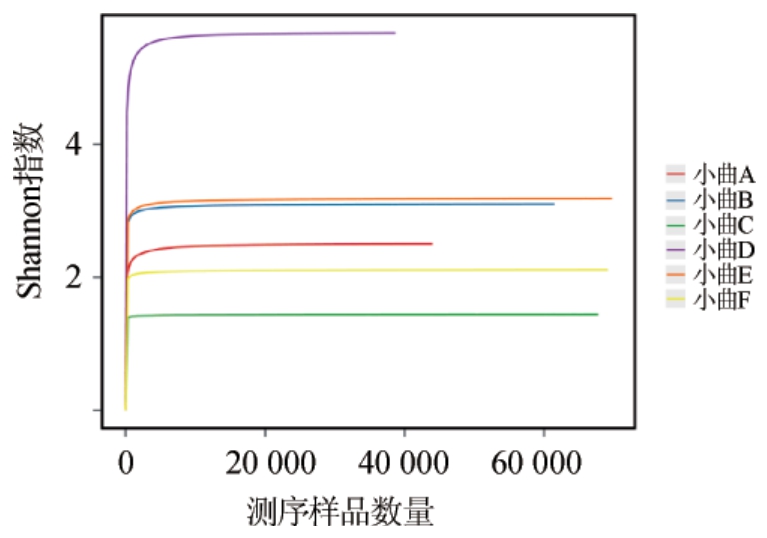
图3 6种小曲样品细菌Shannon指数曲线
Fig.3 Shannon index curve of bacteria in 6 kinds of Xiaoqu samples
表1 6种小曲样品细菌Alpha多样性指数测定结果
Table 1 Determination results of bacterial Alpha diversity index of 6 kinds of Xiaoqu samples
2.2 小曲细菌群落结构分析
2.2.1 基于属水平小曲细菌群落结构分析
基于属水平,对贵州6种小曲的细菌群落结构进行分析,结果见图4,图4中显示丰度水平前十的物种,其他物种合并为Others。由图4可知,在6种小曲样品中主要含有的细菌属为芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、乳酸杆菌属(Lactobacillus)、片球菌属(Pediococcus)和不动杆菌属(Acinetobacter)。各小曲样品优势细菌属不同:小曲A中为Bacillus(55.04%)和Enterobacter(5.46%),小曲B中为Enterobacter(23.90%)、欧文氏菌属(Erwinia)(18.15%)、Bacillus(17.32%)和Pediococcus(11.36%),小曲C 中为Lactobacillus(66.54%)和Pediococcus(4.67%),小曲D中为Bacillus(6.42%)、Lactobacillus(2.95%)和乳球菌属(Lactococcus)(1.14%),小曲E中为Acinetobacter(10.33%)、Pediococcus(10.23%)、明串珠菌属(Leuconostoc)(6.86%)和Lactococcus(5.12%),小曲F中为Pediococcus(37.88%)。
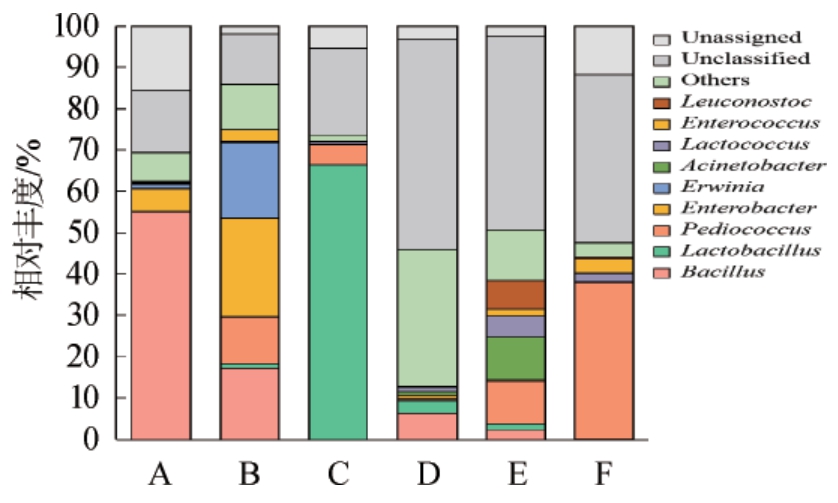
图4 基于属水平6种小曲样品的细菌群落结构
Fig.4 Bacterial community structure of 6 kinds of Xiaoqu samples based on genus level
2.2.2 基于种水平小曲细菌群落结构分析
基于种水平对贵州6种小曲的细菌群落结构进行分析,结果见图5。由图5可知,6种小曲样品中均有大量的细菌无法在种水平上鉴别(样品C、D、E、F中>90%的细菌无法给出种水平的OTU),说明贵州传统小曲中具有丰富的细菌资源尚未被开发,没有列入高通量测序所使用的Greengenes数据库中。在高通量测序能够鉴别至种水平的细菌中,样品A中的优势细菌为凝结芽孢杆菌(Bacillus coagulans),占58.46%;样品B中的优势细菌为Enterobacter cowanii和热淀粉芽孢杆菌(Bacillus thermoamylovorans),分别占46.12%和13.35%;样品C中的优势细菌为短乳杆菌(Lactobacillus brevis),占4.91%;样品D中鉴定出细菌较少,优势细菌为Cetobacterium somerae,仅占3.80%;样品E和F中能够鉴定至种水平的细菌丰度均<1%。

图5 基于种水平6种小曲样品的细菌群落结构
Fig.5 Bacterial community structure of 6 kinds of Xiaoqu samples based on species level
2.3 基于属水平物种丰度聚类热图分析
与柱状图相比,相对丰度热图能更加直观的反映出样本间细菌群落多样性的异同,相对丰度热图通过颜色梯度及相似程度来反映样品群落结构的相似性[20]。基于属水平,6种小曲样品物种丰度聚类热图见图6。由图6可知,散曲D中多个物种丰度较高,小曲A中Bacillus丰度最高,小曲B中Enterobacter、Erwinia等5个物种丰度较高,小曲C中Lac-tobacillus和Weissella丰度较高,小曲E中Acinetobacter、Leuconostoc和Lactococcus等6个物种丰度较高,小曲F中Pedio coccus丰度最高。横向聚类结果显示小曲C与小曲F、小曲A与小曲B间物种丰度相似度较高,散曲D与传统小曲间物种丰度相似度低。
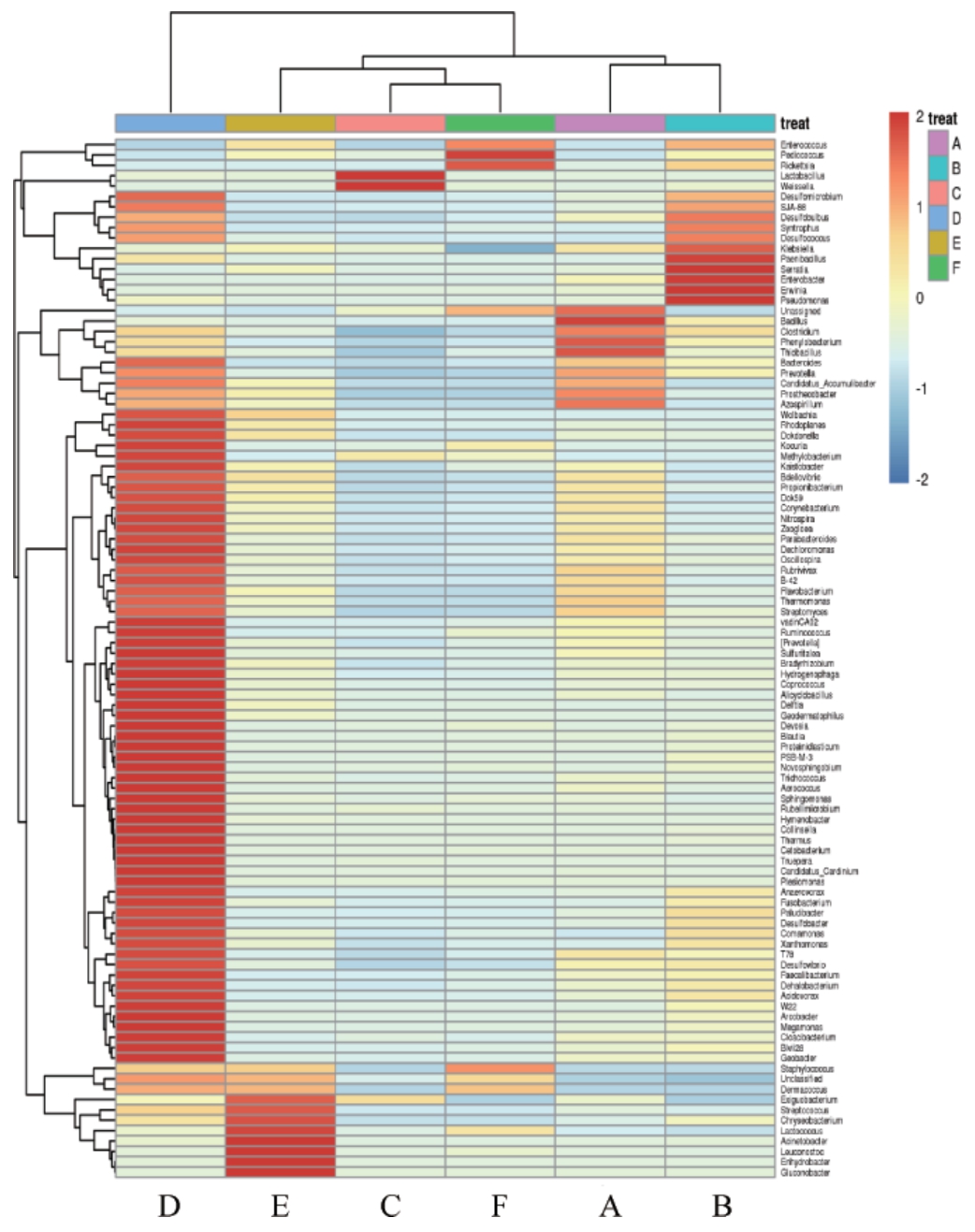
图6 基于属水平6种小曲样品物种丰度聚类热图
Fig.6 Heatmap of species abundance clustering of 6 kinds of Xiaoqu samples based on genus level
热图中颜色代表物种丰度;纵向表示不同物种在各样品间丰度的相似情况,两物种间距离越近,枝长越短,说明两个物种在各样品间的丰度越相似;横向表示不同样品的各物种丰度的相似情况,两样品间距离越近,枝长越短,说明这两个样品的各物种丰度越相似。
2.4 基于属水平主成分分析
基于属水平对6种小曲样品的细菌群落结构的相似性进行PCA,结果见图7。由图7可知,细菌第一主成分(PC1)和第二主成分(PC2)的贡献率分别为48.14%、26.99%,两个主要成分能够解释75.13%的物种差异。因此,采用PC1、PC2对6种小曲样品的细菌群落结构的相似性进行PCA是可行的。小曲样品A、B和D之间细菌群落结构相似,样品E和F之间细菌群落结构相似,样品C与其他5个小曲样品明显分离,说明样品C与其他5个样品细菌群落结构在属水平上有较大差异。

图7 基于属水平6种小曲样品细菌群落结构主成分分析
Fig.7 Principal component analysis of bacterial community structure of 6 kinds of Xiaoqu samples based on genus level
2.5 小曲中细菌的分离及形态学鉴定
采用传统可培养分离方法测定得到A、B、C、E、F 5种传统块状小曲样品中的细菌菌落总数分别为9.21×107 CFU/g、1.15×107 CFU/g、6.93×106 CFU/g、1.17×106 CFU/g和2.77×106 CFU/g;小曲样品A中可培养细菌菌落总数最多,小曲样品B次之,小曲样品E最少。通过分离纯化,共得到84株细菌,根据形态学分类,A、B、C、E和F 5种传统块状小曲中分离得到的细菌种类分别为5种、8种、2种、9种和6种。分离优势菌株的菌落形态及细胞形态见表2。由表2可知,从小曲A、B、C中分离到的细菌主要为杆菌,而小曲E和F中分离出主要为球菌。
表2 传统小曲中分离主要细菌的形态
Table 2 Morphology of main bacteria isolated from traditional Xiaoqu

3 结论
该研究首次运用高通量测序法结合可培养分离法全面研究贵州地区小曲中细菌的多样性。结果表明,散曲细菌多样性及丰富度高于块状小曲,且块状小曲C最低;小曲A、B和D及E和F之间细菌群落结构相似;贵州地区酿酒小曲中优势细菌属为芽孢杆菌(Bacillus)、肠杆菌(Enterobacter)、乳酸杆菌(Lactobacillus)、片球菌(Pediococcus)和不动杆菌(Acinetobacter)。通过传统可培养分离方法从5种传统块状小曲中共分离得到84株细菌,根据形态观察,A、B、C、E和F 5种传统小曲中分离得到的细菌分别为5种、8种、2种、9种和6种,为贵州小曲中功能细菌的研究应用奠定了良好基础。
[1]王和才,李金生,钱菊根.中国酿酒小曲生产现状的调查与分析[J].中国酿造,2011,30(5):13-15.
[2]郭威,方尚玲,庾昌文,等.酿酒小曲的研究进展[J].酿酒科技,2015(6):69-72.
[3]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2007:90-99.
[4]张小龙,陆安谋,王晓丹,等.酱香大曲中产酱香细菌的分离与鉴定[J].酿酒科技,2013(11):4-8.
[5]肖蓓.酱香大曲中细菌类群关系研究与功能细菌筛选[D].贵阳:贵州大学,2015.
[6]CAI H,ZHANG T,ZHANG Q,et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiol,2018,73:319-326.
[7]LIU Z,WANG Z,LV X,et al.Comparison study of the volatile profiles and microbial communities of Wuyi Qu and Gutian Qu,two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiol,2018,69:105-115.
[8]LIU H,SUN B.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[9]班世栋.酱香大曲中霉菌类群和酶系研究[D].贵阳:贵州大学,2015.
[10]赵云峰,田李,张颖.新一代测序技术的发展和应用[J].生物技术通报,2015,31(11):1-8.
[11]米其利,李雪梅,管莹,等.高通量测序在食品微生物生态学研究中的应用[J].食品科学,2016,37(23):302-308.
[12]WU H,ZHANG S,MA Y,et al.Comparison of microbial communities in the fermentation starter used to brew Xiaoqu liquor[J].J I Brewing,2017,123(1):113-120.
[13]WANG J,ZHONG Q,YANG Y,et al.Comparison of bacterial diversity between two traditional starters and the Round-Koji-maker starter for traditional Cantonese Chi-flavor liquor brewing[J].Front Microbiol,2018,9:1053.
[14]胡翠翠.黄酒曲中微生物菌群结构分析及生物胺产生菌的分离鉴定[D].天津:天津科技大学,2017.
[15]GOU M,WANG H,YUAN H,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[16]刘建利,孙敏,曹晓虹,等.利用高通量测序技术分析民间面引子中的真菌多样性[J].食品科学,2018,39(22):186-194.
[17]LI H,LI Z,QU J,et al.Bacterial diversity in traditional Jiaozi and sourdough revealed by high-throughput sequencing of 16S rRNA amplicons[J].LWT-Food Sci Technol,2017,81:319-325.
[18]李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):56-63.
[19]武俊男,刘昱辛,周雪,等.基于Illumina MiSeq 测序平台分析长期不同施肥处理对黑土真菌群落的影响[J].微生物学报,2018,9(9):1658-1671.
[20]吴成,王春晓,王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学,2019,40(3):348-355.