金银花(Lonicerae japonica Thunb)是隶属于忍冬科植物的干燥花蕾,被誉为“国宝一枝花”,其有效成分主要为绿原酸等有机酸类化合物、木犀草苷等黄酮类化合物,以及挥发油、三萜类化合物等活性物质[1],在临床上能起到解毒、抗炎、降血脂、调节免疫等作用[2]。
罗田县位于湖北省东北部,地处大别山,气候环境适宜,山地丘陵随处可见野生金银花,具有很好的金银花资源开发潜能[3]。“罗田金银花”由于具有浓郁的香气和较高含量的绿原酸等活性成分,被评为“中国地理标志产品”[4-5]。“罗田金银花”从2011年开始大面积种植,目前种植规模已超过2万亩,加速了罗田县金银花露加工产业的发展。金银花露加工过程中产生大量的蒸馏残液,其中虽然含有绿原酸等金银花的主要活性物质[6],但由于深加工不足,本地企业多是直接排放,不仅造成巨大的资源浪费,也对环境造成污染。
绿原酸是一种酚类化合物,易溶于水、醇、丙酮等[7],是植物体在有氧呼吸过程中经莽草酸途径产生的一种苯丙素类化合物,具有抗菌、抗病毒、抗氧化、抗肿瘤、降血压、降血脂、抗辐射、提高白细胞数量、补肾、增强免疫调节等能力[8-12]。生物转化又称为生物催化,是依据各种选择性催化生成相应的产物[13],其中涉及到糖基化、环氧化、水解等一系列反应[14-15]。微生物转化植物次生代谢产物近年来逐渐受到人们关注[16],特别是在中药活性物质的转化合成方面表现出良好的应用前景[17-19]。目前对绿原酸转化的研究多是筛选内生真菌来提高其产量或利用微生物对其进行分解[20-22],有关菌株转化金银花中绿原酸的研究较少。
本文拟通过筛选转化绿原酸的优势菌株,探讨其用于发酵转化金银花蒸馏残液中绿原酸的优化条件,从而为地方金银花露加工企业提供一种简单有效的蒸馏剩余物资源化利用工艺。
1 材料与方法
1.1 材料与试剂
金银花蒸馏残液:湖北楚天舒药业有限公司蒸馏剩余物过滤后制得备用;黑曲霉(Aspergillus niger)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli):本校微生物实验室。
氯化钠(分析纯):国药集团化学试剂有限公司;绿原酸标准品(纯度≥95%):天津市天力化学试剂有限公司;氢氧化钠(分析纯):天津市凯通化学试剂有限公司;酵母抽提物、蛋白胨(生化试剂):天津市大茂化学试剂厂。
察氏培养基[23]:取蔗糖30 g,琼脂20 g,NaNO33.0 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,K2HPO41.0 g,KCl 0.5g,蒸馏水1L,pH自然。
1.2 仪器与设备
HYG-B型全温度摇瓶柜:太仓市实验设备厂;YX280/15压力蒸汽灭菌器:上海三申医疗器械有限公司;Ax-205 METTLERTOLEDO型电子天平:瑞士梅特勒-托利多集团;精密试纸:上海三爱思试剂有限公司;SW-CJ-1FD型单人单面净化工作台:苏州净化设备有限公司;H/T18MM型台式高速离心机:湖南赫西仪器装备有限公司;Varian Cary100Scan型紫外可见分光光度计:美国Varian公司;SB25-12DTDN型超声波清洗机:宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 绿原酸标准曲线绘制及样品中绿原酸含量计算
根据文献[24],准确称量6.20 mg绿原酸标准品,反渗透水定容到100 mL容量瓶中,摇匀备用。用移液枪吸取0、1mL、2mL、3mL、4mL、5mL的绿原酸标准品溶液于10 mL容量瓶内,以不加绿原酸标准品溶液的一组作为对照,扫描确定最大吸收波长为320 nm,以吸光度值(A)为纵坐标,绿原酸质量浓度(C)为横坐标,得到绿原酸标准曲线回归方程为A=58.721C-0.119 9,R2=0.999 4,表明绿原酸在0.006 2~0.0310mg/mL范围内的质量浓度与吸光度值呈现良好的线性关系。
按上述方法在波长320 nm处测定样液的吸光度值,并计算绿原酸质量浓度,利用公式(1)计算绿原酸增量:
其中,E为绿原酸增量,μg/mL;C样液为三个平行试验发酵液样品中绿原酸质量浓度,mg/mL;C母液为三个平行样品所对应的未经菌液发酵的混合液中绿原酸质量浓度,mg/mL;V为液体发酵液的体积,mL。
1.3.2 菌株的筛选
实验选取的菌种分别为枯草芽孢杆菌和黑曲霉,将菌扩大培养(细菌培养16~18 h,黑曲霉培养3 d),将培养的菌按1∶2(V∶V)的比例加入灭完菌的含有察氏培养基和金银花蒸馏剩余物的锥形瓶中,做三个平行组以及一个对照组,再将其放入摇床30℃、150 r/min条件下培养6 h,培养结束后,将其取出高速离心,取上清液,测定吸光度值,计算绿原酸含量。
1.3.3 单因素试验
总加入体积为150 mL,取培养基30 mL于250 mL三角瓶,剩余120 mL按一定接种量继续加入,分别以发酵温度(20℃、25℃、30℃、35℃、40℃)、发酵时间(4h、6h、8h、10h、24 h)、接种量(0.58×107CFU/mL、0.72×107CFU/mL、0.96×107CFU/mL、1.44×107CFU/mL、1.92×107CFU/mL)、摇床转速(0、50 r/min、100 r/min、150 r/min和200 r/min)为变量,考察各因素对金银花蒸馏残液中绿原酸含量的影响。
1.3.4 正交试验
选取发酵时间(A)、接种量(B)、发酵温度(C)和转速(D)四个单因素,设计如表1所示的L9(34)正交试验,优化发酵转化金银花蒸馏剩余物中绿原酸的工艺。
表1 生物转化条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for biotrans formation conditions optimization
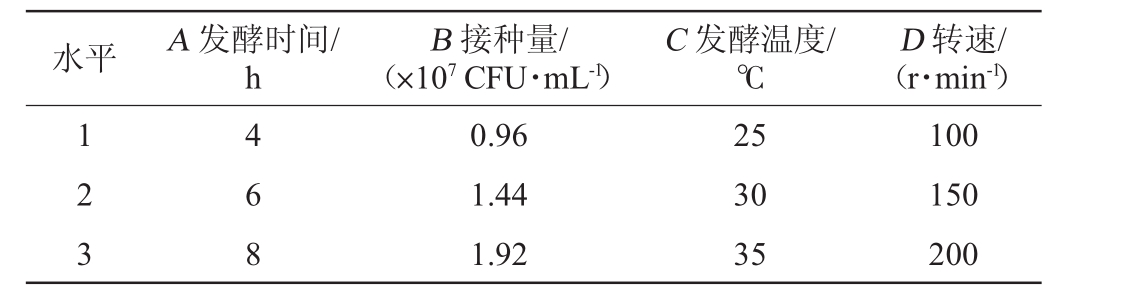
水平 A发酵时间/h B接种量/(×107CFU·mL-1)C发酵温度/℃D转速/(r·min-1)1 2 3 4 6 8 0.96 1.44 1.92 25 30 35 100 150 200
1.3.5 数据分析
利用Microsoft Excel 2003和正交设计助手等软件进行试验设计和数据分析。
2 结果与分析
2.1 菌株筛选
两种菌株转化绿原酸结果如表2所示,两种菌株都能增加金银花蒸馏剩余物中绿原酸含量,其中以枯草芽孢杆菌的转化能力最强,绿原酸含量增加135.33 μg/mL,显著高于黑曲霉的转化能力(P<0.05)。因此,转化菌株宜选枯草芽孢杆菌。
表2 两种菌种对绿原酸含量的影响
Table 2 Effect of two strains on chlorogenic acid content

菌种 枯草芽孢杆菌 黑曲霉绿原酸增量/(μg·mL-1)135.33±8.7675.84±6.02
2.2 单因素试验结果
2.2.1 发酵温度对绿原酸增量的影响
发酵温度是影响菌体生长发育、代谢最直接的因素,考察发酵温度对绿原酸增量的影响,结果如图1所示。由图1可知,当发酵温度20℃增加至30℃时,绿原酸增量增加到峰值,其后随着发酵的温度上升,增量显著降低(P<0.05)。可能是温度超过30℃后,不适宜枯草芽孢杆菌的生长和代谢而影响菌株的活性[25],代谢和转化绿原酸的能力随之减弱。因此,发酵温度以30℃为宜。
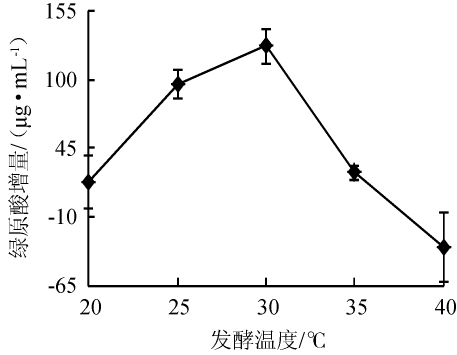
图1 发酵温度对绿原酸增量的影响
Fig.1 Effect of fermentation temperature on chlorogenic acid increment
2.2.2发酵时间对绿原酸增量的影响
考察发酵时间对绿原酸增量的影响,结果如图2所示。由图2可知,发酵4~6 h时,绿原酸的增量升高,延长发酵时间到8 h,绿原酸增量急剧下降。原因可能是随着菌体的生长,营养物质不断的消耗,产生了较多的代谢物质,抑制菌株的生长代谢。因此,发酵时间以6 h为宜。
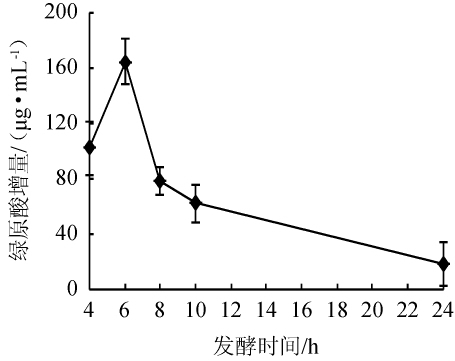
图2 发酵时间对绿原酸增量的影响
Fig.2 Effect of fermentation time on chlorogenic acid increment
2.2.3接种量对绿原酸增量的影响
考察接种量对绿原酸增量的影响,结果如图3所示。由图3可知,随着接种量的减小,金银花蒸馏剩余物中的绿原酸增量呈先增加后减少的趋势,在1.44×107CFU/mL时达到最大值,为(79.70±4.77)μg/mL,可能是由于接种量减少后,枯草芽孢杆菌菌液少,不能及时转化绿原酸,反而被抑制而使绿原酸含量负增长。故以接种量以1.44×107CFU/mL为宜。
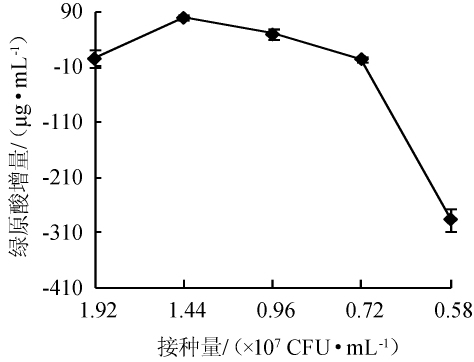
图3 接种量对绿原酸增量的影响
Fig.3 Effect of inoculum on chlorogenic acid increment
2.3.4转速对绿原酸增量的影响
枯草芽孢杆菌发酵受溶氧水平影响,考察转速对绿原酸增量的影响,结果如图4所示。由图4可知,随着转速的加快,金银花蒸馏剩余物中的绿原酸增量不断增大,直到转速为150r/min时,增量增加到峰值。之后,随着转速的增加,绿原酸增量下降趋势明显。这是由于转速加快,增大了溶氧量,使菌株的代谢能力增强,绿原酸增量随之增加。超过150 r/min后,溶氧量虽然增大了,但是发酵液中的剪切力也与之增大,对菌株可能有损伤,影响生长代谢。故选择转速150 r/min为宜。
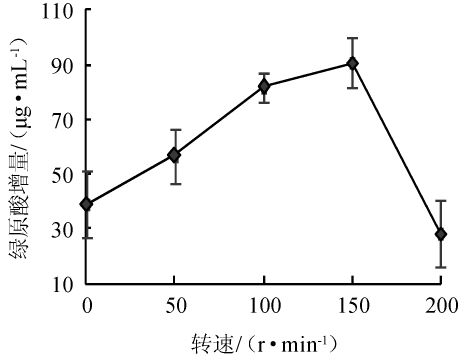
图4 转速对绿原酸增量的影响
Fig.4 Effect of rotating speed on chlorogenic acid increment
2.4 正交优化试验结果
以发酵时间(A)、接种量(B)、发酵温度(C)和转速(D)四个因素设计的L9(34)正交优化试验结果和方差分析分别如表3和表4所示。
表3 生物转化条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiments for biotrans formation conditions optimization
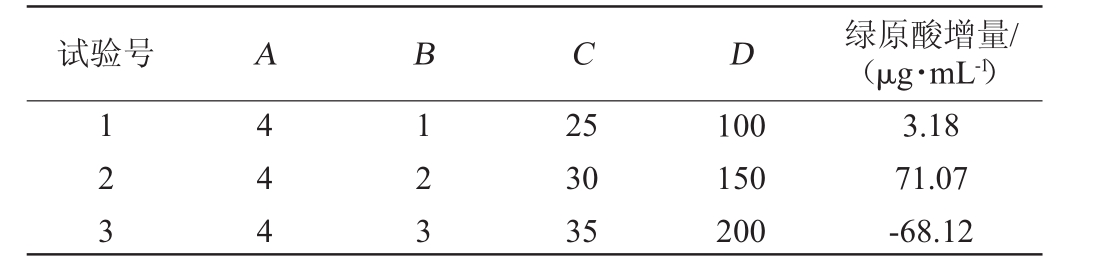
试验号 A B C D 绿原酸增量/(μg·mL-1)123 444 123 25 30 35 100 150 200 3.18 71.07-68.12
续表
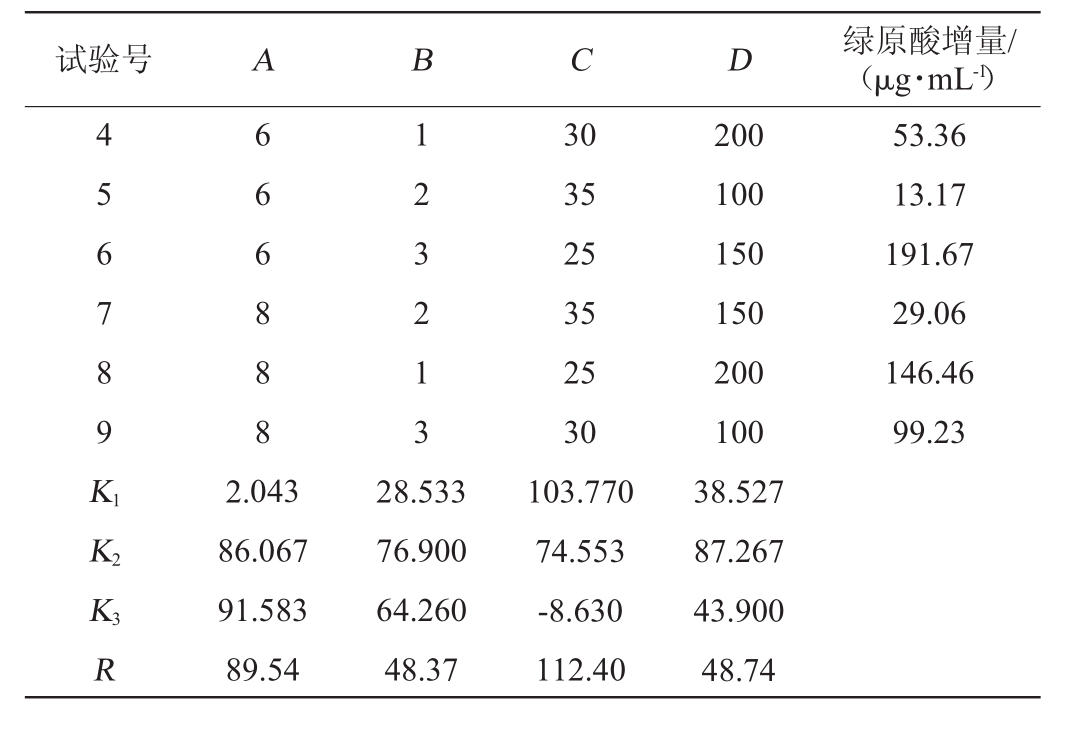
试验号 A B C D 绿原酸增量/(μg·mL-1)4 5 6 7 8 9 K1K2K3R 6 6 6 8 8 8 1 2 3 2 1 3 53.36 13.17 191.67 29.06 146.46 99.23 2.043 86.067 91.583 89.54 28.533 76.900 64.260 48.37 30 35 25 35 25 30 103.770 74.553-8.630 112.40 200 100 150 150 200 100 38.527 87.267 43.900 48.74
表4 正交试验结果方差分析Table 4 Variance analysis of orthogonal experiments results
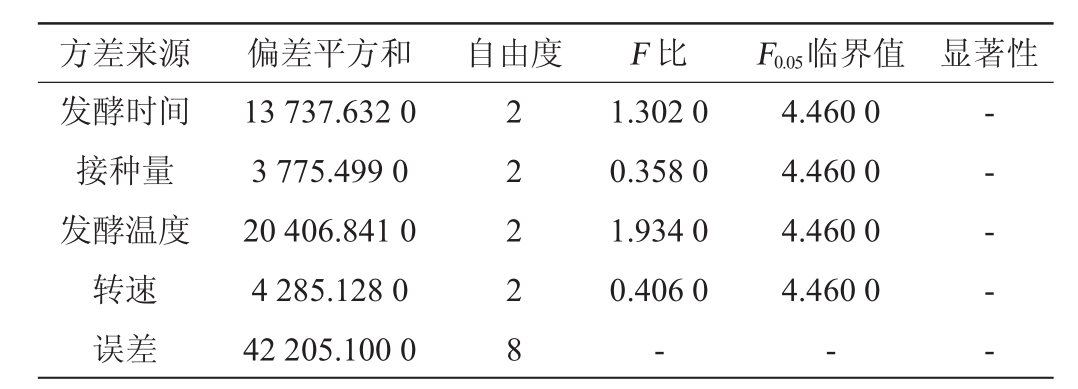
注:“-”表示对结果影响不显著(P>0.05)。
方差来源 偏差平方和 自由度 F比 F0.05临界值 显著性发酵时间接种量发酵温度转速误差13 737.632 0 3 775.499 0 20 406.841 0 4 285.128 0 42 205.100 0 2 2 2 2 8 1.302 0 0.358 0 1.934 0 0.406 0-4.460 0 4.460 0 4.460 0 4.460 0-- - - - -
根据表3~表4的正交优化试验结果,4个因素对枯草芽孢杆菌转化金银花蒸馏残液中绿原酸的影响程度为C>A>D>B,即影响最大的因素为发酵温度,其次为发酵时间,摇床转速和接种量则影响相对较小;由表3可知,发酵转化的优化工艺为A3B2C1D2,即发酵温度25℃,发酵时间8 h,转速150 r/min,接种量1.44×107CFU/mL。
2.5 验证试验
根据优化工艺条件,平行试验3次,绿原酸增量为(193.03±47.60)μg/mL,高于表3中绿原酸最高增量(191.67±39.25)μg/mL,表明正交试验所确定的优化条件可作为枯草芽孢杆菌转化金银花蒸馏剩余物中绿原酸的最佳工艺。
3 结论
以实验室的枯草芽孢杆菌作为优势菌株,可用于转化提高地方企业金银花露加工蒸馏剩余物中的绿原酸含量,其最佳发酵工艺为发酵温度25℃,发酵时间8 h,转速150 r/min,接种量1.44×107CFU/mL。此时,金银花蒸馏剩余物中枯草芽孢杆菌转化绿原酸增量可达(193.03±47.60)μg/mL。该方法可用于工业化生产,从而为地方金银花露加工企业提供了一种简单有效的蒸馏剩余物资源化利用工艺。
[1]刘豪,张冬青,刘硕,等.金银花不同提取物抗氧化活性的研究[J].食品研究与开发,2016(1):48-52.
[2]杨晓杰.金银花的成分及药理作用分析[J].世界最新医学信息文摘,2015,37(24):176-177.
[3]胡艳生,胡兰捷.湖北省罗田县金银花产业发展的SWOT分析[J].安徽农业科学,2012,40(36):17815-17817.
[4]向福,郭文韬,袁婷,等.罗田县两种金银花中绿原酸含量比较[J].黄冈师范学院学报,2013(3):36-37.
[5]张宇.酶催化浸提金银花叶中绿原酸及其转化利用[D].重庆:重庆工商大学,2006.
[6]凌秀菊,吴正奇,陈道玉,等.膜技术分离回收金银花蒸馏残渣中绿原酸的流程分析[J].湖北农业科学,2007,46(4):628-631.
[7]章运典,陈玉海.金银花中绿原酸提取工艺研究[J].中成药,2013,35(7):1564-1566.
[8]席利莎,木泰华,孙红男.绿原酸类物质的国内外研究进展[J].核农学报,2014,28(2):292-301.
[9]王旭瑞,常亮.浅谈蒙医药用植物成分绿原酸抗氧化作用[J].中国民族医药杂志,2016,22(10):44-45.
[10]杨晓丽,张君利,王京峰,等.绿原酸抗肿瘤作用及机制研究进展[J].中国实验方剂学杂志,2018(19):229-234.
[11]王玲娜,姚佳欢,马超美.绿原酸的研究进展[J].食品与生物技术学报,2017,36(11):1121-1130.
[12]张浩超,郝宝燕,孙皓熠,等.绿原酸研究进展[J].食品与药品,2017,19(3):222-227.
[13]景阳林.微生物在中药研究中的重要作用[J].魅力中国,2017(9):237.
[14]严春艳,于荣敏.植物生物转化技术与中药活性化合物研究[J].食品与药品,2005,7(10):4-8.
[15]SHIMODA K,KUBOTA N,TANIUCHI K,et al.Biotrans formation of naringin and naringenin by cultured Eucalyptus perriniana cells[J].Phytochemistry,2010,71(2-3):201-205.
[16]刘颖,魏希颖.内生菌对植物次生代谢产物的转化[J].天然产物研究与开发,2014,26(2):300-303.
[17]李洋,邱智东,王伟楠.中药生物转化技术研究进展[J].中国酿造,2015,34(7):15-19.
[18]马逢时,刘家水,谈永进.微生物转化技术在中药资源开发中的应用研究[J].亚太传统医药,2019(8):174-177.
[19]张志龙,郜玉钢,臧埔,等.真菌转化中药活性成分研究进展[J].中草药,2019,50(11):2736-2742.
[20]丁仁芳,冯甦,谢晨文,等.枯草芽孢杆菌利用红薯叶发酵产绿原酸的新方法[J].中国农业科技导报,2016,18(4):181-189.
[21]CHEN X,SANG X,LI S,et al.Studies on a chlorogenic acid-producing endophytic fungi isolated from Eucommia ulmoides oliver[J].J Ind Microb Biot,2010,37(5):447-454.
[22]王川,李丽,魏丕伟,等.产绿原酸内生菌的分离及其绿原酸合成途径关键基因的克隆和功能研究[J].微生物学通报,2015,42(10):1888-1894.
[23]徐艳阳,于静,繆彬彬,等.玉米中霉菌的分离纯化及鉴定[J].食品研究与开发,2015,36(16):137-141.
[24]宋晓平,任智慧,张德刚,等.金银花和忍冬藤中绿原酸含量测定及分离纯化[C].南宁:中国畜牧兽医学会中兽医分会学术年会,2005:197-200.
[25]刘晓敏,班睿,朱勇,等.温度对枯草芽孢杆菌基因工程菌核黄素发酵的影响[C].北京:全国生物化工学术会议,2000:137-139.