浓香型白酒产销量在各香型中位居首位,其产量和质量深度影响着我国白酒产业的发展[1]。浓香型白酒以泥窖池为发酵容器,窖泥的质量直接影响白酒品质的优劣[2-4]。窖泥中的微生物种类丰富,是酿制浓香型白酒的基础[5]。酯化型微生物是窖泥中一类重要的功能菌[6]。在发酵过程中,酯化菌代谢产生的酯化酶使乙醇与己酸、乙酸、乳酸等有机酸缩合,生成己酸乙酯、乙酸乙酯、乳酸乙酯等酯类,构成浓香型白酒的主体香成分[7]。
在窖泥中,可以产生酯化酶的微生物种类繁多,有酵母菌、霉菌、细菌等[8]。由于窖泥中高醇、高酸、微氧的极端条件,导致其中真菌含量较少[9]。因此,窖泥中的酯化型微生物以细菌为主[10-11]。目前,关于窖泥中酯类物质的研究以香气物质及其前体物的产生菌为主,关于窖泥中酯化型细菌的研究与应用有一些报道[12-15]。本研究基于酯化菌在白酒香气成分中的突出作用,立足于赊店老酒的优质窖泥,分离筛选出高产酯化酶的细菌,利用分子生物学手段对其进行鉴定,并在单因素试验基础上采用响应面法对其发酵产酶条件进行优化。拟将所得到的高酯化力细菌制备成酯化菌液,投入窖池,为生产优质浓香型白酒奠定理论及实践基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
窖泥:赊店老酒股份有限公司。
1.1.2 化学试剂
三丁酸甘油酯(分析纯):上海麦克林生化科技有限公司;环己烷(分析纯):天津市永大化学试剂有限公司;正己酸(分析纯):天津市光复精细化工研究所;无水乙醇、葡萄糖(均为分析纯):天津市科密欧化学试剂有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司;2×EsTaq Master Mix:北京康为世纪生物有限公司;DL2000 Marker:北京博迈德生物技术公司;可溶性淀粉(生化试剂):天津市恒兴化学试剂制造有限公司;高粱粉(食品级)、玉米面(食品级):河南省新乡市原阳县农家自产;红糖(食品级):北京德众嘉鑫经贸有限公司;牛肉膏、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;琼脂粉(生化试剂):北京索莱宝科技有限公司。
1.1.3 培养基
液体培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,121℃灭菌30 min。
初筛培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂粉20 g/L,加入三丁酸甘油酯1%,121℃灭菌30 min。
发酵培养基:牛肉膏20.0 g/L,葡葡糖20.0 g/L,K2HPO4 1.0g/L,(NH)42SO41.0g/L,MgSO·47H2O1.0g/L,NaCl0.5g/L,FeSO·47H2O 0.01 g/L,调pH至7.0,121℃灭菌30 min。
1.2 仪器与设备
H1850R离心机:湖南湘仪实验仪器开发有限公司;ZQLY-300S恒温培养摇床:上海精宏试验设备有限公司;JA1003分析天平:上海舜宇恒平科学仪器有限公司;DNP-9272BS电热恒温培养箱:上海新苗医疗器械制造有限公司;DYY-2C电泳仪:北京六一生物科技有限公司;D-37085聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Senso Quest有限责任公司。
1.3 方法
1.3.1 菌种分离纯化
称取5 g窖泥于45 mL无菌水中,充分振荡,取上清液用无菌水逐级稀释,得到10-2~10-3稀释度的菌悬液。吸取上述菌悬液各100 μL,分别涂布于初筛培养基上,每个稀释度做两个平行。将涂布均匀的平板置于30℃恒温培养箱中,培养24~48 h,观察在菌落周围出现的透明圈,将产圈菌落于平板初筛培养基上划线分离至纯种。
1.3.2 菌种初筛
将分离出的菌株点植于初筛培养基中,每个菌株做三个平行,于30℃恒温培养箱中培养24 h。观察菌落周围出现的透明圈,记录透明圈直径(D)与菌落直径(d)之比,选取D/d值较大者进行复筛。
1.3.3 菌种复筛
将初筛后的菌株接种于5 mL/25 mL液体培养基中,30℃、150 r/min摇床培养19 h,取1 mL转接于50 mL/250 mL液体培养基中,同样条件下再次培养19 h,以5%的接种量将种子液接入发酵培养基中,30℃、150 r/min培养48 h。发酵液经10000r/min离心10min,取上清液于4℃保存,备用。
1.3.4 酯化酶活力的测定[12-13]
测定方法:于10 mL环己烷体系中加入正己酸和无水乙醇,己酸量为6.25 mL,无水乙醇与己酸体积比为1.0∶1.8(上述试剂每500 mL加入无水硫酸钠30 g),并向其中加入0.2 mL酶液,于37℃条件下保温酯化24 h。吸取上清0.5 mL于100mL三角瓶中,加入5mL蒸馏水,2滴酚酞,用0.05mol/L NaOH溶液滴定至终点,记录消耗NaOH溶液体积。
酯化酶酶活力定义:在37℃条件下,每分钟消耗1μmol己酸需要的酯化酶量为1个酶活力单位(U/mL)。
1.3.5 菌种鉴定
(1)形态学鉴定
将产酶活力较高的菌株于固体培养基中划线培养24h,观察菌落的大小、颜色、表面形态、质地、边缘形状和高度等并做记录,菌株经革兰氏染色观察细胞形态,经孔雀绿染液染色观察芽孢形态[16]。
(2)分子生物学鉴定
采用试剂盒法,提取菌株S2D27的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),用细菌的通用引物(27F和1492R)对提取的DNA进行PCR扩增,扩增产物送由上海生物工程有限公司进行测序。根据测序结果,选择准确度较高的基因序列,从GenBank数据库中搜索有关种的公认16SrDNA标准序列数据进行比对,并使用MEGA6.0构建系统发育树[17]。
1.3.6 菌株培养基优化
最适碳源及其最适碳源添加量的确定:分别以2%的葡萄糖、可溶性淀粉、高粱粉、红糖、玉米面替代发酵培养基中的碳源,其他成分不变。按5%的接种量,接入摇床培养19h的菌液,于30℃、150 r/min摇床培养48 h,测定酯化酶活力,优选出最佳碳源。再分别调节最适碳源添加量为1.0%、1.5%、2.0%、2.5%和3.0%,同时测定酯化酶活力,以确定其最适碳源添加量。
最适氮源及其最适氮源添加量的确定:分别以2%的蛋白胨、牛肉膏、酵母浸粉、豆粕、硝酸铵替代发酵培养基中的氮源,其他成分不变。接入5%的菌液,于30℃、150 r/min摇床培养48 h,测定酯化酶活力,优选出最佳氮源。调节最佳氮源的添加量为1.0%、1.5%、2.0%、2.5%和3.0%,测定酯化酶活力以确定其最适氮源添加量[18]。
1.3.7 菌株发酵条件优化单因素试验
考察初始pH值(4、5、6、7、8)、接种量(3%、5%、7%、9%、11%)及培养时间(2d、3d、4d、5d、6d)对酯化酶活力的影响。
1.3.8 菌株发酵条件优化响应面分析试验[20]
使用Design-Expert软件,在单因素试验的基础上,选取豆粕添加量(A)、培养基初始pH值(B)、培养时间(C)3个对产酶影响较大的因素为自变量,以酯化酶活力(Y)为响应值,进行响应面试验,其试验因素与水平见表1。
表1 产酶条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for enzyme producing conditions optimization
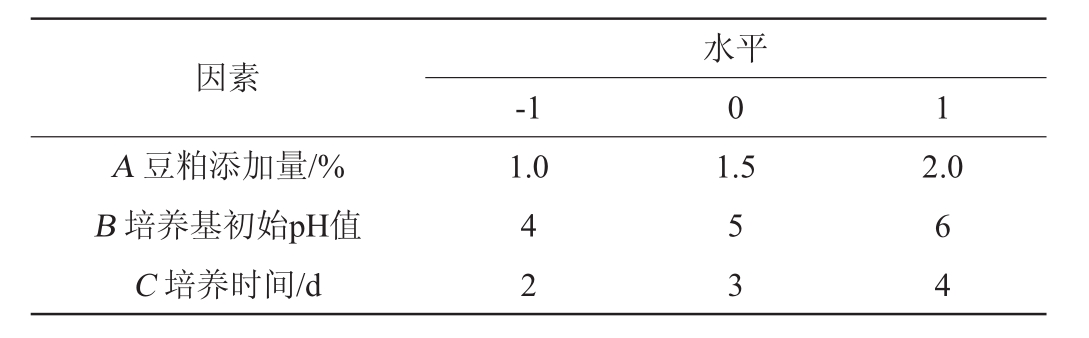
因素A豆粕添加量/%B培养基初始pH值C培养时间/d-1水平0 1 1.01.52.0 4 2 5 3 6 4
2 结果与分析
2.1 菌株筛选结果
2.1.1 菌株初筛
通过透明圈法对窖泥样品进行初筛,得到10株透明圈较大的菌株,结果见表2。由表2可知,菌株S2D27的D/d值最大,为3.66;其他菌株的D/d值在2.14~3.66。
表2 菌株透明圈直径与菌落直径比值
Table 2 Transparent circle diameter and colony diameter ratio of strains
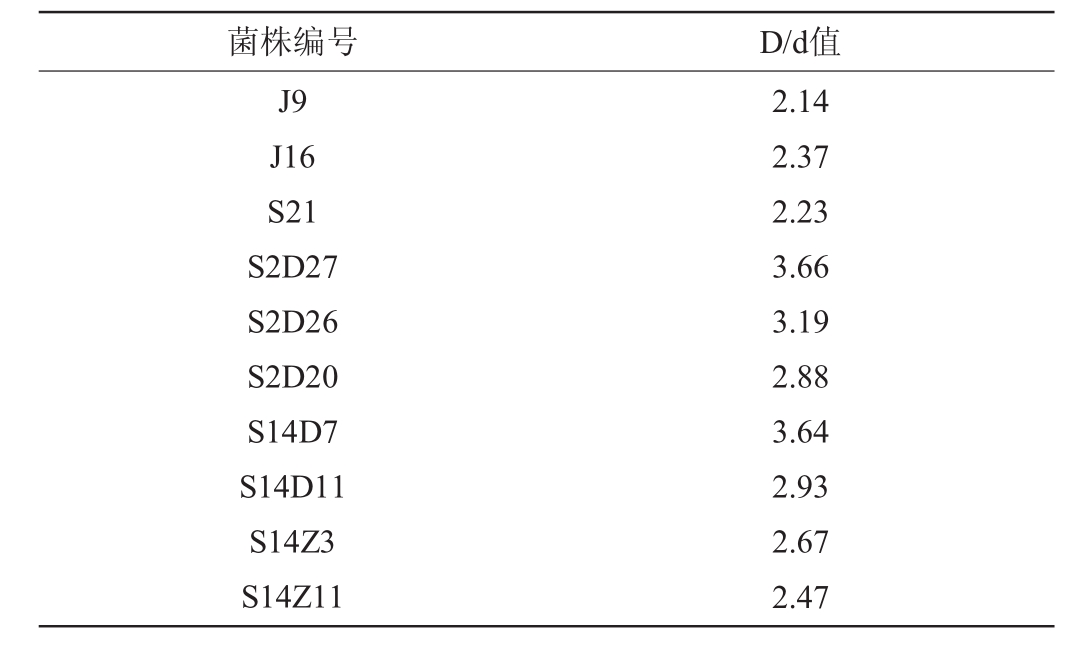
菌株编号 D/d值J9 J16 S21 S2D27 S2D26 S2D20 S14D7 S14D11 S14Z3 S14Z11 2.14 2.37 2.23 3.66 3.19 2.88 3.64 2.93 2.67 2.47
2.1.2菌株复筛
选取初筛D/d值在2.50以上的菌株进行复筛,5株菌酯化酶活力大小测定结果见表3。由表3可知,菌株S2D27产酯化酶活力最高,可达10.43 U/mL,其他菌株产酯化酶活力在7.08~9.63 U/mL。因此,选择菌株S2D27作为出发菌株,对其进行形态观察、分子生物学鉴定及最适发酵条件的优化。
表3 菌株酯化酶活力测定结果
Table 3 Determination results of esterase activity of strain
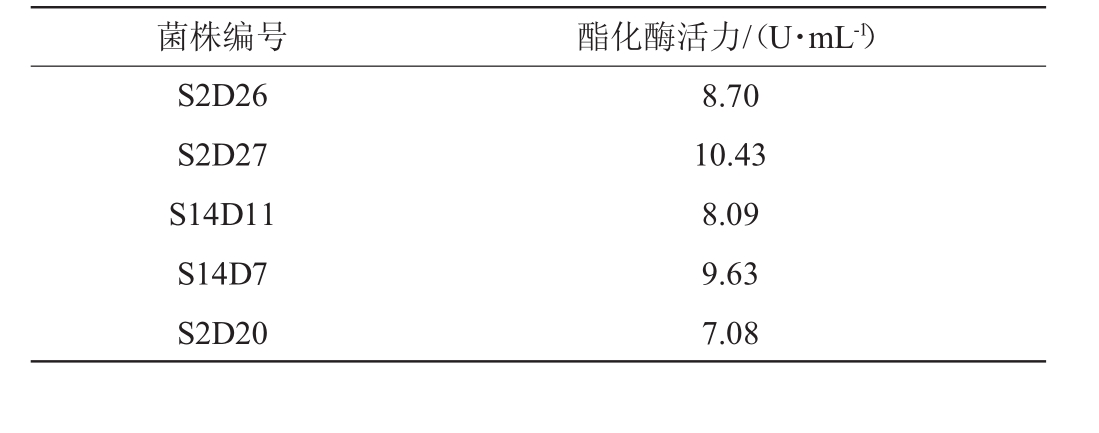
菌株编号酯化酶活力/(U·mL-1)S2D26 S2D27 S14D11 S14D7 S2D20 8.70 10.43 8.09 9.63 7.08
2.2 菌株鉴定结果
2.2.1 形态学鉴定
菌株S2D27经初筛培养基培养24 h后,其菌落、细胞及芽孢形态见图1。由图1A可知,菌株S2D27产透明圈,菌落较小,表面皱褶,低凸起,菌落规则,无光泽,质地黏稠不易挑取,菌落周围与边缘颜色不一致,不透明。由图1B可知,经革兰氏染色后,菌株形态呈短杆状,颜色呈紫红色,为革兰氏阳性菌。由图1C可知,经孔雀绿染液染色后,菌株S2D27产芽孢,芽孢形态为椭圆形。

图1 菌株S2D27的菌落(A)、细胞(B)及芽孢(C)形态
Fig.1 Colony(A),cell(B)and spore(C)morphology of strain S2D27
2.2.2 分子生物学鉴定
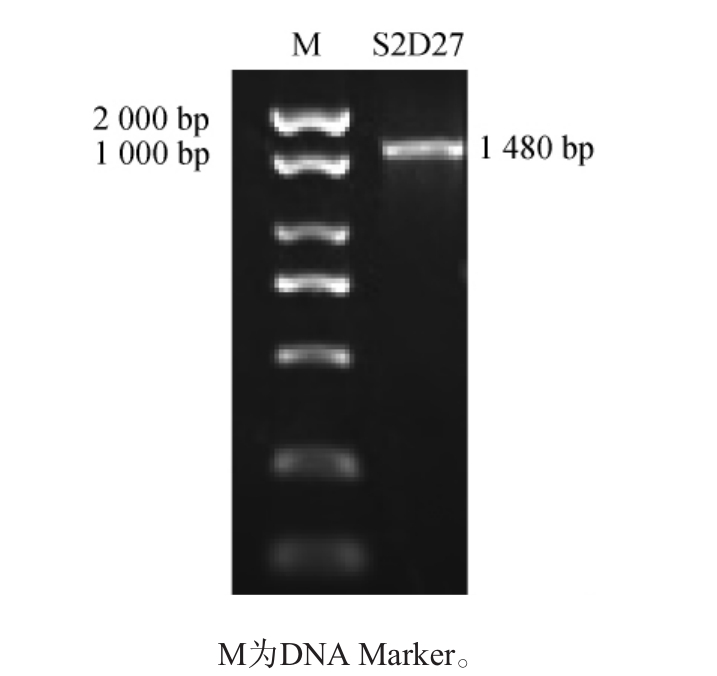
图2 菌株S2D27的16S rDNA PCR扩增产物电泳图
Fig.2 Electrophoresis of 16S rDNA PCR amplification products of strain S2D27
菌株S2D27的PCR扩增产物电泳分析结果见图2。由图2可知,菌株S2D27的16S rDNA序列碱基长度为1 480 bp左右,与预期结果相符。扩增产物送由生工生物工程(上海)股份有限公司进行测序,将测序结果于美国国家生物技术信息中心(national center of biotechnology information,NCBI)上使用基本局部比对搜索工具(basic local alignment search tool,BLAST)分析比对,发现菌株S2D27与贝莱斯芽孢杆菌(Bacillus berezoensis)同源性较高,达到99%。选取9株与菌株S2D27同源性较高的16SrDNA标准序列数据构建系统发育树,结果见图3。由图3可知,菌株S2D27与Bacillus berezoensis(MG234434.1)聚于同一支,因此,鉴定菌株S2D27为贝莱斯芽孢杆菌(Bacillus berezoensis)。

图3 基于16S rDNA序列菌株S2D27的系统发育树
Fig.3 Phylogenetic tree of strain S2D27 based on 16S rDNA sequences
2.3 菌株S2D27发酵培养基优化
2.3.1 最适碳源及最适碳源添加量的确定
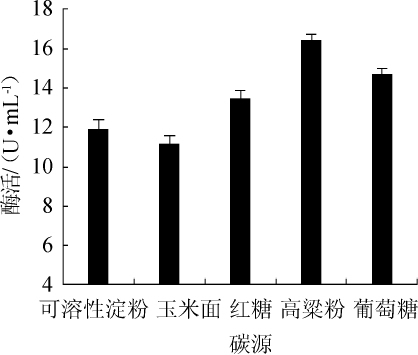
图4 不同碳源对酯化酶酶活的影响
Fig.4 Effect of different carbon sources on esterifying enzyme activity
由图4可知,高粱粉作为碳源时,酯化酶酶活力最高,为16.44 U/mL,同时高粱粉营养丰富,廉价易得,更适合于工业化生产。因此,选择高粱粉作为最适碳源。
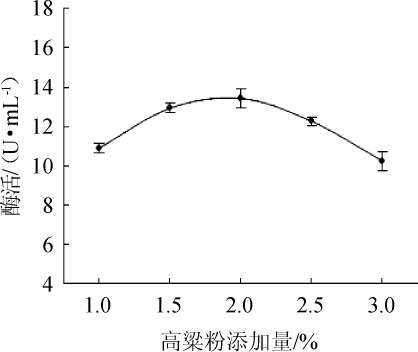
图5 不同高粱粉添加量对酯化酶酶活的影响
Fig.5 Effect of different sorghum flour addition on esterifying enzyme activity
由图5可知,随着高粱粉添加量在1.0%~2.0%范围内的升高,酯化酶酶活有一定程度的提高;当高粱粉添加量为2.0%时,酯化酶酶活最高,为13.43 U/mL;当高粱粉添加量>2.0%之后,酯化酶酶活随之下降。因此,选择最佳高粱粉添加量为2.0%。
2.3.2 最适氮源及最适氮源添加量的确定
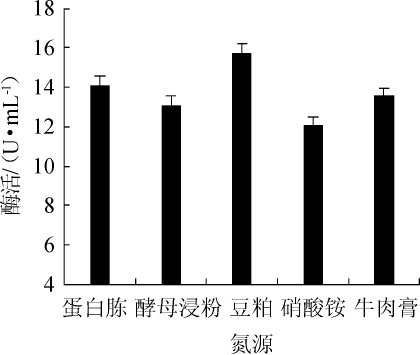
图6 不同氮源对酯化酶酶活的影响
Fig.6 Effect of different nitrogen sources on esterifying enzyme activity
由图6可知,不同氮源种类对酯化酶酶活影响较小,豆粕作为氮源时,酯化酶酶活最高,为15.72 U/mL。因此,选择豆粕作为最适氮源。
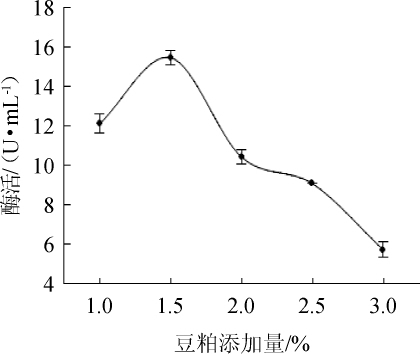
图7 不同豆粕添加量对酯化酶酶活的影响
Fig.7 Effect of different soybean meal addition on esterifying enzyme activity
由图7可知,随着豆粕添加量在1.0%~1.5%范围内的升高,酯化酶酶活随之增加;在豆粕添加量为1.5%时,酯化酶酶活最高,为15.44U/mL;在豆粕添加量>1.5%之后,酯化酶酶活随之下降。因此,选择最适豆粕添加量为1.5%。
2.4 菌株S2D27发酵条件优化
2.4.1 最适初始pH值的确定
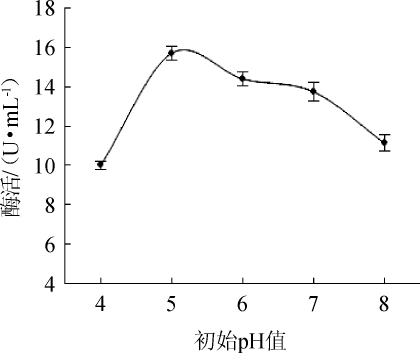
图8 不同初始pH值对酯化酶酶活的影响
Fig.8 Effect of different initial pH on esterifying enzyme activity
由图8可知,酯化酶酶活随培养基初始pH值的升高而升高,当初始pH值为5时,酯化酶酶活达到最大,为15.71U/mL。因此,选择培养基的最适初始pH值为5。
2.4.2 最适接种量的确定
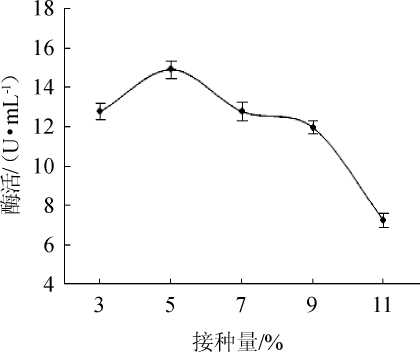
图9 不同接种量对酯化酶酶活的影响
Fig.9 Effect of different inoculum on esterifying enzyme activity
由图9可知,当接种量<5%之前,酯化酶酶活呈上升趋势;当接种量为5%时,酯化酶酶活达到最大,为14.90 U/mL;当接种量>5%之后,酯化酶酶活明显下降。因此,选择最适接种量为5%。
2.4.3 不同培养时间对菌株酶活的影响
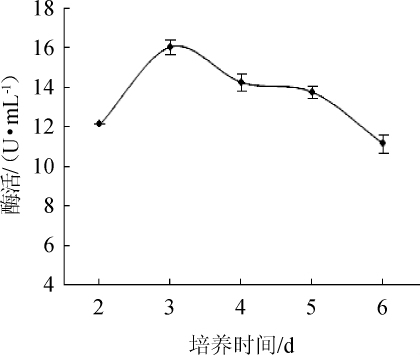
图10 不同培养时间对酯化酶酶活的影响
Fig.10 Effect of different culture time on esterifying enzyme activity
由图10可知,随着培养时间在2~3 d范围内的延长,菌株酶活不断升高;当培养时间为3 d时,酯化酶酶活最高,为16.04 U/mL;当培养时间>3 d之后,酯化酶酶活随之下降。因此,选择最佳培养时间为3 d。
2.5 发酵条件优化响应面试验
2.5.1 回归模型建立及方差分析
在单因素试验的基础上,选取豆粕添加量(A)、培养基初始pH值(B)、培养时间(C)三个对产酶影响较大的因素为自变量,以酯化酶酶活力(Y)为响应值,进行响应面试验。试验设计及结果见表4。
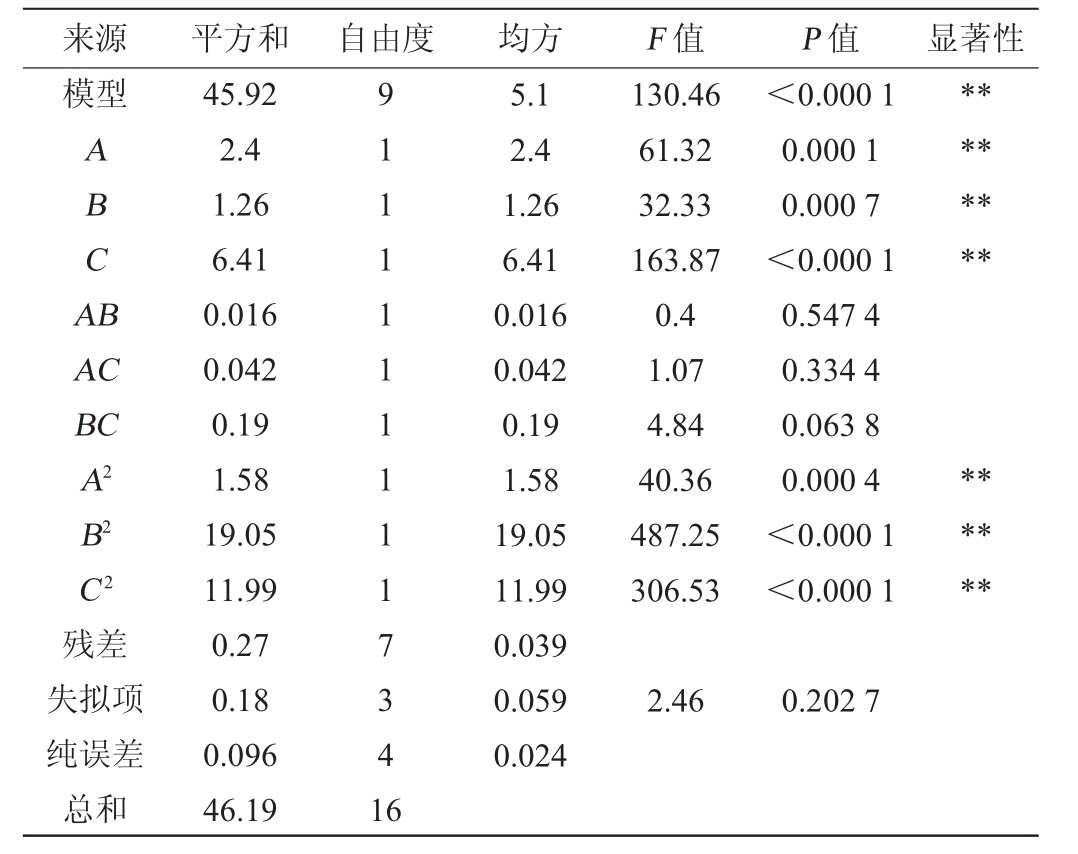
通过响应面分析软件Design-Expert8.0.6对表4中的数据进行分析,得到数学模型,并对数学模型进行方差分析,得到模型和回归系数的显著性,结果见表5。对因素进行二次回归拟合分析,建立显著因素的拟合方程如下:
Y=17.14-0.55A-0.4B+0.90C-0.063AB+0.10AC+0.22BC-0.61A2-2.13B2-1.69C2
表4 产酶条件优化响应面试验设计及结果
Table 4 Design and results of response surface tests for enzyme producing conditions optimization
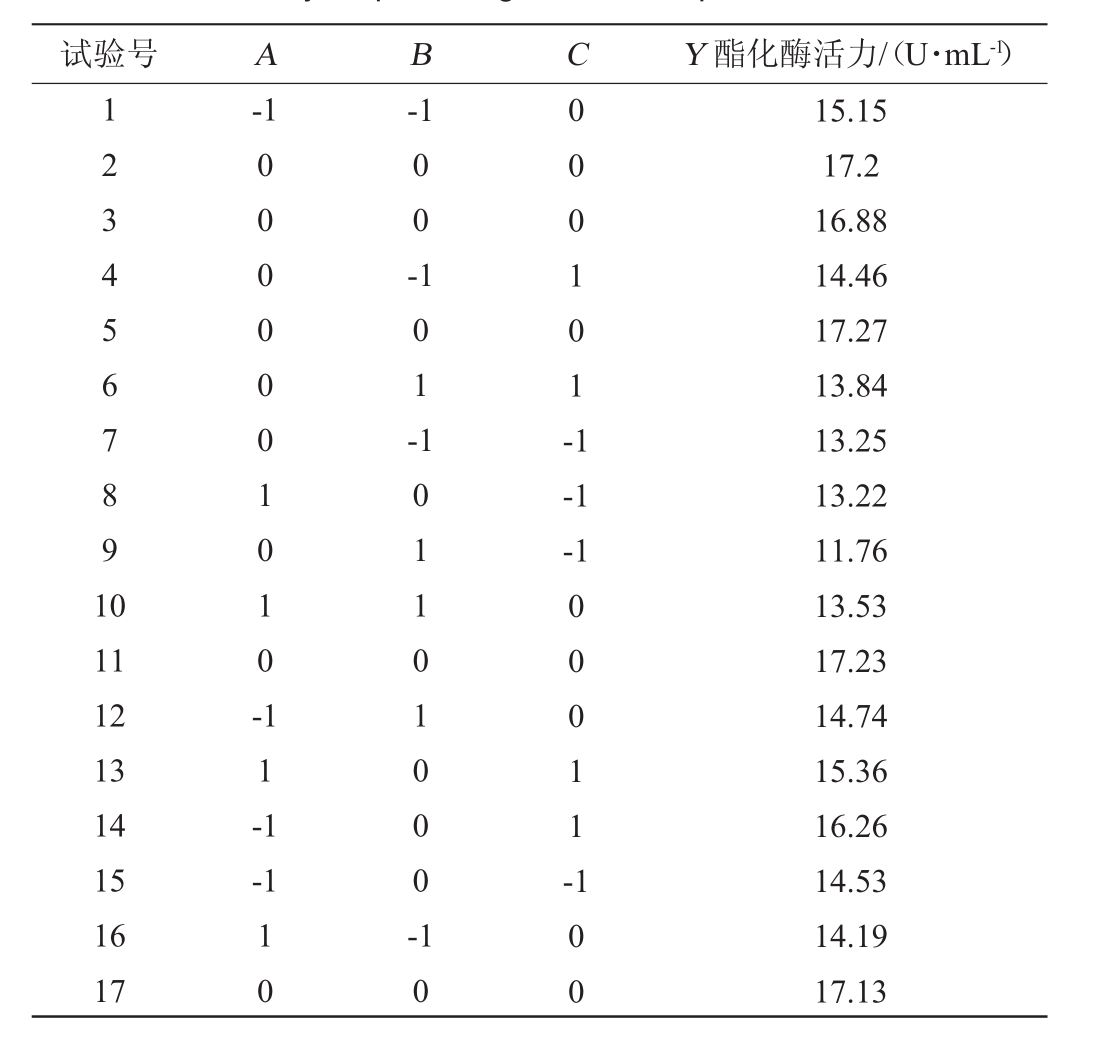
试验号ABCY酯化酶活力/(U·mL-1)1234567891 0-1-1 00-101-000101-1-1-1 11 12 13 14 15 16 17 0000001010-11-1-1 00011-10 101101000-10 100 15.15 17.2 16.88 14.46 17.27 13.84 13.25 13.22 11.76 13.53 17.23 14.74 15.36 16.26 14.53 14.19 17.13
表5 回归模型方差分析Table 5 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
来源 平方和 自由度 均方 F值 P值 显著性模型ABCA B********AC BC A2 B2 C2残差失拟项纯误差总和45.92 2.4 1.26 6.41 0.016 0.042 0.19 1.58 19.05 11.99 0.27 0.18 0.096 46.19 91111111117341 6 5.1 2.4 1.26 6.41 0.016 0.042 0.19 1.58 19.05 11.99 0.039 0.059 0.024 130.46 61.32 32.33 163.87 0.4 1.07 4.84 40.36 487.25 306.53<0.000 1 0.000 1 0.000 7<0.000 1 0.547 4 0.334 4 0.063 8 0.000 4<0.000 1<0.000 1******2.460.202 7
由表5可知,模型的P值<0.000 1,说明该模型显著,失拟项P值=0.202 7>0.05,不显著,说明本试验所得二次回归方程拟合程度良好,能够很好地对响应值进行预测。决定系数R2为0.994 1,调整决定系数R2adj为0.986 5,表明模型拟合程度良好,可以用来预测该菌株的酯化酶活力。由F值可以看出,3个因素对酯化酶活力影响的大小顺序为:培养时间(C)>豆粕添加量(A)>培养基初始pH值(B)。
2.5.2 响应曲面分析
响应面模型直观反映了各因素对酯化酶活力的交互影响,结果见图11。
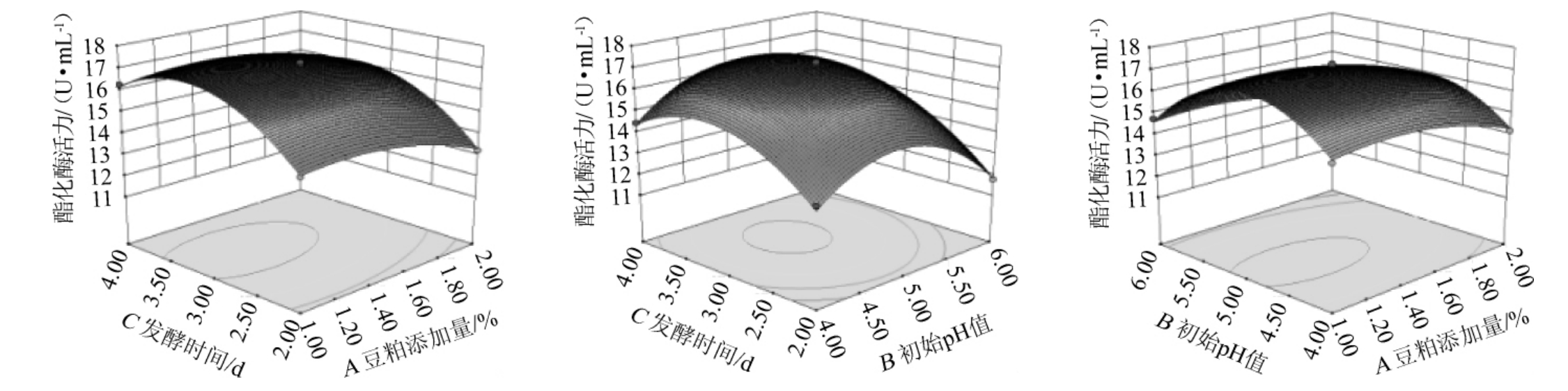
图11 豆粕添加量、培养基初始pH值及培养时间对酯化酶酶活影响的响应面及等高线
Fig.11 Response surface plots and contour lines of effects of interaction between soybean meal addition,initial pH of medium and culture time on esterifying enzyme activity
由图11可知,响应面越陡说明相关因素间交互作用越强。各因素大小从四周逐渐趋向中心点时,曲面呈凸起趋势,说明存在最大响应值。运用Design-Expert8.0软件对其结果进行分析,预测最佳发酵条件为豆粕添加量1.29%、培养基初始pH值4.93、培养时间3.25 d,酯化酶活力理论值为17.38 U/mL。
2.5.3 验证试验
考虑到实际操作的方便性,调整豆粕添加量为1.3%,培养时间为3 d和培养基初始pH值为5,进行3次平行验证试验,酯化酶活力为17.25 U/mL,与预测值17.38 U/mL基本吻合,说明该模型可靠性强。
3 结论
通过透明圈法从窖泥样品中筛选得到一株酯化酶活力较高的菌株S2D27,经分子生物学鉴定为贝莱斯芽孢杆菌(Bacillus berezoensis)。以此菌株为出发菌株,对其最适发酵条件进行了研究,在单因素试验的基础上,以豆粕添加量、培养基初始pH值及培养时间为自变量,以酯化酶活力为响应值,进行响应面试验。结果表明,在豆粕添加量为1.3%、初始pH值为5,培养时间3 d条件下,菌株酯化酶活力可达17.25 U/mL,是优化前的1.65倍。
[1]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[2]彭兵,祝熙,李忠奎,等.窖泥高产己酸菌分离鉴定及培养条件优化的研究[J].中国酿造,2016,35(5):43-46.
[3]张家庆.浓香型白酒窖泥养护与制曲关键技术研究[D].武汉:湖北工业大学,2015.
[4]杜礼泉.窖泥及窖泥功能菌液微生物群落的研究进展与发展趋势[J].中国酿造,2018,37(10):1-4.
[5]岳元媛,张文学,刘霞,等.浓香型白酒窖泥中兼性厌氧细菌的分离鉴定[J].微生物学通报,2007,34(2):251-255.
[6]管健,廖蓓,李兆飞,等.白酒功能菌的功能特性及应用研究[J].中国酿造,2017,36(8):1-5.
[7]申孟林,张超,王玉霞,等.白酒大曲微生物酶系研究进展[J].中国酿造,2018,37(4):7-11.
[8]胡娜,吴鑫颖,李付丽,等.紫色红曲霉FBKL3.0018产酯化酶的酶学性质研究[J].中国酿造,2017,36(5):123-127.
[9]王钎.白酒窖泥产香细菌新种的鉴定及分离菌株的碳源代谢研究[D].济南:山东大学,2016.
[10]倪斌,任道群,唐玉明,等.浓香型酒人工窖泥酿造过程中微生物变化研究[J].中国酿造,2012,31(6):157-160.
[11]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[12]黄丹,方春玉,储玉龙,等.一株酯化酶细菌的分离鉴定及代谢产物特征[J].四川理工学院学报(自然科学版),2010,23(3):321-323.
[13]黄丹,张强,严芳,等.浓香型大曲中酯化酶细菌的分离鉴定及产酶条件研究[J].中国酿造,2009,28(8):57-59.
[14]韩丽,李磊,曾毅,等.一株产酯酶窖泥细菌的筛选、鉴定及酶学性质研究[J].中国酿造,2019,38(6):57-59:43-48.
[15]韦德琴,张晓兰,宋英莉,等.细菌酯酶研究进展[J].微生物学杂志,2018,38(2):110-117.
[16]周晓云.酶学原理与酶工程[M].北京:中国轻工业出版社,2005:1-24.
[17]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-364.
[18]杨胜清.贝莱斯芽孢杆菌S6的鉴定、发酵条件优化及其生防作用研究[D].长春:吉林农业大学,2017.
[19]王攀,隗程峰,蔡凤娇,等.酵母胞外酶的产酯发酵条件优化研究[J].中国酿造,2016,35(9):55-58.
[20]王超,金德强,翟乃明,等.响应面法优化帝国世涛啤酒酿造工艺的研究[J].中国酿造,2018,37(3):120-124.