益生菌是生活在机体内并且有益于宿主健康的一类活的微生物,通常指具有高选择性的乳酸菌,其通过菌体细胞各组分发挥功能作用,如细胞壁、细胞质、菌体肽聚糖和菌体脱氧核糖核酸(deoxyribonucleic acid,DNA)等[1-2],其中最常见的是乳酸杆菌(Lactobacillus)和双歧杆菌(Bifidobacterium)。目前,关于乳酸菌提高人体免疫功能[3]、抗肿瘤及抑菌作用[4-5]的研究已有相关报道。随着对乳酸菌研究的不断深入,各种功能性乳酸菌新品种相继涌现。
目前,功能性乳酸菌的筛选方法主要有3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)。如采用MTT试验筛选具有抑制癌细胞增殖作用的菌株KFRI342细胞质[6];具有抑制人结肠癌细胞系HT-29细胞、Caco-2细胞和SW480细胞增殖作用的青春双歧杆菌(Bifidobacterium adolescentis)SPM0212丁醇提取物[7];具有抑制人早幼粒急性白血病细胞HL-60生长与增殖作用的植物乳杆菌(Lactococcus plantarum)培养上清液[8];具有抑制胃癌细胞和结肠癌细胞增殖作用的热致死菌体细胞、细胞质和菌体肽聚糖[9]。同样,也有研究者采用MTT试验筛选出具有抑制结肠癌细胞系SNUC2A和胃癌细胞SNU-1增殖作用的乳酸乳球菌(Lactococcus lactisssp.lactis)细胞质[10-11],并通过形态学4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色和DNA损伤试验证实其可诱导胃癌细胞SNU-1的凋亡[12]。
课题组前期从中国西部传统发酵食品中分离并筛选出4株具有潜在抗结肠癌功效的乳酸菌X11、X12、M5和K14[13]。本研究以这4株菌为研究对象,分离其细胞壁和细胞质。首先通过MTT法初步筛选具有抑制HT-29细胞增殖能力的成分,再通过研究分离成分对人结肠癌细胞系HT-29细胞的DNA损伤、细胞凋亡及周期的影响,最终获得具有抗结肠癌作用乳酸菌成分,为进一步明确乳酸菌在抑制结肠癌过程中发挥的作用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及细胞
人结肠癌细胞系HT-29:中国医学科学院肿瘤研究所;干酪乳杆菌(Lactobacillus casei)X11、副干酪乳杆菌(Lactobacillus paracasei susbp.paracasei)X12:来源于新疆乳酪;L.caseiK14:来源于西藏酸乳酒;L.paracaseisubsp.paracasei M5:来源于新疆马奶酒。以上乳酸菌保存于哈尔滨工业大学化学工程与技术学院微生物学实验室。鼠李糖乳杆菌(Lactobacillus rhamnosus)GG ATCC 43121(LGG):美国模式菌种收集中心(American type culture collection,ATCC)。
1.1.2 试剂
RPMI 1640培养基、胰酶消化液、二甲基亚砜(dimethyl sulfoxide,DMSO):美国Corning公司;噻唑蓝(MTT):美国Sigma-Aldrich公司;Annexin V-FITC试剂盒、细胞DNA提取试剂盒:美国BD公司;胎牛血清:杭州四季青有限公司;PI染色液:北京Solarbio公司。
1.2 仪器与设备
Universal Hood II凝胶成像系统、Bio-Rad-500酶标仪:美国Bio-Rad公司;FACS Calibur流式细胞仪:美国R&D System公司;HEPA1100二氧化碳培养箱、ULT-1386-3-V超低温冰箱:美国Thermo Electron公司;CX31电子显微镜:日本Olympus公司。
1.3 实验方法
1.3.1 乳酸菌细胞壁及细胞质蛋白质含量的检测
以菌株LGG为阳性对照,参照AMROUCHE T等[3-4]的方法分离4株乳酸菌的细胞壁和细胞质,并采用考马斯亮蓝法测定细胞壁及细胞质中的蛋白质含量[14]。
1.3.2 细胞毒性的检测
首先采用MTT实验测定乳酸菌的细胞壁及细胞质对HT-29细胞的抑制效果,具体方法如下:调整HT-29细胞浓度为1×105个/mL,取100 μL接种于96孔培养板中,待细胞完全贴壁,加入乳酸菌X11、X12、M5和K14细胞壁和细胞质,使各实验组细胞壁和细胞质蛋白质终质量浓度为10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、160 μg/mL[15]。将96孔培养板置于CO2培养箱(37℃,5%CO2,95%空气,100%湿度)中培养48h。当培养44h时,加入10μLMTT,再继续培养4h[16],吸出液体,加入150 μL DMSO[17]。以只加RPMI 1640培养液的细胞为阴性对照,采用酶标仪测定细胞在波长490 nm处的吸光度值(OD490 nm值)。计算乳酸菌细胞壁和细胞质对HT-29细胞抑制率,其计算公式如下:
然后采用改良寇式法[9]计算细胞壁及细胞质对HT-29细胞的半抑制浓度(half maximal inhibitory concentration,IC50),利用IC50值分析乳酸菌细胞壁及细胞质对HT-29细胞的作用大小[18]。
1.3.3 乳酸菌细胞壁及细胞质对HT-29细胞DNA损伤的检测
调整HT-29细胞浓度为5×105个/mL,加入6孔组织培养板中,每孔2 mL。待细胞完全贴壁后加入乳酸菌细胞壁和细胞质,使其蛋白质终含量为80 μg/mL,将6孔组织培养板置于CO2培养箱(37℃,5%CO2,95%空气,100%湿度)中培养48 h。培养结束后,用预冷的磷酸盐缓冲溶液(phosphate buffer saline,PBS)冲洗细胞,加入0.25%的胰酶和乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)混合液2mL,置于CO2培养箱(37℃,5%CO2,95%空气,100%湿度)中消化1~2 min。1 000×g离心5 min,收集细胞,再用预冷PBS溶液清洗细胞2次。采用细胞DNA提取试剂盒提取细胞DNA,采用1.8%琼脂糖凝胶进行电泳检测[19]。
1.3.4 HT-29细胞凋亡及坏死检测
采用Annexin V-FITC/PI细胞凋亡检测试剂盒检测HT-29细胞的凋亡及坏死情况[20-21]。
1.3.5 HT-29细胞周期的测定
采用流式细胞仪进行细胞周期分析[22]。
1.3.6 数据处理及统计分析
实验重复3次,通过SAS 9.1软件进行方差分析,实验结果采用平均值±标准偏差(X±SD)的方式表示,显著性水平设定为P<0.05。
2 结果与分析
2.1 乳酸菌细胞壁和细胞质蛋白质含量的测定
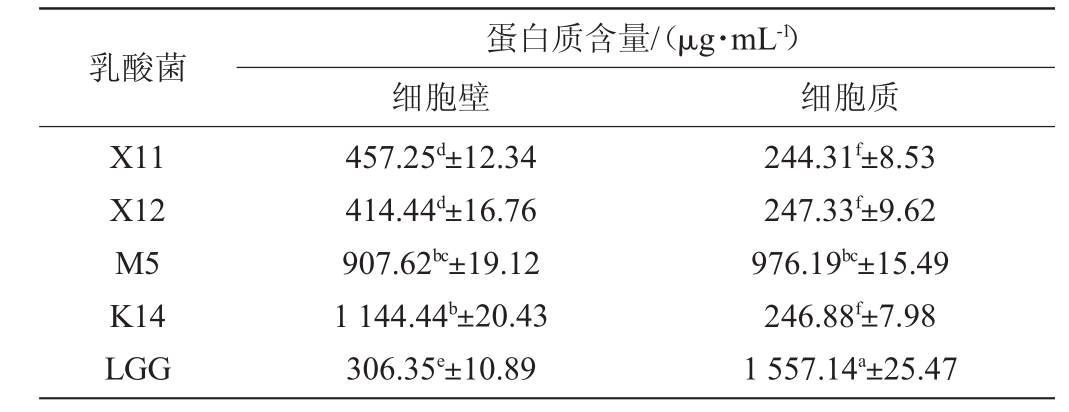
以牛血清蛋白质量浓度(X)为横坐标,OD595 nm值(Y)为纵坐标绘制牛血清蛋白标准曲线,通过线性拟合得到标准曲线回归方程为:Y=0.006 3X,相关系数R2=0.996,说明OD595nm值与牛血清蛋白质量浓度线性关系良好。乳酸菌细胞壁及细胞质蛋白含量的测定结果见表1。
由表1可知,乳酸菌细胞壁及细胞质中的蛋白质含量为244.31~1 557.14 μg/mL,4株乳酸菌细胞壁及细胞质中的蛋白质含量与阳性对照LGG差异显著(P<0.05)。其中,副干酪乳杆菌M5细胞质及细胞壁中的蛋白质含量较高,分别为976.19 μg/mL,907.62 μg/mL;乳酸菌K14细胞壁中的蛋白质含量(1 144.44 μg/mL)仅低于阳性对照组LGG细胞质;而乳酸菌K14、X12、X11细胞质中的蛋白含量均处于较低水平,分别为246.88 μg/mL、247.33 μg/mL、244.3 μg/mL。结果表明,同种菌属不同菌株之间细胞成分中的蛋白质含量不同。在此基础上进行后续抑癌研究。
表1 乳酸菌细胞壁和细胞质蛋白质含量
Table 1 Protein content in the cell wall and cytoplasm of lactic acid bacteria
注:同一列中不同上标字母表示差异显著(P<0.05)。下同。
乳酸菌X11 X12 M5 K14 LGG蛋白质含量/(μg·mL-1)细胞壁 细胞质457.25d±12.34 414.44d±16.76 907.62bc±19.12 1 144.44b±20.43 306.35e±10.89 244.31f±8.53 247.33f±9.62 976.19bc±15.49 246.88f±7.98 1 557.14a±25.47
2.2 乳酸菌细胞壁及细胞质对HT-29细胞的毒性作用
表2 乳酸菌细胞壁和细胞质对HT-29细胞的半抑制浓度值
Table 2 Half maximal inhibitory concentration value of lactic acid bacteria cell wall and cytoplasm on HT-29 cells
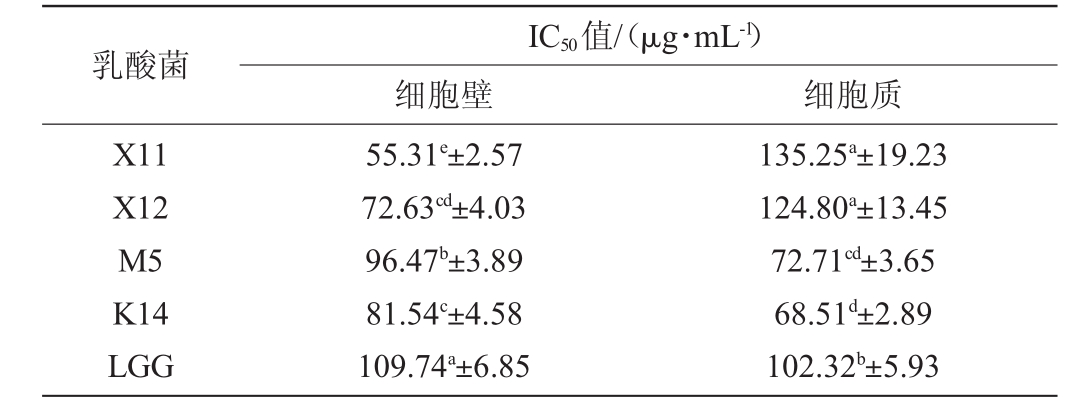
乳酸菌X11 X12 M5 K14 LGG IC50值/(μg·mL-1)细胞壁 细胞质55.31e±2.57 72.63cd±4.03 96.47b±3.89 81.54c±4.58 109.74a±6.85 135.25a±19.23 124.80a±13.45 72.71cd±3.65 68.51d±2.89 102.32b±5.93
由表2可知,乳酸菌M5和K14的细胞壁及细胞质、乳酸菌X12和X11的细胞壁对HT-29细胞的IC50值均显著低于阳性对照组LGG细胞壁(109.74 μg/mL)及细胞质(102.32 μg/mL)(P<0.05),其中,乳酸菌X11细胞壁对HT-29细胞的IC50值(55.31 μg/mL)最低,抑制效果最好。而乳酸菌X12和X11细胞质对HT-29细胞的IC50值显著高于阳性对照组LGG细胞质,分别为135.25 μg/mL、124.80 μg/mL(P<0.05),抑制效果最差。
2.3 乳酸菌细胞壁及细胞质对HT-29细胞DNA的作用
由于含80 μg/mL蛋白质的乳酸菌细胞壁或细胞质持续作用于HT-29细胞48 h后,便可达到抑制HT-29细胞的作用,因此,本实验选用含80 μg/mL蛋白质的细胞壁和细胞质对HT-29细胞进行处理。细胞DNA降解是细胞凋亡的晚期阶段主要特征之一,在细胞凋亡后期,细胞DNA降解成小分子片段[23-24],采用琼脂糖凝胶电泳检测乳酸菌细胞壁及细胞质对HT-29细胞DNA的作用,结果见图1。
由图1可知,乳酸菌细胞壁及细胞质持续作用于HT-29细胞48h后,细胞DNA出现弥散拖尾形态,但没有产生明显的DNA小分子片段。DNA损伤是细胞发生凋亡的一项重要标志[21],有研究显示[22],乳酸菌可通过诱导结肠癌细胞DNA损伤而实现其抗结肠癌功能,如嗜酸乳杆菌(Lactobacillus acidophilus)606可溶性胞外多糖通过诱导HT-29细胞DNA损伤而诱导细胞凋亡[23]。
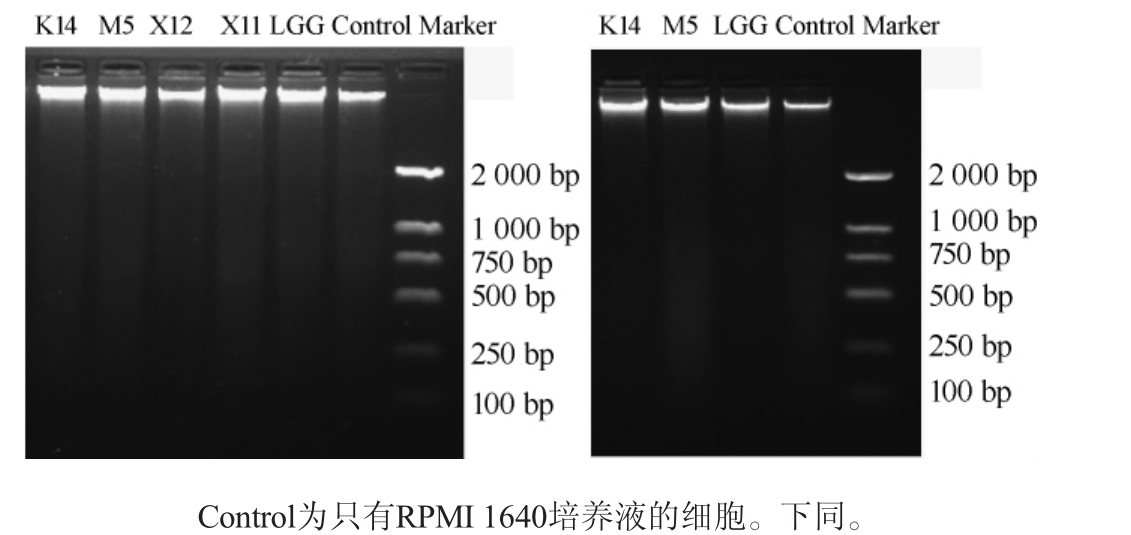
图1 乳酸菌细胞壁(a)及细胞质(b)处理HT-29细胞后的DNA琼脂糖凝胶电泳结果
Fig.1 Agarose gel electrophoresis results of DNA of HT-29 cells after treated with lactic acid bacteria cell wall(a)and cytoplasm(b)
2.4 乳酸菌细胞壁及细胞质对HT-29细胞的影响
表3 乳酸菌细胞壁及细胞质对HT-29细胞的影响
Table 3 Effect of lactic acid bacteria cell wall and cytoplasm on HT-29 cells
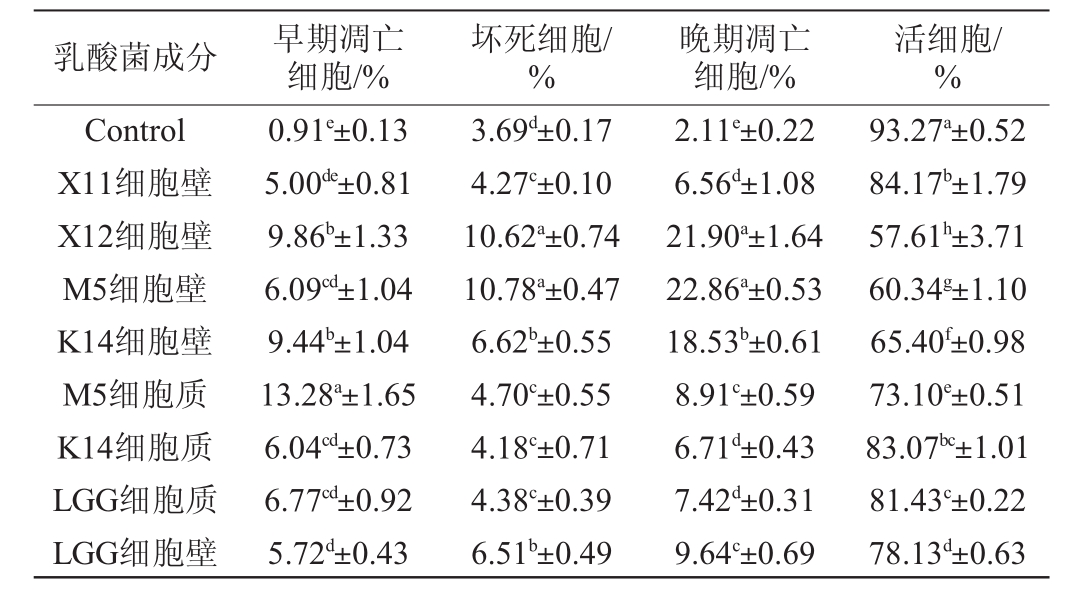
91013
由表3可知,与阳性对照组LGG细胞壁相比,乳酸菌X12、K14细胞壁显著促进HT-29细胞的死亡(P<0.05),使HT-29细胞早期凋亡细胞数分别提高72.38%、65.03%,坏死细胞数分别提高63.13%、1.69%,晚期凋亡细胞数分别提高127.18%、92.22%;乳酸菌M5细胞壁显著促进HT-29细胞的坏死及晚期凋亡(P<0.05),使坏死细胞数提高65.59%,晚期凋亡细胞数提高137.14%。与阳性对照LGG细胞质相比,乳酸菌M5细胞质使HT-29细胞的早期凋亡细胞数提高96.16%,坏死细胞数提高7.31%,晚期凋亡细胞数提高20.08%。而乳酸菌X11细胞壁和K14细胞质作用HT-29细胞48 h,早期凋亡、晚期凋亡和坏死细胞数均低于阳性对照组LGG。结果表明,乳酸菌X12、M5和K14细胞壁对HT-29细胞死亡具有显著的诱导作用。为确认乳酸菌X12、M5和K14细胞壁对HT-29细胞凋亡的诱导,进一步研究乳酸菌X12、M5和K14细胞壁对HT-29细胞周期的影响。
2.5 乳酸菌细胞壁及细胞质对HT-29细胞周期的影响
细胞周期分为DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)和细胞分裂期(M期)4个周期。乳杆菌X12、M5和K14细胞壁作用HT-29细胞后,其细胞周期变化情况见表4。
表4 乳酸菌细胞壁对HT-29细胞周期的影响
Table 4 Effect of lactic acid bacteria cell wall on HT-29 cells cycle
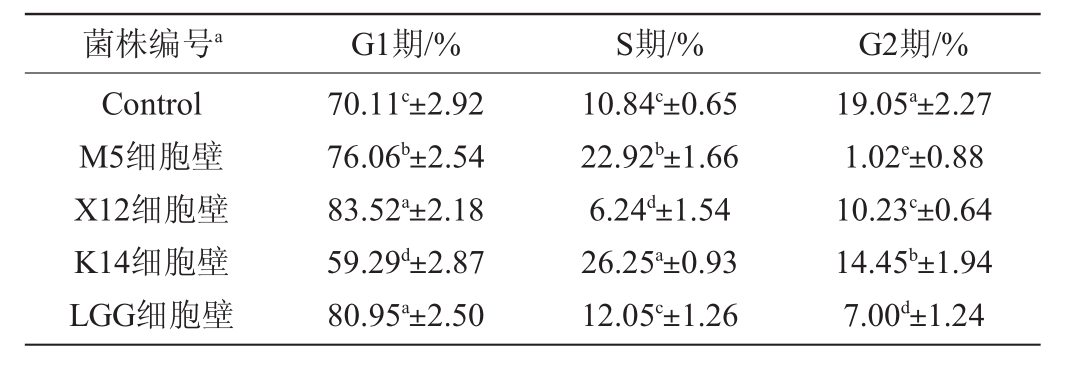
菌株编号a G1期/% S期/% G2期/%Control M5细胞壁X12细胞壁K14细胞壁LGG细胞壁70.11c±2.92 76.06b±2.54 83.52a±2.18 59.29d±2.87 80.95a±2.50 10.84c±0.65 22.92b±1.66 6.24d±1.54 26.25a±0.93 12.05c±1.26 19.05a±2.27 1.02e±0.88 10.23c±0.64 14.45b±1.94 7.00d±1.24
本研究中细胞周期阻滞实验均与对照组Control进行比较。相对于Control(G1期为70.11%),M5和X12细胞壁处理HT-29细胞后G1期显著提高了(分别为76.06%和83.52%),同时M5的S期也显著增高了(为22.92%),因此初步认为M5和X12细胞壁将HT-29细胞周期阻滞在了G1期。相对于Control(S期为10.84%),K14细胞壁处理HT-29细胞S期显著提高了(26.25%)。因此初步认为菌株K14细胞壁将HT-29细胞阻滞在了S期。通过本研究发现,乳酸菌X12、M5和K14细胞壁抑制HT-29细胞的增殖,并诱发癌细胞的凋亡,这一过程是通过调控癌细胞周期而实现。
3 结论
本研究以鼠李糖乳杆菌LGG为阳性对照,研究4株乳酸菌X11、X12、M5和K14细胞壁、细胞质对人结肠癌细胞系HT-29细胞毒性、DNA损伤、细胞死亡及细胞周期的影响,筛选具有抗结肠癌作用的有效成分。结果表明,与阳性对照LGG相比,乳酸菌X11、X12、M5、K14细胞壁和乳酸菌M5、K14细胞质对HT-29细胞增殖能力有显著的抑制作用(P<0.05);HT-29细胞经乳酸菌细胞壁或细胞质(蛋白质含量为80 μg/mL)处理48 h后,细胞DNA出现了明显的弥散拖尾形态;乳酸菌X12、M5和K14细胞壁对HT-29细胞死亡具有显著的诱导作用,并调控癌细胞的周期分布。通过以上筛选模式最终获得乳酸菌X12、M5和K14的细胞壁成分具有抗结肠癌效果,为后续其对结肠癌HT-29细胞周期调控机制的研究奠定了基础。
[1]WANG S,HAN X,ZHANG L,et al.Whole peptidoglycan extracts from the Lactobacillus paracasei subsp.paracasei M5 strain exert anticancer activityin vitro[J/OL].Biomed Res Int,2018,doi:10.1155/2018/2871710.
[2]TUO Y,ZHANG W,ZHANG L,et al.Study of probiotic potential of four wild Lactobacillus rhamnosus strains[J].Anaerobe,2013,21:22-27.
[3]AMROUCHE T,BOUTIN Y,PRIOULT G,et al.Effects of Bifidobacterial cytoplasm,cell wall and exopolysaccharide on mouse lymphocyte proliferation and cytokine production[J].Int Dairy J,2006,16(1):70-80.
[4]TUO Y,ZHANG L,YI H,et al.Short communication:Antiproliferative effect of wild Lactobacillus strains isolated from fermented foods on HT-29 cells[J].J Dairy Sci,2010,93(6):2362-2366.
[5]王淑梅,张兰威,单毓娟.乳酸菌与结肠癌[J].微生物学报,2015,55(6):667-674.
[6]CHANG J H,SHIM Y,CHA S K,et al.Probiotic characteristics of lactic acid bacteria isolated from kimchi[J].J Appl Microbiol,2010,109(1):220-230.
[7]LEE D K,JANG S,KIM M J,et al.Anti-proliferative effects of Bifidobacterium adolescentis Spm0212 extract on human colon cancer cell lines[J].BMC Cancer,2008,8:310.
[8]PUERTOLLANO E,PUERTOLLANO M,CRUZ-CHAMORRO L,et al.Effects of concentrated supernatants recovered from Lactobacillus plantarum on Escherichia coli growth and on the viability of a human promyelocytic cell line[J].J Appl Microbiol,2009,106(4):1194-1203.
[9]KIM J Y,WOO H J,KIM Y S,et al.Screening for anti-proliferative effects of cellular components from lactic acid bacteria against human cancer cell lines[J].Biotechnol Lett,2002,24(17):1431-1436.
[10]KIM J Y,WOO H J,KIM Y S,et al.Cell cycle dysregulation induced by cytoplasm of Lactococcus lactisssp.lactisin Snuc2a,a colon cancer cell line[J].Nutr Cancer,2003,46(2):197-201.
[11]KIM S Y,KIM J E,LEE K W,et al.Lactococcus lactis ssp.lactis inhibits the proliferation of Snu-1 human stomach cancer cells through induction of G0/G1 cell cycle arrest and apoptosis via P53 and P21 expression[J].Ann NY Acad Sci,2009,1171(1):270-275.
[12]KIM S Y,LEE K W,KIM J Y,et al.Cytoplasmic fraction of Lactococcus lactis ssp.lactis induces apoptosis in Snu-1 stomach adenocarcinoma cells[J].Biofactors,2004,22(1):119-122.
[13]WANG S,ZHANG L,FAN R,et al.Induction of HT-29 cells apoptosis by Lactobacilli isolated from fermented products[J].Res Microbiol,2014,165(3):202-214.
[14]张莉丽.MgCl2胁迫调控茂原链霉菌谷氨酰胺转氨酶合成及酶应用特性研究[D].哈尔滨:哈尔滨工业大学,2012.
[15]HAZA A I,ZABALA A,MORALES P.Protective effect and cytokine production of a Lactobacillus plantarum strain isolated from Ewes'milk cheese[J].Int Dairy J,2004,14(1):29-38.
[16]THIRABUNYANON M,BOONPRASOM P,NIAMSUP P.Probiotic potential of lactic acid bacteria isolated from fermented dairy milks on antiproliferation of colon cancer cells[J].Biotechnol Lett,2009,31(4):571-576.
[17]YU Z,LI W.Induction of apoptosis by puerarin in colon cancer HT-29 cells[J].Cancer Lett,2006,238(1):53-60.
[18]AYKUL S,MARTINEZ H E.Determination of half-maximal inhibitory concentration using biosensor-based protein interaction analysis[J].Anal Biochem,2016,508:97-103.
[19]LU C,ZHU F,CHO Y Y,et al.Cell apoptosis:requirement of H2ax in DNAladder formation,but not for the activation of caspase-3[J].Mol cell,2006,23(1):121-132.
[20]LI N,BU X,WU P,et al.The"HER2-PI3K/AKT-FASN axis"regulated malignant phenotype of colorectal cancer cells[J].Lipids,2012,47(4):403-411.
[21]FULLWOOD M J,LEE J,LIN L,et al.Next-generation sequencing of apoptotic DNA breakpoints reveals association with actively transcribed genes and gene translocations[J].Plos One,2011,6(11):e26054.
[22]KOLLER V J,MARIAN B,STIDL R,et al.Impact of lactic acid bacteria on oxidative DNA damage in human derived colon cells[J].Food Chem Toxicol,2008,46(4):1221-1229.
[23]CHOI S,KIM Y,HAN K,et al.Effects of lactobacillus strains on cancer cell proliferation and oxidative stressin vitro[J].Lett Appl Microbiol,2006,42(5):452-458.