利用秸秆、木材等可再生资源生物炼制生物基产品是生物技术领域的研究热点,其技术关键是葡萄糖和木糖的高效生物转化。与代谢葡萄糖不同,微生物对木糖利用率普遍不高。细菌中木糖分解代谢涉及两种重要的酶:木糖异构酶(EC 5.3.1.5)和木酮糖激酶(EC 2.7.1.17)。木糖异构酶将木糖代谢为木酮糖,然后由木酮糖激酶将其转化为木酮糖5-磷酸后进入磷酸戊糖途径或磷酸解酮酶途径以分解代谢[1]。微生物中木酮糖激酶的克隆表达与理化性质的研究已有大量报道[2-3]。通常,来源于耐/嗜热微生物的酶具有耐微生物污染、催化能力强和高温稳定等优点,在工业催化领域独具优势[4]。AHMAD S等[5-6]对两株耐热菌Saccharococcus caldoxylosilyticus和海栖热袍菌(Thermotogamaritima)中的木酮糖激酶进行了系统研究,获得了高活性、耐高温的催化酶。
凝结芽孢杆菌(Bacillus coagulans)具有高温发酵木糖和葡萄糖生产乳酸的能力[7-8],已经成功应用于秸秆、淀粉等可再生资源的生物炼制[9-10],对其所含功能酶的克隆、表达和纯化研究已经多有报道[11-14]。然而,针对该菌种的木糖代谢机制的研究还很匮乏。ZHENG Z等[15]首次从木糖操纵子角度,研究了B.coagulans NL01中的木酮糖激酶,然而未对该酶的结构特点和耐热机制进行研究。
B.coagulans IPE22是本实验室分离鉴定的一株乳酸生产菌,可高温发酵木糖生产L-乳酸[16],说明该菌株中一定具有高效的木糖代谢酶系。因此,本研究拟对B.coagulans IPE22中木酮糖激酶基因Bc-XK进行克隆表达和生物信息学分析,并对其热稳定性进行研究,最后将木酮糖激酶Bc-XK与其它细菌来源的木酮糖激酶进行氨基酸序列比对、活性位点分析和系统发育树聚类分析,旨在阐述该酶的耐热机制,为其工业化应用提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
凝结芽孢杆菌(Bacillus coagulans)IPE22、大肠杆菌(Escherichia coli)BL21(DE3):本实验保存。
1.1.2 培养基
固体LB培养基:胰蛋白胨1%、酵母提取物0.5%、氯化钠1%、琼脂粉1.5%,121℃高压灭菌20min。液体LB培养基中不添加琼脂粉。
1.1.3 主要试剂
载体pET-30a:美国Novagen公司;His-Trap镍亲和层析柱:美国GE health公司;细菌基因组(deoxyribonucleic acid,DNA)提取试剂盒、质粒小提试剂盒:天根生化科技(北京)有限公司;DL2000 DNA Marker、蛋白质Marker、Taq DNA聚合酶(5 U/μL)、限制性内切酶NcoI(10 U/μL)和XhoI(10U/μL)、T4 DNA连接酶(350U/μL):宝生物工程(大连)有限公司;琼脂糖凝胶回收试剂盒:北京索莱宝科技有限公司。
1.2 仪器与设备
5430型台式高速离心机:德国艾本德公司;SHA-C水浴恒温振荡器:常州国华电器有限公司;SW-CJ-2FD超净工作台:苏洁净化设备有限公司;PowerPac 300电泳仪:美国伯乐公司;2720型PCR基因扩增仪:美国ABI公司;MLS-3750型全自动灭菌锅:日本三洋公司;Scientz-IID型超声波细胞破碎仪:宁波新芝生物有限公司。
1.3 方法
1.3.1 木酮糖激酶基因Bc-XK的克隆
将B.coagulans IPE22接种于LB液体培养基中,45℃、150 r/m in条件下培养16 h,离心,收集菌体,采用细菌基因组DNA提取试剂盒提取B.coagulans IPE22基因组DNA。根据美国国立生物技术信息中心(national center forbiotechnology information,NCBI)GenBank数据库中B.coagulans 36D1(登录号:CP003056.1)的木酮糖激酶基因信息设计基因Bc-XK的PCR扩增引物,正向引物为5'-CATGCCATGGCTATGAAATATGCAATCGGTGTC-3',反向引物为5'-CCGCTCGAGCGGTTAAATTTCATCTGTTTTCCCT-3'。引物中,下划线部分为限制性内切酶位点NcoI(正向引物)和XhoI(反向引物)。以基因组DNA为模板,采用设计的引物进行聚合酶链式反应(polymerasechain reaction,PCR)扩增,PCR扩增体系和扩增条件参考文献[11]。PCR扩增产物采用1%琼脂糖凝胶进行检测。
1.3.2 重组菌的构建
PCR扩增产物经纯化后,采用限制性核酸内切酶NcoI和XhoI分别对纯化的PCR扩增产物和质粒pET-30a进行双酶切,酶切产物经1%琼脂糖凝胶电泳后,采用琼脂糖凝胶回收试剂盒纯化目的片段。采用T4 DNA连接酶连接酶切产物,以获得重组质粒pET-30a-Bc-XK。采用氯化钙法[17]将重组质粒pET-30a-Bc-XK转化至E.coli BL21(DE3)宿主菌中,涂布于含有25mg/L卡那霉素的LB平板上,于37℃条件下倒置培养18 h。挑取阳性克隆子送至苏州金唯智公司进行测序。
1.3.3 Bc-XK基因的表达
将重组菌E.coli BL21 pET-30a-Bc-XK接种于LB液体培养基中,37℃、200 r/min条件下培养至OD600 nm值约0.6后,添加终浓度为0.5mmol/L异丙基-β-D-硫代半乳糖(isopropylβ-D-thiogalactoside,IPTG)诱导表达。继续培养8 h后,8 000 r/min离心10min,收获菌体。
1.3.4 重组酶Bc-XK的纯化
获得的菌体在冰水浴中进行超声破壁,超声条件为功率95W,12m in,2 s工作,2 s间隔,360个循环。细胞破碎液在4℃、10 000 r/min条件下离心15min,弃沉淀,取上清液,使用镍柱进行蛋白纯化[4]。采用10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulfatepolyacrylamidegel electrophoresis,SDS-PAGE)检测重组酶Bc-XK的分子质量。
1.3.5 木酮糖激酶活性检测及热稳定性研究
参照文献[15]测定木酮糖激酶活性。将酶促反应体系分别置于50℃、60℃和70℃,每隔60min测定一次木酮糖激酶活性,以相对酶活力表示。相对酶活力定义为残留酶活力与未经热处理的初始酶活力之比值。
1.3.6 分析方法
参照《生物信息学》[18]进行生物信息学分析。利用ProtParam(http://web.expasy.org/protparam/)和NetPhosBac(http://www.cbs.dtu.dk/services/NetPhosBac/)对Bc-XK基因及其编码的氨基酸序列进行理化性质分析;采用Prositeexpasy(https://prosite.expasy.org/)预测Bc-XK基因编码蛋白的二级结构;采用NCBI-CDD(http://www.ncbi.nlm.nih.gov/Structure/cdd/w rpsb.cgi)分析蛋白质保守结构域和功能位点;采用SW ISS-MODEL(https://sw issmodel.expasy.org/interactive)预测高级结构。
从NCBI中选取15株细菌的木酮糖激酶氨基酸序列,使用MEGA X 10.0.5软件将其与Bc-XK氨基酸序列进行比对分析。基于木酮糖激酶氨基酸序列,采用最大似然(maximum likelihood,ML)法构建系统发育树。利用Timetree数据库(http://www.timetree.org/)对木酮糖激酶来源物种系统进化地位进行分析。
2 结果与分析
2.1 木酮糖激酶基因Bc-XK的克隆
以B.coagulans IPE22基因组为模板进行PCR扩增,PCR扩增产物的琼脂糖凝胶电泳结果见图1。由图1可知,PCR扩增产物碱基长度约为1 500 bp,与Bc-XK基因的预期片段大小相符合。

图1 PCR扩增产物的琼脂糖凝胶电泳图
Fig.1 Agarose gelelectrophoresis of PCR amplification product
M:DL2 000DNAMarker;1:PCR扩增产物。
2.2 重组酶Bc-XK的表达与纯化
重组菌E.coli BL21 pET-30a-Bc-XK经IPTG诱导、表达后,对重组酶Bc-XK进行纯化和SDS-PAGE分析,结果见图2。由图2可知,重组菌E.coli BL21 pET-30a-Bc-XK经IPTG诱导表达,获得重组酶Bc-XK,其分子质量为56 kDa,该结果与生物信息学预测结果一致。经镍柱纯化后,重组酶Bc-XK条带单一,达到电泳纯,比酶活力为(20.56±3.31)U/mg。

图2 粗酶液和重组蛋白的SDS-PAGE结果
Fig.2 SDS-PAGE results of crude enzyme and recombinant protein
1:蛋白质Marker;2:未诱导重组菌的粗酶液;3:IPTG诱导后重组菌的粗酶液;4:纯化后的重组蛋白Bc-XK。
2.3 重组酶Bc-XK的热稳定性研究
B.coagulans IPE22可高温发酵木糖生产乳酸,对源于其的重组酶Bc-XK进行温度稳定性研究结果如图3所示。由图3可知,Bc-XK在50℃稳定性非常好;当温度为60℃时,重组酶Bc-XK也表现出良好的稳定性,在180min内几乎没有活性损失;当温度为70℃时,孵育180min后,重组酶Bc-XK的相对酶活力为(39±3.1)%。说明重组酶Bc-XK具有良好的热稳定性,在工业上具有潜在的应用价值[19-20]。并且,可以利用基因工程方法将Bc-XK基因转入其他具备生物炼制能力的细菌或酵母中,实现微生物对木质纤维素中葡萄糖或木糖的全利用[21]。

图3 重组酶Bc-XK的热稳定性
Fig.3 Thermalstability of recombinase Bc-XK
2.4 重组酶Bc-XK的生物信息学分析
2.4.1 重组酶Bc-XK的结构分析
将Bc-XK基因的核苷酸序列信息提交至NCBI的Gen-Bank数据中,登录号为MF543361。利用ProtParam对Bc-XK基因进行分析,结果表明,Bc-XK基因含有碱基长度为1 536 bp的一个开放阅读框,共编码511个氨基酸(登录号:ATB56311.1),该基因编码的蛋白质等电点为5.46。
经Prosite-expasy和NetPhosBac预测,重组酶Bc-XK为亲水蛋白质,含有4个N-糖基化位点和多个磷酸化位点。基于Prosite-expasy的蛋白质二级结构预测结果显示,重组酶Bc-XK中α-螺旋、无规卷曲和延伸链含量丰富,分别为38.16%、43.25%和18.59%。
利用NCBI-CDD分析重组酶Bc-XK的保守结构域,结果如图4A所示。由图4A可知,重组酶Bc-XK含有多个木酮糖结合位点、金属结合位点和镁三磷酸腺苷(magnesium adenosine triphophate,MgATP)结合位点,这与FLANAGAN T等[22]的研究结果一致。同时,重组酶Bc-XK中含有墨角藻糖激酶-葡萄糖酸激酶-甘油激酶-木酮糖激酶(fucolokinase-gluconokinase-glycerolkinase-xylulokinase,FGGY)结构域和氮端核苷酸结合域-糖激酶-热休克蛋白-肌动蛋白(N-terminalnucleotidebinding domain-sugarkinase-heatshock protein-actin superfam ily,NBD-sugar-kinase-HSP70-actin su-perfamily)超家族结构域。重组酶Bc-XK中具有的FGGY结构域是激酶典型的结构特点,与E.coli中木酮糖激酶类似[23]。NBD-sugar-kinase-HSP70-actin结构域中热休克蛋白(heatshock protein,HSP)具有辅助热变性蛋白质恢复高级结构的功能,因此,推测重组酶Bc-XK中的HSP结构域可能与其高温催化特性有关。
使用SWISS-MODEL预测重组酶Bc-XK的高级结构,结果见图4B。由图4B清晰可见酶的催化位点:天冬氨酸-8、苏氨酸-11和天冬氨酸-239。并且,图4B中也显示了Bc-XK中底物(木酮糖)结合区域与催化位点相邻,这与NCBI-CDD预测结果一致。

图4 重组酶Bc-XK的保守结构域(A)和高级结构(B)预测结果
Fig.4 Forecasted results of conserved domains(A)and advanced structure(B)of recombinase Bc-XK
2.4.2 重组酶Bc-XK的活性位点分析
为了研究蛋白质结构与功能的关系,使用ClustalX2软件将重组酶Bc-XK与海栖热袍菌(Thermotogamaritima)中的木酮糖激酶Tm-XK、模式生物大肠杆菌(E.coli)中的木酮糖激酶Ec-XK和常见工业乳酸生产菌短乳杆菌(Lactobacillusbrevis)中的木糖激酶Lb-XK的氨基酸序列进行比对分析,结果见图5。
由图5可知,木酮糖激酶Bc-XK与Tm-XK、Ec-XK和Lb-XK的氨基酸序列相似性分别为38%、38%和57%,且4个木酮糖激酶均含有27个活性位点,包括3个催化位点(见图4):天冬氨酸-8、苏氨酸-11、天冬氨酸-239;2个金属结合位点:天冬氨酸-8、天冬氨酸-239;7个木酮糖底物结合位点:谷氨酰胺-80、甲硫氨酸-81、组氨酸-82、色氨酸-100、天冬氨酸-239、天冬酰胺-240、甲硫氨酸-294;21个MgATP结合位点:天冬氨酸-8、甘氨酸-10、苏氨酸-11、丝氨酸-12、丝氨酸-13、赖氨酸-15、天冬氨酸-239、异亮氨酸-259、甘氨酸-260、苏氨酸-261、甘氨酸-301、酪氨酸-302、亮氨酸-304、丝氨酸-305、苯丙氨酸-317、丙氨酸-318、亮氨酸-320、甘氨酸-402、甘氨酸-403、甘氨酸-404、丝氨酸-407。

图5 重组酶Bc-XK与其他木酮糖激酶氨基酸序列比对与活性位点分析
Fig.5 Am ino acid sequence alignm ent and active sites analysis between recombinase Bc-XK and other xylulose kinase
氨基酸上面标注的空心方框(□)表示活性位点;黑色实心方框(■)和灰色实心方框(■)字体背景分别代表保守氨基酸位点和相似氨基酸位点;“*”和“.”表示相似度。
值得指出的是,木酮糖激酶Bc-XK与Tm-XK虽然都是耐热木酮糖激酶,但是其氨基酸序列相似性不高。木酮糖激酶Bc-XK和Tm-XK的27个活性位点中存在7个差异位点(丝氨酸-12、异亮氨酸-259、甘氨酸-301、丝氨酸-305、苯丙氨酸-317、丙氨酸-318和亮氨酸-320),且仅涉及MgATP结合位点功能区域,而其他活性位点(木酮糖结合位点、催化位点和金属结合位点)均相同。一般而言,决定酶促反应机制的关键位点是催化位点[22]。木酮糖激酶Bc-XK与Tm-XK的催化位点完全相同,均为天冬氨酸-8、苏氨酸-11和天冬氨酸-239。因此,木酮糖激酶Bc-XK和Tm-XK具有类似的催化机制。推测木酮糖激酶Bc-XK和Tm-XK在MgATP结合位点存在的差异仅会导致底物结合能力变化,影响酶的催化反应速度高低。
2.4.3 木酮糖激酶Bc-XK的遗传学分析
重组酶Bc-XK的系统发育树见图6A。由图6A可知,16个木酮糖激酶聚为4个类群(I、II、III和IV)。其中,类群I由来自芽孢杆菌属(Bacillus)的木酮糖激酶组成;类群II和III由来自乳酸细菌的木酮糖激酶组成;类群IV由来自T.maritim e、T.neapolitana和E.coli中的木酮糖激酶组成。为了验证基于木酮糖激酶氨基酸序列构建的系统发育树是否与物种的进化地位一致,基于Timetree数据库,对本研究涉及的14个物种进行分析[24],结果如图6B所示。由图6B可知,涉及的14个物种聚类为4个类群:类群I为包括凝结芽孢杆菌在内的5株芽孢杆菌属细菌;类群II均为乳酸细菌;类群III为E.coli;类群IV为两种嗜热细菌(T.maritime和T.neapolitana)。与图6A结果类似,说明基于木酮糖激酶构建的系统发育树可以很好的反映出物种的进化关系。从系统进化和发育角度而言,虽然Bc-XK不是一个崭新的催化酶,但是其具有良好的高温催化能力和优异的热稳定性,在工业上亦具有广阔的应用价值。
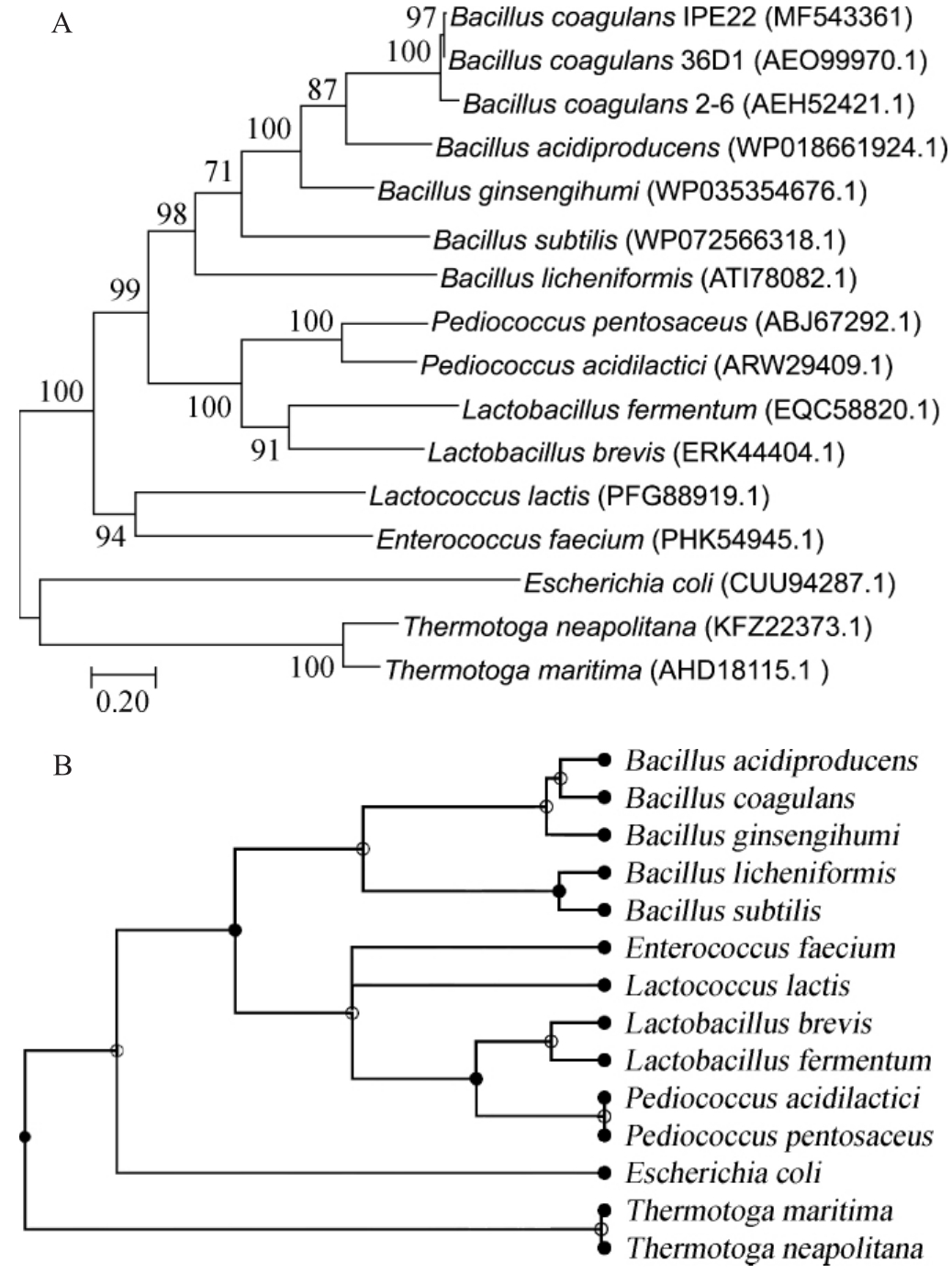
图6 基于木酮糖激酶氨基酸序列的系统发育树(A)和基于物种的时间树(B)
Fig.6 Phylogenetic tree based on am ino acid sequence ofxylulose kinase(A)and time tree based on species(B)
2.5 基于生物信息学分析木酮糖激酶Bc-XK热稳定性机理
有研究报道,耐热蛋白质富含带电氨基酸残基;高级结构中α-螺旋结构较多且肽链长;与α-螺旋形成有关的丙氨酸含量高;富含金属离子结合位点等[25-26]。通过生物信息学分析可知,木酮糖激酶Bc-XK中带电氨基酸(精氨酸、赖氨酸、天冬氨酸和谷氨酸)共有112个,占总氨基酸数量21.92%;分子中易于形成α-螺旋的丙氨酸含量位于所有氨基酸组成的第3位,比例为7.80%;高级结构中α-螺旋含量较高,且含有2个金属结合位点。因此,木酮糖激酶Bc-XK具有较好的热稳定性。
3 结论
菌株B.coagulans IPE22中的木酮糖激酶基因Bc-XK与载体pET-30a连接后,成功在E.coli BL21(DE3)中诱导表达。重组酶Bc-XK经纯化后,比酶活力为(20.56±3.31)U/mg。该酶热稳定性好,可以在60℃保持活力180min以上。生物信息分析结果显示,基因Bc-XK含有一个1 536bp的开放阅读框,共编码511个氨基酸,其编码的蛋白质为亲水蛋白,分子质量为56 kDa,等电点为5.46,二级结构中α-螺旋、无规卷曲和延伸链含量丰富,3个催化位点为天冬氨酸-8、苏氨酸-11、天冬氨酸-239。氨基酸序列比对和聚类分析结果显示,不同细菌来源的木酮糖激酶具有高度保守的3个催化位点,且基于木酮糖激酶构建的系统发育树可以很好的反映出物种的进化关系。
[1]LU X Y,FU X M,ZONG H,etal.Overexpressions of xylA and xylB in Klebsiella pneumoniae lead to enhanced 1,3-propanediol production by cofermentation of glyceroland xylose[J].JM icrobiol Biotechn,2016,26(7):1252-1258.
[2]LAWLISV B,DENNISM S,CHEN E Y,et al.Cloning and sequencing of the xylose isomerase and xylulose kinase genes of Escherichia coli[J].Appl Environ M icrobiol,1984,47(1):15-21.
[3]WANG R L,ZHANG L,WANG D M,etal.Identification of a xylulokinase catalyzing xylulose phosphorylation in the xylosemetabolic pathway of Kluyveromycesmarxianus NBRC1777[J].J Ind M icrobiol Biot,2011,38(10):1739-1746.
[4]AULITTO M,FUSCO S,FIORENTINO G,et al.Thermus thermophilus as source of thermozymes for biotechnological applications:homologous expression and biochemical characterization ofan α-galactosidase[J].M icrob Cell Factor,2017,16:28.
[5]AHMAD S,SCOPESR K.Isolation and propertiesof a constitutive D-xylulokinase from a novel thermophilic Saccharococcus caldoxylosilyticus DSM 12041(ATCC 700356)[J].Enzyme M icrob Tech,2002,30(5):627-632.
[6]DEL CAMPO JS,CHUN Y,KIM JE,etal.Discovery and characterization of a novel ATP/polyphosphate xylulokinase from a hyperthermophilic bacterium Thermotogamaritima[J].J Ind M icrobiol Biot,2013,40(7):661-669.
[7]AULITTO M,FUSCO S,BARTOLUCCIS,et al.Bacillus coagulans MA-13:a promising thermophilic and cellulolytic strain for the production of lactic acid from lignocellulosic hydrolysate[J].Biotechnol Biofuels,2017,10(1):210.
[8]严涛,朱建国,姜甜,等.一株凝结芽孢杆菌的分离筛选及产孢条件优化[J].微生物学通报,2018,45(2):238-249.
[9]刘冬梅,周全兴,周劲松.芽孢杆菌BCS13002的鉴定及同步糖化发酵生产高光学纯度L-乳酸[J].华南理工大学学报(自然科学版),2017,45(9):81-86.
[10]张玉明.凝结芽孢杆菌在乳酸生物炼制中的应用[J].中国酿造,2017,36(2):10-14.
[11]韩军军,段斐,刘进兰,等.凝结芽胞杆菌IPE22中乳酸脱氢酶基因的克隆表达与特征分析[J].基因组学与应用生物学,2018,37(4):1439-1447.
[12]夏美娟,宦才辉,姜婷,等.凝结芽孢杆菌N-乙酰-β-D-氨基葡萄糖苷酶基因的克隆鉴定及酶学性质[J].林业工程学报,2017,2(2):75-80.
[13]张营营,郭茜,熊利霞,等.凝结芽孢杆菌Liu-g1产中性蛋白酶的发酵培养基及条件优化[J].食品工业科技,2016,37(21):150-154.
[14]李文婷,边斐,王翠萍,等.凝结芽孢杆菌RY237β-半乳糖苷酶酶学性质研究[J].食品工业科技,2017,38(14):111-114.
[15]ZHENG Z,XIL,JIANG T,et al.Genom ic analysis of a xylose operon and characterization of novel xylose isomerase and xylulokinase from Bacillus coagulans NL01[J].Biotechnol Lett,2016,38(8):1331-1339.
[16]ZHANG YM,CHEN X R,LUO JQ,etal.An efficientprocess for lactic acid production from wheat straw by a new ly isolated Bacillus coagulans strain IPE22[J].Bioresource Technol,2014,158:396-399.
[17]吴乃虎.基因工程原理(第二版(上册))[M].北京:科学出版社,2003:316-319.
[18]李霞.生物信息学(第二版)[M].北京:人民卫生出版社,2015:176-205.
[19]MEIW,LUW,YING Z,et al.Characterization of an L-arabinose isomerase from Bacillus coagulans NL01 and its application for D-tagatose production[J].BMC Biotechnol,2016,16(1):55.
[20]SINGH S,GUPTA P,BAJAJB K.Characterization of a robust serine protease from Bacillussubtilis K-1[J].JBasic M icrob,2018,58(1):88-98.
[21]TANG Y J,SAPRA R,JOYNER D,et al.Analysis ofmetabolic pathways and fluxes in a new ly discovered thermophilic and ethanol-tolerant Geobacillus strain[J].Biotechnol Bioeng,2009,102(5):1377-1386.
[22]FLANAGAN T,WAITESM J.Purification and characterization of D-xylulokinase from the pentose-fermenting yeast Pichia stipitis NCYC 1541[J].Enzyme M icrob Tech,1992,14(12):975-979.
[23]DIL E,PETSCHACHER B,VOEGTLIJ,et al.Structural and kinetic studiesof induced fitin xylulose kinase from Escherichia coli[J].JM ol Biol,2007,365(3):783-798.
[24]KUMAR S,STECHER G,SULESKIM,et al.Timetree:a resource for timelines,timetrees,and divergence times[J].M ol Biol Evol,2017,34(7):1812-1819.
[25]沈嘉澍,沈标.嗜热酶的耐热机理[J].微生物学杂志,2010,30(2):80-85.
[26]VIEILLEC,ZEIKUSG.Hyperthermophilic enzymes:sources,uses,and molecularmechanisms for thermostability[J].M icrobiol M ol Biol R,2001,65(1):1-43.