黑糯米酒在我国有着悠久的酿造和饮用历史,其富含矿物质元素、γ-氨基丁酸和黄酮类化合物等,具有预防老年痴呆等功效[1]。此外,黑糯米酒中的花色苷类物质增强了黑糯米酒的抗氧化能力,同时也使得黑糯米酒的颜色与众不同[2]。
目前,对于花色苷测定方法的研究较多,其中以pH示差法、单一pH法和差减法的应用较为普遍,但精密度差异较大。翦祎等[3]比较了以上3种方法测定干红葡萄酒花色苷结果的差异性,发现3种方法的测定结果无显著差异。唐琳等[4]对单一pH法和pH示差法测定玫瑰花花色苷的方法进行了研究,发现单一pH法受溶剂影响较大,测定时必须在同一溶剂中进行;pH示差法的准确性较高,但测定时要保证样品吸光度值在0.2以上。霍琳琳等[5]比较了直接分光光度法和pH示差法,发现两种方法无显著差异。花色苷测定方法的选定是花色苷后续研究的基础,以黑糯米酒花色苷为研究对象,通过对以上3种测定方法进行综合比较,得到黑糯米酒花色苷测定最佳方法和最优条件,给后续黑糯米花色苷测定提供一些有益的参考。
由于在黑糯米酒的发酵、陈酿以及贮藏等过程中,其花色苷种类和含量会随发酵微环境、介质温度、外界光照等变化而发生改变,而且花色苷的组成较为复杂,其最大吸收波长始终处于动态变化的过程中,因此,一般均选用花色苷标准品来表示黑糯米酒中总花色苷含量。矢车菊素在自然界中分布最为广泛且含量最为丰富[6],相关研究表明,黑糯米种皮中富含矢车菊-3-O-葡萄糖苷(cyanidin-3-O-glucoside),而且矢车菊素在黑糯米酒中含量较高[7-8],因此以矢车菊-3-O-葡萄糖苷为标准品来表示黑糯米酒总花色苷。通过对黑糯米酒花色苷的测定方法的研究,以期得到一种适合黑糯米酒总花色苷测定的方法,对更深入地研究花色苷有着重要的意义。
1 材料与方法
1.1 材料与试剂
黑糯米、酒曲:贵州永红酒厂提供;黑糯米酒:实验室自酿。
柠檬酸、柠檬酸三钠、亚硫酸钠、酒石酸钾钠(分析纯):天津市福晨化学试剂厂;氯化钾、三水合乙酸钠、氢氧化钠、葡萄糖(分析纯):广州化学试剂厂;盐酸(分析纯):大丰市俐科发特种化学试剂厂;矢车菊-3-O-葡萄糖苷标准品:北京世纪奥科生物技术有限公司。
缓冲液(pH 0.5~2.0:将HCl逐滴滴入0.1mol/L柠檬酸;pH 0.8缓冲液0.2mol/L KCl∶0.3mol/L HCl=29∶40;pH 4.5缓冲液0.2mol/L NaAc·3H2O:0.2mol/LHAc=1∶1;pH 3.0缓冲液0.1mol/L柠檬酸∶0.1mol/L柠檬酸钠=82∶18;pH 4.0缓冲液0.1mol/L柠檬酸∶0.1mol/L柠檬酸钠=59:41;pH 5.0缓冲液0.1mol/L柠檬酸∶0.1mol/L柠檬酸钠=35∶65;pH 6.0缓冲液0.1mol/L柠檬酸∶0.1mol/L柠檬酸钠=12∶88)。
1.2 仪器与设备
TU-1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;SP-02恒温培养箱:黄石市恒丰医疗器械有限公司;HH-2数显恒温水浴锅:上海泰坦科技股份有限公司;PB-10酸度计:赛多利斯科学仪器有限公司。
1.3 实验方法
1.3.1 黑糯米酒花色苷测定波长的选定
配制质量浓度为500mg/L的矢车菊-3-O-葡萄糖苷标准溶液,从中吸取1m L用去离子水稀释6倍,再吸取1m L稀释后溶液并用pH 0.8缓冲液定容至10m L。以pH 0.8缓冲液作为空白,于波长350~710 nm区间对酒样进行全波段扫描,确定其最大吸收波长,并测定吸光度值。
1.3.2 测定条件选定
缓冲液pH的选定:在11支比色管中各加入1m L的酒样,再加入9m L pH为0.6、0.8、1.0、1.2、1.4、2.0、3.0、4.0、4.5、5.0、6.0的缓冲溶液,30℃恒温水浴平衡40m in后,以去离子水作为空白,测定其最大吸收波长处吸光度值。
平衡温度和平衡时间的选定:向6个100m L容量瓶中加入酒样10m L,其中3个容量瓶中加入pH 0.8缓冲溶液并定容至100m L,另外3个容量瓶中加入pH4.5缓冲溶液并定容至100m L。分别置于20℃、30℃、40℃的水浴锅中,每隔20min在波长511 nm条件下测定吸光度值。
1.3.3 矢车菊-3-O-葡萄糖苷标准曲线的绘制
将500mg/L的花色苷标准品溶液用去离子水分别稀释2、4、6、8、10、20、40倍(质量浓度分别为250mg/L、125mg/L、83.33mg/L、62.5mg/L、50mg/L、25mg/L、12.5mg/L),从中各吸取1m L并用pH 0.8缓冲液定容至10m L,在30℃恒温水浴平衡40min,以pH 0.8的缓冲溶液作为空白,在波长350~710 nm区间对样品进行全波段扫描,并记录曲线。在最大吸收波长处测定吸光度值,绘制标准曲线。
1.3.4 3种方法测定黑糯米酒总花色苷
pH示差法:分别量取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0m L酒样于10个10mL容量瓶中,设A、B两组平行。A组:加入pH 0.8的缓冲液并定容,B组:加入pH 4.5的缓冲液并定容。于30℃恒温水浴平衡40min后,以去离子水作为空白,在波长511 nm和700 nm处测定其吸光度值[9-10]。
单一pH法:分别量取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0m L酒样于10个10m L容量瓶中,再用pH 0.8缓冲液定容。于30℃恒温水浴平衡40m in后,以去离子水作为空白,在波长511 nm和700 nm处测定吸光度值。
差减法:分别量取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0m L酒样于10个10m L容量瓶中,再用pH 0.8的缓冲液定容。另外量取上述相同体积的酒样于10个10m L容量瓶中,添加0.8m L20%的Na2SO3溶液,再用pH 0.8的缓冲液定容至10m L。置于30℃水浴锅中平衡40min后,以去离子水作为空白,在波长511 nm和700 nm处测定吸光度值。
1.3.5 总花色苷计算方法
pH示差法[9-10]测定花色苷含量公式:

式中:A=Aλmax;M w为矢车菊-3-O-葡萄糖苷分子量,449.38g/mol;DF为稀释倍数;ε为矢车菊-3-O-葡萄糖苷摩尔消光系数,26 900 L/(mol·cm)-1;I为比色杯光程/1cm;A1和A2分别为使用亚硫酸钠漂白前和漂白后所测得的酒液吸光度值;k为用矢车菊-3-O-葡萄糖苷绘制的标准曲线斜率。
1.3.6 黑糯米酒酒精含量对测定结果的影响
用无水乙醇配制酒精含量为20%vol、40%vol、60%vol、80%vol、100%vol的酒精溶液。分别吸取1m L酒样于18个10m L容量瓶中,各加入1m L上述酒精,并分为A、B、C共3组,每组6个。向A组和B组容量瓶中分别加入pH 0.8和pH 4.5的缓冲液并定容,向C组中先添加0.8m L 20%亚硫酸钠溶液,再用pH 0.8的缓冲溶液定容。将这18个容量瓶放入30℃水浴锅中,40min后,以去离子水作为空白,于波长511 nm和700 nm处测定吸光度值。
1.3.7精密度和加标回收率试验
吸取2m L酒样于3个20m L容量瓶中,往其中2个容量瓶中分别加入pH 0.8和pH 4.5的缓冲溶液并定容,向剩下1支容量瓶先加入1.6m L 20%的亚硫酸钠溶液,再用pH 0.8缓冲液定容。于30℃恒温处理40m in后,以去离子水为空白,于波长511 nm和700 nm处测定吸光度值。
分别从已知花色苷浓度黑糯米酒中吸取1m L至两个容量瓶里,然后用pH 0.8的缓冲溶液定容至10m L,向其中一个容量瓶中再添加1m L稀释6倍的矢车菊-3-O-葡萄糖苷标准品溶液,于30℃恒温处理40min,以去离子水作为空白,于波长511 nm和700 nm处测定吸光度值。
2 结果与分析
2.1 黑糯米酒花色苷的光谱特性
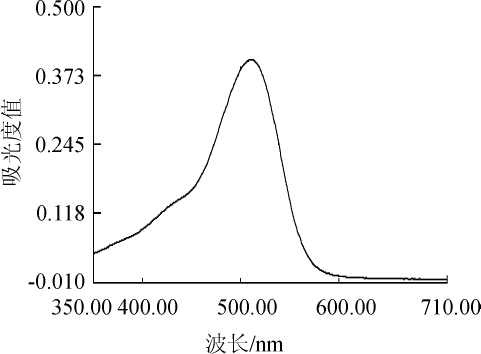
图1 矢车菊-3-O-葡萄糖苷的紫外可见吸收光谱图
Fig.1 UV-visible absorption spectra of cyanidin-3-O-glucoside
从图1可以看出,波长350~511 nm处吸光度值不断增大,直至511 nm附近趋于稳定;波长511~600 nm处吸光度显著降低,波长600~710 nm处吸光度值基本保持在0附近。当波长为511 nm附近时,矢车菊-3-O-葡萄糖苷出现强烈的吸收峰(吸光度值为0.402),因此选定最大吸收波长λmax=511 nm作为黑糯米酒花色苷的测定波长。卢钰等[11-12]也选用矢车菊-3-O-葡萄糖苷为标样,最大吸收波长为520 nm。
2.2 测定条件选定
2.2.1 缓冲液pH的选定
由于自身结构特性,花色苷只有在pH<7的环境中保持稳定,故仅需考察缓冲溶液pH<7的条件下花色苷的吸光度值[3]。从图2可以看出,在pH=0.8时吸光度值最高,在pH=4.5时所测得的吸光度值最低,pH>4.5时所测得吸光度值基本不变,原因可能是pH>4.5时花色苷在波长511 nm处无吸收并且转化成无色结构。pH示差法中,两个pH条件下的吸光度值差距最大且能保持稳定,通过这两个示差pH可计算得到花色苷含量[13]。黑糯米酒花色苷在pH值为0.8和4.5时的吸光度值的差值是最大的,并且在pH 0.8和pH 4.5左右的吸光度浮动较小,所以本实验选择缓冲液pH 0.8和pH 4.5来检测黑糯米酒样品花色苷的吸光度值。
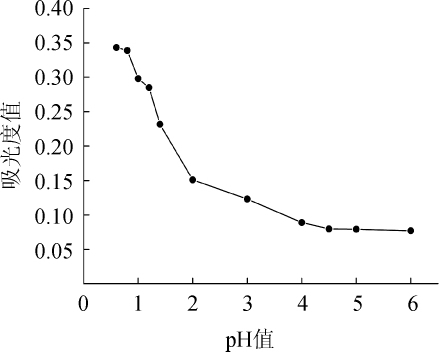
图2 缓冲液pH值对花色苷的影响
Fig.2 Effect of buffer solution pH on anthocyanin
2.2.2 平衡温度和平衡时间的选定
花色苷溶液加入pH缓冲液后,需要放置一段时间,待达到平衡之后方可用于检测[14]。研究显示,花色苷在高于40℃的介质中稳定性很差[15],所以选择在低于40℃条件下进行平衡。
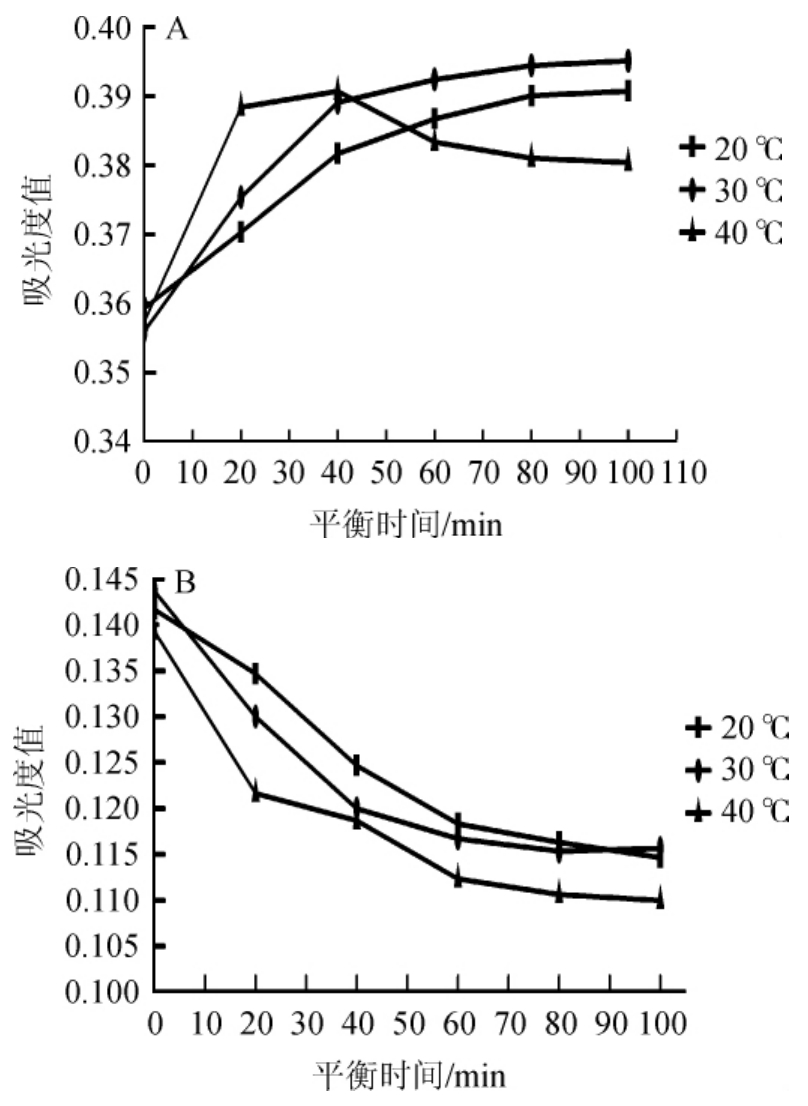
图3 pH值为0.8(A)、pH值为4.5(B)时平衡温度、时间对花色苷影响
Fig.3 Effect of equilibrium temperature and time on anthocyanin at pH 0.8(A)and 4.5(B)
由图3可知,在pH 0.8的缓冲介质中,20℃和30℃条件下,样品的吸光度值随时间延长整体呈上升趋势,40min后慢慢趋于平缓,其中30℃条件下的吸光度值始终高于20℃的吸光度值。40℃条件下吸光度值随着时间延长吸光度值先增加,但在40min时达到平衡后减少,60min后趋于平缓。在pH 4.5缓冲介质中,20℃、30℃、40℃条件下的吸光度值随着时间延长整体呈下降趋势,分别在60min、40min和60m in后逐渐趋于平缓。其中,在40℃条件下,20m in时达到平衡一段时间后继续呈下降趋势,可能是由于花色苷被O2氧化,从而影响了吸光度值。
综上所述,当3个温度最后达到平衡时,黑糯米酒花色苷在30℃条件下,在不同pH值缓冲液的吸光度差值最大且最稳定,并于40min时基本呈稳定状态,因此平衡温度和时间选定为30℃、40min。
2.3 标准曲线的绘制
矢车菊素-3-O-葡萄糖苷标准曲线方程为y=0.044 9x+0.02,R2=0.996 4,表明矢车菊-3-O-葡萄糖苷质量浓度在11.39~221.72mg/L范围内,与溶液的吸光度值呈现良好的线性相关。
2.4 3种总花色苷测定方法的比较
由图4可知,3种测定方法曲线均呈现出良好的线性相关,相关系数(R2)均大于0.99,表明3种方法都可以检测黑糯米酒中的总花色苷。
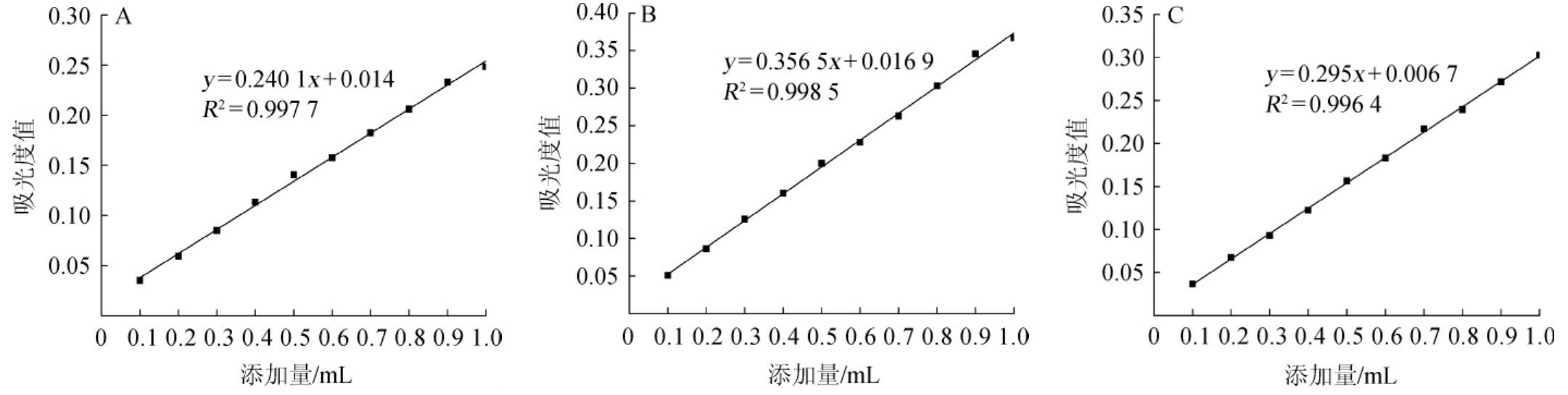
图4 pH示差法(A)、单一pH法(B)、差减法(C)测总花色苷含量比较
Fig.4 Comparison of totalanthocyanin content determ ined by pH differentialmethod(A),single pH method(B)and subtraction method(C)
2.5 酒液pH对测定结果的影响
由图5可知,酒液pH为4时,3种方法所测得的花色苷吸光度值均为最大值,并且酒液pH4附近时所测得的吸光度值差距很小。酒液pH为1和6时,3种方法所测得的吸光度值低于其他pH条件下吸光度值。综上所述,用3种方法测定酒液样品吸光度值时,首先要保证所测的酒液样品pH在4附近(pH为3~5)。经测定,所用黑糯米酒的pH值为3.70,在其范围内,因此不需调整pH。
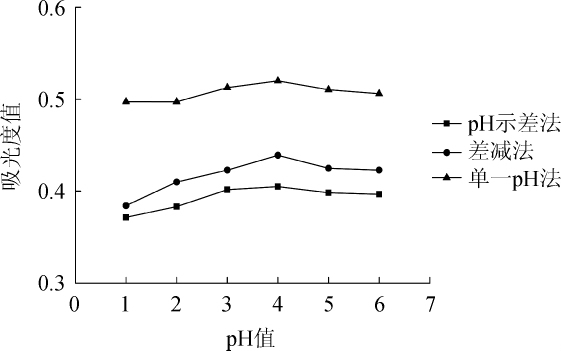
图5 酒液pH值对3种方法测定结果的影响
Fig.5 Effectofwine pH on determ ination results of three kinds ofmethods
2.6 黑糯米酒乙醇体积分数对测定结果的影响
由图6可知,3种方法所得结果的曲线没有明显的变化趋势,而且差距不大。单一pH法、pH示差法、差减法测定黑糯米酒花色苷吸光度值的标准偏差依次为0.010、0.009 9、0.004 4。可见黑糯米酒中的酒精含量基本不影响测定结果的准确性,可以不计加热时乙醇挥发对测定结果带来的影响。
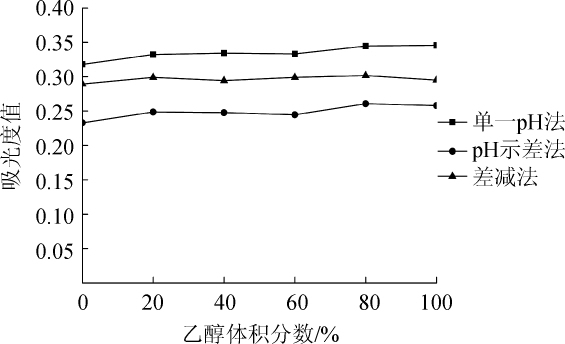
图6 酒精含量对3种方法测定结果的影响
Fig.6 Effect of alcohol content on determ ination results of three kinds ofmethods
2.7 3种方法精密度试验
采用优化后pH示差法、单一pH法和差减法对样品重复测6次,从表1可知,其相对标准偏差(relative standard deviation,RSD)分别为0.83%、1.60%和1.24%,表明这3种方法测定黑糯米酒花色苷的精密度良好,其中pH示差法精密度最高。
单一pH法比另外两种方法的操作更加简便、步骤更少、数据处理相对较简易,在花色苷定量检测中应用广泛[16],但存在不全面、方向单一,针对性不强等缺点。此外,在精密度试验中单一pH法的相对标准偏差最高为1.60%,精密度相对另外两种方法稍差。
表1 3种方法精密度试验结果
Table 1 Precision test results of three kinds ofmethods
序号1 2 3 4 5 6标准差平均值RSD/%38.42 38.09 37.59 37.59 37.92 38.26 0.31 37.98 0.83 52.29 54.46 53.79 54.79 53.96 53.29 0.86 53.86 1.60 56.35 57.01 55.01 57.02 56.79 56.12 0.70 56.38 1.24花色苷含量/(mg·L-1)pH示差法 单一pH法 差减法
pH示差法和差减法的优势在于仪器廉价,操作简单,实用性强。由于差减法需要用到漂白剂,操作过程相对比较复杂,容易造成误差。此外,漂白剂的添加会使得干扰物的吸光度值下降,导致最终结果比实际值偏大,偏差相对较大[17]。pH示差法方便、快捷、精确,适用于有干扰物的溶液中花色苷检测,可以排除非花色苷类物质对测定结果的影响[18]。王颖等[19-20]均使用该方法对有色马铃薯总花色苷进行检测。因此选择pH示差法对黑糯米酒花色苷测定。2.8 pH示差法加标回收率试验
表2 加标回收率试验结果
Table 2 Results of standard recovery rate test
酒液花色苷含量/(mg·L-1)加标量/(mg·L-1)测得量/(mg·L-1)回收率/%平均回收率/%标准偏差/%RSD/%84.95 85.73 85.93 79.29 79.29 79.29 163.07 164.24 163.82 98.52 99.01 98.28 98.60 30.01 0.38
由表2可知,加标回收率平均值达98.60%,RSD为0.38%,表明该优化条件后的方法可靠、准确,适用于黑糯米酒中总花色苷测定。
3 结论
对黑糯米酒花色苷的测定方法进行了研究。结果表明,pH示差法、单一pH法和差减法所测标准曲线的相关系数为0.997 7、0.998 5、0.999 4,线性关系较好,均可用于测定黑糯米酒中总花色苷含量。3种方法测定黑糯米酒花色苷的平衡温度为30℃,平衡时间为40min,测定波长为511 nm。单一pH法和差减法的最适pH为0.8,pH示差法最适pH为0.8和4.5。3种方法可直接测定黑糯米酒总花色苷含量,且精密度良好,其中pH示差法精密度最高,相对标准偏差(RSD)为0.83%。pH示差法加标回收率试验结果RSD为0.38%,表明该优化条件后的方法可靠、准确,适用于黑糯米酒中总花色苷测定。
[1]张元,白卫东,刘功良,等.黄酒生物活性成分及其功能研究进展[J].中国酿造,2017,36(7):5-9.
[2]刘媛媛.黑米及黑米酒中抗氧化成分分析[D].杨凌:西北农林科技大学,2013.
[3]翦祎,韩舜愈,张波,等.单一pH法、pH示差法和差减法快速测定干红葡萄酒中总花色苷含量的比较[J].食品工业科技,2012,33(23):323-325.
[4]唐琳,李子江,赵磊,等.两种pH值法测定玫瑰花花色苷含量的比较[J].食品科学,2009,30(18):310-313.
[5]霍琳琳,苏平,吕英华.分光光度法测定桑葚总花色苷含量的研究[J].酿酒,2005,32(4):88-89.
[6]刘达玉,马艳华,王新惠,等.黑米酒的酿造及其品质分析研究[J].食品研究与开发,2012,56(9):86-91.
[7]ELISIA I,HUC,POPOVICHDG,etal.Antioxidantassessmentof an anthocyanin-enriched blackberry extract[J].Food Chem,2007,101(3):1052-1058.
[8]赵旭.酶协同微生物发酵黑糯米酒工艺研究[D].贵阳:贵州大学,2016.[9]WROLSTAD R E,CULBERTSON JD,CORNWELL C J.Detection of adulteration in blackberry juice concentratesand wines[J].J Assoc Anal Chem,1982,65(6):1417-1423.
[10]LEEJ,DURSTRW,WROLSTADRE.Determination of totalmonomeric anthocyanin pigment content of fruit juices,beverages,natural colorants,and winesby the pH differentialmethod:Collaborative study[J].J Aoac Int,2005,88(5):1269-1278.
[11]卢钰,董现义,杜景平,等.花色苷研究进展[J].山东农业大学学报(自然科学版),2004,35(2):315-320.
[12]李安文.蓝莓花色苷稳定性及分离纯化技术研究[D].长沙:湖南农业大学,2011.
[13]FULEKIT,FRANCISFJ.Quantitativemethods foranthocyanins:1.Extraction and determination of total anthocyanins in cranberry juice[J].J Food Sci,1968,33(1):72-77.
[14]MARKAKISP.Anthocyaninsas food colors[J].Food Sci Technol,1983,21(4):509.
[15]DANGLESO,SAITON,BROUILLARDR.Kinetic and thermodynamic control of flavylium hydration in the pelargonidin-cinnam ic acid complexation.Origin of the extraordinary flower color diversity of Pharbitis nil[J].J Am Chem Soc,1993,115(8):3125-3132.
[16]刘洪海,张晓丽,杜平,等.pH示差法测定烟73葡萄中花青素含量[J].中国调味品,2009,34(4):110-111.
[17]孙婧超,刘玉田,赵玉平,等.pH示差法测定蓝莓酒中花色苷条件的优化[J].中国酿造,2011(11):171-174.
[18]石岳,张秀玲,邹阳.pH示差法测定黑莓残渣中花青素含量的研究[J].中国食品工业,2007(12):56-57.
[19]王颖,潘哲超,李先平,等.不同肉色马铃薯花色苷含量及总抗氧化能力的分析研究[J].中国食物与营养,2017,23(2):66-69.
[20]张玥,龙君,文云,等.紫色马铃薯花色苷定量分析方法的比较[J].湖南农业科学,2012(9):25-28.