传统发酵蔬菜多是指将不同的蔬菜利用环境中的微生物及各种配料进行发酵处理,使之具有不同风味,并增强了保藏性的蔬菜制品,如四川泡菜[1]、榨菜[2]、东北酸菜[3]、发酵芥菜[4]、剁辣椒[5]等。晴隆酸菜是贵州省黔西南州的特色发酵蔬菜之一,主要以芥菜叶为原料,经自然发酵而成。其具有酸爽可口、回味悠长、柔韧适中等特点,深受食客的喜爱。目前,晴隆酸菜的生产工艺以工厂化生产及家庭作坊式生产两种方式为主,工厂化生产工艺与家庭作坊生产工艺的最主要区别是工厂化生产在腌制(发酵)初期进行了老酸汤或者菌剂的添加;而家庭作坊式生产仅依靠环境微生物进行自然发酵。
目前,关于酸菜中微生物群落的研究主要集中在乳酸菌多样性的分析,有文献报道[6-10],乳酸杆菌属(Lactobacillus)为酸菜的优势菌属。而关于晴隆酸菜中细菌多样性的研究尚少见报道。高通量测序技术广泛应用于传统发酵食品中微生物多样性分析[11-13]。关统伟等[14]通过高通量测序技术对郫县豆瓣全发酵过程中的细菌群落结构、丰度及演替规律进行了研究;刘大群等[15]利用高通量测序技术对不同盐量榨菜坯料中细菌群落多样性进行了分析。
本研究采用高通量测序技术分析工厂化和家庭作坊式两种不同工艺生产的晴隆酸菜中细菌的多样性,采用热图分析和主成分分析(principal component analysis,PCA)对不同晴隆酸菜酸菜样品间细菌群落结构相似性进行分析,最后对其优势细菌属进行分析,为晴隆酸菜风味研究以及安全性评价奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
晴隆酸菜:市售。包括工厂化生产酸菜样品分别编号为F1、F2,标记为A组;家庭作坊生产酸菜样品分别编号为S1、S2、S3,标记为B组。
1.1.2 试剂
E.Z.N.A.R Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:美国OMEGA公司;Qubit3.0DNA检测试剂盒:美国Life公司;Taq DNA聚合酶(1 000U):中国Vazyme公司;AgencourtAMPure XP:美国Beckman公司。
1.2 仪器与设备
Pico-21台式离心机:美国ThermoFisher公司;TND03-H-H混匀型干式恒温器:深圳拓能达科技有限公司;DYY-6C电泳仪:北京市六一仪器厂;T100TM Thermal Cyeler/1861096聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司。
1.3 方法
1.3.1 总DNA提取与检测
使用E.Z.N.A.R SoilDNA试剂盒提取晴隆酸菜样品的总DNA,采用琼脂糖凝胶电泳检测其完整性。
1.3.2 PCR扩增
利用Qubit3.0DNA检测试剂盒对总DNA精确定量后,以其为模板进行两轮PCR扩增。第一轮PCR扩增所用引物为V3-V4区通用引物(341 Primer F:5'-CCCTACACGACGCTCTTCCGATCTG-3';805 Primer R:5'-GACTGGAGTTCCTTGGCACCCGAGAATTCCA-3')[16]。第二轮PCR扩增所用引物为引入Illumina桥式PCR兼容引物(Primer F:5'-CCCTACACGACGCTCTTCCGATCTGCCTACGGGNGGCWGCAG-3;Primer R:5'-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC-3')。第一轮PCR扩增体系:2×Taq masterM ix15μL,341PrimerF(10μmol/L)1μL,805PrimerR(10μmol/L)1μL,基因组DNA 10~20ng,双蒸水(ddH2O)补充至30μL。PCR扩增条件:94℃、3min;94 ℃、3m in,45 ℃、20 s,65 ℃、30 s,共5个循环;94 ℃、20 s,55℃、20s,72℃、30s,共20个循环;72℃、5min。以第一轮PCR扩增产物为模板进行第二轮PCR扩增,PCR扩增体系同第一轮,PCR扩增条件:95℃、3m in;94℃、20s,55℃、20s,72℃、30 s,共5个循环;72℃、5min。采用AgencourtAMPureXP对PCR扩增产物纯化、回收。
1.3.3 测序
回收的PCR扩增产物由生工生物工程(上海)股份有限公司测序。测序平台为Illum inaM ieq,测序读长为双向300bp。
1.3.4 分析方法
高通量测序所得序列通过拼接、过滤、去除嵌合体,得到最终有效序列。利用QIIME划分操作分类单元(operational taxonomic unit,OUT),将相似度>97%的序列定义为一个OTU,每个OTU对应于一种代表序列。基于16SRNA基因数据库(RDP数据库、Silva数据库、NCBINT数据库)进行16S rRNA基因序列比对、分类学注释。
2 结果与分析
2.1 基于操作分类单元细菌Alpha多样性分析
通过拼接、过滤、去除嵌合体,得到最终有效序列。利用QIIME划分OUT,将相似度>97%的序列定义为一个OUT,并基于OTU对5种晴隆酸菜中细菌的Alpha多样性(Shannon指数、Chao1指数和Simpson指数)进行分析[17],具体结果见表1。
表1 晴隆酸菜中细菌Alpha多样性分析结果
Table 1 Analysis and results of bacterial Alpha diversity in Qinglong sauerkraut
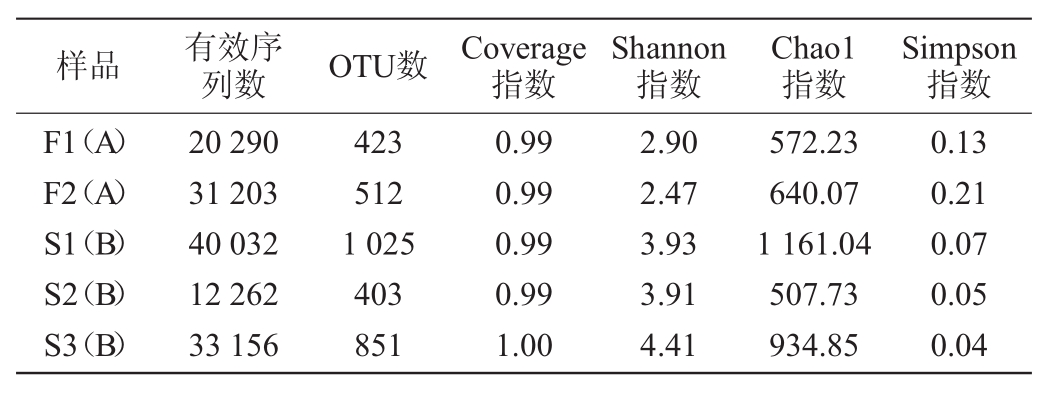
样品 有效序列数OTU数Coverage指数Shannon指数Chao1指数Simpson指数F1(A)F2(A)S1(B)S2(B)S3(B)20 290 31 203 40 032 12 262 33 156 423 512 1 025 403 851 0.99 0.99 0.99 0.99 1.00 2.90 2.47 3.93 3.91 4.41 572.23 640.07 1 161.04 507.73 934.85 0.13 0.21 0.07 0.05 0.04
由表1可知,通过高通量测序,从5种晴隆酸菜样本中共获得136 943条有效序列,3 214个OUT。所有样品的Coverage指数均>0.9,说明样品文库中序列的覆盖率高,可反应样品测序的真实情况。A组Shannon指数均低于B组,而Simpson指数均高于B组,说明家庭作坊生产酸菜细菌群落多样性普遍高于工厂化生产酸菜。A组Chao1指数较为相近,而B组Chao1指数相差较大,分析原因可能与B组中不同家庭作坊的生产环境变化较大有关。
2.2 基于门与属水平的细菌群落结构分析
通过高通量测序分析,从5种晴隆酸菜样品中共鉴定出细菌门19个,细菌属416个,结果如图1所示。由图1可知,样品F1中鉴定出8个门91个属,样品F2中鉴定出9个门121个属,样品S1中鉴定出18个门240个属,样品S2中鉴定出8个门167个属,样品S3中鉴定出15个门269个属,且A组(F1、F2)细菌的门与属明显低于B组(S1、S2、S3),说明工厂化生产晴隆酸菜中细菌种类在门水平及属水平上均明显低于家庭作坊生产晴隆酸菜中的细菌种类。
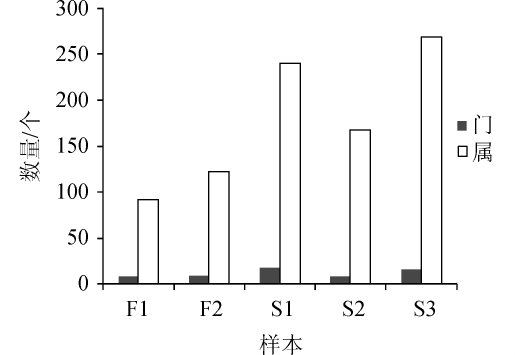
图1 样品中细菌的门与属数目
Fig.1 Phyla and genera num bers of bacteria in allsamples
韦恩图可以直观的体现样品中细菌组成的相似性和重叠情况,因此,对两组样品的细菌门、属数目进行韦恩图分析,结果如图2、图3所示。由图2可知,工厂化生产晴隆酸菜样品F1、F2共有细菌门为7个;家庭作坊式生产晴隆酸菜样品S1、S2、S3共有细菌门为7个。由图3可知,样品组内存在共有细菌属,其中样品F1、F2共有细菌属53个;样品S1、S2、S3共有细菌属96个。
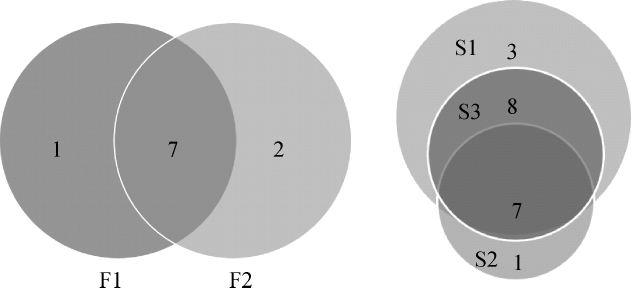
图2 工厂化(A)及家庭作坊式(B)生产酸菜细菌门数目韦恩图
Fig.2 Venn diagram of bacteria phyla numbers in sauerkraut produced by factory(A)and fam ily workshops(B)

图3 工厂化(A)及家庭作坊式(B)生产酸菜细菌属数目韦恩图
Fig.3 Venn diagram of bacteria genera numbers in sauerkraut produced by factory(A)and fam ily workshops(B)
2.3 基于属水平、OTU水平晴隆酸菜样品间细菌群落结构相似性分析
对5种晴隆酸菜样品中细菌相对丰度前20的细菌属进行热图-聚类分析,结果见图4。由图4可知,样品F1和F2各属颜色深浅较为接近且为同一聚类,说明工厂化生产的晴隆酸菜细菌群落中各属组成较为接近。而样品S1、S2和S3各属颜色深浅差距较大且不在同一聚类,说明家庭作坊生产的晴隆酸菜细菌群落组成差异较大。
基于OTU水平,采用PCA对5种晴隆酸菜样品中细菌群落结构的相似性进行分析,结果见图5。由图5可知,PC1、PC2、PC3分别解释了样品中细菌OUT的58%、23%、11%的信息,累计贡献率为99%。基于这3个主成分,样品F1和F2距离较近,说明F1和F2样品中细菌群落结构相似性较高,即两种工厂化生产酸菜的细菌群落构成较为相似。A组(F1、F2)和B组(S1、S2、S3)存在一定距离,说明两组样品细菌群落结构相似性有一定差异,即工厂化生产晴隆酸菜的细菌群落构成与家庭作坊生产晴隆酸菜区别较大。细菌群落的PCA结果与细菌相对丰度热图分析结果较为一致。

图4 5种晴隆酸菜样品细菌相对丰度热图
Fig.4 Heatmap of bacterial relative abundance of 5 Qinglong sauerkraut samples
热图中颜色代表物种丰度;纵向表示不同物种在各样品间丰度的相似情况,两物种间距离越近,枝长越短,说明两个物种在各样品间的丰度越相似;横向表示不同样品的各物种丰度的相似情况,两样品间距离越近,枝长越短,说明这两个样品的各物种丰度越相似。
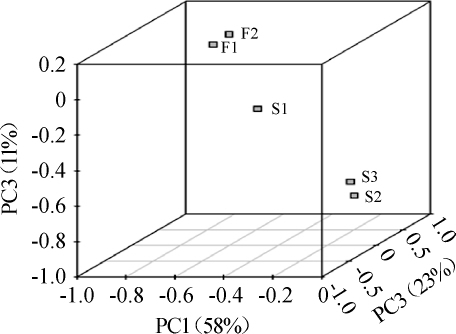
图5 5种晴隆酸菜样品中细菌群落主成分分析
Fig.5 Principal component analysis of bacterial community in 5 Qinglong sauerkraut samples
2.4 基于属水平优势菌株的分析
在属水平上对两种类型晴隆酸菜中的细菌进行分类,统计它们的相对丰度。根据相对丰度≥5.0%确定为晴隆酸菜中的优势细菌,结果如表2所示。
表2 5种晴隆酸菜样品中优势细菌及相对丰度
Table 2 Dom inantbacteria and relative abundance of 5 Qinglong sauerkraut samples

样品 优势细菌(相对丰度/%)F1(A)F2(A)S1(B)S2(B)S3(B)Lactococcus(26.33%)、Bacillus(25%)、Lactobacillus(12.55%)、Oceanobacillus(8.33%)Lactococcus(16.67%)、Bacillus(19.36%)、Lactobacillu s(47.94%)、Oceanobacillus(5.69%)Lactococcus(16.79%)、Bacillus(21.7%)、Lactobacillus(5.76%)、Oceanobacillus(6.51%)、Corynebacterium(7.54%)、Psychrobacter(5.32%)Lactobacillus(8.03%)、Halomonas(11.91%)、Vibrio(24.62%)、Pseudoalteromonas(7.25%)Lactobacillus(5.16%)、Corynebacterium(20.14%)、Psychrobacter(9.56%)、Halomonas(5.53%)
由表2可知,在两种工厂化生产的晴隆酸菜中,优势细菌属的种类相同,分别为乳酸球菌属(Lactococcus)、芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)、大洋杆菌属(Oceanobacillus)。但不同细菌属的相对丰度不同,其中样品F1中Lactococcus相对丰度最高,为26.33%,而样品F2中Lactobacillus相对丰度最高,为47.94%,均为常见乳酸菌属。在工厂化生产的晴隆酸菜中的4种优势细菌属中,Lactococcus[18-20]、Bacillus[21-22]、Lactobacillus[23-24]均属于发酵食品常见菌,而Oceanobacillus在食品研究中较少[25]。
3种家庭作坊生产的晴隆酸菜样品中,优势细菌属各有差异,但均含有Lactobacillus,相对丰度分别为5.76%、8.03%、5.16%。在家庭作坊生产的晴隆酸菜优势细菌属中,弧菌属(Vibrio)和棒状杆菌属(Corynebacterium)中存在致病微生物。因此,对于可直接食用的酸菜来说,仍存在较大的食品安全隐患。
3 结论
采用高通量测序技术对两种不同工艺生产的晴隆酸菜样品中的细菌多样性进行分析,结果表明,细菌多样性方面,5个酸菜样品中共鉴定出19门,416属。样品F1中8门91属,F2中9门121属,共有门为7个,共有属为53个;样品S1中18门240属,S2中8门167属,S3中15门269属,共有门为7个,共有属为96个;家庭作坊生产的酸菜的细菌多样性较工厂化生产的酸菜高;工厂化生产的酸菜细菌群落组成较相近。优势细菌属方面,工厂化生产的酸菜优势细菌属相同,均为乳酸球菌属(Lactococcus)、芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)、大洋杆菌属(Oceanobacillus)。而家庭作坊生产的酸菜优势细菌属各有差异,但均含有Lactobacillus,优势细菌属中的弧菌属(Vibrio)和棒状杆菌属(Corynebacterium)中存在致病微生物。
[1]赵楠.四川泡菜的主要特性及其成因分析[D].无锡:江南大学,2017.
[2]朱莉莉,罗惠波,黄治国,等.大头菜等蔬菜腌制工艺研究现状与展望[J].中国酿造,2018,37(7):11-16.
[3]许蓉,孙健,高冬妮,等.东北酸菜发酵过程菌群变化偶联酸菜品质的初步探究[J].中国农学通报,2018,34(33):152-159.
[4]侯爱香,王一淇,黄晴,等.自然发酵与人工接种发酵湖南芥菜的挥发性风味组分和品质分析[J].食品科学,2018,39(6):237-245.
[5]胡博涵,吴晖,赖富饶,等.农家风味剁辣椒发酵工艺的优化[J].湖南农业大学学报(自然科学版),2014,40(1):108-112.
[6]苗乘源.东北传统蔬菜发酵食品的微生物及品质分析[D].延吉:延边大学,2018.
[7]赵勇.我国民间几种典型传统手工发酵食品中乳酸菌多样性研究[C]//第十二届益生菌与健康国际研讨会摘要集.北京:中国食品科学技术学会,2017:1.
[8]张颖,孙慧君,姜静,等.酸菜中细菌群落结构多样性分析[J].食品科技,2017,42(1):34-39.
[9]张璐璐.我国传统手工发酵酸菜和酸奶样品中乳酸菌的多样性分析及分离鉴定[D].上海:上海海洋大学,2016.
[10]武俊瑞.东北传统发酵特色食品中主要微生物多样性研究[D].沈阳:沈阳农业大学,2013.
[11]孙炜宁.基于高通量测序的泸酒酒醅和酸菜中细菌区系的研究[D].天津:天津大学,2017.
[12]LIJ,HUW,HUANG X,etal.Investigation of yeastpopulation diversity and dynamics in spontaneous fermentation of Vidal blanc icewine by traditional culture-dependent and high-throughput sequencing methods[J].Food Res Inte,2018,112:66-77.
[13]MENDOZA LM,NEEFA,VIGNOLO G,etal.Yeast diversity during the fermentation of Andean chicha:A comparison of high-throughput sequencing and culture-dependent approaches[J].Food M icrobiol,2017,67:1-10.
[14]关统伟,向慧平,王鹏昊,等.基于高通量测序的郫县豆瓣不同发酵期细菌群落结构及其动态演替[J].食品科学,2018,39(4):106-111.
[15]刘大群,张程程,童川.基于高通量测序分析不同盐量榨菜坯料中细菌群落多样性[J].中国食品学报,2017,17(12):215-224.
[16]YANG C,LIY,ZHOU B,et al.Illumina sequencing-based analysis of free-living bacterial community dynamics during an Akashiwo sanguine bloom in Xiamen sea,China[J].Sci Rep,2015,5(5):1-11.
[17]刘波,王阶平,陈倩倩,等.养猪发酵床微生物宏基因组基本分析方法[J].福建农业学报,2016,31(6):630-648.
[18]何捷,曾小群,吕鸣春,等.新疆酸奶中高产蛋白酶与产脂肪酶乳酸菌的筛选[J].食品科学,2015,36(17):130-133.
[19]邵建宁,张文齐,麻和平,等.甘肃牧区传统发酵乳制品中优良乳酸菌的分离筛选[J].中国酿造,2017,36(3):75-79.
[20]王一淇,李宗军.湖南芥菜腌制发酵过程中的菌相变化规律[J].食品科学,2014,35(11):200-203.
[21]张楠楠.产脂肽枯草芽孢杆菌的发酵优化以及在面包中的应用[D].无锡:江南大学,2017.
[22]杨培周,朱星星,操丽丽,等.传统发酵食品臭鳜鱼中分离的苏云金芽孢杆菌(Bacillus thuringiensis29.118)的毒理学评价[J].食品科学,2019,40(3):186-193.
[23]赵山山,杨晓艳,杜秋玲,等.江西酸芋荷中乳酸菌的分离鉴定及在泡菜发酵中的应用[J].中国酿造,2018,37(10):36-42.
[24]贺云.豆腐酸浆中乳酸菌的分离鉴定及其在酸浆豆腐中的应用[D].无锡:江南大学,2018.
[25]马含笑.真空包装熟肉制品中兼性厌氧污染微生物生物防腐技术的研究[D].石河子:石河子大学,2011.