α-半乳糖苷酶(EC 3.2.1.12)能够将α-半乳寡糖、半乳甘露聚糖侧链、半乳糖脂和糖蛋白通过α-半乳糖苷键连接的非还原端的半乳糖苷残基逐个水解,释放出半乳糖[1-2]。该酶在食品、饲料等工业中有着广泛的应用[1]。在制糖工业中,α-半乳糖苷酶可以分解甜菜浆中的棉籽糖来提高蔗糖的回收率[3]。在饲料工业中,α-半乳糖苷酶可以分解饲料中的棉籽糖家族寡糖类抗营养物质,减少其在单胃动物饲喂中引起的腹胀和腹泻问题,同时又能提高饲料的利用率[2,4-8]。在造纸工业中,α-半乳糖苷酶还可以用来提高甘露聚糖酶对纸浆的漂白效果[3,9-10]。
α-半乳糖苷酶属于糖苷水解酶(glycosidehydrolase,GH),根据其氨基酸序列的同源性,将其归入GH 4、GH 27、GH 36、GH 57、GH 97和GH 110家族,其中以GH 27和GH 36家族成员最多。α-半乳糖苷酶在动植物和微生物中广泛存在[2,11-16],由于α-半乳糖苷酶的微生物来源最为广泛,易于基因工程操作,且大规模生产成本较低,所以得到了更广泛的关注[2]。细菌来源的α-半乳糖苷酶大部分归属于GH 36家族,能够水解分子质量较小的底物(包括人工合成的对硝基苯基底物和棉籽糖家族寡糖等),最适温度35℃~90℃各不相同,最适pH值一般在5.5~6.5[17-20],而真菌来源的α-半乳糖苷酶的最适温度一般在50~75℃,pH值一般在4.0~5.5[3,21-23]。目前,α-半乳糖苷酶性质研究的主要手段是以其基因为出发点,选择合适的表达系统,进行酶的异源表达,从而高效、明确地了解α-半乳糖苷酶的分子基础及酶学性质,为后续通过基因工程、蛋白质工程等技术手段对其进行修饰改性,开发其工业化应用价值,以及相关酶系的生物信息学等研究提供理论支持。并且通过异源表达的酶易于特异性纯化,避免了从原生菌株中直接分离纯化蛋白的复杂操作。微生物α-半乳糖苷酶异源表达系统一般选用的表达宿主包括大肠埃希菌(Escherichia coli)[22]、巴斯德毕赤酵母(Pichiapastoris)[3]以及丝状真菌如里氏木霉(Trichoderma reesei)等[24],最高酶活可达1 900U/m L[3]。
本实验室保存的一株链球菌(Streptococcus)S1在含有5-溴-4-氯-3-吲哚基-a-D-吡喃半乳糖苷(5-bromo-4-chloro-3-indolyl-a-D-galactopyranoside,X-α-gal)的培养平皿上呈现出明显的蓝色,说明其具有α-半乳糖苷酶活性。以该菌株含有的α-半乳糖苷酶基因为目的基因,在大肠杆菌(Escherichia coli)中进行异源表达与重组酶的纯化,并对其酶学性质进行了研究,为寻找更多不同性质的α-半乳糖苷酶以适应不同的需求奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
链球菌(Streptococcus)S1:本实验室分离保存;E.coli Top10感受态细胞、E.coli BL21(DE3)感受态细胞:全式金生物技术有限公司。
实验室改造质粒pET-M-3C:通过XbaⅠ和BamHⅠ双酶切,并经T4 DNA连接酶连接成新片段的方法去除质粒pET-32a的S-tag和Trx-tag,并将其thrombin(凝血酶)酶切位点替换为3C酶切位点(L-G-V-L-F-G-P)。
1.1.2 化学试剂
蛋白胨、酵母粉(均为生化试剂):北京奥博星生物技术有限责任公司;NaCl(分析纯):天津市恒兴化学制造有限公司;镍-琼脂糖凝胶、Tris饱和酚:北京索莱宝科技有限公司;对硝基苯(p-nitrophenyl,pNP)(分析纯)、对硝基苯-α-D-半乳糖苷(p-nitrophenyl-α-D-galactoside,pNPG)(纯度98%)、水苏糖(纯度98%):上海阿拉丁生化科技股份有限公司;蜜二糖(纯度99%)、棉籽糖(纯度99%):上海麦克林生化科技有限公司;冰醋酸(分析纯)、正丁醇(分析纯):国药集团化学试剂有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)限制性内切酶BamHⅠ和XhoⅠ:美国赛默飞世尔科技公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度定量试剂盒:北京市普利莱基因技术有限公司;氯仿、异戊醇(均为分析纯):天津市瑞金特化学品有限公司;细菌基因组提取试剂盒、质粒提取试剂盒:美国OMEGA BIO-TEK公司;2Es Taq MasterM ix(Dye)试剂:北京康维世纪生物科技有限公司。
1.1.3 培养基
MRS肉汤培养基:北京索莱宝科技有限公司。
LB培养基:蛋白胨10 g/L;酵母粉5 g/L;NaCl5 g/L,调pH值至7.4,用去离子水定容至1 000m L,121℃条件下灭菌20min。降至室温加入氨苄青霉素,质量浓度为100μg/m L。
1.2 仪器与设备
HYG-A恒温摇床:太仓市豪成实验仪器制造公司;MULTIFUGEX1R台式离心机、3001全波长酶标仪:美国赛默飞世尔科技公司;Hema L1低温连接仪:珠海黑马医学仪器有限公司;Biometra TProfessional聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐公司;M ini PROTEAN 3Cell垂直电泳仪、DYCP-31D水平DNA电泳仪:北京六一仪器厂。
1.3 方法
1.3.1 目的基因提取
(1)引物设计
利用细菌基因组提取试剂盒提取链球菌S1的基因组DNA,以提取的基因组DNA为模板,以通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')为引物,用2Es Taq MasterM ix(Dye)试剂进行PCR扩增(95℃预变性5min;95℃变性30s,54℃退火30 s,72℃延伸2m in,共30个循环;72℃再延伸5m in;16℃保温)获得16S rDNA,送测序公司测序,测序结果在https://blast.ncbi.nlm.nih.gov/Blast.cgi网站与数据库中的已有菌株的16S rDNA进行比较,鉴定菌种。根据鉴定结果,在美国国家生物技术信息中心(national centerofbiotechnology information,NCBI)数据库中找亲缘关系较近菌种中的α-半乳糖苷酶基因序列,利用软件Primer Premier5设计引物。
(2)目的基因扩增
以提取的链球菌S1基因组DNA为模板,以Sagal-F(5'-AGGGATCCATGGGA ATTCGCATCGAAGG-3')和Sagal-R(5'-AAACTCGAGTTATTGTTTCACGAAATAG-3')为引物,用2Es Taq MasterM ix(Dye)试剂进行PCR扩增(95℃预变性5min;95℃变性30 s,54℃退火30 s,72℃延伸2m in,共30个循环;72℃再延伸5min;16℃保温),获得目的基因片段。
1.3.2 基因克隆与载体构建
用BamHⅠ和XhoⅠ限制性核酶内切酶分别酶切目的基因片段和载体pET-M-3C,抽提沉淀后用T4DNA连接酶连接,然后转化到E.coli Top10感受态细胞中,涂布在加有100μg/m L氨苄青霉素的LB平板上,37℃培养16 h后,挑取单克隆,以Sagal-F和Sagal-R为引物进行菌落PCR筛选阳性克隆,挑取阳性克隆接种至含有100μg/m L氨苄青霉素的LB液体培养基中37℃振荡培养16 h后用质粒提取试剂盒提取质粒pET-M-C-Sagal,送测序公司测序。
1.3.3 蛋白表达与纯化
按E.coli BL21(DE3)感受态细胞转化操作说明书,将质粒pET-M-3C-Sagal转化到E.coli BL21感受态细胞中,涂布在加有100μg/mL氨苄青霉素的LB平板上,37℃培养16h后,挑取单克隆接种于5m L LB(含100μg/mL氨苄青霉素)液体培养基中,37℃、180 r/min培养6 h后转接入200m L LB(含100μg/m L氨苄青霉素)液体培养基中,37℃、180 r/min培养至OD600 nm值达到0.6左右,加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度0.3mmol/L,16℃、180 r/min培养16 h。5000 r/min离心15min,收集细胞,用结合缓冲液(20mmol/L pH 7.9 Tris-HCl;150mmol/LNaCl;10mmol/L咪唑)重悬细胞,超声破碎(200W、15min)后15 000 r/min离心30min,收集上清液,0.2μm滤膜过滤后,将上清液加入到结合缓冲液平衡过的镍柱中(填充物为镍-琼脂糖凝胶)结合10min后,放掉上清,再用结合缓冲液漂洗柱子3次,之后用洗脱缓冲液(20mmol/L pH 7.9 Tris-HCl;150mmol/LNaCl;300mmol/L咪唑)洗脱,收集洗脱液,采用BCA法测定蛋白含量,每一步采集样品用于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测。
1.3.4 pNPG法检测α-半乳糖苷酶活性
α-半乳糖苷酶酶活测定方法参照文献[3]进行了部分修改,在相应的反应温度预热2min后,取100μL待测酶液和100μL的pNPG溶液(10mmol/L)混合,相应温度下反应10min,加入800 μL 0.5mol/L的Na2CO3溶液终止反应,混匀后取200μL加入到96孔板中,用酶标仪测波长405 nm处吸光度值,代入预先用对硝基苯(pNP)测定的标准曲线回归方程,得出α-半乳糖苷酶的活力值。α-半乳糖苷酶酶活定义:一定条件下,每分钟水解pNPG产生1μmol的pNP所需的酶量定义为1个α-半乳糖苷酶酶活单位(U)。
1.3.5 α-半乳糖苷酶酶学性质
(1)最适pH值及pH值耐受性的确定
取不同pH的缓冲液(醋酸钠缓冲液(pH 3.5~6.0)、磷酸钠缓冲液(pH 6.5~7.50)、Tris-HCl缓冲液(pH 8.0~9.0)、甘氨酸-NaOH缓冲液(pH 9.5~10.5)),在37℃条件下依照1.3.4的方法测定不同pH条件下(终浓度25mmol/L,pH值分别为3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5)α-半乳糖苷酶(0.18 μg/m L)催化反应的酶活,确定其最适pH值。用不同的缓冲液(终浓度50mmol/L,pH值分别为3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5)在冰上预处理α-半乳糖苷酶1h后测定α-半乳糖苷酶的残余酶活,确定其耐受pH范围以最高酶活为100%计算相对酶活。
(2)最适温度及温度耐受性的确定
pH 6.5条件下测定α-半乳糖苷酶在35~60℃温度范围内的酶活,确定其最适反应温度。在0~60℃的温度范围内预处理α-半乳糖苷酶1 h后测定其残余酶活来确定其耐受温度范围以最高酶活为100%计算相对酶活。
(3)α-半乳糖苷酶反应动力学
测定α-半乳糖苷酶催化不同浓度pNPG底物浓度([S]=0.125mmol/L、0.250mmol/L、0.500mmol/L、1.250mmol/L、2.500mmol/L、5.000mmol/L)的水解速率V,以1/[S](X)为横坐标,以1/V(Y)为纵坐标制作林-贝氏方程曲线(Y=K m/V max·X+1/V max),确定α-半乳糖苷酶的酶动力学数据(包括米氏常数K m和最大催化速率V max)。
1.3.6 α-半乳糖苷酶对蜜二糖、棉籽糖和水苏糖的水解活性
分别配制含有蜜二糖、棉籽糖和水苏糖的反应体系,反应体系中含有4mg/m L的糖、10U/m L的重组α-半乳糖苷酶和50mmol/L的pH 6.5的磷酸钠缓冲液,40℃反应,不同时间点(0、5min、15min、30min、1 h)取样,取出样品立即煮沸失活。参照文献中的薄层层析(thin-layer chromatography,TLC)方法[3],用层析液(丙醇∶醋酸∶水=1∶1.5∶0.1,V/V)在硅胶层析板上展开样品(层析两次),喷洒显色液(甲醇∶浓硫酸=95∶5,V/V)后,将层析板置于105 ℃烘箱加热显色,根据迁移条带观察各寡糖水解情况。
1.3.7 数据处理
使用软件MEGA6基于16SrDNA序列构建系统进化树,使用Excel软件分析α-半乳糖苷酶酶活数据并制作图表。
2 结果与分析
2.1 链球菌α-半乳糖苷酶基因Sagal的获取
采用加X-α-gal的MRS肉汤培养基培养链球菌S1,菌落显示蓝色,证明链球菌S1具有α-半乳糖苷酶活性。采用软件Mega7.0构建该菌株的系统发育树,结果见图1。由图1可知,在链球菌范围内基于16SrDNA对菌株S1进行相似性比对,菌株S1与巴黎链球菌(Streptococcus lutetiensis)相似性为100%。因此,链球菌S1被鉴定为巴黎链球菌(Streptococcus lutetiensis)。
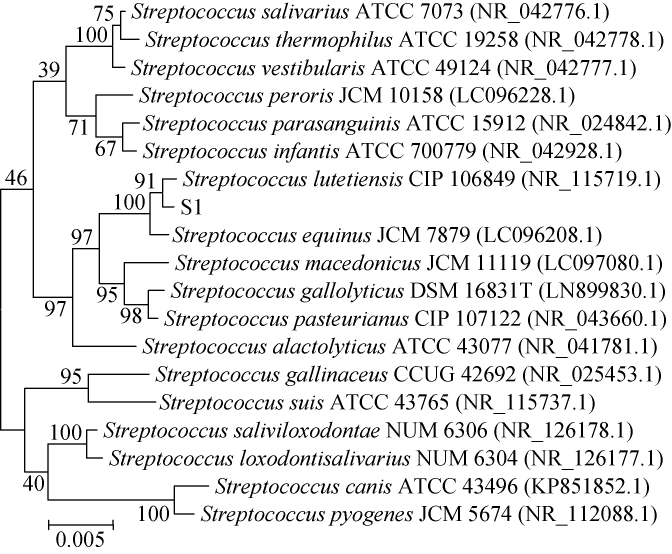
图1 菌株S1基于16S rDNA序列构建的系统进化树
Fig.1 Phylogenetic tree of strain S1 based on 16S rDNA sequences
以与链球菌S1菌株亲缘关系较近的Streptococcusequinus的α-半乳糖苷酶基因(GenBank:LPVR01000005.1)为模板设计引物Sagal-F(5'-AGGGATCCATGGGA ATTCGCATC-GAAGG-3')和Sagal-R(5'-AAACTCGAGTTATTGTTTCACGAAATAG-3'),对链球菌菌株S1的基因组进行PCR扩增,获得了2 200 bp左右大小的DNA片段,如图2A所示,成功将其构建到载体pET-M-3C中。经酶切验证结果如图2B所示,经测序获得了该基因片段的DNA序列,如图3A所示,命名该基因为Sagal。将此链球菌S1基因序列与Streptococcus equinus的α-半乳糖苷酶基因(GenBank:LPVR01000005.1)进行相似性比对,显示有96%的同源性,氨基酸序列比对结果如图3B所示,鉴定此序列为一段来自链球菌S1的α-半乳糖苷酶基因(分子质量:80.4 kDa,等电点:pH 5.25)。
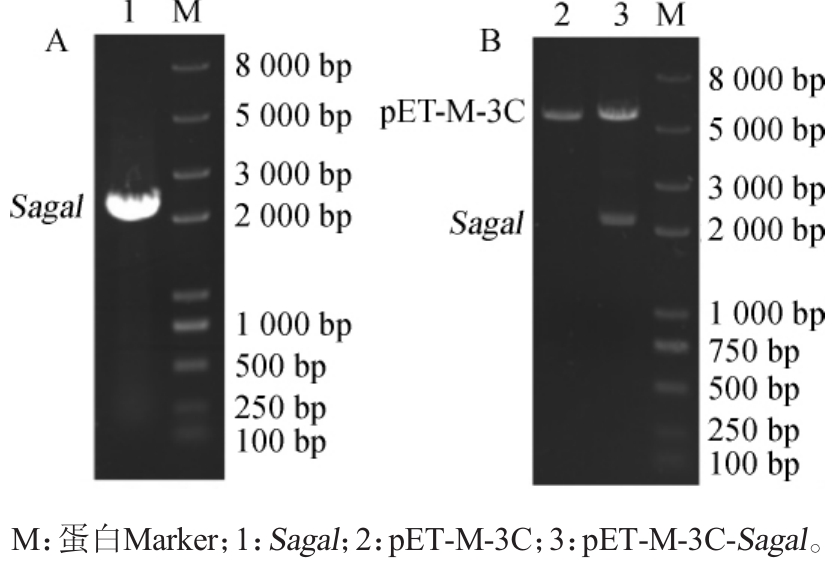
图2 α-半乳糖苷酶基因PCR扩增产物(A)和质粒酶切产物(B)琼脂糖凝胶电泳检测结果
Fig.2 Agarose gelelectrophoresis determ ination results of PCR product ofα-galactosidase(A)and plasm id enzyme cutting products(B)


图3 Sagal基因序列(A)及其蛋白与马链球菌的α-半乳糖苷酶氨基酸序列比对图(B)
Fig.3 Sagal DNA sequence(A)and am ino acid sequence comparison of its protein withα-galactosidase from Streptococcus equinus(B)
2.2 链球菌S1α-半乳糖苷酶的表达纯化
携带质粒pET-M-3C-Sagal的重组大肠杆菌BL21(DE3)经0.3mmol/L的IPTG诱导表达,经镍柱纯化的重组链球菌S1α-半乳糖苷酶的SDS-PAGE电泳结果如图4所示,可以看到Sagal在大肠杆菌中能够可溶性大量表达,重组蛋白能够结合镍柱,一步纯化后能够得到纯度较高的重组α-半乳糖苷酶,重组α-半乳糖苷酶含量>100mg/L菌液。
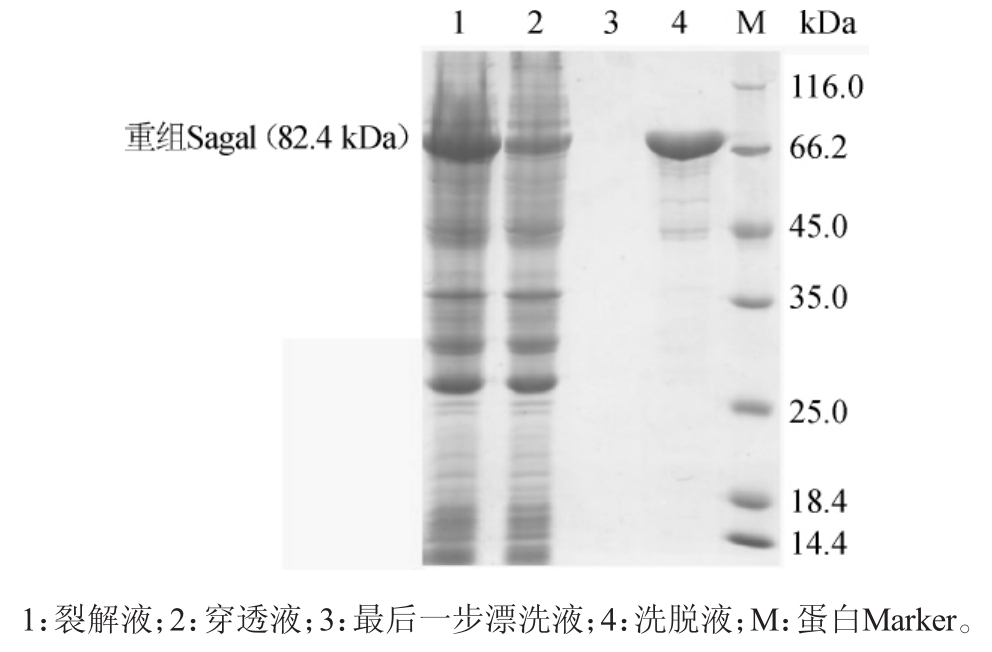
图4 α-半乳糖苷酶纯化结果
Fig.4 Results of purification ofα-galactosidase
2.3 链球菌S1α-半乳糖苷酶最适pH值及pH稳定性
重组链球菌S1α-半乳糖苷酶在不同pH值条件下测定酶活,结果见图5。由图5A可知,37℃条件下,Sagal在pH 5.0~7.0范围内具有80%以上的活性,pH为8.0时酶活迅速显著降低至20%以下;在pH 6.5显示最大酶活,因此该重组酶最适pH值为6.5,是一种酸性α-半乳糖苷酶。由图5B可知,重组链球菌S1α-半乳糖苷酶在pH 7.5~10.5的条件下均比较稳定,1 h内仍能保留89%以上的活性。
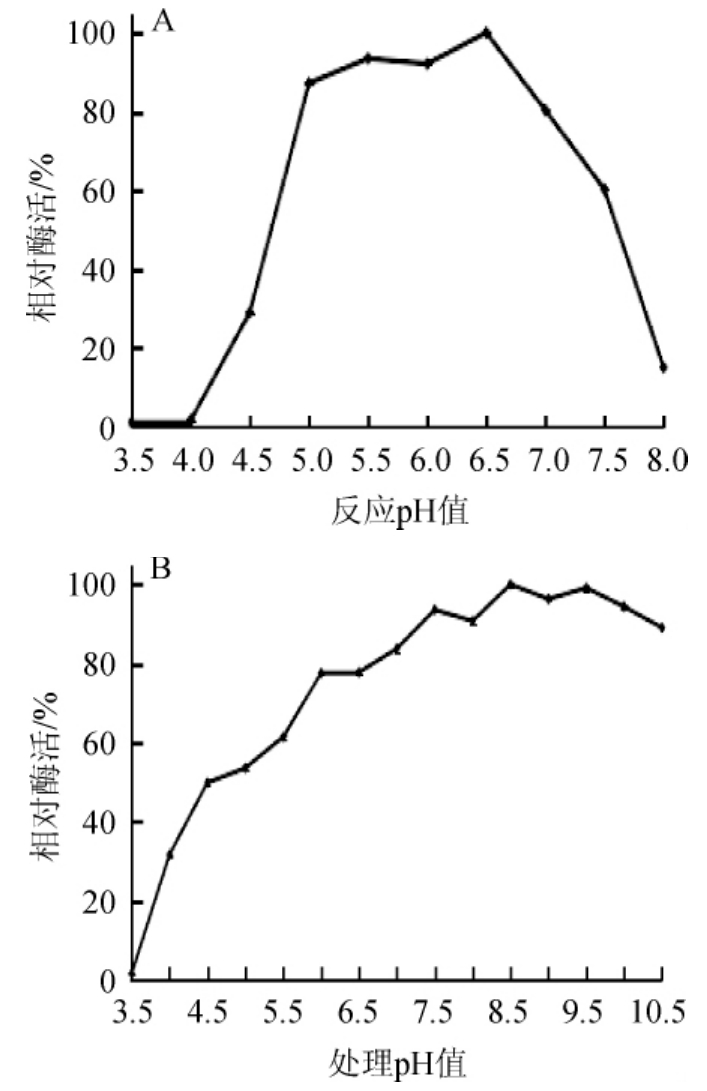
图5 α-半乳糖苷酶的最适pH值(A)及pH稳定性(B)
Fig.5 OptimalpH value(A)and pH stability(B)ofα-galactosidase
2.4 链球菌S1α-半乳糖苷酶最适温度及温度稳定性
重组链球菌S1α-半乳糖苷酶在35~60℃反应测定酶活,结果见图6。由图6A可知,在40~55℃的温度范围内具有80%以上的活性,并且温度为50℃时,α-半乳糖苷酶活性最高。因此,最适反应温度为50℃。由图6B可知,α-半乳糖苷酶活性在≤40℃条件下处理1h比较稳定(酶活均能保持在95%以上),在45℃处理1 h后其酶活仅保留20%以下,说明该α-半乳糖苷酶在45℃以上的高温环境中稳定性较差,适宜保存在40℃以下的环境中。
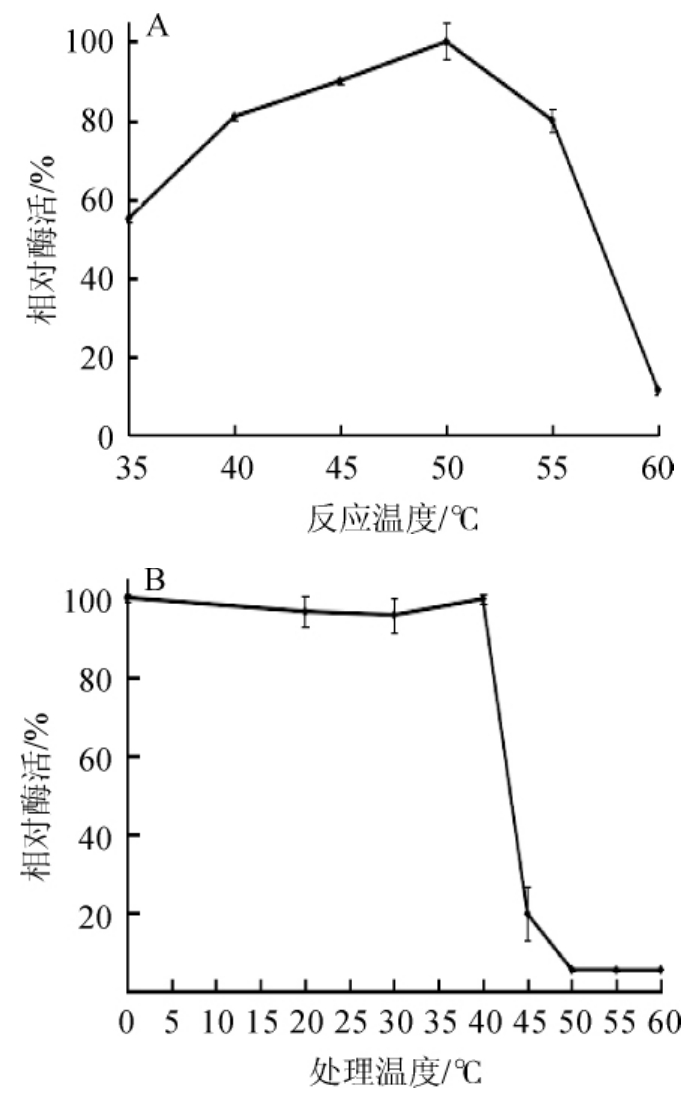
图6 α-半乳糖苷酶的最适温度(A)及温度稳定性(B)
Fig.6 Optimal temperature(A)and temperature stability(B)of α-galactosidase
2.5 链球菌S1α-半乳糖苷酶对几种天然底物降解能力检测
由于链球菌S1α-半乳糖苷酶在40℃以上温度条件下不稳定,所以为了兼顾酶的稳定性与较高的活性,选取在40℃条件下分别以蜜二糖、棉籽糖和水苏糖作为α-半乳糖苷酶的底物进行反应,反应过程中不同时间点取样,样品立即在100℃加热失活,薄层层析法检测α-半乳糖苷酶对以上3种含有α-半乳糖苷键的寡糖的水解活性,结果见图7。
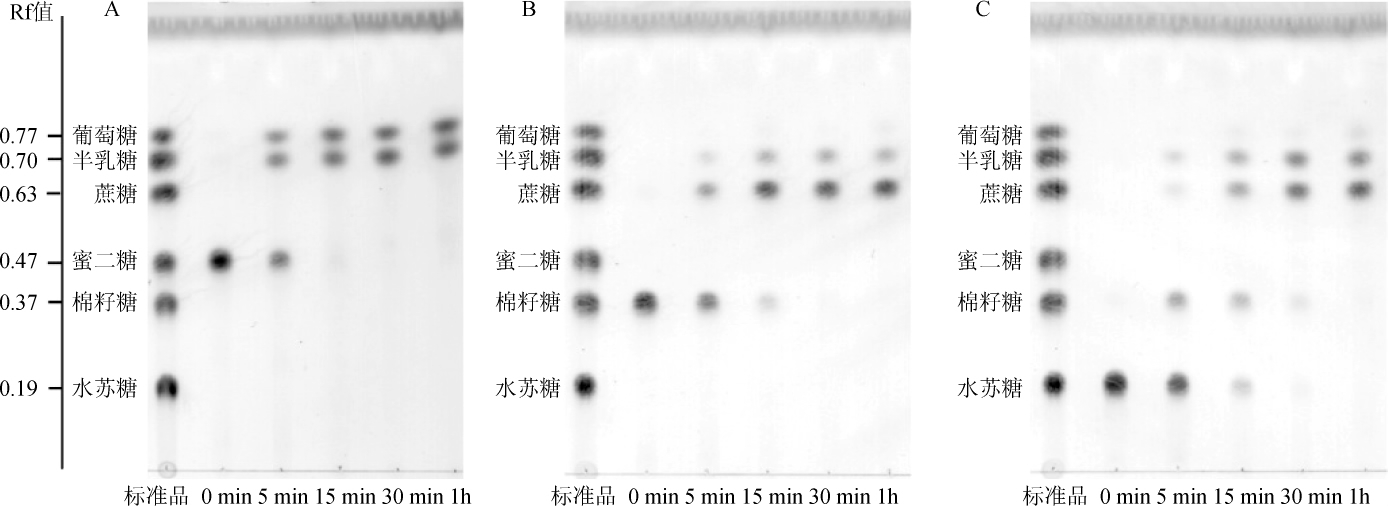
图7 薄层色谱检测α-半乳糖苷酶水解蜜二糖(A)、棉籽糖(B)和水苏糖(C)的效果
Fig.7 Determ ination of hydrolysis effect ofα-galactosidase on melibiose(A),raffinose(B)and stachyose(C)by thin layer chromatography
由图7可知,随着水解时间的增加α-半乳糖酶可逐渐水解蜜二糖(图7A,水解为葡萄糖和半乳糖)、棉籽糖(图7B,水解为蔗糖和半乳糖)和水苏糖(图7C,先水解为棉籽糖和半乳糖,后棉籽糖被进一步水解为蔗糖和半乳糖),1 h内所有底物中的α-半乳糖苷键基本全部水解,说明该酶可以有效地水解这些α-半乳寡糖,具有应用于食品和饲料等工业中来避免这些α-半乳寡糖所带来的干扰的价值。
2.6 链球菌S1α-半乳糖苷酶酶学性质比较
本文研究了链球菌来源的α-半乳糖苷酶的酶活性质,其最适pH值为6.5,最适温度为50℃,且具有较高比酶活,K m也较低,k cat/K m可达567.77 L/(mmol·s)。表1列出了一些来源于真菌和细菌的α-半乳糖苷酶的酶活性质,由表1可以看出,这些α-半乳糖苷酶各有特点,链球菌S1α-半乳糖苷酶也具有一些自身的特性,在细菌来源的α-半乳糖苷酶中,其催化效率相对较高,而相对于真菌α-半乳糖苷酶,其最适温度较低,最适pH接近于中性,这些α-半乳糖苷酶相互补充可以适用于不同的需求,结合开发使用这些α-半乳糖苷酶可以更加有效地服务于生产实际需要。
表1 Sagal与一些其他的α-半乳糖苷酶酶学性质比较
Table 1 Comparison of enzymatic property of Sagalwith otherα-galactosidases

种属 最适/耐受温度 最适/耐受pH值 K m/(mmol·L-1)V Max/(μmol·min-1·mg-1)k cat/(S-1)k cat/K m/[L·(mmol·s)-1]参考文献Streptococcusspecies Talaromyces leycettanus Neosartoryafischeri Neosartoryafischeri Thermomyces lanuginosus Penicillium canescens Bispora species Debaryomyceshansenii Rhizomucorm iehei Rhizomucorm iehei Brachybacterium species Bifidibacterium longum A lkalibacterium species Bacillusmegaterium Bifidibacterium breve 50 ℃/40 ℃(1 h)70 ℃/65 ℃(1 h)60 ℃/60 ℃(10m in)75 ℃/70 ℃(1 h)65~70 ℃/60 ℃(6 h)55 ℃/50 ℃(3 h)55 ℃/65 ℃(30min)55 ℃/40 ℃(1 h)55 ℃/55 ℃(30min)45 ℃/60 ℃(30min)40℃/40 ℃(5m in)42 ℃/40 ℃(2.5 h)55 ℃/55 ℃(1 h)37 ℃/40 ℃(2 h)45 ℃/50 ℃(30min)pH 6.5/pH 7.5~10.0 pH 4.0/pH 3.0~11.0 pH 4.5/pH 2.0~12.0 pH 4.0/pH 3.0~11.0 pH 4.5~5.0/pH 3.0~7.5 pH 4.0~5.0/pH 3.0~6.0 pH 3.5/pH 2.0~8.0 pH 5.0/pH 4.6~6.2 pH 5.5/pH 5.5~9.5 pH 4.5/pH 4.5~10.0 pH 6.0/pH 5.0~10.0 pH 5.0/pH 5.0~6.0 pH 5.5/pH 5.0~10.0 pH 6.8/pH 7.0~8.0 pH 4.0/pH 4.0~6.0 1.20 1.32 0.80 2.84 0.50 0.48 3.10 0.32 0.22 0.36-2.64 0.09 1.43 508.38 389.80 449.50 1 850.00 52.40 6.89 612.90 3.60 505.50 378.90-49.60 454.55 303.03 35.71 681.32 341.00 368.6 1621 49.80 7.00 470.90 3.29-6.32-347.73 567.77 258.40 460.80 570.80 99.60 14.60 651.90 10.28-17.50-本研究[23][21][25][26][27][28][29][3][22][17][30][31][32][33]
2.7 链球菌S1α-半乳糖苷酶反应动力学
重组链球菌S1α-半乳糖苷酶林-贝氏方程曲线如图8所示。由图8可知,测得米氏常数K m为1.20mmol/L,最大反应速率V max为508.38μmol/(min·mg),催化常数k cat为681.32S-1。
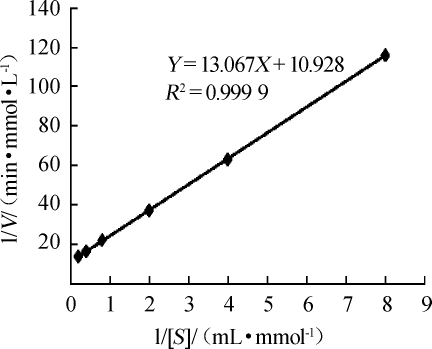
图8 α-半乳糖苷酶的林-贝氏方程曲线
Fig.8 Lineweaver-Burk equation curve ofα-galactosidase
3 结论
以本实验室从牛胃溶物中分离保存的一株链球菌S1为研究对象,基于16SrDNA的遗传信息获得了该菌株α-半乳糖苷酶基因序列,并在大肠杆菌中成功异源表达。通过镍枉纯化了该α-半乳糖苷酶,每升菌液可获得100mg以上的重组α-半乳糖苷酶,其酶活显著高于原始菌株。重组α-半乳糖苷酶的最适反应pH值为6.5,最适反应温度为50℃,在碱性环境中(pH 7.5~10.5)及在40℃以下温度条件下较为稳定,该酶可以有效地水解pNPG,K m为1.20mmol/L,最大反应速率V max可达到508.38μmol/(min·mg),催化常数k cat为681.32 S-1,还可以有效地水解天然底物蜜二糖、棉籽糖和水苏糖中的α-半乳糖苷键,是酶学性质优良的α-半乳糖苷酶。
[1]KATROLIA P,RAJASHEKHARA E,YANQ,etal.Biotechnological potential ofm icrobial alpha-galactosidases[J].Crit Rev Biotechnol,2014,34(4):307-317.
[2]闫巧娟,刘瑜,江正强.微生物α-半乳糖苷酶的研究进展[J].微生物学杂志,2017,37(3):1-9.
[3]CHEN Z,YANQ,JIANG Z,etal.High-levelexpression of anovelalphagalactosidase gene from Rhizomucormiehei in Pichia pastoris and characterization of the recombinantenzyme[J].Protein Express Purif,2015,110(4):107-114.
[4]林谦,蒋桂韬,张旭,等.饲粮α-半乳糖苷酶对爱拔益加肉鸡生长性能和养分利用率及肠道黏膜形态结构的影响[J].中国畜牧杂志,2016,52(5):38-43.
[5]段文娟,汤海鸥.α-半乳糖苷酶在饲料工业中的应用与基因工程研究进展[J].饲料工业,2011(S1):34-37.
[6]VARALAKSHM IK N,KUMUDINIBS,NANDINIBN,etal.Production and characterizationofalpha-amylase from Aspergillusniger JGI24 isolated in Bangalore[J].Pol JM icrobiol,2009,58(1):29-36.
[7]CHEN L,VADLANIPV,MADL R L.High-efficiency removal of phytic acid in soymeal using two-stage temperature-induced Aspergillus oryzae solid-state fermentation[J].J Sci Food Agr,2014,94(1):113-118.
[8]缪志军,王向荣,蒋桂韬,等.复合非淀粉多糖酶制剂中补充α-半乳糖苷酶对番鸭生产性能的影响[J].中国饲料,2010(12):17-19.
[9]CAO Y,WANG Y,LUO H,et al.Molecular cloning and expression of a novel protease-resistantGH-36 alpha-galactosidase from Rhizopus sp.F78 ACCC 30795[J].JM icrobiol Biotechn,2009,19(11):1295-1300.
[10]SHANKAR S K,MULIMANIV H.Alpha-galactosidase production by Aspergillus oryzae in solid-state fermentation[J].Bioresource Technol,2007,98(4):958-961.
[11]ZHA H G,FLOWERSV L,YANG M,et al.Acidic alpha-galactosidase is themostabundant nectarin in floral nectar of common tobacco(Nicotiana tabacum)[J].Ann Bot-London,2012,109(4):735-745.
[12]ZHANGW,DU F,TIAN G,et al.Characterization of an acidic alphagalactosidase from hemp(Cannabissativa L.)seedsand itsapplication in removal of raffinose fam ily oligosaccharides(RFOs)[J].Acta Biochim Pol,2018,65(3):383-389.
[13]CITRO V,PEŃA-GARCIA J,DEN-HAAN H,etal.Identification of an allosteric binding site on human lysosomalalpha-galactosidase opens the way to new pharmacological chaperones for Fabry disease[J].Plos One,2016,11(10):e0165463.
[14]XU L,CHEN B,GENG X,etal.A protease-resistantalpha-galactosidase characterized by relatively acid pH tolerance from the Shitakemushroom Lentinula edodes[J].Int JBiol Macromol,2019,128(2):324-330.
[15]RIERA C,LOISS,DOMÍNGUEZC,etal.Molecular damage in Fabry disease:characterization and prediction of alpha-galactosidase A pathologicalmutations[J].Proteins,2015,83(1):93-104.
[16]XU H,QIN Y,HUANG Z,etal.Characterization and site-directedmutagenesis of an alpha-galactosidase from the deep-sea bacterium Bacillus megaterium[J].Enzyme M icrob Tech,2014,56(2):46-52.
[17]刘小丹,董继胜,姬铁强,等.一种来源于Brachybacterium sp.DB5的α-半乳糖苷酶克隆及性质研究[J].生物技术进展,2015,5(4):310-314.
[18]WAKINAKA T,KIYOHARA M,KURIHARA S,et al.Bifidobacterial alpha-galactosidasewith unique carbohydrate-bindingmodulespecifically actson blood group B antigen[J].Glycobiology,2013,23(2):232-240.
[19]ZHOU J,LU Q,ZHANG R,etal.Characterization of two glycoside hydrolase family 36 alpha-galactosidases:novel transglycosylation activity,lead-zinc tolerance,alkaline and multiple pH optima,and low-temperatureactivity[J].Food Chem,2016,194(1):156-66.
[20]AULITTOM,FUSCO S,FIORENTINO G,etal.Thermus thermophilus as sourceof thermozymes forbiotechnologicalapplications:Homologous expression and biochem ical characterization of anα-galactosidase[J].M icrob Cell Factor,2017,16(1):28.
[21]WANGH,SHIP,LUOH,etal.A thermophilic alpha-galactosidase from Neosartorya fischeri P1 with high specific activity,broad substrate specificity and significanthydrolysisability of soym ilk[J].Bioresource Technol,2014,153:361-364.
[22]KATROLIA P,JIA H,YANQ,etal.Characterization of a protease-resistantalpha-galactosidase from the thermophilic fungus Rhizomucormiehei and its application in removal of raffinose fam ily oligosaccharides[J].Bioresource Technol,2012,110(7):578-586.
[23]WANGC,WANGH,MAR,etal.Biochemicalcharacterization ofanovel thermophilic alpha-galactosidase from Talaromyces leycettanus JCM 12802 with significant transglycosylation activity[J].JBiosci Bioeng,2016,121(1):7-12.
[24]SM ITHW,JANTTIJ,OJAM,etal.Comparison of intracellular and secretion-based strategies for production of human alpha-galactosidase A in the filamentous fungus Trichoderma reesei[J].BMC Biotechnol,2014,14(20):91.
[25]WANG H,MA R,SHIP,etal.Insights into the substrate specificity and synergy withmannanase of fam ily 27 alpha-galactosidases from Neosartorya fischeri P1[J].Appl M icrobiol Biot,2015,99(3):1261-1272.
[26]PUCHARTV,VRSANSKAM,BHATM K,etal.Purificationand characterization of alpha-galactosidase from a thermophilic fungus Thermomyces lanuginosus[J].BBA-Bioenergetics,2000,1524:27-37.
[27]SINITSYNA O,FEDOROVA E,VAKAR I,et al.Isolation and characterization of extracellulara-galactosidases from Penicillium canescens[J].Biochem istry,2008,73(1):97-106.
[28]WANGH,LUOH,LIJ,etal.An alpha-galactosidase from an acidophilic Bispora sp.MEY-1 strain acts synergistically with beta-mannanase[J].Bioresource Technol,2010,101(21):8376-8382.
[29]VIANA P A,DE REZENDE S T,PASSOS FM,et al.Debaryomyces hansenii UFV-1 intracellular alpha-galactosidase characterization and comparativestudiesand extracellularenzyme[J].JAgr Food Chem,2009,57(6):2515-2522.
[30]陈俊亮,田芬,霍贵成,等.长双歧杆菌α-半乳糖苷酶的分离纯化及酶学性质[J].食品科学,2014,35(7):118-122.
[31]邱聪花,罗蒙,林娟,等.Alkalibacterium sp.SL3中α-半乳糖苷酶基因的克隆、表达和性质研究[J].福州大学学报(自然科学版),2019,47(1):136-142.
[32]贲培培.α-半乳糖苷酶高产菌株的筛选及其基因的克隆、表达、纯化和性质研究[D].南京:南京农业大学,2011.
[33]陆宇.短双歧杆菌α-半乳糖苷酶基因及其重组表达研究[D].济南:山东大学,2004.